ご利用について
医療専門家向けの本PDQがん情報要約では、前立腺がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 前立腺がんに関する一般情報
-
前立腺がん診断時の年齢中央値は66歳である。[ 1 ]前立腺がんは限局性であれば治癒する可能性があり、広範囲に及んでいても治療に反応することが多い。腫瘍の増殖速度はきわめて緩徐な場合から中等度の場合までさまざまであり、骨転移などの遠隔転移を来していても長い生存期間が得られる患者もいる。米国では、2001年から2007年に局所または領域の前立腺がんと診断された男性の5年相対生存率は100%で、遠隔転移例では28.7%であった;全病期を合わせると、99%の生存率が確認されている。[ 2 ]治療に対するアプローチは、年齢および同時に存在する医学的問題の影響を受ける。適切な治療体制を選択するに当たっては、種々の治療方法の副作用を考慮する必要がある。
多くの患者、特に限局性腫瘍の患者では、治癒目的の治療を目指すことなく、控えめに管理された場合でも、前立腺がんによる重大な障害を経験することなく、別の疾患で死亡する場合がある。[ 3 ][ 4 ]一部では、これらの良好な転帰は、死に至る可能性がほとんどないか、全くない無症状の患者を特定可能な前立腺特異抗原(PSA)検査による広範なスクリーニングの結果である可能性が高い。[ 5 ]このような臨床的に潜行性の腫瘍の例は非常に多く、前立腺がんとは無関係な原因で死亡した男性の剖検シリーズから、60歳を超える男性の30~70%にみられると推定されている。[ 6 ][ 7 ]
時代とともに診断方法が変化してきているため、前立腺がんの治療後の生存解析や種々の治療戦略間の比較は、非致死性腫瘍の診断数が増加しているという証拠により複雑化している。ランダム化せずに治療法を比較すれば、患者選択因子だけでなく時勢によっても混乱が生じる可能性がある。
例えば、スウェーデンで実施された集団ベースの研究では、スクリーニング目的でPSAの使用が開始される前の1960年から1980年代後半にかけて、より感度の高い診断方法が導入されるにつれて、前立腺がん診断後の長期的な相対生存率が大幅に改善されることが示された。この全期間中の限局性前立腺がんに対する最も一般的な治療戦略として、注意深い経過観察、積極的サーベイランス、または症状緩和を目的としたホルモン療法が使用されたにもかかわらず、このような改善がみられたのである(1980年代後半にスウェーデンで実施された根治的前立腺全摘除術は年間150件に満たなかった)。この研究では、1960年から1964年に診断されたすべての前立腺がんが致死性とすれば、1980年から1984年に診断されたがんの33%以上が非致死性であると推定された。[ 8 ][証拠レベル:3iB]米国で最も一般的な検知方法としてのPSAスクリーニングが進化するのに伴い、非致死性前立腺がんの診断能力はさらに高まってきている。
時期を異にする患者のシリーズ間の治療成績の比較を困難にする問題としては、この他にも前立腺がんの組織学的診断基準が変化する可能性が挙げられる。[ 9 ]この現象は治療の成果について錯覚させる統計的アーチファクトを生み出し、より積極的な治療につながる場合もある。
スクリーニングの価値、最も適切な病期分類のための評価法、および本疾患の病期ごとの至適治療法については見解の一致をみていない。[ 10 ][ 11 ][ 12 ][ 13 ][ 14 ]
発生率および死亡率
米国において、2020年に推定される前立腺がんの新規症例数および死亡数:[ 15 ][A Snapshot of Prostate Cancer]
スクリーニング
前立腺がんのスクリーニングの問題については、見解が一致していない。米国では、PSA血液検査または頻度は低いが直腸指診のいずれかによるスクリーニングによってほとんどの前立腺がんが診断される。ランダム化試験では、矛盾する結果が得られている。[ 16 ][ 17 ][ 18 ]前立腺がんスクリーニングにより、前立腺がんによる死亡リスクが低下すること、つまりその有益性がスクリーニングの有害性を上回ることを示す明確な証拠はないことが、系統的な文献レビューとメタアナリシスにより報告されている。[ 19 ][ 20 ]
(前立腺がんのスクリーニングの有益性および有害性に関する詳しい要約については、前立腺がんのスクリーニングに関するPDQ要約を参照のこと。)
病理学
95%を超える原発性前立腺がんが腺がんである。前立腺腺がんは、多巣性で、分化パターンが不均一なことが多い。前立腺上皮内腫瘍([PIN]、良性にみえる腺房内の非侵襲性非定型上皮細胞)は、しばしば前立腺腺がんに伴って現れる。PINは、低悪性度と高悪性度に細分される。高悪性度型は、腺がんの前駆型の1つである可能性がある。[ 21 ]
いくつかのまれな腫瘍が残りの症例の少ないパーセンテージの中に含まれる。これらの腫瘍には以下のものがある:
グリソンスコア
通常、前立腺腺がんの組織学的悪性度は、予後を判定する際の腫瘍病期判定の補助として、大まかではあるが有用な方法となるグリソンスコア採点変法の1つに基づいて報告されている。[ 22 ]このグリソンスコアは、分化度1(高分化型)から分化度5(超低分化型)までの支配的な組織学的悪性度を基に算出される。古典的なスコアでは、最も広くみられる2つの悪性度パターンを加算することで、スコア範囲を2~10として算出される。最も低分化の標本部分により、独立した予後的情報が得られる可能性を示す証拠がいくつかあるため、その異なった部分によってスコアが算出されることが多い(例えば、グリソンスコア 3 + 4 = 7;または 4 + 3 = 7)。[ 23 ]
病理医は、時代の流れとともに、同じ組織学的パターンに対してより高いグリソンスコアを与えようとする傾向があること、つまり、ときに悪性度インフレーション(grade inflation)と呼ばれる現象を示す証拠がある。[ 24 ][ 25 ]この現象は、現在と過去の患者のシリーズにおける転帰の比較を複雑にしている。例えば、1990年から1992年に前立腺がんと診断された男性1,858人の集団ベースコホートについて、前立腺生検の再判定が2002年から2004年にかけて実施された。[ 24 ][ 25 ]現在のグリソンスコアの値は、10年前の同じ標本の値より、平均で0.85ポイント(95%信頼区間、0.79-0.91;P < 0.001)高くなっていた。その結果、これらの男性に対する前立腺がんによるグリソンスコアで標準化された死亡率は、100人年当たりの死亡で2.08から1.50に人為的に改善されたが、これは、全体的な転帰が変化していないにもかかわらず、28%の低下に相当している。
臨床所見
米国では、ほとんどの前立腺がんが、スクリーニングの結果として診断される;したがって、診断時点でがんの症状がみられることはほとんどない。[ 22 ]それでも、腫瘍の局所的な増殖により、以下のような尿路閉塞の症状を生じることがある:
これらの症状は、非特異的で、がんよりも良性の前立腺肥大を示すことが多い。
現在のような広範にスクリーニングが実施されている時代ではまれであるが、骨痛、病的骨折、または骨髄病変により引き起こされる症状など、転移症状を伴って前立腺がんが現れることもある。
診断的評価
針生検が前立腺がんの診断に最もよく使用される検査法である。現在、ほとんどの泌尿器科医は、エコーガイド下バイオプティーガンを用いて経直腸生検を実施している。頻度は少ないが、経直腸的アプローチの使用による合併症リスクが高い可能性がある患者では、エコーガイド下の経会陰的アプローチを用いることができる。[ 26 ]数年にわたって、前立腺のいくつかの領域から8~10個またはそれ以上の生検サンプルを採取する傾向がみられ、その結果、PSAの血液検査で評価した後に、がんが検出される例が増加している。[ 22 ]しかしながら、1件のランダム化試験により、経験を積んだ専門家においてマルチパラメータの磁気共鳴画像法(MRI)で誘導された生検は、臨床的に重要ながんと考えられるがんを発見する上で経直腸ガイド下の生検よりも正確であることが示されている。この多施設研究では、MRIによりグリソンスコアが7以上の病変がより多く発見され、グリソンスコアが7未満の病変の発見はより少なく、全体の生検数も少なかった。[ 27 ]
経直腸的針生検の前には、特にフルオロキノロンによる予防的抗生物質投与がしばしば使用される。生検の処置後に、特にフルオロキノロン耐性の大腸菌(E. coli)による敗血症および入院の発生率増加が報告されている。[ 28 ][ 29 ]したがって、経直腸生検を受ける男性に対しては、生検後に発熱がみられた場合は、直ちに医師の診察を受けるよう伝えておくべきである。
予後因子
前立腺がん患者の生存は、以下のものを含め、いくつかの因子に関係している:[ 30 ][ 31 ][ 32 ][ 33 ][ 34 ]
(Surveillance, Epidemiology, and End Resultsの5年および10年生存率を参照のこと。)
腫瘍の範囲
がんが前立腺に限局していれば、長期的な予後が優れている。局所進行がんの患者は、一般に治癒できないが、それでも、5年生存率は非常に良好である。前立腺がんが遠隔転移すれば、現在の治療法で治癒することはない。通常、生存期間中央値は1~3年であり、これらの患者のほとんどが前立腺がんにより死亡する。この患者集団でも、長年にわたって変化のない臨床経過が続くことが観察されることがある。
腫瘍の組織学的悪性度
低分化腫瘍は、診断前に既に転移している可能性が高く、不良な予後と関連している。腫瘍分化の報告に最も多く使用されている方法は、グリソンスコアである。(詳しい情報については、本要約の前立腺がんに関する一般情報のセクション内の病理学のセクションを参照のこと。)
患者の年齢と健康状態
治癒目的の根治的局所療法で何らかの有益性が現れるのに数年を費やすことがある。したがって、治癒目的の治療は、一般に平均余命が十分に長い男性のみに使用される。例えば、根治的前立腺全摘除術は、推定寿命が10年以上の男性に使用されることが多い。
前立腺特異抗原(PSA)の値
PSAは組織特異的マーカーで、しばしば腫瘍マーカーの1つとして使用される。[ 32 ][ 33 ][ 35 ][ 36 ][ 37 ][ 38 ][ 39 ][ 40 ]ベースライン時にPSA値が高いほど、転移性疾患またはその後の疾患進行のリスクが高くなる。しかしながら、リスクに関しては、不正確なマーカーである。
例えば、根治的前立腺全摘除術と注意深い経過観察または積極的なサーベイランスを比較したランダム化試験の対照群における注意深い経過観察または積極的なサーベイランスにより管理された臨床的に限局性の前立腺がん男性コホート267人では、ベースライン時のPSA値およびPSA値の変化の割合がその後の転移または前立腺がんによる死亡と関連していた。[ 41 ][ 42 ]にもかかわらず、がんが低悪性度のままであったグループ vs がんが進行したグループに男性を分類する正確度は、PSA値またはPSA値の変化の割合について調査したすべてのカットポイントで不満足なものであった。
血清酸性ホスファターゼ値
血清酸性ホスファターゼ値が高いと、限局がんでも播種性転移を有するがんでも予後不良である。しかしながら、血清酸性ホスファターゼ値は、米国がん合同委員会(AJCC)の前立腺がんの病期分類システムには採用されていない。[ 35 ]
診断ツールとしてのノモグラムの利用
治癒を目的とした根治的前立腺全摘除術の前[ 43 ][ 44 ][ 45 ][ 46 ]、または根治的前立腺全摘除術の後[ 47 ][ 48 ]のいずれかで転帰を予測するために、数種のノモグラムが開発されている。術前のノモグラムは、臨床病期、PSA値、グリソンスコア、ならびに陽性および陰性の前立腺生検コア数に基づいている。独立して妥当性が確認された1つのノモグラムにより、トランスフォーミング増殖因子β1および可溶性インターロイキン-6受容体の術前血漿中濃度を含めることで、生化学的無再発生存率の予測における正確度が増加したことが実証された。[ 49 ][ 50 ]
術後ノモグラムではさらに、被膜浸潤や切除断端、精嚢浸潤、リンパ節転移などの病理所見が加わる。しかしながら、こうしたノモグラムは学術機関で開発されたものであり、ほとんどの患者が治療を受ける病院という臨床の現場用に一般化された場合には、正確ではない可能性がある。[ 51 ][ 52 ]さらに、このノモグラムは、PSAの上昇または外科的病理所見などの健康とは直接関係のない(中間的な)転帰に加え、追加療法を必要とする医師の認識などの主観的なエンドポイントを使用している。加えてこうしたノモグラムには、診断法や術前補助療法の経時的な変化によって影響を受けるという可能性もある。[ 44 ]
治療後のフォローアップ
前立腺がんの治療を受けた男性に対する最適なフォローアップ戦略は明らかではない。治療による副作用が治療変更によって管理可能かどうかに加え、再発または疾患進行の症状または徴候がないか、男性患者に対して問診を実施すべきである。しかしながら、臨床的に決定を下すために代理エンドポイントを用いることには議論の余地があり、このようなエンドポイントに基づいて治療を変更することで、臨床的な有益性につながるという証拠は乏しい。多くの場合、PSA値の変化の割合は、腫瘍増殖のマーカーと考えられる。しかしながら、腫瘍マーカーまたは腫瘍の特徴は、前立腺がんの進行または死亡のリスクが高いことと一貫して関連している可能性があるとしても、非常に弱い予測因子であり、治療の決定を下す上で、有用性はきわめて限られている可能性がある。
PSA検査は、ほぼ例外なく患者のフォローアップに使用されているが、フォローアップケアの提供に対する推奨に多様性がみられることは、確固たる結論を基にした研究による証拠が現時点で欠けていることを反映している。国際的なガイドラインの系統的レビューでは、前立腺がん男性に対するフォローアップケアの今後のエビデンスベースモデルに情報を提供する強固な初期研究の必要性が強調されている。[ 53 ]
根治的前立腺全摘除術または放射線療法のいずれかの治療を受けた臨床的に限局性の前立腺がん患者8,669人から構成されるレトロスペクティブ・コホートから得られた予備データにより、治療後のPSA倍加時間が短いこと(この研究では3ヵ月未満)は、全原因死亡率および手術後または放射線療法後の前立腺がん特異的死亡率に対する代理エンドポイントとしての基準をある程度満たすことが示唆された。[ 54 ]
同様に、レトロスペクティブ解析(SWOG-S9916[NCT00004001])により、ホルモン非依存性前立腺がんに対する化学療法開始から3ヵ月後で20~40%(50%ではない)、または2ヵ月後で30%以上のPSA値低下は、全生存(OS)に対する代理性のいくつかの基準を満たすことが示された。[ 55 ]
これらの観察結果は、プロスペクティブな研究デザインで別個に確認されるべきであり、またホルモン療法で治療された患者には適用できない。さらに、代理性(surrogacy)の標準的な基準または代理エンドポイントの妥当性に対する標準的なカットポイントは、プロスペクティブ試験においてでさえ存在しない。[ 56 ]
根治的前立腺全摘除術後のフォローアップ
根治的前立腺全摘除術後にPSA値が検出可能なことで、局所療法失敗または腫瘍転移のリスクが高い患者が特定される[ 37 ];しかしながら、術後にPSAの高値または増加傾向を示す患者のかなりの割合が、長期間にわたって臨床的に無症状のままである。[ 57 ]このため、PSAの高値または緩徐な上昇傾向に基づく生化学的な治療失敗の証拠のみで別の治療を開始するには不十分な可能性がある。
例えば、治癒目的での根治的前立腺全摘除術を受けて平均5.3年間追跡された2,000人近い男性のレトロスペクティブ分析では、315人の男性(15%)が0.2ng/mL以上のPSA異常値を示しており、これは生化学的再発の証拠と考えられる。これらの315人の男性で、臨床的に再発の証拠が得られたのは103人(34%)であった。生化学的再発から臨床的転移が現れるまでの時間は、中央値で8年であった。転移性疾患発生後の死亡までの時間の中央値は5年であった。[ 58 ]
放射線療法後のフォローアップ
放射線療法による治療を受けた患者では、再燃リスクを推定するために、臨床的腫瘍病期、グリソンスコア、および治療前PSA値を組み合わせて使用することが多い。[ 59 ][証拠レベル:3iDii]前立腺摘除術の場合と同じように、放射線療法後の腫瘍再発の徴候を調べるために、PSAがしばしば追跡される。根治目的の放射線療法後におけるPSAの持続的な高値または増大は臨床的疾患再発の予後因子となりうる;しかしながら、既報のケースシリーズは多岐にわたるPSA再発の定義を用いている。米国放射線療法および腫瘍学会コンセンサス・パネル(American Society for Therapeutic Radiology and Oncology Consensus Panel)により開発されている基準もある。[ 60 ][ 61 ]生化学的治療失敗のみに基づいて追加治療の開始を決定するのは困難である。OSに対するPSAを基にした治療失敗の種々の定義の意義は不明であり、放射線療法による治療を受けた患者では、外科的シリーズと同様に、生化学的再燃(PSA値上昇のみ)の多くの例が臨床的に顕在化しない可能性がある。[ 62 ][ 63 ]
関連する要約
前立腺がんに関する情報を含む他のPDQ要約には以下のものがある:
参考文献- National Cancer Institute: SEER Stat Fact Sheets: Prostate. Bethesda, Md: National Cancer Institute. Available online. Last accessed April 22, 2020.[PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2012. Atlanta, Ga: American Cancer Society, 2012. Available online. Last accessed March 11, 2020.[PUBMED Abstract]
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management. JAMA 302 (11): 1202-9, 2009.[PUBMED Abstract]
- Albertsen PC, Moore DF, Shih W, et al.: Impact of comorbidity on survival among men with localized prostate cancer. J Clin Oncol 29 (10): 1335-41, 2011.[PUBMED Abstract]
- Welch HG, Albertsen PC: Prostate cancer diagnosis and treatment after the introduction of prostate-specific antigen screening: 1986-2005. J Natl Cancer Inst 101 (19): 1325-9, 2009.[PUBMED Abstract]
- Welch HG, Black WC: Overdiagnosis in cancer. J Natl Cancer Inst 102 (9): 605-13, 2010.[PUBMED Abstract]
- Zlotta AR, Egawa S, Pushkar D, et al.: Prevalence of prostate cancer on autopsy: cross-sectional study on unscreened Caucasian and Asian men. J Natl Cancer Inst 105 (14): 1050-8, 2013.[PUBMED Abstract]
- Helgesen F, Holmberg L, Johansson JE, et al.: Trends in prostate cancer survival in Sweden, 1960 through 1988: evidence of increasing diagnosis of nonlethal tumors. J Natl Cancer Inst 88 (17): 1216-21, 1996.[PUBMED Abstract]
- Berner A, Harvei S, Skjorten FJ: Follow-up of localized prostate cancer, with emphasis on previous undiagnosed incidental cancer. BJU Int 83 (1): 47-52, 1999.[PUBMED Abstract]
- Garnick MB: Prostate cancer: screening, diagnosis, and management. Ann Intern Med 118 (10): 804-18, 1993.[PUBMED Abstract]
- Croswell JM, Kramer BS, Crawford ED: Screening for prostate cancer with PSA testing: current status and future directions. Oncology (Williston Park) 25 (6): 452-60, 463, 2011.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005.[PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
- Hegarty J, Beirne PV, Walsh E, et al.: Radical prostatectomy versus watchful waiting for prostate cancer. Cochrane Database Syst Rev (11): CD006590, 2010.[PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Andriole GL, Grubb RL, Buys SS, et al.: Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 360 (13): 1310-9, 2009.[PUBMED Abstract]
- Schröder FH, Hugosson J, Roobol MJ, et al.: Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 360 (13): 1320-8, 2009.[PUBMED Abstract]
- Sandblom G, Varenhorst E, Rosell J, et al.: Randomised prostate cancer screening trial: 20 year follow-up. BMJ 342: d1539, 2011.[PUBMED Abstract]
- Djulbegovic M, Beyth RJ, Neuberger MM, et al.: Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials. BMJ 341: c4543, 2010.[PUBMED Abstract]
- Ilic D, O'Connor D, Green S, et al.: Screening for prostate cancer: an updated Cochrane systematic review. BJU Int 107 (6): 882-91, 2011.[PUBMED Abstract]
- Nelson WG, De Marzo AM, Isaacs WB: Prostate cancer. N Engl J Med 349 (4): 366-81, 2003.[PUBMED Abstract]
- Zelefsky MJ, Eastham JA, Sartor AO: Cancer of the prostate. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1220-71.[PUBMED Abstract]
- Chan TY, Partin AW, Walsh PC, et al.: Prognostic significance of Gleason score 3+4 versus Gleason score 4+3 tumor at radical prostatectomy. Urology 56 (5): 823-7, 2000.[PUBMED Abstract]
- Albertsen PC, Hanley JA, Barrows GH, et al.: Prostate cancer and the Will Rogers phenomenon. J Natl Cancer Inst 97 (17): 1248-53, 2005.[PUBMED Abstract]
- Thompson IM, Canby-Hagino E, Lucia MS: Stage migration and grade inflation in prostate cancer: Will Rogers meets Garrison Keillor. J Natl Cancer Inst 97 (17): 1236-7, 2005.[PUBMED Abstract]
- Webb JA, Shanmuganathan K, McLean A: Complications of ultrasound-guided transperineal prostate biopsy. A prospective study. Br J Urol 72 (5 Pt 2): 775-7, 1993.[PUBMED Abstract]
- Kasivisvanathan V, Rannikko AS, Borghi M, et al.: MRI-Targeted or Standard Biopsy for Prostate-Cancer Diagnosis. N Engl J Med 378 (19): 1767-1777, 2018.[PUBMED Abstract]
- Nam RK, Saskin R, Lee Y, et al.: Increasing hospital admission rates for urological complications after transrectal ultrasound guided prostate biopsy. J Urol 183 (3): 963-8, 2010.[PUBMED Abstract]
- Liss MA, Chang A, Santos R, et al.: Prevalence and significance of fluoroquinolone resistant Escherichia coli in patients undergoing transrectal ultrasound guided prostate needle biopsy. J Urol 185 (4): 1283-8, 2011.[PUBMED Abstract]
- Gittes RF: Carcinoma of the prostate. N Engl J Med 324 (4): 236-45, 1991.[PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990.[PUBMED Abstract]
- Matzkin H, Eber P, Todd B, et al.: Prognostic significance of changes in prostate-specific markers after endocrine treatment of stage D2 prostatic cancer. Cancer 70 (9): 2302-9, 1992.[PUBMED Abstract]
- Pisansky TM, Cha SS, Earle JD, et al.: Prostate-specific antigen as a pretherapy prognostic factor in patients treated with radiation therapy for clinically localized prostate cancer. J Clin Oncol 11 (11): 2158-66, 1993.[PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994.[PUBMED Abstract]
- Carlton JC, Zagars GK, Oswald MJ: The role of serum prostatic acid phosphatase in the management of adenocarcinoma of the prostate with radiotherapy. Int J Radiat Oncol Biol Phys 19 (6): 1383-8, 1990.[PUBMED Abstract]
- Stamey TA, Yang N, Hay AR, et al.: Prostate-specific antigen as a serum marker for adenocarcinoma of the prostate. N Engl J Med 317 (15): 909-16, 1987.[PUBMED Abstract]
- Stamey TA, Kabalin JN: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. I. Untreated patients. J Urol 141 (5): 1070-5, 1989.[PUBMED Abstract]
- Stamey TA, Kabalin JN, McNeal JE, et al.: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. II. Radical prostatectomy treated patients. J Urol 141 (5): 1076-83, 1989.[PUBMED Abstract]
- Stamey TA, Kabalin JN, Ferrari M: Prostate specific antigen in the diagnosis and treatment of adenocarcinoma of the prostate. III. Radiation treated patients. J Urol 141 (5): 1084-7, 1989.[PUBMED Abstract]
- Andriole GL: Serum prostate-specific antigen: the most useful tumor marker. J Clin Oncol 10 (8): 1205-7, 1992.[PUBMED Abstract]
- Fall K, Garmo H, Andrén O, et al.: Prostate-specific antigen levels as a predictor of lethal prostate cancer. J Natl Cancer Inst 99 (7): 526-32, 2007.[PUBMED Abstract]
- Parekh DJ, Ankerst DP, Thompson IM: Prostate-specific antigen levels, prostate-specific antigen kinetics, and prostate cancer prognosis: a tocsin calling for prospective studies. J Natl Cancer Inst 99 (7): 496-7, 2007.[PUBMED Abstract]
- Partin AW, Kattan MW, Subong EN, et al.: Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 277 (18): 1445-51, 1997.[PUBMED Abstract]
- Partin AW, Mangold LA, Lamm DM, et al.: Contemporary update of prostate cancer staging nomograms (Partin Tables) for the new millennium. Urology 58 (6): 843-8, 2001.[PUBMED Abstract]
- Kattan MW, Eastham JA, Stapleton AM, et al.: A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 90 (10): 766-71, 1998.[PUBMED Abstract]
- Stephenson AJ, Scardino PT, Eastham JA, et al.: Preoperative nomogram predicting the 10-year probability of prostate cancer recurrence after radical prostatectomy. J Natl Cancer Inst 98 (10): 715-7, 2006.[PUBMED Abstract]
- Kattan MW, Wheeler TM, Scardino PT: Postoperative nomogram for disease recurrence after radical prostatectomy for prostate cancer. J Clin Oncol 17 (5): 1499-507, 1999.[PUBMED Abstract]
- Stephenson AJ, Scardino PT, Eastham JA, et al.: Postoperative nomogram predicting the 10-year probability of prostate cancer recurrence after radical prostatectomy. J Clin Oncol 23 (28): 7005-12, 2005.[PUBMED Abstract]
- Shariat SF, Walz J, Roehrborn CG, et al.: External validation of a biomarker-based preoperative nomogram predicts biochemical recurrence after radical prostatectomy. J Clin Oncol 26 (9): 1526-31, 2008.[PUBMED Abstract]
- Kattan MW, Shariat SF, Andrews B, et al.: The addition of interleukin-6 soluble receptor and transforming growth factor beta1 improves a preoperative nomogram for predicting biochemical progression in patients with clinically localized prostate cancer. J Clin Oncol 21 (19): 3573-9, 2003.[PUBMED Abstract]
- Penson DF, Grossfeld GD, Li YP, et al.: How well does the Partin nomogram predict pathological stage after radical prostatectomy in a community based population? Results of the cancer of the prostate strategic urological research endeavor. J Urol 167 (4): 1653-7; discussion 1657-8, 2002.[PUBMED Abstract]
- Greene KL, Meng MV, Elkin EP, et al.: Validation of the Kattan preoperative nomogram for prostate cancer recurrence using a community based cohort: results from cancer of the prostate strategic urological research endeavor (capsure). J Urol 171 (6 Pt 1): 2255-9, 2004.[PUBMED Abstract]
- McIntosh HM, Neal RD, Rose P, et al.: Follow-up care for men with prostate cancer and the role of primary care: a systematic review of international guidelines. Br J Cancer 100 (12): 1852-60, 2009.[PUBMED Abstract]
- D'Amico AV, Moul JW, Carroll PR, et al.: Surrogate end point for prostate cancer-specific mortality after radical prostatectomy or radiation therapy. J Natl Cancer Inst 95 (18): 1376-83, 2003.[PUBMED Abstract]
- Petrylak DP, Ankerst DP, Jiang CS, et al.: Evaluation of prostate-specific antigen declines for surrogacy in patients treated on SWOG 99-16. J Natl Cancer Inst 98 (8): 516-21, 2006.[PUBMED Abstract]
- Baker SG: Surrogate endpoints: wishful thinking or reality? J Natl Cancer Inst 98 (8): 502-3, 2006.[PUBMED Abstract]
- Frazier HA, Robertson JE, Humphrey PA, et al.: Is prostate specific antigen of clinical importance in evaluating outcome after radical prostatectomy. J Urol 149 (3): 516-8, 1993.[PUBMED Abstract]
- Pound CR, Partin AW, Eisenberger MA, et al.: Natural history of progression after PSA elevation following radical prostatectomy. JAMA 281 (17): 1591-7, 1999.[PUBMED Abstract]
- Pisansky TM, Kahn MJ, Rasp GM, et al.: A multiple prognostic index predictive of disease outcome after irradiation for clinically localized prostate carcinoma. Cancer 79 (2): 337-44, 1997.[PUBMED Abstract]
- Consensus statement: guidelines for PSA following radiation therapy. American Society for Therapeutic Radiology and Oncology Consensus Panel. Int J Radiat Oncol Biol Phys 37 (5): 1035-41, 1997.[PUBMED Abstract]
- Roach M, Hanks G, Thames H, et al.: Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys 65 (4): 965-74, 2006.[PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: Prostate-specific antigen for pretreatment prediction and posttreatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 32 (2): 307-16, 1995.[PUBMED Abstract]
- Sandler HM, Dunn RL, McLaughlin PW, et al.: Overall survival after prostate-specific-antigen-detected recurrence following conformal radiation therapy. Int J Radiat Oncol Biol Phys 48 (3): 629-33, 2000.[PUBMED Abstract]
- Ruckle HC, Klee GG, Oesterling JE: Prostate-specific antigen: concepts for staging prostate cancer and monitoring response to therapy. Mayo Clin Proc 69 (1): 69-79, 1994.[PUBMED Abstract]
- 前立腺がんの病期情報
-
病期分類検査
ほとんどの男性が初期の臨床病期で前立腺がんと診断され、転移が検出されることはない。したがって、ほとんどの場合、骨スキャン、コンピュータ断層撮影(CT)、または磁気共鳴画像法(MRI)などの病期分類検査を受ける必要はない。それでも、骨痛などにより転移が臨床的に疑われる場合;局所腫瘍が前立腺被膜を超えて拡がっている場合;または転移のリスクがかなり高い(前立腺特異抗原[PSA]が20ng/mLを超え、かつグリソンスコアが7を超える)場合は、病期分類検査を実施する。[ 1 ]
病期判定に用いられている検査には以下のものがある:
放射性核種骨スキャン
放射性核種骨スキャンは、腫瘍が最も多く遠隔転移する部位である骨への転移に対して最も広く使用されている検査法である。
血清前立腺特異抗原(PSA)値
新たに診断された患者では、血清PSA値により、放射性核種骨スキャンの結果が予測できる。
磁気共鳴画像法(MRI)
MRIはこれまで、前立腺がんの前立腺被膜外への進展を検知するのに用いられてきたが、陽性反応的中度が約70%であることと、観察者間変動の大きいことが、病期診断の際のルーチン使用を不確実にする問題となっている。[ 4 ]しかしながら、超音波法もMRIも臨床的過小病期診断を減少させることができ、それによって局所療法に対する患者の選択が改善される。直腸内コイルを用いたMRIは、特に分光法と併用した場合に、臓器限局的腫瘍および前立腺被膜外腫瘍の特定がより正確に行えると考えられている。[ 1 ]MRIはリンパ節病変の評価には不向きな手段である。
MRIは、放射性核種骨スキャンよりも骨転移の検出感度が高いが、骨格系全体を検査するには実用性に欠ける。
骨盤リンパ節郭清(PLND)
PLNDは、依然として骨盤リンパ節転移の評価に最も正確な方法であり、しかも腹腔鏡下PLNDにより、開腹手術と同程度の有効性で、骨盤リンパ節を正確に評価できることが示されている。[ 5 ]
何らかのタイプのPLNDが適応となるかどうかを判断する際の決定的因子は、根治療法が変更される可能性がある場合である。例えば、根治的前立腺全摘除術は、一般的にリンパ節転移がない男性のみに使用される。同様に、腫瘤が触知されて根治的前立腺全摘除術が検討されている患者では、精嚢浸潤が一次治療の選択に影響し、骨盤リンパ節転移が予測されるために、(グリソンスコアが低くない限り)術前精嚢生検が有用な場合がある。[ 6 ]
臨床的限局性(I期、またはII期)前立腺がん患者の場合、Gleasonの病理学的分類および酵素的血清前立腺酸性ホスファターゼ値(正常範囲内であっても)によって、前立腺被膜浸潤、精嚢浸潤または所属リンパ節転移の可能性が予測できる。[ 7 ]臨床病期がI期またはII期で、根治的前立腺全摘除術を受けた前立腺がん患者166人のシリーズを解析したところ、グリソン生検スコアとリンパ節転移が手術で発見されるリスクとの相関が明らかになった。グリソン生検スコアに従って分類した患者のリンパ節転移のリスクは、グリソンスコアが5で2%、グリソンスコアが6で13%、およびグリソンスコアが8で23%であった。[ 8 ]
すべての患者がPLNDの対象になるかどうかについては議論の余地があるが、根治的恥骨後前立腺摘除術を受ける患者では、当然のことながら、リンパ節の状態を確認するのが通例である。しかしながら、PSA値が20ng/mL未満で、グリソンスコアの合計が低値の患者が根治的会陰式前立腺摘除術を受ける場合、特に悪性腫瘍が触知できないものの超音波で検知された患者では、PLNDが不必要な可能性の高いことを示す証拠が蓄積されている。[ 7 ][ 9 ]
経直腸的または経会陰的生検
前立腺がんが疑われる場合に、診断を確定し、グリソンスコアを測定する最も一般的な手段は、針生検による方法である。現在、ほとんどの泌尿器科医は、エコーガイド下バイオプティーガンを用いて経直腸生検を実施している。頻度は少ないが、経直腸的アプローチの使用による合併症リスクが高い可能性がある患者では、エコーガイド下の経会陰的アプローチを用いることができる。[ 10 ]数年にわたって、前立腺のいくつかの領域から8~10個またはそれ以上の生検サンプルを採取する傾向がみられ、その結果、PSAの血液検査で評価した後に、がんが検出される例が増加している。[ 1 ]
経直腸的超音波(TRUS)
TRUSでは針生検の方向が示されるため、診断が容易になる可能性がある;しかしながら、超音波検査は検査技師の技量に左右され、リンパ節のサイズは測定できない。
根治的前立腺全摘除術に適格となる臨床的に限局性の前立腺がん男性を対象とした術前TRUSのプロスペクティブ多施設研究により、前立腺被膜外への腫瘍の進展または精嚢浸潤を予測する上で、TRUSは直腸指診と変わらないことが示された。[ 11 ]
病期分類システム
歴史的に、前立腺がんの病期分類では、2つのシステムが一般に使用されている。
AJCC病期分類とTNMの定義
AJCCはTNM分類による病期決定を指定している。[ 15 ]
表1.組織学的悪性度グループの定義a 悪性度グループ グリソンスコア グリソンパターン a出典:AJCC: Prostate.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.715–26. 1 ≤6 ≤3+3 2 7 3+4 3 7 4+3 4 8 4+4、3+5、または5+3 5 9または10 4+5、5+4、または5+5 表2.TNM分類におけるI期の定義a 病期 TNM 説明 PSA グリソンスコア;グリソンパターン(悪性度グループ) 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;cT = 臨床的T;PSA = 前立腺特異抗原;pT = 病理学的T。 a出典:AJCC: Prostate.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.715–26. 上付き文字b~gの説明は、表5の末尾に示している。 I cT1a-c、cT2a、N0、M0 cT1 = 触診で認められない臨床的に不顕性の腫瘍。 <10 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 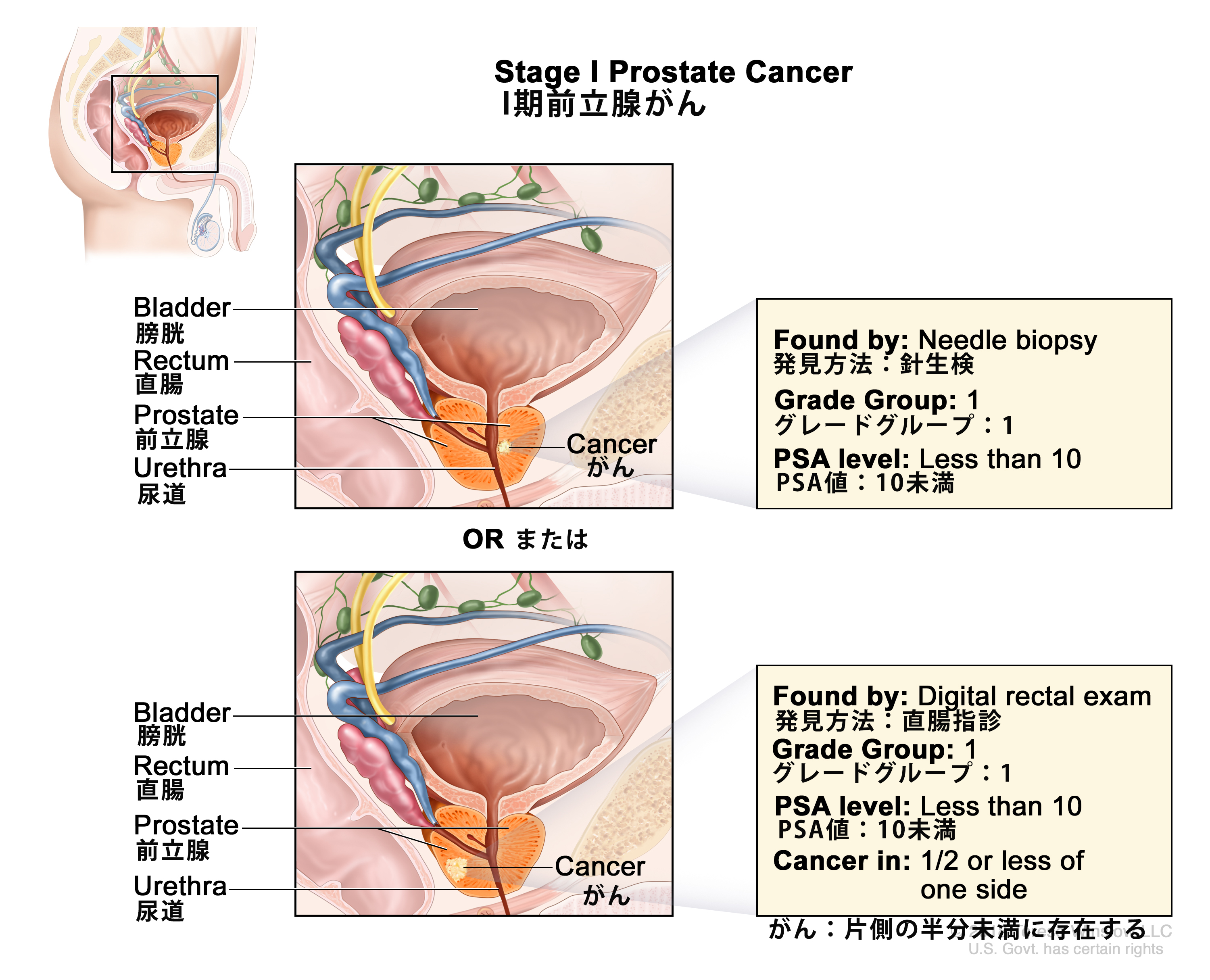
-cT1a = 切除組織の5%以下の組織学的に偶然発見された腫瘍。 -cT1b = 切除組織の5%を超える組織学的に偶然発見された腫瘍。 -cT1c = 針生検で片側または両側に特定されるが、触知できない腫瘍。 cT2 = 腫瘍が触知可能で、前立腺内に限局している。 -cT2a = 腫瘍の浸潤が片側の1/2以下。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 pT2、N0、M0 pT2 = 臓器に限局する。 <10 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 表3.TNM分類におけるIIA期、IIB期、およびIIC期の定義a 病期 TNM 説明 PSA グリソンスコア;グリソンパターン(悪性度グループ) 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;cT = 臨床的T;PSA = 前立腺特異抗原;pT = 病理学的T。 a出典:AJCC: Prostate.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.715–26. 上付き文字b~gの説明は、表5の末尾に示している。 IIA cT1a-c、cT2a、pT2、N0、M0 表2、I期のcT1a-c、cT2aの記述を参照のこと。 ≥10 <20 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 
pT2 = 臓器に限局する。 cT2b-c、N0、M0 cT2 = 腫瘍が触知可能で、前立腺内に限局している。 <20 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 cT2b = 浸潤が片側の1/2を超えているが、両側には及んでいない腫瘍。 cT2c = 両側に及んでいる腫瘍。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 IIB T1-2、N0、M0 T1 = 触診で認められない臨床的に不顕性の腫瘍。 <20 グリソンスコア、7;グリソンパターン、3+4(2)。 
-T1a = 切除組織の5%以下の組織学的に偶然発見された腫瘍。 -T1b = 切除組織の5%を超える組織学的に偶然発見された腫瘍。 -T1c = 針生検で片側または両側に特定されるが、触知できない腫瘍。 cT2 = 腫瘍が触知可能で、前立腺内に限局している。 -cT2a = 腫瘍の浸潤が片側の1/2以下。 -cT2b = 浸潤が片側の1/2を超えているが、両側には及んでいない腫瘍。 -cT2c = 両側に及んでいる腫瘍。 pT2 = 臓器に限局する。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 IIC T1-2、N0、M0 上述のIIB期のT1-2、N0、M0の記述を参照のこと。 <20 グリソンスコア、7;グリソンパターン、4 + 3(3)。 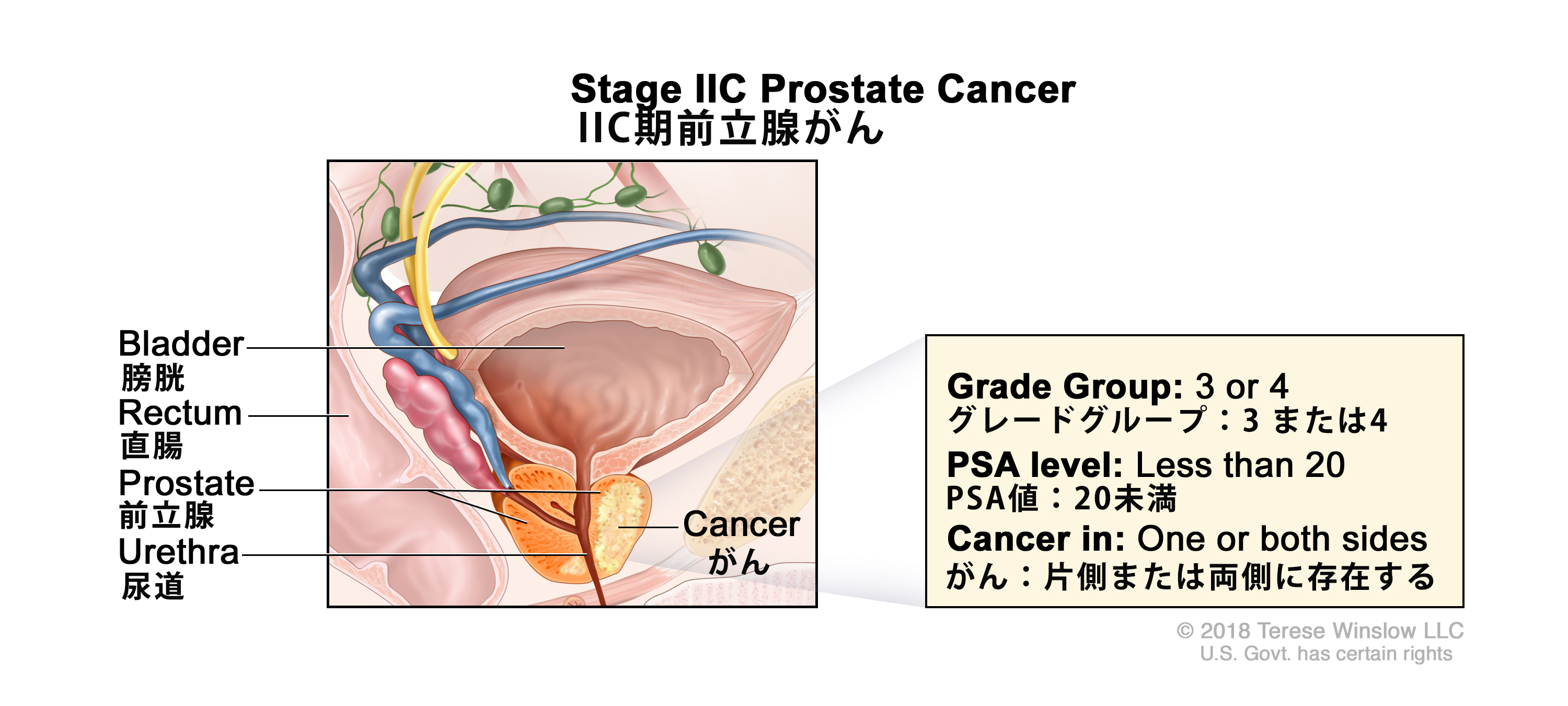
T1-2、N0、M0 上述のIIB期のT1-2、N0、M0の記述を参照のこと。 <20 グリソンスコア、8;グリソンパターン、4+4、3+5、または5+3(4)。 表4.TNM分類におけるIIIA期、IIIB期、およびIIIC期の定義a 病期 TNM 説明 PSA グリソンスコア;グリソンパターン(悪性度グループ) 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;cT = 臨床的T;PSA = 前立腺特異抗原;pT = 病理学的T。 a出典:AJCC: Prostate.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.715–26. 上付き文字b~gの説明は、表5の末尾に示している。 IIIA T1-2、N0、M0 表3、IIB期のT1-2、N0、M0の記述を参照のこと。 ≥20 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 
グリソンスコア、7;グリソンパターン、3+4(2)。 グリソンスコア、7;グリソンパターン、4+3(3)。 グリソンスコア、8;グリソンパターン、4+4、3+5、または5+3(4)。 IIIB T3-4、N0、M0 cT3 = 隣接臓器に固着も浸潤もしていない前立腺外の腫瘍。 すべての値 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 
-cT3a = 前立腺外への進展(片側または両側)。 グリソンスコア、7;グリソンパターン、3+4(2)。 -cT3b = 片側または両側の精嚢へ浸潤した腫瘍。 グリソンスコア、7;グリソンパターン、4+3(3)。 pT3 = 前立腺外への進展。 グリソンスコア、8;グリソンパターン、4+4、3+5、または5+3(4)。 -pT3a = 前立腺外への進展(片側または両側)または膀胱頸部への顕微鏡的浸潤。 -pT3b = 片側または両側の精嚢へ浸潤した腫瘍。 cT4またはpT4 = 精嚢以外の外括約筋、直腸、膀胱、挙筋、および/または骨盤壁などの隣接臓器に固着または浸潤した腫瘍。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 IIIC すべてのT、N0、M0 TX = 原発腫瘍の評価が不可能。 すべての値 グリソンスコア、9または10;グリソンパターン、4+5、5+4、または5+5(5)。 
T0 = 原発腫瘍の証拠を認めない。 T1 = 触診で認められない臨床的に不顕性の腫瘍。 -T1a = 切除組織の5%以下の組織学的に偶然発見された腫瘍。 -T1b = 切除組織の5%を超える組織学的に偶然発見された腫瘍。 -T1c = 針生検で片側または両側に特定されるが、触知できない腫瘍。 cT2 = 腫瘍が触知可能で、前立腺内に限局している。 -cT2a = 腫瘍の浸潤が片側の1/2以下。 -cT2b = 浸潤が片側の1/2を超えているが、両側には及んでいない腫瘍。 -cT2c = 両側に及んでいる腫瘍。 -pT2 = 臓器に限局する。 cT3 = 隣接臓器に固着も浸潤もしていない前立腺外の腫瘍。 -cT3a = 前立腺外への進展(片側または両側)。 -cT3b = 片側または両側の精嚢へ浸潤した腫瘍。 pT3 = 前立腺外への進展。 -pT3a = 前立腺外への進展(片側または両側)または膀胱頸部への顕微鏡的浸潤。 -pT3b = 片側または両側の精嚢へ浸潤した腫瘍。 cT4またはpT4 = 精嚢以外の外括約筋、直腸、膀胱、挙筋、および/または骨盤壁などの隣接臓器に固着または浸潤した腫瘍。 N0 = 転移陽性の所属リンパ節を認めない。 M0 = 遠隔転移を認めない。 表5.TNM分類におけるIVA期およびIVB期の定義a 病期 TNM 説明 PSA グリソンスコア;グリソンパターン(悪性度グループ) 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;cT = 臨床的T;PSA = 前立腺特異抗原;pT = 病理学的T。 a出典:AJCC: Prostate.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.715–26. bPSAまたは悪性度グループのいずれかが利用できない場合、病期分類はT分類および/またはPSAまたは悪性度グループのいずれか(利用できる場合)により決定すべきである。 c病理学的なT1分類は存在しない。 d切除断端陽性は、R1(顕微鏡的残存病変を示す)という記述語で指定すべきである。 e複数の部位に転移が認められる場合は、最も進行した分類を用いる。M1cが最も進行した分類である。 fPSA値は、この分類を割り当てるために用いられる。 g最近、グリソンシステムは、いわゆる悪性度グループに要約されている。[ 16 ] IVA すべてのT、N1、M0 すべてのT = 表4、IIIC期の記述を参照のこと。 表4、IIIC期のすべてのPSA値を参照のこと。 グリソンスコア、≤6;グリソンパターン、≤3+3(1)。 
グリソンスコア、7;グリソンパターン、3+4(2)。 グリソンスコア、7;グリソンパターン、4+3(3)。 N1 = 所属リンパ節転移を認める。 グリソンスコア、8;グリソンパターン、4+4、3+5、または5+3(4)。 M0 = 遠隔転移を認めない。 グリソンスコア、9または10;グリソンパターン、4+5、5+4、または5+5(5)。 IVB すべてのT、すべてのN、M1 すべてのT = 表4、IIIC期の記述を参照のこと。 表4、IIIC期のすべてのPSA値を参照のこと。 すべてのグリソンスコア;グリソンパターン(悪性度グループ) = 上述のIVA期を参照のこと。 
NX = 所属リンパ節未評価。 N0 = 転移陽性の所属リンパ節を認めない。 N1 = 所属リンパ節転移を認める。 M1 = 遠隔転移を認める。 -M1a = 所属リンパ節以外への転移。 -M1b = 骨転移。 -M1c = 骨転移の有無を問わず、その他の部位への転移。 参考文献- Zelefsky MJ, Eastham JA, Sartor AO: Cancer of the prostate. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1220-71.[PUBMED Abstract]
- Oesterling JE, Martin SK, Bergstralh EJ, et al.: The use of prostate-specific antigen in staging patients with newly diagnosed prostate cancer. JAMA 269 (1): 57-60, 1993.[PUBMED Abstract]
- Huncharek M, Muscat J: Serum prostate-specific antigen as a predictor of radiographic staging studies in newly diagnosed prostate cancer. Cancer Invest 13 (1): 31-5, 1995.[PUBMED Abstract]
- Schiebler ML, Yankaskas BC, Tempany C, et al.: MR imaging in adenocarcinoma of the prostate: interobserver variation and efficacy for determining stage C disease. AJR Am J Roentgenol 158 (3): 559-62; discussion 563-4, 1992.[PUBMED Abstract]
- Schuessler WW, Pharand D, Vancaillie TG: Laparoscopic standard pelvic node dissection for carcinoma of the prostate: is it accurate? J Urol 150 (3): 898-901, 1993.[PUBMED Abstract]
- Stone NN, Stock RG, Unger P: Indications for seminal vesicle biopsy and laparoscopic pelvic lymph node dissection in men with localized carcinoma of the prostate. J Urol 154 (4): 1392-6, 1995.[PUBMED Abstract]
- Oesterling JE, Brendler CB, Epstein JI, et al.: Correlation of clinical stage, serum prostatic acid phosphatase and preoperative Gleason grade with final pathological stage in 275 patients with clinically localized adenocarcinoma of the prostate. J Urol 138 (1): 92-8, 1987.[PUBMED Abstract]
- Fournier GR, Narayan P: Re-evaluation of the need for pelvic lymphadenectomy in low grade prostate cancer. Br J Urol 72 (4): 484-8, 1993.[PUBMED Abstract]
- Daniels GF, McNeal JE, Stamey TA: Predictive value of contralateral biopsies in unilaterally palpable prostate cancer. J Urol 147 (3 Pt 2): 870-4, 1992.[PUBMED Abstract]
- Webb JA, Shanmuganathan K, McLean A: Complications of ultrasound-guided transperineal prostate biopsy. A prospective study. Br J Urol 72 (5 Pt 2): 775-7, 1993.[PUBMED Abstract]
- Smith JA, Scardino PT, Resnick MI, et al.: Transrectal ultrasound versus digital rectal examination for the staging of carcinoma of the prostate: results of a prospective, multi-institutional trial. J Urol 157 (3): 902-6, 1997.[PUBMED Abstract]
- Gerber GS, Goldberg R, Chodak GW: Local staging of prostate cancer by tumor volume, prostate-specific antigen, and transrectal ultrasound. Urology 40 (4): 311-6, 1992.[PUBMED Abstract]
- Hanks GE, Krall JM, Pilepich MV, et al.: Comparison of pathologic and clinical evaluation of lymph nodes in prostate cancer: implications of RTOG data for patient management and trial design and stratification. Int J Radiat Oncol Biol Phys 23 (2): 293-8, 1992.[PUBMED Abstract]
- Jewett HJ: The present status of radical prostatectomy for stages A and B prostatic cancer. Urol Clin North Am 2 (1): 105-24, 1975.[PUBMED Abstract]
- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26.[PUBMED Abstract]
- Epstein JI, Egevad L, Amin MB, et al.: The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 40 (2): 244-52, 2016.[PUBMED Abstract]
- 前立腺がんに対する治療法選択肢の概要
-
限局性前立腺がん患者の多くで、局所療法により無病生存(DFS)期間の延長がみられるが、腫瘍が局所的に進展した患者における治癒はまれである。臨床的理解が現状の診断技法を用いたものであるため、臨床的にはがんが前立腺に限局している場合でも、手術または放射線による局所療法後に、播種性腫瘍が認められる患者もいる。
各病期の前立腺がんに対する治療法の選択肢について、表6に示している。
表6.病期ごとの前立腺がんに対する治療法の選択肢 病期( 標準治療法の選択肢 EBRT = 外照射療法;LH-RH = 黄体化ホルモン放出ホルモン;TURP = 経尿道的前立腺切除術。 I期の前立腺がん 注意深い経過観察または積極的サーベイランス/積極的モニタリング 根治的前立腺全摘除術 外照射療法(EBRT) 組織内密封小線源治療 II期の前立腺がん 注意深い経過観察または積極的サーベイランス/積極的モニタリング 根治的前立腺全摘除術 ホルモン療法併用または非併用のEBRT 組織内密封小線源治療 III期の前立腺がん ホルモン療法併用または非併用のEBRT 放射線療法併用または非併用のホルモン操作療法 EBRT併用または非併用の根治的前立腺全摘除術 注意深い経過観察または積極的サーベイランス/積極的モニタリング IV期の前立腺がん ホルモン操作療法 ビスホスホネート ホルモン療法併用または非併用のEBRT 症状緩和目的の放射線療法 経尿道的前立腺切除術(TURP)による症状緩和目的の手術 注意深い経過観察または積極的サーベイランス/積極的モニタリング 再発前立腺がん ホルモン療法 ホルモン抵抗性前立腺がんに対する化学療法 免疫療法 放射性医薬品治療/アルファ線エミッター放射線療法 各治療アプローチの副作用が以下の該当するセクションで扱われている。患者が報告する有害作用は、臨床的に限局性の疾患を管理するための選択肢間でかなり異なっており、直接比較したものはほとんどなく、選択肢としては注意深い経過観察/積極的サーベイランス/積極的モニタリング、根治的前立腺全摘除術、放射線療法などがある。有害作用における差は、治療法の選択肢間の患者の選択において重要な役割を果たす可能性がある。集団ベースのコホート研究において、追跡期間は2~3年と比較的短かったが、こうした有害作用の詳細な比較が報告されている。[ 1 ][ 2 ]
注意深い経過観察または積極的サーベイランス/積極的モニタリング
高齢であるかまたは随伴疾患のある無症候性の患者は、すぐに積極的に治療することはせず、慎重に観察する方がよい。[ 3 ][ 4 ]観察と待機、観察、待機的管理、および積極的サーベイランス/積極的モニタリングは、治癒目的の即時治療を採用しない戦略を指す用語である。
注意深い経過観察および積極的サーベイランス/積極的モニタリングの用語が最も広く使用されているが、文献では必ずしも明確に区別されているわけではなく、結果の解釈が困難となっている。注意深い経過観察の一般的な考え方は、腫瘍増悪による症状を軽減するために必要な緩和ケアを適応した患者をフォローアップすることである。フォローアップのいずれの時点でも治癒目的の治療を試みることは予定しない。例えば、局所の腫瘍増殖がみられる場合には、腫瘍に伴う尿道閉塞の症状を軽減するために、経尿道的前立腺切除術(TURP)またはホルモン療法を実施することがある;また、転移による疼痛を緩和するために、ホルモン療法または骨への放射線療法を実施することもある。病期が初期(すなわち、臨床病期がT1b、T1c、またはT2)の男性を対象に、根治的前立腺全摘除術が注意深い経過観察または積極的サーベイランス/積極的モニタリングと比較されている。[ 5 ](詳しい情報については、本要約の前立腺がんに対する治療法選択肢の概要のセクション内の根治的前立腺全摘除術のセクションを参照のこと。)
対照的に、積極的サーベイランス/積極的モニタリングの背景にある戦略は、臨床的に限局性の病変に対する治療は遅らせるものの、定期的に患者を追跡し、腫瘍の局所進行の徴候が少しでも認められた場合には、治癒目的の局所療法を開始することである。[ 6 ][ 7 ][ 8 ][ 9 ]この意図は、腫瘍が無症候性または非進行性の男性では治療による合併症を避けるが、腫瘍が進行した場合は、治癒させる能力を温存しておくことである。積極的サーベイランス/積極的モニタリングには、しばしば以下のものが含まれる:
介入基準のほか、患者選別、検査間隔、および特殊検査については、任意に選択できるが、対照試験で確立されたものではない。
広範なPSAスクリーニングの他の設定と同様に、米国における限局性前立腺がんの保存的管理の結果は特に良好である。総じて、注意深い経過観察または積極的サーベイランス/積極的モニタリング(研究によってさまざまな基準を使用)により管理された男性の前立腺がん特異的死亡率は(最近のシリーズにおける最も良好なもので)約1~10%と非常に良好である。[ 10 ][ 11 ][ 12 ][ 13 ][ 14 ][ 15 ][ 16 ][ 17 ][ 18 ]したがって、前立腺がんがスクリーニングで発見された男性のほとんどが積極的サーベイランス/積極的モニタリングの候補の可能性があり、根治治療は腫瘍増悪の徴候に対してのみ使用すべきである。このことは、積極的モニタリング、根治的前立腺全摘除術、および放射線療法を比較した大規模なProstate Testing for Cancer Treatment(ProtecT[NCT02044172およびISRCTN20141297])ランダム化試験で最も明確に示されている。[ 19 ](積極的サーベイランスおよび/または積極的モニタリングと即時治療との比較に関する情報については、本要約の根治的前立腺全摘除術のセクションを参照のこと。)
(詳しい情報については、本要約のII期の前立腺がんの治療のセクションを参照のこと。)
根治的前立腺全摘除術
根治的前立腺全摘除術は、一般に以下の患者のみに使用される:[ 20 ][ 21 ][ 22 ]
開創前立腺摘出術は、経会陰式または恥骨後式アプローチによって施行可能である。経会陰式では、リンパ節郭清術に別の切開が必要となる。腹腔鏡下リンパ節郭清は技術的に可能である。[ 23 ]ロボット支援前立腺摘出術は開創前立腺摘出術の代替であり、先進国では最も一般的な手技となっている。経験豊かな術者では、開創とロボット支援の前立腺摘出術間の機能的転帰はきわめて類似しているとみられ、少なくとも短期から中期では同程度である。前立腺摘出術に適した308人の男性を対象としたランダム化試験で、追跡期間中央値24ヵ月での排尿機能、性機能、および腸機能の転帰は、開放手術による恥骨後式手術とロボット支援手術間で類似していた。[ 24 ]あまりにもサンプルサイズが小さく、追跡期間が短いため、がんの転帰に意味のある違いは検出できなかった。
小さな高分化結節であれば、骨盤リンパ節陽性となる割合は20%未満であり、骨盤リンパ節郭清術は実施せずにおいてもよい。[ 25 ]腫瘍が大きく分化度が低いほど、骨盤リンパ節郭清が重要となる。これらの症例で、開腹手術または腹腔鏡下による骨盤リンパ節郭清術に治療的価値はないが、これによりリンパ節陽性患者が前立腺摘出術の合併症にさらされずに済む。骨盤リンパ節凍結切片の評価により転移が明らかになれば、通常、根治的前立腺全摘除術が実施されることはない;このような患者では、既存の臨床試験への登録を考えるか、放射線療法により局所症状を抑えるべきである。
術前(ネオアジュバント)ホルモン療法の役割は現時点では確立されていない。[ 26 ][ 27 ]
根治的前立腺全摘除術後は、病理学的評価により、腫瘍の範囲が以下の種類に層別化される:
他の治療選択肢と比較した根治的前立腺全摘除術
1993年に、144本の論文について構造化文献レビューが実施され、臨床的に限局性の前立腺がんに対する最初の治療戦略として、以下の3種類が比較された:[ 30 ]
- 根治的前立腺全摘除術。
- 根治的放射線療法。
- 観察(注意深い経過観察または積極的サーベイランス/積極的モニタリング)。
本レビューの著者らは、どの研究にも報告および選択に不備があり、上の3つの対応戦略の有効性について妥当な比較をするのは不可能であると締めくくっている。
腫瘍が触知可能で臨床的に限局性の患者を対象としたケースシリーズの文献レビューで、著者らは、10年前立腺がん特異的生存率が根治的前立腺全摘除術のシリーズで最も良好(約93%)で、放射線療法のシリーズで最も不良(約75%)であり、待機療法がその中間(約85%)であったことを明らかにした。[ 31 ]放射線療法ががん特異的生存を悪化させるとはまず考えられず、選択因子が治療選択に影響していると考えるのが最も妥当である。このような選択因子により、治療戦略が正確に比較できなくなっている。[ 32 ]
病期が早期(すなわち、臨床病期がT1b、T1c、またはT2)の男性を対象に、根治的前立腺全摘除術を注意深い経過観察または積極的サーベイランス/積極的モニタリングと比較したランダム化試験では、矛盾する結果が得られている。この結果の相違は、男性が前立腺がんと診断された方法が異なっていた結果である可能性がある。
証拠(根治的前立腺全摘除術 vs 注意深い経過観察または積極的サーベイランス/積極的モニタリング):
- PSAスクリーニング導入前の時代にスウェーデンで実施された1件のランダム化臨床試験では、前立腺がんの男性695人が、根治的前立腺全摘除術か注意深い経過観察のいずれかにランダムに割り付けられた。この試験において、PSAスクリーニングにより診断された男性はわずかに約5%であった。したがって、この男性群は、米国で前立腺がんと診断される男性で典型的にみられる場合よりも、より進展した局所腫瘍を有していた。[ 33 ][ 34 ][ 35 ]
- Prostate Intervention Versus Observation Trial(PIVOT-1または、VA-CSP-407)は、PSAスクリーニング導入後の時代に実施され、根治的前立腺全摘除術と注意深い経過観察を直接比較したランダム化試験である。1994年11月から2002年1月に、限局性前立腺がん(病期T1-2、NX、M0、血中PSA 50ng/mL未満)で平均余命が10年以上の75歳以下の男性731人が、根治的前立腺全摘除術群または注意深い経過観察群にランダムに割り付けられた。[ 5 ][ 36 ][ 37 ][証拠レベル:1iiA、証拠レベル:1iiB]
-
ProtecT試験(NCT02044172およびISRCTN20141297)では、82,429人の男性がPSA検査でスクリーニングを受け、2,664人が臨床的に限局性の前立腺がんと診断され、このうち1,643人(年齢中央値62歳、範囲50~69歳)が、積極的モニタリング、根治的前立腺全摘除術(可能な場合には神経温存)、または三次元(3D)原体外照射療法(37分割で74Gy)のいずれかにランダムに割り付けて実施する比較に同意した。主要エンドポイントは前立腺がん特異的死亡率であった。[
19
]
- 中央値10年の追跡で、前立腺がんにより17人が死亡したが、3つの研究群間で統計的有意差は認められなかった(P = 0.48)。10年前立腺がん特異的生存率は、積極的モニタリング群で98.8%、根治的前立腺全摘除術群で99.0%、および放射線療法群で99.6%であった。[ 19 ][証拠レベル:1iiA]
- 同様に、全原因死亡率は3つの研究群すべてでほぼ同じであった:1,000人年当たりの死亡は積極的モニタリング群で10.9、根治的前立腺全摘除術群で10.1、および放射線療法群で10.3であった(P = 0.87)。[ 19 ][証拠レベル:1iiB]
- 治療群間で転移性疾患への進行(4年後に出現が見られ始めた)については統計的有意差がみられた(積極的モニタリング、33/545;根治的前立腺全摘除術、13/553;放射線療法、16/545)が、こうした差は10年間の追跡で死亡率における差につながらなかった。10年間で、患者の52%が積極的な介入を必要とした。
- 予想されたように、患者が報告するアウトカムは3つの管理アプローチ間でかなりの差がみられた。[ 38 ][証拠レベル:1iiC]ランダム化後、最長6年間で患者が報告するアウトカムに関するサブスタディは以下の通りであった:
根治的前立腺全摘除術の合併症
根治的前立腺全摘除術の合併症としては、以下のものがある:
性機能、排尿機能、腸機能、および健康関連の生活の質(QOL)について根治的前立腺全摘除術の機能的転帰は、手技が開放手術による恥骨後式根治的前立腺全摘除術、腹腔鏡下前立腺全摘除術、またはロボット支援根治的前立腺全摘除術であるかに関係なくほぼ同じようである。[ 59 ]
根治的前立腺全摘除術に起因する病的状態および死亡
1991年から1994年までに施行された101,604件の根治的前立腺全摘除術のメディケア記録の解析では、以下のことが示された:[ 39 ]
この研究期間全体で、これらの発生率は、それぞれ30%、8%、および12%低下した。[ 39 ]
施行例が少ない病院で行われた前立腺摘除術は、施行例が多い病院で行われた場合と比べ、以下のことに関係していた:[ 40 ][ 41 ]
手術による病的状態および死亡の発生率は年齢とともに増加する。共存症、特に基礎にある心血管疾患および脳卒中の病歴は、年齢に関連した30日間の死亡率増加の一部を占める。
1990年から1999年までにオンタリオで全例が根治的前立腺全摘除術を受けた前立腺がん男性のコホートで、共存症がみられない75歳の男性では、30日死亡率が0.74%と予測された。また、手術後30日の合併症発生率は、年齢よりも共存症に多く依存していた(すなわち、共存基礎疾患数が0 vs 4つ以上の男性で、それぞれ約5% vs 40%)。[ 41 ]
尿失禁および勃起不全
尿失禁および勃起不全は、根治的前立腺全摘除術に起因する可能性のある合併症で、多くの研究で調査されている。
証拠(根治的前立腺全摘除術後の尿失禁および勃起不全):
- 解剖学的(神経温存)手技により根治的前立腺全摘除術を受けた男性の大規模なケースシリーズでは、以下のことが報告された:[ 43 ]
- 1988年から1990年に根治的前立腺全摘除術を受けたメディケア加入患者を対象とした全国的調査では、前述のケースシリーズよりも高い罹病率が報告された。[ 44 ]
- 前立腺がんに対して根治的前立腺全摘除術を最近受けた55~74歳の男性901人の集団ベースの縦断的コホート(Prostate Cancer Outcomes Study)では、以下のことが報告された:[ 45 ]
- 管理されたケア状況下で、根治的前立腺全摘除術、放射線療法、または注意深い経過観察および積極的サーベイランスによる治療を受けた前立腺がん患者を対象とした横断的調査により、前立腺摘除術施行群に性機能不全および排尿障害の割合が大幅に高いことが示された。[ 46 ]
- 熟練外科医による根治的前立腺全摘除術を受けた男性93人、459人、および89人の各ケースシリーズでは、性交能力について男性に細かく質問したところ、全国的なメディケア調査と同程度に勃起不全の割合が高いことが示されたが、これらのケースシリーズの男性は、メディケア調査よりも平均年齢が若かった。[ 47 ][ 48 ][ 49 ]このうちの1つのケースシリーズは、国の調査と同一の問診票を用いた。[ 47 ]この研究での尿失禁率も、国の調査のものと近似していた。
集団ベースの調査と個々の施設からのケースシリーズとの間では、報告に違いがあることが多い。その理由として、以下のものが考えられる:
陰茎の短縮
根治的前立腺全摘除術を受けた男性を対象としたケースシリーズでは、陰茎長の短縮(平均で1~2cm)が示されている。[ 50 ][ 51 ][ 52 ]短縮の機能的結果については十分に研究されていないが、一部の男性にとっては注目に値する結果である。
臨床的に限局性の前立腺がんの初期治療後にPSAが上昇した男性を登録したデータによると、根治的前立腺全摘除術を受けた男性510人中19人(3.7%)が陰茎サイズの短縮を訴えた。[ 60 ]しかしながら、このデータは患者への直接質問または治療前後の陰茎長測定ではなく、患者の愁訴に関する医師の報告を基にしていた。また、この研究の症例は、腫瘍再発が確認されたか、疑われる患者に限定されており、一般化が困難になっている。
すべてではないものの一部のケースシリーズ(男性が長期間追跡された)において、1~2年以内に陰茎長が手術前の測定値に回復することが報告されている。[ 61 ]
鼠径ヘルニア
根治的前立腺全摘除術の合併症の1つとして、鼠径ヘルニアが報告されている。
証拠(根治的前立腺全摘除術後の鼠径ヘルニア):
- レトロスペクティブ・コホート研究およびケースシリーズにより、根治的前立腺全摘除術を受けた男性における鼠径ヘルニアの発現率増加が示されており、その範囲は7~21%で、発現率は手術の2年以内にピークに達する。[ 53 ][ 54 ][ 55 ][ 56 ][ 57 ]
- 観察研究により、発現率は良性疾患に対して前立腺生検単独、経尿道的切除、および開創単純前立腺摘出術(simple open prostatectomy)を受けた比較可能な男性[ 53 ][ 54 ];または骨盤リンパ節郭清単独または放射線療法を受けた前立腺がん男性[ 53 ][ 55 ][ 56 ]におけるよりも高いことが示唆されている。
根治的前立腺全摘除術後の鼠径ヘルニアの発現率増加が一貫して観察されているが、泌尿器科医により慎重に経過観察されている前立腺がん男性では、頻回の検査または画像診断検査によって鼠径ヘルニアの検出率が高くなっている(すなわち、検出バイアス)と考えられる。男性には、前立腺摘除術のこの潜在的な合併症について認識させておくべきである。
大便失禁
根治的前立腺全摘除術は、便失禁の原因となることがあり、その発生率は手術法によって異なる場合がある。[ 58 ]
証拠(根治的前立腺全摘除術後の大便失禁):
- 国の調査では、調査時から1年以上前に根治的前立腺全摘除術を受けた男性907人において、会陰式(神経温存的)根治的前立腺全摘除術を受けた男性の32%および恥骨後式根治的前立腺全摘除術を受けた男性の17%が、偶発的な便漏れの症候を報告した。回答者の10%は中等量の便の漏れがあったと報告し、回答者の4%は大量の便の漏れがあったと報告した。便失禁を経験した男性のうち、このことを医師または医療提供者に報告したと回答したものは15%未満であった。[ 58 ]
放射線療法および放射性医薬品療法
外照射療法(EBRT)
根治的放射線療法が適応とされる患者は、臨床的に前立腺および/または周囲組織にがんが限局している(I期、II期、およびIII期)ことが病理学的な診断で確定していなければならない。病期判定のための開腹術およびリンパ節郭清は必要ない。
医学的に根治的前立腺全摘除術が適用しにくいと考えられる患者では、放射線療法が優れた選択肢となる場合がある。これらの患者では、照射手技に注意を払えば、許容範囲内の低い合併症発生率で治療が可能となる。[ 62 ]
放射線療法の長期成績は病期に左右されるとともに、放射線量に関連している。
証拠(EBRT):
- 高エネルギー放射線療法を受けた患者999人のレトロスペクティブ・レビューでは、10年原因特異的生存率がT病期によって大幅に異なることが示された:T1(79%)、T2(66%)、T3(55%)、およびT4(22%)。[ 63 ]最初の血清PSA値が15ng/mLを超えることは、従来の放射線療法が失敗する可能性を示す予測因子である。[ 64 ]
- いくつかのランダム化研究によって、高線量(74~79Gy)の放射線療法では、低線量(64~70Gy)と比較した場合、生化学的(PSAに基づく)再発がみられない期間の延長が明らかになっている。[ 65 ][ 66 ][ 67 ][ 68 ][ 69 ][証拠レベル:1iiDiii]これらの研究で、原因特異的生存率における高線量の有益性を実証したものはなかった。
(放射線療法と積極的サーベイランス/積極的モニタリングおよび根治的前立腺全摘除術との直接比較については、本要約の他の治療選択肢と比較した根治的前立腺全摘除術のセクションを参照のこと。)
臨床的にも病理学的にも転移がみられない骨盤リンパ節に対する予防的放射線療法では、例えば、RTOG-7706試験において確認されているように、OSまたは前立腺がん特異的生存の改善はみられないようである。[ 70 ][証拠レベル:1iiA]
従来のEBRT vs 低分割EBRT
より便利な治療スケジュールの低分割放射線療法(1分割当たりの線量を高くして、より少ない分割数を用いる)によって従来のスケジュールの放射線と同等の治療成績が得られるようである(少なくともDFSおよび無失敗生存の中間結果-証拠レベルが低く健康上のアウトカムに結びつくかどうかは不明-およびOS率に関する初期のデータについて)。しかしながら、低分割放射線療法は、用いられるスケジュール次第で標準線量よりも高い毒性を招く可能性がある。[ 71 ]
証拠(従来のEBRT vs 低分割EBRT):
- 主に1つの治療施設からの小規模なランダム化試験で、従来の低分割照射法は従来の分割照射法より優れているとはいえないことが明らかになった。[ 72 ]この試験では、評価可能な男性303人が2.0Gyごとに38分割した計76GyのIMRT(従来型IMRT[CIMRT]群)または2.7Gyごとに26分割した計70.2GyのIMRT(低分割IMRT[HIMRT]群)のいずれかにランダムに割り付けられた。
- はるかに大規模の多施設Conventional or Hypofractionated High-Dose Intensity Modulated Radiotherapy in Prostate Cancer(CHHiP)試験[NCT00392535]では、T1b-T3a期、N0、M0のがんを有し精嚢転移の推定リスクが30%未満の男性3,216人が、37分割で74Gy(従来の分割照射群)、20分割で60Gy、または19分割で57Gyのいずれか(1:1:1の比率)を照射される群にランダムに割り付けられた。[ 73 ][ 74 ]この試験は、非劣性研究としてデザインされた。
- 前立腺がん患者に対して低分割 vs 従来の分割による放射線療法に関する別の多施設ランダム化試験(HYPRO研究[ISRCTN85138529])では、中リスクまたは高リスク前立腺がん(T1b-T4期、NX-0、MX-0)の男性820人において低分割に対する非劣性デザインで従来の放射線療法の線量(8週間にわたって78Gyを39分割)が低分割放射線療法の線量(6.5週間にわたって64.6Gyを19分割)と比較された。[ 75 ][ 76 ]追跡期間中央値は60ヵ月であった。
- RTOGにより、低リスク前立腺がん(T1b-T2c)で低分割放射線療法(5.6週間にわたって70Gyを28分割) vs 従来の放射線療法の線量(8.2週間にわたって73.8Gyを41分割)を受ける群にランダムに割り付けられた男性1,115人の非劣性試験が報告された。[ 78 ]
- 1件の多施設試験(NCT00304759)では、中リスクの前立腺がん(T1-2a、グリソンスコアが6以下、PSAが10.1-20ng/mL;T2b-2c、グリソンスコアが6以下、PSAが20ng/mL以下;またはT1-2、グリソンスコアが7、PSAが20ng/mL以下)の男性1,206人が、非劣性試験のデザインで従来の放射線療法(39分割で78Gy) vs 低分割放射線療法(20分割で60Gy)を受けるようにランダムに割り付けられた。[ 79 ]
密封小線源治療
密封小線源治療を受ける患者は、以下のような良好な特徴で選択されることが多い:
病勢コントロールおよびQOLに対する最新の組織内密封小線源治療の効果についてさらに詳しく定義し、転帰に対する有利な患者選択の寄与を明確にするには、さらに多くの情報とさらなる研究が必要である。[ 80 ][証拠レベル:3iiiDiv]
現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
放射性医薬品療法
アルファ線エミッター放射線療法
ラジウム Ra 223(223Ra)は、アルファ粒子(すなわち、ヘリウム核と同じように2個の陽子と2個の中性子が結合した粒子)を放出し、半減期は11.4日である。これを静脈内投与すると、新たに形成された骨間質に選択的に取り込まれる。高エネルギーのアルファ粒子の射程距離は100mcM未満と短い。前立腺がんが骨に転移した患者では、223RaによりOSの改善が得られた。1件の二重盲検ランダム化比較試験において、症候性去勢抵抗性前立腺がんで、2ヵ所以上に骨転移を認め、内臓転移は不明な男性921人が、223Raを投与する群とプラセボ群に2:1の比率でランダムに割り付けられた。223Raは、OS(中央値14.9ヵ月 vs 11.3ヵ月)、症候性の骨関連事象発生率(33% vs 38%)、脊髄圧迫(4% vs 7%)のそれぞれに統計的に有意な改善をもたらした。[ 81 ][ 82 ][証拠レベル:1iA]4週間ごとに体重当たり50kBqの線量を6回投与した場合でも、副作用はプラセボと同程度であった。
放射線療法の合併症
根治的EBRTにより、急性膀胱炎、直腸炎、および腸炎が発生することがある。[ 20 ][ 42 ][ 49 ][ 83 ][ 84 ][ 85 ]こうした疾患は一般に可逆性であるが、慢性化することもあり、まれに外科的介入が必要になることもある。[ 85 ]
管理されたケア状況下で根治的前立腺全摘除術、放射線療法、または注意深い経過観察と積極的サーベイランスによる治療を受けた前立腺がん患者の横断的調査により、放射線療法群では性機能不全および排尿障害が多いことが示された。[ 46 ]
放射線もまた発がん性であることが知られている。[ 86 ][ 87 ][ 88 ]前立腺がんに対するEBRTに伴って、膀胱および消化管のがんリスクが増大する。密封小線源治療では、膀胱がんのリスク増加を伴う。
合併症の低減
短期間での放射線療法では、ほとんどの場合、勃起機能は温存されるが、長期化すると減退していくと考えられる。[ 85 ]一部の男性においては、放射線療法後の性機能障害の対処に、クエン酸シルデナフィルが効果的である。
証拠(合併症の低減):
- 臨床的限局性前立腺がんに対する放射線療法を受け、その後勃起不全を報告した60人の男性患者の完了したランダム化プラセボ対照クロスオーバーデザイン研究(RTOG-0215[NCT00057759])において、プラセボ投与後の18%に対し、シルデナフィル投与後では55%が性交の成功を報告した(P < 0.001)。[ 89 ][証拠レベル:1iC]
- 勃起機能が損なわれていない男性121人を対象に含む1件のランダム化試験(RTOG-0831[NCT00931528])では、EBRTまたは密封小線源治療の開始時から24週にわたり、予防的なタダラフィルの連日投与(5mg/日を経口)とプラセボを比較した[ 90 ][証拠レベル:1iC]。
直線加速器の使用など、高度な放射線療法技術を採用し、シミュレーションを綿密に行って、治療計画を立てることで、合併症が減少する可能性がある。[ 91 ][ 92 ]
証拠(3D原体照射法 vs 従来の放射線療法):
- 同程度の線量(総線量、60~64Gy)を用いた3D原体照射法と従来の放射線療法による副作用が、ランダム化非盲検研究で比較されている。[ 92 ][証拠レベル:1iiC]
放射線療法は、腹膜外のリンパ節郭清術後にも実施することができ、照射手技に慎重を期していれば、合併症が増大することはない。照射野には、郭清した骨盤リンパ節を含む領域を加えてはならない。TURPを受けていた場合は、放射線療法単独でみられる前述の尿道狭窄のリスクが高くなるが、TURPから4~6週間後まで放射線療法を延期すれば、尿道狭窄リスクは低下する。[ 93 ][ 94 ][ 95 ]閉塞症状の緩和目的で照射前に実施するTURPは、腫瘍の播種との関連が指摘されている;しかしながら、病理学的悪性度分類を行った症例における多変量解析では、この播種の原因が、手技そのものの結果というよりも、TURPを必要とする症例の基礎にある不良な予後によるものである可能性を示している。[ 96 ]
放射線療法と根治的前立腺全摘除術による合併症の比較
一般的に、根治的前立腺全摘除術は、尿失禁および早期の勃起不全の発生率が高いことに関連しているが、便失禁および直腸損傷の発生率は低い。しかしながら、放射線療法からの経過時間が長いほど勃起不全のリスクが増すため、この勃起不全における差は時間とともに縮小する。前立腺がんに対する根治的局所療法の副作用の多くが治療から10年を過ぎても確実に継続し、勃起不全に加えて尿の問題は年齢を重ねるとともに悪化しうる。[ 97 ]
証拠(根治的前立腺全摘除術 vs 放射線療法の比較):
ホルモン療法とその合併症
さまざまな病期の前立腺がんの管理では、複数の異なるホルモンによるアプローチが使用される。
これらの治療法には以下のものがある:
酢酸アビラテロン
酢酸アビラテロンは、進行期前立腺がんが去勢感受性疾患である男性においてADTに追加した場合に、OSを改善することが示されている。酢酸アビラテロンは一般的に忍容性が良好である;しかしながら、ADT単独と比較してグレード3または4の高血圧および低カリウム血症といったミネラルコルチコイド作用の増加に関連する。[ 100 ]酢酸アビラテロンはまた、呼吸障害のわずかな増加と関連しうる。[ 101 ]
両側精巣摘除術
両側精巣摘除術の利点には以下のものがある:[ 42 ]
- 手技が容易。
- コンプライアンスの問題がない。
- テストステロン値の低下が迅速。
- 他の種類のADTと比べて低コスト。
両側精巣摘除術の欠点には以下のものがある:[ 42 ][ 102 ]
- 心理的影響。
- 性欲喪失。
- 勃起不全の回復不良。
- ほてり。
- 骨粗鬆症。[ 102 ]
両側精巣摘除術では、冠動脈心疾患および心筋梗塞のリスク上昇との関連も指摘されている。[ 103 ][ 104 ][ 105 ][ 106 ]
(ほてりおよび寝汗に関するPDQ要約を参照のこと。)
エストロゲン療法
エストロゲンをジエチルスチルベストロール(DES)として3mg/日を投与すれば、テストステロン値が去勢レベルとなる。精巣摘除術と同じく、エストロゲンは性欲喪失および勃起不全を引き起こすことがある。また、エストロゲンは女性化乳房も引き起こすため、この合併症を予防するために、乳房に対して低線量の放射線療法を予防的に実施する。
米国では、もはやDESは製造も販売もされておらず、心筋梗塞、脳血管障害、肺塞栓症などの重篤な副作用のリスクのために、現在ではほとんど用いられない。
黄体形成ホルモン放出ホルモン(LH-RH)アゴニスト療法
leuprolide、ゴセレリン、およびブセレリンのようなLH-RHアゴニストは、テストステロン値を去勢レベルまで低下させる。精巣摘除術およびエストロゲンと同様に、LH-RHアゴニストは、勃起不全、ほてり、および性欲喪失を引き起こす。一過性に腫瘍増悪反応が生じることがあるが、抗アンドロゲン投与または数週間の短期エストロゲン低用量投与により防止可能である。
LH-RHアゴニストが心血管系罹病率または死亡率のリスク増加に関連しているという証拠がいくつか得られているが、その結果は一致していない。[ 103 ][ 104 ][ 105 ][ 106 ][ 107 ]
証拠(LH-RHアゴニストと心血管系疾患):
- Department of Veterans Affairsシステム内で実施された集団ベースの研究において、LH-RHアゴニストは、冠動脈心疾患、心筋梗塞、突然死、および脳卒中のような心血管疾患に加え、糖尿病のリスク増加と関連していた。[ 103 ][ 104 ][ 105 ]
- 非転移性の前立腺がん男性(対象患者4,141人)を対象に、LH-RHアゴニストの投与群と非投与群にランダムに割り付けた8件の試験に関する系統的証拠レビューおよびメタアナリシスでは、心血管疾患による死亡率に差は認められなかった(11.0% vs 11.2%;RR死亡、0.93;95%CI、0.79-1.10;P = 0.41)。[ 108 ]これらの試験の追跡期間中央値は7.6~13.2年であった。治療期間または患者の年齢(年齢中央値、70歳未満 vs 70歳以上)にかかわらず、LH-RHアゴニストの過剰リスクは確認されなかった。
抗アンドロゲン療法
前立腺がんの治療に用いられる抗アンドロゲン剤としては、フルタミドおよびビカルタミドがある。1件の証拠の系統的レビューでは、11件のランダム化試験からの局所進行性、転移性、または局所療法後に再発した前立腺がん男性3,060人において、非ステロイド性抗アンドロゲン単独療法と外科的または内科的去勢が比較された。[ 109 ]単独療法としての非ステロイド性抗アンドロゲンの使用では、OSが低下し、臨床的進行および治療失敗の割合が増加した。[ 109 ][証拠レベル:1iiA]
純粋な抗アンドロゲン剤であるフルタミドは、下痢、乳房圧痛、および吐き気を引き起こすことがある。致死性および非致死性の肝毒性作用の症例報告がある。[ 110 ]
また、ビカルタミドは、吐き気、乳房圧痛、のぼせ、性欲喪失および勃起不全の原因となる。[ 111 ](詳しい情報については、消化管の合併症;がん治療に関連した吐き気と嘔吐;およびほてりおよび寝汗に関するPDQ要約を参照のこと。)
ステロイド性抗アンドロゲンである酢酸メゲストロールは、アンドロゲン産生の抑制作用が不完全であり、一般的に初回療法としては用いられない。
QOLに対する種々ホルモン療法の効果を評価するさらなる試験が必要である。[ 112 ]
ADT
前立腺がんに対して根治的前立腺全摘除術を受け、アンドロゲン遮断療法(内科的または外科的方法のいずれかで遮断)を受けた男性または受けなかった男性を対象にした全国的なメディケア調査によると、アンドロゲン遮断群では以下の7項目の健康関連のQOLのすべての指標において低下が認められた:[ 113 ][証拠レベル:3iC]
- がんと治療の影響。
- 体型に関する懸念。
- 精神衛生。
- 一般的健康。
- 活動。
- がんと死についての悩み。
- 活力。
ADTは、骨粗鬆症および骨折を引き起こすことがある。追跡期間中央値5.1年の66歳以上のメディケア加入患者50,613人の集団ベースの標本において、ゴナドトロピン放出ホルモン(GnRH)または精巣摘除術のいずれかによる治療を受けた男性では、骨折の発生率が19.4%であったのに対して、ホルモン遮断療法を受けなかった男性では12.6%であった。その影響は、男性に転移性骨疾患が認められたかどうかにかかわらず、ほぼ同じであった。[ 114 ]
ADTの実施は、陰茎短縮の愁訴に関係している可能性があるが、データはきわめて限られている。[ 60 ]臨床的に限局性の前立腺がんの初期治療として放射線療法とADTを受けた後にPSAが上昇した男性の登録研究によると、陰茎サイズの短縮を訴えた男性は225人中6人(2.7%)であった。放射線療法を受けたがADTを受けなかった男性213人のうち、陰茎サイズの変化について訴えた男性はいなかった。しかしながら、このデータは患者への直接質問または治療前後の陰茎長測定ではなく、患者の愁訴に関する医師の報告を基にしていた。また、この研究の症例は、腫瘍再発が確認されたか、疑われる患者に限定されており、一般化が困難になっている。
プラセボ対照ランダム化試験で、前立腺がんに対してADTを受けた男性では、ビスホスホネートを用いた骨損失の治療により骨折リスクが低下する(15件の試験のメタアナリシスで、RR、0.80;95%CI、0.69-0.94)ことが示されている。このメタアナリシスでは、ゾレドロン酸が最も大きな効果を示した。[ 115 ]
ADTの使用は、大腸がんのリスク増加とも関係している。
証拠(大腸がんのリスク増加):
- Surveillance, Epidemiology, and End Results(SEER)のMedicareデータベースを用いて、研究者らは、最初に前立腺がんと診断された67歳以上の男性107,859人を対象に、その後の大腸がんのリスクを評価した。[
116
]
- 大腸がんの1,000人年当たりの発生率は、精巣摘除術を受けた男性で6.3(95%CI、5.3-7.5)、GnRH作動薬による治療を受けた男性で4.4(95%CI、4.0-4.9)、アンドロゲン除去療法を受けなかった男性で3.7(95%CI、3.5-3.9)であった。
- GnRH作動薬による治療を受けた男性では、治療期間の長期化とともにリスクが増大した(傾向でP = 0.01)。
抗副腎療法
前立腺がんの治療に用いられる抗副腎剤としては、ケトコナゾールおよびaminoglutethimideがある。ケトコナゾールを長期間使用すると、勃起不全、そう痒感、爪の変化、副腎不全が発生することがある。(詳しい情報については、そう痒症に関するPDQ要約を参照のこと。)aminoglutethimideは、鎮静および発疹を引き起こすことが多い。
臨床評価段階にある治療法の選択肢
前立腺がん患者に対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 凍結手術。
- 陽子線治療。
- 光線力学療法。
- 術前補助ホルモン療法。
- ビカルタミド。
凍結手術
凍結手術または凍結療法は、限局性前立腺がんの治療法として評価段階にある。これは、冷凍プローブを用いて前立腺を間欠的に冷凍することで前立腺がん細胞を破壊し、その後解凍させる手術手技の1つである。[ 117 ][証拠レベル:3iiiC];[証拠レベル:3iii];[ 118 ][ 119 ][証拠レベル:3iiiDiv]この手技では、標準的な前立腺摘除術および放射線療法と比較した場合の有効性および安全性に関する証拠が限られており、局所的毒性および正常組織の損傷を軽減する試みとして進化している。有効性に関する証拠の質は低く、現在は比較的小規模のケースシリーズ、短い追跡期間、および有効性の代替結果に限定されている。[ 120 ]
凍結手術に伴う重篤な毒性作用としては、膀胱下尿道損傷、尿失禁、勃起不全、および直腸損傷がある。勃起不全は多くみられ、約47~100%に及ぶ。
他の副作用の頻度および5年追跡時のがん制御率は、報告する施設間でばらつきがあり、手術や放射線療法のシリーズと比べて小規模である。[ 118 ][ 119 ]他の重大な合併症としては、尿道組織脱落、尿瘻または尿道狭窄、および膀胱頸部閉塞がある。[ 120 ]
陽子線治療
前立腺がんの治療を目的とした陽子線治療の使用に関心が高まっている。この方式の荷電粒子放射線の線量分布では、理論的に前立腺放射線の治療可能比を改善できる可能性があるため、副作用の大幅な増加を伴わずに腫瘍への線量増加が可能となるが、有効性および毒性について他の方式の放射線療法と比較したランダム化比較試験は報告されていない。
光線力学療法
低リスク前立腺がん男性において、光感作性薬剤を用いた血管標的光線力学療法が検証されている。[ 121 ]
ビカルタミド
ビカルタミドが限局性または局所進行前立腺がんの患者におけるOSを改善することは示されていない。
証拠(ビカルタミド):
- Early Prostate Cancerプログラムは、非転移性の限局性または局所進行前立腺がん(T1-2、N0、NX;T3-4、すべてのN;またはすべてのT、N+)の男性を対象として、ビカルタミド(150mg/日の経口投与) + 標準ケア(各施設の慣行に応じて、根治的前立腺全摘除術、放射線療法、または注意深い経過観察)を標準ケア単独と比較した国際的な大規模ランダム化プラセボ対照試験である。8,113人の男性のうち、リンパ節転移が確認されたのは2%未満であった。[
122
][証拠レベル:1iA]
- 追跡期間中央値7.4年で、ビカルタミド群とプラセボ群でOSに差は認められなかった(両群とも約76% [HR、0.99;95%CI、0.91-1.09;P = 0.89])。
現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Barocas DA, Alvarez J, Resnick MJ, et al.: Association Between Radiation Therapy, Surgery, or Observation for Localized Prostate Cancer and Patient-Reported Outcomes After 3 Years. JAMA 317 (11): 1126-1140, 2017.[PUBMED Abstract]
- Chen RC, Basak R, Meyer AM, et al.: Association Between Choice of Radical Prostatectomy, External Beam Radiotherapy, Brachytherapy, or Active Surveillance and Patient-Reported Quality of Life Among Men With Localized Prostate Cancer. JAMA 317 (11): 1141-1150, 2017.[PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994.[PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994.[PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009.[PUBMED Abstract]
- Klotz L: Active surveillance with selective delayed intervention: using natural history to guide treatment in good risk prostate cancer. J Urol 172 (5 Pt 2): S48-50; discussion S50-1, 2004.[PUBMED Abstract]
- Carter HB, Walsh PC, Landis P, et al.: Expectant management of nonpalpable prostate cancer with curative intent: preliminary results. J Urol 167 (3): 1231-4, 2002.[PUBMED Abstract]
- Klotz L, Vesprini D, Sethukavalan P, et al.: Long-term follow-up of a large active surveillance cohort of patients with prostate cancer. J Clin Oncol 33 (3): 272-7, 2015.[PUBMED Abstract]
- Johansson JE, Holmberg L, Johansson S, et al.: Fifteen-year survival in prostate cancer. A prospective, population-based study in Sweden. JAMA 277 (6): 467-71, 1997.[PUBMED Abstract]
- Johansson JE, Andrén O, Andersson SO, et al.: Natural history of early, localized prostate cancer. JAMA 291 (22): 2713-9, 2004.[PUBMED Abstract]
- Waaler G, Stenwig AE: Prognosis of localised prostatic cancer managed by "watch and wait" policy. Br J Urol 72 (2): 214-9, 1993.[PUBMED Abstract]
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management. JAMA 302 (11): 1202-9, 2009.[PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010.[PUBMED Abstract]
- Holmström B, Holmberg E, Egevad L, et al.: Outcome of primary versus deferred radical prostatectomy in the National Prostate Cancer Register of Sweden Follow-Up Study. J Urol 184 (4): 1322-7, 2010.[PUBMED Abstract]
- Barry MJ, Albertsen PC, Bagshaw MA, et al.: Outcomes for men with clinically nonmetastatic prostate carcinoma managed with radical prostactectomy, external beam radiotherapy, or expectant management: a retrospective analysis. Cancer 91 (12): 2302-14, 2001.[PUBMED Abstract]
- Lu-Yao GL, Yao SL: Population-based study of long-term survival in patients with clinically localised prostate cancer. Lancet 349 (9056): 906-10, 1997.[PUBMED Abstract]
- van den Bergh RC, Roemeling S, Roobol MJ, et al.: Outcomes of men with screen-detected prostate cancer eligible for active surveillance who were managed expectantly. Eur Urol 55 (1): 1-8, 2009.[PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016.[PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990.[PUBMED Abstract]
- Corral DA, Bahnson RR: Survival of men with clinically localized prostate cancer detected in the eighth decade of life. J Urol 151 (5): 1326-9, 1994.[PUBMED Abstract]
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994.[PUBMED Abstract]
- Schuessler WW, Vancaillie TG, Reich H, et al.: Transperitoneal endosurgical lymphadenectomy in patients with localized prostate cancer. J Urol 145 (5): 988-91, 1991.[PUBMED Abstract]
- Coughlin GD, Yaxley JW, Chambers SK, et al.: Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet Oncol 19 (8): 1051-1060, 2018.[PUBMED Abstract]
- Fournier GR, Narayan P: Re-evaluation of the need for pelvic lymphadenectomy in low grade prostate cancer. Br J Urol 72 (4): 484-8, 1993.[PUBMED Abstract]
- Witjes WP, Schulman CC, Debruyne FM: Preliminary results of a prospective randomized study comparing radical prostatectomy versus radical prostatectomy associated with neoadjuvant hormonal combination therapy in T2-3 N0 M0 prostatic carcinoma. The European Study Group on Neoadjuvant Treatment of Prostate Cancer. Urology 49 (3A Suppl): 65-9, 1997.[PUBMED Abstract]
- Fair WR, Cookson MS, Stroumbakis N, et al.: The indications, rationale, and results of neoadjuvant androgen deprivation in the treatment of prostatic cancer: Memorial Sloan-Kettering Cancer Center results. Urology 49 (3A Suppl): 46-55, 1997.[PUBMED Abstract]
- Adolfsson J, Rönström L, Löwhagen T, et al.: Deferred treatment of clinically localized low grade prostate cancer: the experience from a prospective series at the Karolinska Hospital. J Urol 152 (5 Pt 2): 1757-60, 1994.[PUBMED Abstract]
- Grossfeld GD, Chang JJ, Broering JM, et al.: Impact of positive surgical margins on prostate cancer recurrence and the use of secondary cancer treatment: data from the CaPSURE database. J Urol 163 (4): 1171-7; quiz 1295, 2000.[PUBMED Abstract]
- Wasson JH, Cushman CC, Bruskewitz RC, et al.: A structured literature review of treatment for localized prostate cancer. Prostate Disease Patient Outcome Research Team. Arch Fam Med 2 (5): 487-93, 1993.[PUBMED Abstract]
- Adolfsson J, Steineck G, Whitmore WF: Recent results of management of palpable clinically localized prostate cancer. Cancer 72 (2): 310-22, 1993.[PUBMED Abstract]
- Austenfeld MS, Thompson IM, Middleton RG: Meta-analysis of the literature: guideline development for prostate cancer treatment. American Urological Association Prostate Cancer Guideline Panel. J Urol 152 (5 Pt 2): 1866-9, 1994.[PUBMED Abstract]
- Holmberg L, Bill-Axelson A, Helgesen F, et al.: A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 347 (11): 781-9, 2002.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 370 (10): 932-42, 2014.[PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012.[PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017.[PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016.[PUBMED Abstract]
- Yao SL, Lu-Yao G: Population-based study of relationships between hospital volume of prostatectomies, patient outcomes, and length of hospital stay. J Natl Cancer Inst 91 (22): 1950-6, 1999.[PUBMED Abstract]
- Lu-Yao GL, McLerran D, Wasson J, et al.: An assessment of radical prostatectomy. Time trends, geographic variation, and outcomes. The Prostate Patient Outcomes Research Team. JAMA 269 (20): 2633-6, 1993.[PUBMED Abstract]
- Alibhai SM, Leach M, Tomlinson G, et al.: 30-day mortality and major complications after radical prostatectomy: influence of age and comorbidity. J Natl Cancer Inst 97 (20): 1525-32, 2005.[PUBMED Abstract]
- Sanda MG, Dunn RL, Michalski J, et al.: Quality of life and satisfaction with outcome among prostate-cancer survivors. N Engl J Med 358 (12): 1250-61, 2008.[PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993.[PUBMED Abstract]
- Fowler FJ, Barry MJ, Lu-Yao G, et al.: Patient-reported complications and follow-up treatment after radical prostatectomy. The National Medicare Experience: 1988-1990 (updated June 1993). Urology 42 (6): 622-9, 1993.[PUBMED Abstract]
- Potosky AL, Davis WW, Hoffman RM, et al.: Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study. J Natl Cancer Inst 96 (18): 1358-67, 2004.[PUBMED Abstract]
- Litwin MS, Hays RD, Fink A, et al.: Quality-of-life outcomes in men treated for localized prostate cancer. JAMA 273 (2): 129-35, 1995.[PUBMED Abstract]
- Jønler M, Messing EM, Rhodes PR, et al.: Sequelae of radical prostatectomy. Br J Urol 74 (3): 352-8, 1994.[PUBMED Abstract]
- Geary ES, Dendinger TE, Freiha FS, et al.: Nerve sparing radical prostatectomy: a different view. J Urol 154 (1): 145-9, 1995.[PUBMED Abstract]
- Lim AJ, Brandon AH, Fiedler J, et al.: Quality of life: radical prostatectomy versus radiation therapy for prostate cancer. J Urol 154 (4): 1420-5, 1995.[PUBMED Abstract]
- Savoie M, Kim SS, Soloway MS: A prospective study measuring penile length in men treated with radical prostatectomy for prostate cancer. J Urol 169 (4): 1462-4, 2003.[PUBMED Abstract]
- Gontero P, Galzerano M, Bartoletti R, et al.: New insights into the pathogenesis of penile shortening after radical prostatectomy and the role of postoperative sexual function. J Urol 178 (2): 602-7, 2007.[PUBMED Abstract]
- McCullough A: Penile change following radical prostatectomy: size, smooth muscle atrophy, and curve. Curr Urol Rep 9 (6): 492-9, 2008.[PUBMED Abstract]
- Sun M, Lughezzani G, Alasker A, et al.: Comparative study of inguinal hernia repair after radical prostatectomy, prostate biopsy, transurethral resection of the prostate or pelvic lymph node dissection. J Urol 183 (3): 970-5, 2010.[PUBMED Abstract]
- Sekita N, Suzuki H, Kamijima S, et al.: Incidence of inguinal hernia after prostate surgery: open radical retropubic prostatectomy versus open simple prostatectomy versus transurethral resection of the prostate. Int J Urol 16 (1): 110-3, 2009.[PUBMED Abstract]
- Lughezzani G, Sun M, Perrotte P, et al.: Comparative study of inguinal hernia repair rates after radical prostatectomy or external beam radiotherapy. Int J Radiat Oncol Biol Phys 78 (5): 1307-13, 2010.[PUBMED Abstract]
- Lodding P, Bergdahl C, Nyberg M, et al.: Inguinal hernia after radical retropubic prostatectomy for prostate cancer: a study of incidence and risk factors in comparison to no operation and lymphadenectomy. J Urol 166 (3): 964-7, 2001.[PUBMED Abstract]
- Lepor H, Robbins D: Inguinal hernias in men undergoing open radical retropubic prostatectomy. Urology 70 (5): 961-4, 2007.[PUBMED Abstract]
- Bishoff JT, Motley G, Optenberg SA, et al.: Incidence of fecal and urinary incontinence following radical perineal and retropubic prostatectomy in a national population. J Urol 160 (2): 454-8, 1998.[PUBMED Abstract]
- Nossiter J, Sujenthiran A, Charman SC, et al.: Robot-assisted radical prostatectomy vs laparoscopic and open retropubic radical prostatectomy: functional outcomes 18 months after diagnosis from a national cohort study in England. Br J Cancer 118 (4): 489-494, 2018.[PUBMED Abstract]
- Parekh A, Chen MH, Hoffman KE, et al.: Reduced penile size and treatment regret in men with recurrent prostate cancer after surgery, radiotherapy plus androgen deprivation, or radiotherapy alone. Urology 81 (1): 130-4, 2013.[PUBMED Abstract]
- Kadono Y, Machioka K, Nakashima K, et al.: Changes in penile length after radical prostatectomy: investigation of the underlying anatomical mechanism. BJU Int 120 (2): 293-299, 2017.[PUBMED Abstract]
- Forman JD, Order SE, Zinreich ES, et al.: Carcinoma of the prostate in the elderly: the therapeutic ratio of definitive radiotherapy. J Urol 136 (6): 1238-41, 1986.[PUBMED Abstract]
- Duncan W, Warde P, Catton CN, et al.: Carcinoma of the prostate: results of radical radiotherapy (1970-1985) Int J Radiat Oncol Biol Phys 26 (2): 203-10, 1993.[PUBMED Abstract]
- Zietman AL, Coen JJ, Shipley WU, et al.: Radical radiation therapy in the management of prostatic adenocarcinoma: the initial prostate specific antigen value as a predictor of treatment outcome. J Urol 151 (3): 640-5, 1994.[PUBMED Abstract]
- Peeters ST, Heemsbergen WD, Koper PC, et al.: Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy. J Clin Oncol 24 (13): 1990-6, 2006.[PUBMED Abstract]
- Zietman AL, DeSilvio ML, Slater JD, et al.: Comparison of conventional-dose vs high-dose conformal radiation therapy in clinically localized adenocarcinoma of the prostate: a randomized controlled trial. JAMA 294 (10): 1233-9, 2005.[PUBMED Abstract]
- Pollack A, Zagars GK, Starkschall G, et al.: Prostate cancer radiation dose response: results of the M. D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 53 (5): 1097-105, 2002.[PUBMED Abstract]
- Dearnaley DP, Jovic G, Syndikus I, et al.: Escalated-dose versus control-dose conformal radiotherapy for prostate cancer: long-term results from the MRC RT01 randomised controlled trial. Lancet Oncol 15 (4): 464-73, 2014.[PUBMED Abstract]
- Michalski JM, Moughan J, Purdy J, et al.: Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial. JAMA Oncol 4 (6): e180039, 2018.[PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998.[PUBMED Abstract]
- Yu JB: Hypofractionated Radiotherapy for Prostate Cancer: Further Evidence to Tip the Scales. J Clin Oncol 35 (17): 1867-1869, 2017.[PUBMED Abstract]
- Pollack A, Walker G, Horwitz EM, et al.: Randomized trial of hypofractionated external-beam radiotherapy for prostate cancer. J Clin Oncol 31 (31): 3860-8, 2013.[PUBMED Abstract]
- Wilkins A, Mossop H, Syndikus I, et al.: Hypofractionated radiotherapy versus conventionally fractionated radiotherapy for patients with intermediate-risk localised prostate cancer: 2-year patient-reported outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 16 (16): 1605-16, 2015.[PUBMED Abstract]
- Dearnaley D, Syndikus I, Mossop H, et al.: Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol 17 (8): 1047-60, 2016.[PUBMED Abstract]
- Aluwini S, Pos F, Schimmel E, et al.: Hypofractionated versus conventionally fractionated radiotherapy for patients with prostate cancer (HYPRO): late toxicity results from a randomised, non-inferiority, phase 3 trial. Lancet Oncol 17 (4): 464-74, 2016.[PUBMED Abstract]
- Incrocci L, Wortel RC, Alemayehu WG, et al.: Hypofractionated versus conventionally fractionated radiotherapy for patients with localised prostate cancer (HYPRO): final efficacy results from a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol 17 (8): 1061-9, 2016.[PUBMED Abstract]
- Wortel RC, Pos FJ, Heemsbergen WD, et al.: Sexual Function After Hypofractionated Versus Conventionally Fractionated Radiotherapy for Prostate Cancer: Results From the Randomized Phase III HYPRO Trial. J Sex Med 13 (11): 1695-1703, 2016.[PUBMED Abstract]
- Lee WR, Dignam JJ, Amin MB, et al.: Randomized Phase III Noninferiority Study Comparing Two Radiotherapy Fractionation Schedules in Patients With Low-Risk Prostate Cancer. J Clin Oncol 34 (20): 2325-32, 2016.[PUBMED Abstract]
- Catton CN, Lukka H, Gu CS, et al.: Randomized Trial of a Hypofractionated Radiation Regimen for the Treatment of Localized Prostate Cancer. J Clin Oncol 35 (17): 1884-1890, 2017.[PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997.[PUBMED Abstract]
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369 (3): 213-23, 2013.[PUBMED Abstract]
- Sartor O, Coleman R, Nilsson S, et al.: Effect of radium-223 dichloride on symptomatic skeletal events in patients with castration-resistant prostate cancer and bone metastases: results from a phase 3, double-blind, randomised trial. Lancet Oncol 15 (7): 738-46, 2014.[PUBMED Abstract]
- Schellhammer PF, Jordan GH, el-Mahdi AM: Pelvic complications after interstitial and external beam irradiation of urologic and gynecologic malignancy. World J Surg 10 (2): 259-68, 1986.[PUBMED Abstract]
- Lee JY, Daignault-Newton S, Heath G, et al.: Multinational Prospective Study of Patient-Reported Outcomes After Prostate Radiation Therapy: Detailed Assessment of Rectal Bleeding. Int J Radiat Oncol Biol Phys 96 (4): 770-777, 2016.[PUBMED Abstract]
- Hamilton AS, Stanford JL, Gilliland FD, et al.: Health outcomes after external-beam radiation therapy for clinically localized prostate cancer: results from the Prostate Cancer Outcomes Study. J Clin Oncol 19 (9): 2517-26, 2001.[PUBMED Abstract]
- Nieder AM, Porter MP, Soloway MS: Radiation therapy for prostate cancer increases subsequent risk of bladder and rectal cancer: a population based cohort study. J Urol 180 (5): 2005-9; discussion 2009-10, 2008.[PUBMED Abstract]
- Abdel-Wahab M, Reis IM, Wu J, et al.: Second primary cancer risk of radiation therapy after radical prostatectomy for prostate cancer: an analysis of SEER data. Urology 74 (4): 866-71, 2009.[PUBMED Abstract]
- Nam RK, Cheung P, Herschorn S, et al.: Incidence of complications other than urinary incontinence or erectile dysfunction after radical prostatectomy or radiotherapy for prostate cancer: a population-based cohort study. Lancet Oncol 15 (2): 223-31, 2014.[PUBMED Abstract]
- Incrocci L, Koper PC, Hop WC, et al.: Sildenafil citrate (Viagra) and erectile dysfunction following external beam radiotherapy for prostate cancer: a randomized, double-blind, placebo-controlled, cross-over study. Int J Radiat Oncol Biol Phys 51 (5): 1190-5, 2001.[PUBMED Abstract]
- Pisansky TM, Pugh SL, Greenberg RE, et al.: Tadalafil for prevention of erectile dysfunction after radiotherapy for prostate cancer: the Radiation Therapy Oncology Group [0831]randomized clinical trial. JAMA 311 (13): 1300-7, 2014.[PUBMED Abstract]
- Hanks GE, Hanlon AL, Schultheiss TE, et al.: Dose escalation with 3D conformal treatment: five year outcomes, treatment optimization, and future directions. Int J Radiat Oncol Biol Phys 41 (3): 501-10, 1998.[PUBMED Abstract]
- Dearnaley DP, Khoo VS, Norman AR, et al.: Comparison of radiation side-effects of conformal and conventional radiotherapy in prostate cancer: a randomised trial. Lancet 353 (9149): 267-72, 1999.[PUBMED Abstract]
- Greskovich FJ, Zagars GK, Sherman NE, et al.: Complications following external beam radiation therapy for prostate cancer: an analysis of patients treated with and without staging pelvic lymphadenectomy. J Urol 146 (3): 798-802, 1991.[PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986.[PUBMED Abstract]
- Green N, Treible D, Wallack H, et al.: Prostate cancer--the impact of irradiation on urinary outlet obstruction. Br J Urol 70 (3): 310-3, 1992.[PUBMED Abstract]
- Zelefsky MJ, Whitmore WF, Leibel SA, et al.: Impact of transurethral resection on the long-term outcome of patients with prostatic carcinoma. J Urol 150 (6): 1860-4, 1993.[PUBMED Abstract]
- Jang JW, Drumm MR, Efstathiou JA, et al.: Long-term quality of life after definitive treatment for prostate cancer: patient-reported outcomes in the second posttreatment decade. Cancer Med 6 (7): 1827-1836, 2017.[PUBMED Abstract]
- Fowler FJ, Barry MJ, Lu-Yao G, et al.: Outcomes of external-beam radiation therapy for prostate cancer: a study of Medicare beneficiaries in three surveillance, epidemiology, and end results areas. J Clin Oncol 14 (8): 2258-65, 1996.[PUBMED Abstract]
- Potosky AL, Legler J, Albertsen PC, et al.: Health outcomes after prostatectomy or radiotherapy for prostate cancer: results from the Prostate Cancer Outcomes Study. J Natl Cancer Inst 92 (19): 1582-92, 2000.[PUBMED Abstract]
- Fizazi K, Tran N, Fein L, et al.: Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 377 (4): 352-360, 2017.[PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017.[PUBMED Abstract]
- Daniell HW: Osteoporosis after orchiectomy for prostate cancer. J Urol 157 (2): 439-44, 1997.[PUBMED Abstract]
- Keating NL, O'Malley AJ, Freedland SJ, et al.: Diabetes and cardiovascular disease during androgen deprivation therapy: observational study of veterans with prostate cancer. J Natl Cancer Inst 102 (1): 39-46, 2010.[PUBMED Abstract]
- Keating NL, O'Malley AJ, Smith MR: Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J Clin Oncol 24 (27): 4448-56, 2006.[PUBMED Abstract]
- D'Amico AV, Denham JW, Crook J, et al.: Influence of androgen suppression therapy for prostate cancer on the frequency and timing of fatal myocardial infarctions. J Clin Oncol 25 (17): 2420-5, 2007.[PUBMED Abstract]
- O'Farrell S, Garmo H, Holmberg L, et al.: Risk and timing of cardiovascular disease after androgen-deprivation therapy in men with prostate cancer. J Clin Oncol 33 (11): 1243-51, 2015.[PUBMED Abstract]
- Levine GN, D'Amico AV, Berger P, et al.: Androgen-deprivation therapy in prostate cancer and cardiovascular risk: a science advisory from the American Heart Association, American Cancer Society, and American Urological Association: endorsed by the American Society for Radiation Oncology. CA Cancer J Clin 60 (3): 194-201, 2010 May-Jun.[PUBMED Abstract]
- Nguyen PL, Je Y, Schutz FA, et al.: Association of androgen deprivation therapy with cardiovascular death in patients with prostate cancer: a meta-analysis of randomized trials. JAMA 306 (21): 2359-66, 2011.[PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014.[PUBMED Abstract]
- Wysowski DK, Freiman JP, Tourtelot JB, et al.: Fatal and nonfatal hepatotoxicity associated with flutamide. Ann Intern Med 118 (11): 860-4, 1993.[PUBMED Abstract]
- Soloway MS, Schellhammer PF, Smith JA, et al.: Bicalutamide in the treatment of advanced prostatic carcinoma: a phase II multicenter trial. Urology 47 (1A Suppl): 33-7; discussion 48-53, 1996.[PUBMED Abstract]
- Kirschenbaum A: Management of hormonal treatment effects. Cancer 75 (7 Suppl): 1983-86, 1995.[PUBMED Abstract]
- Fowler FJ, McNaughton Collins M, Walker Corkery E, et al.: The impact of androgen deprivation on quality of life after radical prostatectomy for prostate carcinoma. Cancer 95 (2): 287-95, 2002.[PUBMED Abstract]
- Shahinian VB, Kuo YF, Freeman JL, et al.: Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 352 (2): 154-64, 2005.[PUBMED Abstract]
- Serpa Neto A, Tobias-Machado M, Esteves MA, et al.: Bisphosphonate therapy in patients under androgen deprivation therapy for prostate cancer: a systematic review and meta-analysis. Prostate Cancer Prostatic Dis 15 (1): 36-44, 2012.[PUBMED Abstract]
- Gillessen S, Templeton A, Marra G, et al.: Risk of colorectal cancer in men on long-term androgen deprivation therapy for prostate cancer. J Natl Cancer Inst 102 (23): 1760-70, 2010.[PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999.[PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002.[PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002.[PUBMED Abstract]
- Shelley M, Wilt TJ, Coles B, et al.: Cryotherapy for localised prostate cancer. Cochrane Database Syst Rev (3): CD005010, 2007.[PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017.[PUBMED Abstract]
- McLeod DG, Iversen P, See WA, et al.: Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 97 (2): 247-54, 2006.[PUBMED Abstract]
- I期の前立腺がんの治療
-
概要
I期の前立腺がんは米国がん合同委員会のTNM(腫瘍、リンパ節、転移)分類により、以下のように定義される:[ 1 ]
- cT1a-c、N0、M0、前立腺特異抗原(PSA) < 10ng/mL、グリソンスコア ≤ 6。
- cT2a、N0、M0、PSA < 10ng/mL、グリソンスコア ≤ 6。
- pT2、N0、M0、PSA < 10ng/mL、グリソンスコア ≤ 6。
病理解剖で発見される臨床的に無症候性の非転移性前立腺がんの頻度は、年齢とともに増大し、90歳以上の男性では50~60%にもなる。別の理由で実施された前立腺手術でこうした潜伏がんが偶然に発見されることがあるが、このことによって、年齢で調整するとI期の前立腺がん男性に正常男性集団と同じような生存率が観察されることが説明できる。
I期のがんの多くが高分化型で、前立腺のみに限局している(T1a、N0、M0);大半が慎重な追跡以外に治療の必要がない。[ 2 ]
期待生存期間が長い若い患者(50-60歳)においては、治療を検討すべきである。[ 3 ]無対照の選択されたシリーズでは、根治的前立腺全摘除術、外照射療法(EBRT)、組織内密封小線源治療、および注意深い経過観察と積極的サーベイランス/積極的モニタリングにより、一見して同程度の生存率が得られている。患者の年齢、関連する医学的疾患および個人の希望を考慮して、治療の決定をすべきである。[ 3 ]
I期の前立腺がんに対する標準治療法の選択肢
I期の前立腺がんを有する患者に対する標準治療法の選択肢には以下のものがある:
注意深い経過観察または積極的サーベイランス/積極的モニタリング
高齢であるかまたは随伴疾患のある無症候性の患者は、すぐに積極的に治療することはせず、慎重に観察する方がよい。[ 4 ][ 5 ][ 6 ]観察と待機、観察、待機的管理、および積極的サーベイランス/積極的モニタリングは、治癒目的の即時治療を採用しない戦略を指す用語である。(詳しい情報については、本要約の前立腺がんに対する治療法選択肢の概要のセクション内の注意深い経過観察または積極的サーベイランス/積極的モニタリングのセクションを参照のこと。)
証拠(ホルモン療法を遅延した経過観察):
- レトロスペクティブ・プール解析で、臨床的に限局性の前立腺がん男性828人が最初に温存療法を受け、その後、症状が現れた時点でホルモン療法を受けた。
- この試験では、分化度1または分化度2の腫瘍の患者では前立腺特異的10年生存率が87%で、その全生存率(OS)は一般集団における同年齢の男性の期待生存率とほぼ同等であったことが示された。[ 4 ]
根治的前立腺全摘除術
根治的前立腺全摘除術は、一般に骨盤内リンパ節郭清術(勃起能力を温存するようデザインされた神経温存法を用いるまたは用いない)を併用し、治癒目的で最も多く適用される治療法である。[ 7 ][ 8 ][ 9 ]経尿道的前立腺切除術(TURP)後には根治的前立腺全摘除術の実施が困難となる場合がある。
臨床的に臓器に限局したがんの男性の約40~50%では、前立腺被膜または切除断端を越えて病理的に進展していることが明らかになっているため、前立腺摘除術後に実施する補助放射線療法の役割が研究されている。
前立腺摘除術時に腫瘍による精嚢浸潤を来していることが確認された患者、または術後3週間を超えてもPSAが検出可能レベルにある患者では、術後放射線療法(PORT)を検討することも可能である。[ 10 ][ 11 ][ 12 ]今のところ利用可能な研究の追跡期間が比較的短いため、PORTの意義はまだ明らかではない;しかしながら、PORTにより、局所再発が確かに減少する。[ 10 ]合併症の回避には、慎重な治療計画が必要である。
証拠(根治的前立腺全摘除術後の放射線療法):
- 病理学的病期がT3、N0、M0の腫瘍の男性425人を対象としたランダム化試験で、術後EBRT(前立腺窩に対して30~32分割で60~64Gyを照射)が経過観察群と比較された。[
11
][証拠レベル:1iiA]
- 主要エンドポイントである無転移生存は、連続的なPSAモニタリングおよびその結果としてのPSA値上昇に対する転移の精密検査によって影響を受ける可能性がある。このことは、PSAが上昇する割合がより低い放射線療法が有利になり、主要エンドポイントにバイアスがかかっていた可能性がある。にもかかわらず、この研究の2群間で無転移生存に統計的有意差は認められなかった。(P = 0.06)。追跡期間中央値10.6年後で、全生存期間中央値は、放射線療法群で14.7年であったのに対して、経過観察群では13.8年であった(P = 0.16)。
- OS率に統計的有意差は認められなかったが、合併症の発生率は放射線療法群の方がかなり高かった:それぞれ、全合併症発生率23.8% vs 11.9%、直腸合併症発生率3.3% vs 0%、および尿道狭窄発生率17.8% vs 9.5%であった。
- しかしながら、追跡期間中央値約12.5年後で、OSは放射線療法群の方が良好であった;ハザード比(HR)死亡は、0.72(95%信頼区間[CI]、0.55-0.96;P = 0.023)であった。推定10年生存率は、放射線療法群で74%、対照群で66%であった。推定10年無転移生存率は73%および65%(P = 0.016)であった。[ 12 ][証拠レベル:1iiA]
- 別のランダム化試験では、術後放射線療法によるOSへの影響に関して異なった結論が得られている。[
13
][証拠レベル:1iiA]European Organization for Research and Treatment of Cancer(EORTC)試験(EORTC-22911[NCT00002511])では、臨床的にT0~T3の前立腺がんの75歳以下の男性1,005人が、前立腺切除術後にPORT(60Gy)群または生化学的または臨床的再燃のいずれかが認められるまで後続の治療を遅らせる経過観察群にランダムに割り付けられた。局所再発に対して推奨される治療法は放射線療法であった。
- 追跡期間中央値10.6年(最大16.6年)で、生化学的無増悪生存(PFS)率は、観察研究群の方が高かった(60.6% vs 41.1%;HR、0.49;95%CI、0.41-0.59;P < 0.0001)。局所領域再燃率は、8.4% vs 17.3%で、即時放射線療法群が良好であった(HR、0.45;95%CI、0.32-0.68;P < 0.0001)。
- しかしながら、生化学的無再燃生存および局所再発における大きな相違は、遠隔転移(11.0% vs 11.3%;HR、0.99;95%CI、0.67-1.44;P = 0.94)またはOS(即時放射線療法群で76.9% vs 経過観察群で80.7%;HR、1.18;95%CI、0.91-1.53;P = 0.2)のいずれの利点にもつながらなかった。また、前立腺がん特異的死亡率(3.9% vs 5.2%;HR、0.78;95%CI、0.46-1.33;P = 0.34)にも差はみられなかった。
- 即時放射線療法研究群における重度(グレード3)の晩期毒性の10年累積リスクは、5.3%であったのに対して、経過観察群では2.5%であった(P = 0.052)。グレードを問わない晩期の有害作用も、即時放射線療法群の方が高かった(70.8% vs 59.7%;P = 0.001)。
根治的前立腺全摘除術が注意深い経過観察または積極的サーベイランス/積極的モニタリングと比較されている。(根治的前立腺全摘除術と注意深い経過観察または積極的サーベイランス/積極的モニタリングとの比較に関する詳しい情報については、本要約の前立腺がんに対する治療法選択肢の概要のセクション内の他の治療選択肢と比較した根治的前立腺全摘除術のセクションを参照のこと。)
証拠(根治的前立腺全摘除術と注意深い経過観察との比較):
- Prostate Intervention Versus Observation Trial(PIVOT-1または、VA-CSP-407[NCT00007644])は、PSAスクリーニング導入後の時代に実施され、根治的前立腺全摘除術と注意深い経過観察を直接比較したランダム化試験である。1994年11月から2002年1月に、限局性前立腺がん(病期T1-2、NX、M0、血中PSA 50ng/mL未満)で平均余命が10年以上の75歳以下の男性731人が、根治的前立腺全摘除術群 vs 注意深い経過観察群にランダムに割り付けられた。[
14
][
15
][
16
][証拠レベル:1iiA、証拠レベル:1iiB]
- 約半数の男性に、触知不可能でスクリーニングにより検出される病変が認められた。
- 中央値12.7年の追跡後(範囲は最長で約19.5年)、全原因死亡率は根治的前立腺全摘除術群および注意深い経過観察群で、それぞれ61.3% vs 66.8%であり、5.5%(95%CI、-1.5-12.4)の絶対差で統計的有意差とならなかった(HR、0.84;95%CI、0.70-1.01)。前立腺がん特異的死亡率は、7.4% vs 11.4%で、こちらも統計的有意差に達しなかった(HR、0.63;95%CI、0.3-1.02)。
- 疾患進行に対する治療はこの研究の観察群における方が頻繁に実施されたが、治療のほとんどは無症候性の、限局性の、または生化学的(PSA)進行に対する治療であった。
- 予想された通り、少なくとも10年以上の追跡期間中、尿失禁および勃起不全/性機能障害は根治的前立腺全摘除術群により多くみられた。患者報告の尿吸収パッドの使用における絶対差は、少なくとも10年間以上の期間のすべての時点で手術群の方が30%以上大きかった。日常生活活動における疾患または治療関連の制限は2年までは観察群よりも手術群の方が不良であったが、その後は両研究群でほぼ同じであった。
外照射療法(EBRT)
EBRTは、治癒目的で用いられる別の治療選択肢である。[ 17 ][ 18 ][ 19 ][ 20 ][ 21 ]尿道狭窄の発生率を抑えるため、TURPから4~6週間後までは根治的放射線療法を延期すべきである。[ 22 ]腫瘍塊の大きいT2bからT2cの患者では、補助ホルモン療法を検討すべきである。[ 23 ][ 24 ]
証拠(補助ホルモン療法併用または非併用のEBRT):
- Radiation Therapy Oncology Group(RTOG)の7706試験(RTOG-7706)。[
25
][証拠レベル:1iiA]
- 臨床的にも病理学的にも転移がみられない骨盤リンパ節に対する予防的放射線療法では、OSまたは前立腺がん特異的生存の改善はみられない。
- RTOG-9413(RTOG-9413[NCT00769548])試験。[
26
];[
27
][証拠レベル:1iiDiii]
- RTOG-9413では、リンパ節転移の推定リスクが15%であるため全骨盤放射線療法を受けた患者は、前立腺のみに放射線療法を受けた患者に比べ、4年PFS率が高いことが示されたが、OSおよびPSAに基づく治療失敗率は有意差に達しなかった。
- ランダム化試験で、局所進行非転移性前立腺がん(T1b-T2の中分化型または低分化型腫瘍;悪性度を問わないT3腫瘍)の男性875人が、3ヵ月間の黄体形成ホルモン放出ホルモンアゴニスト + 長期フルタミド(250mgの1日3回経口投与)を受けるEBRT併用群または非併用群にランダムに割り付けられた。[
24
][証拠レベル:1iiA]
- 男性の19%で腫瘍病期はT2であり、78%でT3であった。10年時点で、全死亡率(29.6% vs 39.4%;差の95%CI、0.8%-18.8%)および前立腺がん特異的死亡率(11.9% vs 23.9%;差の95%CI、4.9%-19.1%)は、いずれもホルモン療法と放射線療法の併用群の方が良好であった。
- フルタミドは、腫瘍がT2またはT3の状況では標準の単独ホルモン療法とみなすことはできないが、この単独療法を適用したとしても、放射線療法により、無病生存または腫瘍特異的生存の有益性がもたらされる。この解析は、フルタミドが平均余命およびがん特異的生存期間を短縮することはないという仮定に基づいている。放射線療法は最新の標準線量および技術で実施されたものではなかった。
組織内密封小線源治療
エコーガイド下またはコンピュータ断層撮影ガイド下で、経会陰法により実施する組織内密封小線源治療(すなわち、ヨウ素125[125I]、パラジウム、およびイリジウム Ir 192)は、腫瘍がT1またはT2aの患者に使用されている。これらの患者における短期成績は、根治的前立腺全摘除術またはEBRTと同程度である。[ 28 ][ 29 ];[ 30 ][証拠レベル:3iiiDiv]
組織内密封小線源治療の使用に際して考慮すべき因子としては以下のものがある:
- 組織内密封小線源治療は、外来手術として実施される。
- 組織内密封小線源治療による性的能力の温存率は、86~92%と報告されている。[ 28 ][ 30 ]対照的に、根治的前立腺全摘除術による性的能力の温存率は10~40%で、EBRTでは40~60%である。
- 組織内密封小線源治療による副作用は時間とともに軽減し、典型的なものとして、頻尿、尿意促迫、および低頻度ながら尿閉がみられる。
- 直腸潰瘍がみられることもある。1件のシリーズでは、生命表法による2年での泌尿生殖器のグレード2の合併症の発生率は10%であり、直腸潰瘍のリスクは12%であった。このリスクは、術者の経験の増加およびインプラント手技の改良に伴って低下した。[ 28 ]
このような患者には長期追跡調査を実施して、治療の効果および副作用を評価する必要がある。
フリーハンドによる125 Iの恥骨後埋め込みは、局所コントロール不良および合併症の増加が認められており[ 31 ][ 32 ]、現在この手技が実施されることはまれである。
I期の前立腺がんに対して臨床評価段階にある治療法の選択肢
I期の前立腺がん患者に対して臨床評価段階にある治療法の選択肢には以下のものがある:
光線力学療法
低リスク前立腺がん男性において、光感作性薬剤を用いた血管標的光線力学療法が検証されている。CLIN1001 PCM301(NCT01310894)ランダム化試験では、低リスクがん(病期がT1-T2c、PSA値が10ng/mL以下、一般にグリソンスコアが3 + 3の腫瘍)の男性413人がオープンラベル試験で光感作性薬剤のpadeliporfin(4mg/kg、10分かけて静注[IV]し、光ファイバーを前立腺の標的エリアに挿入して、753nmのレーザー光線を150mW/cm2で22分15秒間照射して励起する)、または積極的サーベイランスのいずれかを受けるようにランダムに割り付けられた。[ 37 ]局所疾患進行までの期間中央値は、padeliporfinを受けた患者で28.3ヵ月および積極的サーベイランスに割り付けられた患者で14.1ヵ月であった(HR、0.34;95%CI、0.24-0.46;P < 0.0001)。[ 37 ][証拠レベル:1iiDiii]しかしながら、光線力学療法が適切な集団はかなり限られている可能性があり、非常に低リスクがんの男性では過剰治療となる可能性があり、より高リスクのがんの男性では過小治療の可能性がある。[ 38 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26.[PUBMED Abstract]
- Consensus conference. The management of clinically localized prostate cancer. JAMA 258 (19): 2727-30, 1987.[PUBMED Abstract]
- Epstein JI, Paull G, Eggleston JC, et al.: Prognosis of untreated stage A1 prostatic carcinoma: a study of 94 cases with extended followup. J Urol 136 (4): 837-9, 1986.[PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994.[PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994.[PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009.[PUBMED Abstract]
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994.[PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990.[PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993.[PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009.[PUBMED Abstract]
- Bolla M, van Poppel H, Collette L, et al.: Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 366 (9485): 572-8, 2005 Aug 13-19.[PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012.[PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017.[PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980.[PUBMED Abstract]
- Forman JD, Zinreich E, Lee DJ, et al.: Improving the therapeutic ratio of external beam irradiation for carcinoma of the prostate. Int J Radiat Oncol Biol Phys 11 (12): 2073-80, 1985.[PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986.[PUBMED Abstract]
- Pilepich MV, Bagshaw MA, Asbell SO, et al.: Definitive radiotherapy in resectable (stage A2 and B) carcinoma of the prostate--results of a nationwide overview. Int J Radiat Oncol Biol Phys 13 (5): 659-63, 1987.[PUBMED Abstract]
- Amdur RJ, Parsons JT, Fitzgerald LT, et al.: The effect of overall treatment time on local control in patients with adenocarcinoma of the prostate treated with radiation therapy. Int J Radiat Oncol Biol Phys 19 (6): 1377-82, 1990.[PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009.[PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998.[PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003.[PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003.[PUBMED Abstract]
- Wallner K, Roy J, Harrison L: Tumor control and morbidity following transperineal iodine 125 implantation for stage T1/T2 prostatic carcinoma. J Clin Oncol 14 (2): 449-53, 1996.[PUBMED Abstract]
- D'Amico AV, Coleman CN: Role of interstitial radiotherapy in the management of clinically organ-confined prostate cancer: the jury is still out. J Clin Oncol 14 (1): 304-15, 1996.[PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997.[PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: I-125 interstitial implantation for prostate cancer. What have we learned 10 years later? Cancer 63 (12): 2415-20, 1989.[PUBMED Abstract]
- Fuks Z, Leibel SA, Wallner KE, et al.: The effect of local control on metastatic dissemination in carcinoma of the prostate: long-term results in patients treated with 125I implantation. Int J Radiat Oncol Biol Phys 21 (3): 537-47, 1991.[PUBMED Abstract]
- Thüroff S, Chaussy C, Vallancien G, et al.: High-intensity focused ultrasound and localized prostate cancer: efficacy results from the European multicentric study. J Endourol 17 (8): 673-7, 2003.[PUBMED Abstract]
- Blana A, Murat FJ, Walter B, et al.: First analysis of the long-term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 53 (6): 1194-201, 2008.[PUBMED Abstract]
- Ficarra V, Novara G: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1201-2, 2008.[PUBMED Abstract]
- Eastham JA: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1202-3, 2008.[PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017.[PUBMED Abstract]
- Freedland SJ: Low-risk prostate cancer: to treat or not to treat. Lancet Oncol 18 (2): 156-157, 2017.[PUBMED Abstract]
- II期の前立腺がんの治療
-
概要
II期の前立腺がんは米国がん合同委員会のTNM(腫瘍、リンパ節、転移)分類により、以下のように定義される:[ 1 ]
IIA期
- cT1a-c、N0、M0、前立腺特異抗原(PSA) ≥10 <20ng/mL、グリソンスコア ≤ 6。
- cT2a、N0、M0、PSA ≥ 10 < 20ng/mL、グリソンスコア ≤ 6。
- pT2、N0、M0、PSA ≥ 10 < 20ng/mL、グリソンスコア ≤ 6。
- cT2b-c、N0、M0、PSA < 20ng/mL、グリソンスコア ≤ 6。
IIB期
- T1-2、N0、M0、PSA < 20ng/mL、グリソンスコア 7。
IIC期
- T1-2、N0、M0、PSA < 20、グリソンスコア 7または8。
根治的前立腺全摘除術、外照射療法(EBRT)、および組織内密封小線源治療がそれぞれII期の前立腺がんの治療に採用されており、治療効果はほぼ同じである。根治的前立腺全摘除術と放射線療法では、追跡期間10年に至るまで一見して同等の生存率が得られる。厳選した患者では、根治的前立腺全摘除術に伴って、年齢をマッチさせた前立腺がんではない集団と同程度の15年生存が得られる。[ 2 ]残念ながら、これらの治療法の長期の追跡によるランダム化比較試験はない。
がんが触知可能で小さい(T2a、N0、M0)患者は、がんが前立腺の両葉に及ぶ患者(T2c、N0、M0)よりも予後良好である。骨盤内リンパ節郭清術によりリンパ節転移のないことが明らかな患者は、この病期診断手技を実施していない患者よりも状態がよい;ただし、これは予後の良好な患者を選択した結果である。
採用する治療法を決定する際には、勃起不全や失禁、腸損傷などのさまざまな副作用を考慮に入れるべきである。
腫瘍増悪のマーカーとしての前立腺特異抗原(PSA)の変化
多くの場合、PSAの変化は、腫瘍増悪のマーカーと考えられる。腫瘍マーカーまたは腫瘍の特徴は、前立腺がんの進行または死亡のリスクが高いことと一貫して関連している可能性があるとしても、非常に弱い予測因子であり、治療の決定を下す上での有用性はきわめて限られているであろう。
根治的前立腺全摘除術と注意深い経過観察または積極的なサーベイランスとを比較したランダム化試験の対照群における注意深い経過観察により管理された臨床的に限局性の前立腺がん男性コホート267人では、ベースライン時のPSA値およびPSA値の変化の割合がその後の転移または前立腺がんによる死亡と関連していた。[ 3 ][ 4 ]にもかかわらず、がんが低悪性度のままであったグループ vs がんが進行したグループに男性を分類する正確度は、PSA値またはPSA値の変化の割合について調査したすべてのカットポイントで不満足なものであった。
ビスホスホネートと骨転移リスク
腫瘍が局所進行非転移性(T2-T4、N0-N1、M0)の患者は、骨転移を来すリスクがある。このリスクを低下させる戦略として、ビスホスホネートが研究されている。
証拠(ビスホスホネートと骨転移リスク):
- 第一世代のビスホスホネートであるクロドロン酸を高用量(2,080mg/日)で5年間経口投与するレジメンのプラセボ対照ランダム化試験(MRC-PR04)では、症候性骨転移までの期間または生存のいずれに関しても良好な効果はみられなかった。[ 5 ][証拠レベル:1iA]
II期の前立腺がんに対する標準治療法の選択肢
II期の前立腺がんを有する患者に対する標準治療法の選択肢には以下のものがある:
注意深い経過観察または積極的サーベイランス/積極的モニタリング
高齢であるかまたは随伴疾患のある無症候性の患者は、すぐに積極的に治療することはせず、慎重に観察する方がよい。[ 6 ][ 7 ][ 8 ]観察と待機、観察、待機的管理、および積極的サーベイランス/積極的モニタリングは、治癒目的の即時治療を採用しない戦略を指す用語である。(詳しい情報については、本要約の前立腺がんに対する治療法選択肢の概要のセクションを参照のこと。)
証拠(ホルモン療法を遅延した経過観察):
- レトロスペクティブ・プール解析で、臨床的に限局性の前立腺がん男性828人が最初に温存療法を受け、その後、症状が現れた時点でホルモン療法を受けた。[
6
]
- この研究によると、高分化型腫瘍または中分化型腫瘍の患者では、10年疾患特異的生存率が87%で、その全生存率(OS)は一般集団における同年齢層の男性の期待生存率ときわめて近いことが示された。
- 患者の年齢、関連する医学的疾患および個人の希望を考慮して、治療の決定をすべきである。
根治的前立腺全摘除術
根治的前立腺全摘除術は、一般に骨盤内リンパ節郭清術(勃起能力を温存するようデザインされた神経温存法を用いるまたは用いない)を併用し、治癒目的で最も多く適用される治療法である。[ 2 ][ 9 ][ 10 ]経尿道的前立腺切除術(TURP)後には根治的前立腺全摘除術の実施が困難となる場合がある。
臨床的に臓器に限局したがんの男性の約40~50%では、前立腺被膜または切除断端を越えて病理的に進展していることが明らかになっているため、前立腺摘除術後に実施する補助放射線療法の役割が研究されている。
前立腺摘除術時に腫瘍による精嚢浸潤を来していることが確認された患者、または術後3週間を超えてもPSAが検出可能レベルにある患者では、術後放射線療法(PORT)を検討することも可能である。[ 11 ][ 12 ][ 13 ]利用可能な研究の追跡期間が比較的短いため、PORTの意義はまだ明らかではない;しかしながら、PORTにより、局所再発が確かに減少する。[ 11 ]合併症の回避には、慎重な治療計画が必要である。
証拠(根治的前立腺全摘除術後の放射線療法):
- 病理学的病期がT3、N0、M0の腫瘍の男性425人を対象としたランダム化試験で、術後EBRT(前立腺窩に対して30~32分割で60~64Gyを照射)が経過観察群と比較された。[
12
][証拠レベル:1iiA]
- 主要エンドポイントである無転移生存は、連続的なPSAモニタリングおよびその結果としてのPSA値上昇に対する転移の精密検査によって影響を受ける可能性がある。このことは、PSAが上昇する割合がより低い放射線療法が有利になり、主要エンドポイントにバイアスがかかっていた可能性がある。にもかかわらず、この研究の2群間で無転移生存に統計的有意差は認められなかった。(P = 0.06)。追跡期間中央値10.6年後で、全生存期間中央値は、放射線療法群で14.7年であったのに対して、経過観察群では13.8年であった(P = 0.16)。
- OS率に統計的有意差は認められなかったが、合併症の発生率は放射線療法群の方が経過観察群と比べてかなり高かった:全合併症発生率がそれぞれ23.8% vs 11.9%、直腸合併症発生率が3.3% vs 0%、および尿道狭窄発生率が17.8% vs 9.5%であった。
- しかしながら、追跡期間中央値約12.5年後で、OSは放射線療法群の方が良好であった;ハザード比(HR)死亡は、0.72(95%信頼区間[CI]、0.55-0.96;P = 0.023)であった。推定10年生存率は、放射線療法群で74%、対照群で66%であった。推定10年無転移生存率は73%および65%(P = 0.016)であった。[ 13 ][証拠レベル:1iiA]
証拠(注意深い経過観察/積極的サーベイランス/積極的モニタリングおよび/または外照射療法と直接比較した根治的前立腺全摘除術):
- PSAスクリーニング導入前の時代にスウェーデンで実施された1件のランダム化臨床試験では、前立腺がんの男性695人が、根治的前立腺全摘除術か注意深い経過観察のいずれかにランダムに割り付けられた。この試験において、PSAスクリーニングにより診断された男性はわずかに約5%であった。したがって、この男性群は、米国で前立腺がんと診断される男性で典型的にみられる場合よりも、より進展した局所腫瘍を有していた。[
14
][
15
][
16
]
- 18年累積全死亡率は、根治的前立腺全摘除術群で56.1%、注意深い経過観察群で68.9%であった(絶対差、12.7%;95%CI、5.1-20.3%;相対リスク[RR]死亡、0.71;95%CI、0.59-0.86)。[ 16 ][証拠レベル:1iiA]
- 前立腺がんによる死亡の18年累積発生率は、17.7% vs 28.7%(絶対差、11.0%;95%CI、4.5-17.5%;前立腺がんによるRR死亡、0.56;95%CI、0.41-0.77)であった。[ 16 ]
- 事後サブセット解析によると、根治的前立腺全摘除術に関連した全死亡率および前立腺がん特異的死亡率の改善は、65歳より若い男性に限定されていた。
- Prostate Intervention Versus Observation Trial(PIVOT-1または、VA-CSP-407)は、PSAスクリーニング導入後の時代に実施され、根治的前立腺全摘除術と注意深い経過観察を直接比較したランダム化試験である。1994年11月から2002年1月に、限局性前立腺がん(病期T1-2、NX、M0、血中PSA 50ng/mL未満)で平均余命が10年以上の75歳以下の男性731人が、根治的前立腺全摘除術群 vs 注意深い経過観察群にランダムに割り付けられた。[
17
][
18
][
19
][証拠レベル:1iiA、証拠レベル:1iiB]
- 約半数の男性に、触知可能な腫瘍が認められた。
- 中央値12.7年の追跡後(範囲は最長で約19.5年)、全原因死亡率は根治的前立腺全摘除術群および注意深い経過観察群で、それぞれ61.3% vs 66.8%であり、5.5%(95%CI、-1.5-12.4)の絶対差で統計的有意差とならなかった(HR、0.84;95%CI、0.70-1.01)。前立腺がん特異的死亡率は、7.4% vs 11.4%で、こちらも統計的有意差に達しなかった(HR、0.63;95%CI、0.3-1.02)。
- 疾患進行に対する治療はこの研究の観察群における方が頻繁に実施されたが、こうした治療のほとんどは無症候性の、限局性の、または生化学的(PSA)進行に対する治療であった。
- 予想された通り、少なくとも10年以上の追跡期間中、尿失禁および勃起不全/性機能障害は根治的前立腺全摘除術群により多くみられた。患者報告の尿吸収パッドの使用における絶対差は、少なくとも10年間以上の期間のすべての時点で手術群の方が30%以上大きかった。日常生活活動における疾患または治療関連の制限は2年までは観察群よりも手術群の方が不良であったが、その後は両研究群でほぼ同じであった。
-
ProtecT試験(NCT02044172およびISRCTN20141297)では、82,429人の男性がPSA検査でスクリーニングを受け、2,664人が臨床的に限局性の前立腺がんを診断され、このうち1,643人(年齢中央値62歳、範囲50-69歳)が、積極的モニタリング、根治的前立腺全摘除術(可能な場合には神経温存)、または3D原体外照射療法(37分割で74Gy)のいずれかにランダムに割り付けて実施する比較に同意した。主要エンドポイントは前立腺がん特異的死亡率であった。[
20
]
- 中央値10年の追跡で、前立腺がんにより計17人が死亡したが、3つの研究群間で統計的有意差は認められなかった(P = 0.48)。10年前立腺がん特異的生存率は、積極的モニタリング群で98.8%、根治的前立腺全摘除術群で99.0%、および放射線療法群で99.6%であった。[ 20 ][証拠レベル:1iiA]
- 同様に、全原因死亡率は3つの研究群すべてでほぼ同じであった:1,000人年当たりの死亡は積極的モニタリング群で10.9、根治的前立腺全摘除術群で10.1、および放射線療法群で10.3であった(P = 0.87)。[ 20 ][証拠レベル:1iiB]
- 治療群間で転移性疾患への進行(4年後に出現が見られ始めた)については統計的有意差がみられた(積極的モニタリング、33/545;根治的前立腺全摘除術、13/553;放射線療法、16/545)が、こうした差は10年間の追跡で死亡率における差につながらなかった。10年間で、患者の52%が積極的な介入を必要とした。
- 予想されたように、患者が報告するアウトカムは3つの管理アプローチ間でかなりの差がみられた。[
21
][証拠レベル:1iiC]ランダム化後、最長6年間で患者が報告するアウトカムに関するサブスタディは以下の通りであった:
- 根治的前立腺全摘除術群の男性では、尿失禁率がかなり高かった(例、尿吸収パッドの1日当たりの使用枚数が1枚以上と報告した男性は6ヵ月経過時に46%、6年目で17%であった)のに対して、他の2研究群では尿失禁はほとんどみられなかった。
- 根治的前立腺全摘除術群では、性機能もまた不良であった(例、6ヵ月経過時に性交に十分な硬さの勃起を報告したのは男性の12%であったのに対し、放射線療法群では22%および積極的モニタリング群では52%であった)。
- しかしながら、腸機能は放射線療法群の方が不良であった(例、約5%が2年を過ぎてもしばしば血便を報告したのに対して、根治的前立腺全摘除術群および積極的モニタリング群での血便の報告はなかった)。
ホルモン療法併用または非併用の外照射療法(EBRT)
EBRTは、治癒目的でよく用いられる別の治療選択肢である。[ 22 ][ 23 ][ 24 ][ 25 ][ 26 ]尿道狭窄の発生率を抑えるため、TURPから4~6週間後までは根治的放射線療法を延期すべきである。[ 27 ]腫瘍塊の大きいT2bからT2cの患者では、補助ホルモン療法を検討すべきである。[ 28 ]
局所進行がん患者における補助ホルモン療法の役割が、米国医療政策研究局(現在のAgency for Healthcare Research and Quality)によって分析されている。腫瘍が局所進行性の患者に対する補助ホルモン療法の役割を再評価するこの研究では、ほとんどの患者の病期が進行していたが、腫瘍塊の大きいT2bからT2cの患者も含まれていた。
証拠(補助ホルモン療法併用または非併用のEBRT):
- Radiation Therapy Oncology Group(RTOG)の7706試験(RTOG-7706)。[
29
][証拠レベル:1iiA]
- 臨床的にも病理学的にも転移がみられない骨盤リンパ節に対する予防的放射線療法では、OSまたは前立腺がん特異的生存の改善はみられない。
- RTOG-9413(RTOG-9413 [NCT00769548])試験。[
30
][
31
][証拠レベル:1iiDiii]
- RTOG-9413では、リンパ節転移の推定リスクが15%であるため全骨盤放射線療法を受けた患者は、前立腺のみに放射線療法を受けた患者に比べ、4年無増悪生存率が高いことが示されたが、OSおよびPSAに基づく治療失敗率は有意差に達しなかった。
- ランダム化試験で、局所進行非転移性前立腺がん(T1b-T2の中分化型または低分化型腫瘍;悪性度を問わないT3腫瘍)の男性875人が、3ヵ月間の黄体形成ホルモン放出ホルモン(LH-RH)アゴニスト + 長期フルタミド(250mgの1日3回経口投与)を受けるEBRT併用群または非併用群にランダムに割り付けられた。[
32
][証拠レベル:1iiA]
- 男性の19%の腫瘍病期はT2であり、男性の78%の腫瘍病期はT3であった。10年時点で、全死亡率(29.6% vs 39.4%;差の95%CI、0.8%-18.8%)および前立腺がん特異的死亡率(11.9% vs 23.9%;差の95%CI、4.9%-19.1%)は、いずれもホルモン療法と放射線療法の併用群の方が良好であった。
- フルタミドは、腫瘍がT2またはT3の状況では標準の単独ホルモン療法とみなすことはできないが、この単独療法を適用したとしても、放射線療法により、無病生存または腫瘍特異的生存の有益性がもたらされる。この解析は、フルタミドが平均余命およびがん特異的生存期間を短縮することはないという仮定に基づいている。放射線療法は最新の標準線量および技術で実施されたものではなかった。
- 別の試験で、アンドロゲン遮断療法(ADT:LH-RHアゴニストまたは精巣摘除術)とADT + 放射線療法(組織学的に陰性と判明しているリンパ節は除いて、骨盤全体、精嚢、外/内腸骨リンパ節への45Gyの照射を含む、「直交4門照射(4-field box technique)」による前立腺への65~69Gyの照射)が比較された。この試験は、カナダ国立がん研究所(NCIカナダ)によるNCIC CTG PR.3/MRC UKPRO7(NCT00002633)で、高リスク(PSAが40ng/mLを上回るか、PSAが20ng/mLを上回りかつグリソンスコアが8以上)であり、臨床的および病理学的病期がN0、M0、かつT2(患者の12~13%)、T3(患者の83%)、およびT4(患者の4~5%)の患者1,205人をランダムに割り付けた。[
33
][
34
][証拠レベル:1iiA]
- 追跡期間中央値8年(最長 = 13年)で、OSはADT + 放射線療法群の方が優れていた(HR死亡、0.77;95%CI、0.57-0.85、P = 0.001)。10年OS率は、ADT + 放射線療法群が55%であったのに対し、ADT単独群では49%であった。
- 放射線療法では腸および泌尿器の副作用が予想されていたが、生活の質は、いずれの研究群でも24ヵ月を過ぎる頃には同程度であった。[ 35 ]
- 放射線療法単独と放射線療法 + 長期アンドロゲン抑制を比較したランダム化臨床試験の証拠を解析したメタアナリシスが公表されている。このメタアナリシスによると、5年OSに差が認められ、放射線療法単独と比較した場合、放射線療法 + 長期アンドロゲン抑制(LH-RHアゴニストまたは精巣摘除術)の方が良好であった(HR、0.631;95%CI、0.479-0.831)。[ 28 ][証拠レベル:1iiA]
- ランダム化プロスペクティブ臨床試験で、LH-RHアゴニストによる18ヵ月間のアンドロゲン抑制では、OS率および疾患特異的生存率に関して36ヵ月間と同様な結果が得られるとみられる。[
36
][証拠レベル:1iiA、1iiB]ある多施設試験で、II期からIVA期(臨床病期がT3–T4、またはPSAが20ng/mLを上回るか、グリソンスコアが7を上回る)のがん男性630人に対して、35分割での70Gyの放射線照射に加え、酢酸ゴセレリンが計18ヵ月間または36ヵ月間投与された。
- 追跡期間中央値9.4年で、各試験群でのOS率(10年で62%;HR死亡 = 1.02;95%CI、0.81–1.29;P = 0.8)はほぼ同じであり、前立腺がん特異的生存率(HR前立腺がん死亡 = 0.95;95%CI、0.58–0.55;P = 0.8)も同様であった。
- 両試験群で総合的な生活の質はほぼ同じであったが、性的活動およびセックスへの関心は18ヵ月群がやや良好であった。[ 36 ][証拠レベル:1iiC]
- 局所進行前立腺がん患者を対象に早期ホルモン療法(術後補助または術前補助)と待機ホルモン療法(LH-RHアゴニストおよび/または抗アンドロゲン)を比較した7件のランダム化比較試験のメタアナリシスでは、前立腺摘除術、放射線療法、注意深い経過観察または積極的サーベイランス/積極的モニタリングのいずれの治療を受けたかどうかにかかわらず、早期治療を受けた患者に全死亡率の改善が示された(RR、0.86;95%CI、0.82-0.91)。[ 37 ][証拠レベル:1iiA]
- 放射線療法前および施行期間中に実施された短期の術前補助アンドロゲン療法では、臨床的に限局性の前立腺がん患者の少なくとも一部に有益性が示されている。オープンラベルのランダム化試験(RTOG-9408[NCT00002597])では、腫瘍が非転移性で病期がT1b-c、T2a、またはT2b、PSA値が20ng/mL以下の男性1,979人が、放射線療法(1.8Gy/日で分割して前立腺へ66.6Gy照射)を受け、その2ヵ月前に開始する4ヵ月間のADT(フルタミド250mgの1日3回経口投与 + 月1回のゴセレリン3.6mgの皮下(SQ)投与またはleuprolide7.5mgの筋肉内投与)の併用群または非併用群にランダムに割り付けられた。追跡期間中央値は約9年であった。[
38
][証拠レベル:1iiA]
- 10年OS率は、放射線療法単独群で57%であったのに対し、併用療法群では62%であった(HR死亡、1.17;95%CI、1.01-1.35;P = 0.03)。
- 事後解析では、治療効果と患者のベースラインでのリスク分類との間に統計的に有意な相互作用はみられなかった。しかしながら、患者のうち最低リスク分類(グリソンスコア 6以下;PSA 10ng/mL以下;および臨床病期 T2a以下)では、併用療法に伴う有益性は、あったとしても、わずかであると考えられた。
- OSの有益性は、腫瘍が中リスクの男性(グリソンスコア 7;またはグリソンスコア 6以下、かつPSAが10ng/mLを上回る;または臨床病期 T2b)で最も明らかであった。
- 術前補助ホルモン療法の期間について、局所進行(T2b、T2c、T3、T4)非転移性がんの男性818人に対して放射線療法(2Gy/日に分割し前立腺および精嚢に66Gy照射、ただし所属リンパ節は含めない)を実施するランダム化試験(TROG96.01[ACTRN12607000237482])で検討されている。[
39
]オープンラベルのデザインで、放射線療法単独、放射線療法の2ヵ月前から施行期間中にかけて計3ヵ月間の術前補助アンドロゲン遮断療法(NADT)(毎月のゴセレリン3.6mgの皮下投与 + フルタミド250mgの1日3回経口投与)、または放射線療法の5ヵ月前から施行期間中にかけて計6ヵ月間のNADTを受けるいずれかの群に患者をランダムに割り付けた。[
39
][証拠レベル:1iiA]
- 中央値にして10.6年追跡調査した後、放射線療法単独群と放射線 + 3ヵ月のNADT群との間に統計的な有意差はみられなかった。
- しかしながら、6ヵ月のNADT群では、前立腺がん特異的死亡率および全死亡率が放射線療法単独群よりも良好なことが示された;10年全原因死亡率は、29.2% vs 42.5%(HR、0.63;95%CI、0.48-0.83;P = 0.0008)であった。
- 術前補助ホルモン療法の期間が、中リスクの前立腺がん(T1b-4、グリソンスコア 2-6、およびPSA > 10ng/mLであるが、100ng/mL以下;T1b-4、グリソンスコア 7、およびPSA < 20ng/mL;またはT1b-1c、グリソンスコア 8-10、およびPSA < 20ng/mL)で転移の証拠のない適格男性1,489人を対象にした別の試験(RTOG -9910[NCT00005044])で検討された。男性は、短期コースの術前補助アンドロゲン抑制(放射線療法前の8週間および放射線療法施行期間中の8週間にわたってLH-RHアゴニスト + ビカルタミドまたはフルタミド)または長期コースの術前補助アンドロゲン抑制(放射線療法前の28週間および放射線療法施行期間中の8週間)を受ける群にランダムに割り付けられた。両治療群とも、前立腺に対して70.2Gyを39分割で1日1回照射および腸骨リンパ節に対して46.8Gyを照射された。[
40
][証拠レベル:1iiAおよび証拠レベル:1iiB]
- EBRTへのアンドロゲン抑制療法の追加は、前立腺がんの再発およびそれによる死亡のリスクが高い男性に利益をもたらす可能性がある(RTOG-9202 [NCT00767286])。
三次元(3D)原体照射法
コンピュータ断層撮影法(CT)ベースの3D原体照射法の治療計画策定などの方法を用いて、正常組織への曝露を抑えるようにデザインされたEBRTが臨床評価段階にある。[ 41 ]
組織内密封小線源治療
エコーガイド下またはCTガイド下で、経会陰法により実施する組織内密封小線源治療(すなわち、ヨウ素125[125I]、パラジウム、およびイリジウム)は、腫瘍がT1またはT2aの患者に施行されている。これらの患者における短期成績は、根治的前立腺全摘除術またはEBRTと同程度である。[ 42 ][ 43 ];[ 44 ][証拠レベル:3iiiDiv]
組織内密封小線源治療の使用に際して考慮すべき因子としては以下のものがある:
- 組織内密封小線源治療は、外来手術として実施される。
- 組織内密封小線源治療による性的能力の温存率は、86~92%と報告されている。[ 42 ][ 44 ]対照的に、根治的前立腺全摘除術による性的能力の温存率は10~40%で、EBRTでは40~60%である。
- 根治的前立腺全摘除術による副作用は、ほとんどの患者にみられるが、時間とともに軽減し、典型的なものとして、頻尿、尿意促迫、および低頻度ながら尿閉がみられる。
- 直腸潰瘍がみられることもある。[ 42 ]1件のシリーズでは、生命表法による2年での泌尿生殖器のグレード2の合併症の発生率は10%であり、直腸潰瘍のリスクは12%であった。このリスクは、術者の経験の増加およびインプラント手技の改良に伴って低下した。[ 45 ]
このような患者には長期追跡調査を実施して、治療の効果および副作用を評価する必要がある。
フリーハンドによる125 Iの恥骨後埋め込みは、局所コントロール不良および合併症の増加が認められており[ 45 ][ 46 ]、現在この手技が実施されることはまれである。
II期の前立腺がんに対して臨床評価段階にある治療法の選択肢
II期の前立腺がん患者に対して臨床評価段階にある治療法の選択肢には以下のものがある:
エコーガイド下経皮的凍結手術
凍結手術は、冷凍プローブを用いて前立腺を間欠的に冷凍し、その後解凍させることによって、前立腺がん細胞を破壊する手術手技の1つである。[ 47 ][証拠レベル:3iiiC];[ 48 ][ 49 ][証拠レベル:3iiiDiv]凍結手術は、標準の前立腺摘除術ほどは確立されておらず、長期治療成績も前立腺摘除術や放射線療法ほど確立されていない。重篤な毒性作用には以下のものがある:
- 膀胱下尿道損傷。
- 尿失禁。
- 勃起不全。
- 直腸損傷。
他の副作用の頻度および5年追跡時のがん制御率は、報告する施設間でばらつきがあり、手術や放射線療法のシリーズと比べて小規模である。[ 48 ][ 49 ]
高密度焦点式超音波
高密度焦点式超音波では、ケースシリーズで良好な腫瘍の局所制御が得られたことが報告されている。しかしながら、より標準的な治療法と直接比較されたことはなく、その実績も比較的限られている。[ 50 ][ 51 ][ 52 ]
陽子線治療
前立腺がんの治療を目的とした陽子線治療の使用に関心が高まっている。この方式の荷電粒子放射線の線量分布では、前立腺放射線の治療可能比が改善する可能性があるため、副作用の大幅な増加を伴わずに腫瘍への線量増加が可能となるが、有効性および毒性について他の方式の放射線療法と比較したランダム化比較試験は報告されていない。
光線力学療法
低リスク前立腺がん男性において、光感作性薬剤を用いた血管標的光線力学療法が検証されている。CLIN1001 PCM301(NCT01310894)ランダム化試験では、低リスクがん(病期がT1-T2c、PSA値が10ng/mL以下、一般にグリソンスコアが3 + 3の腫瘍)の男性413人がオープンラベル試験で光感作性薬剤のpadeliporfin(4mg/kg、10分かけて静注し、光ファイバーを前立腺の標的エリアに挿入して、753nmのレーザー光線を150mW/cm2で22分15秒間照射して励起する)、または積極的サーベイランスのいずれかを受けるようにランダムに割り付けられた。[ 53 ]局所疾患進行までの期間中央値は、padeliporfinを受けた患者で28.3ヵ月および積極的サーベイランスを受けていた患者で14.1ヵ月であった(HR、0.34;95%CI、0.24-0.46;P < 0.0001)。[ 53 ][証拠レベル:1iiDiii]しかしながら、光線力学療法が適切な集団はかなり限られている可能性があり、非常に低リスクがんの男性では過剰治療となる可能性があり、より高リスクのがんの男性では過小治療の可能性がある。[ 54 ]
その他の臨床試験
術前補助ホルモン療法の後、根治的前立腺全摘除術を行う試験など、その他の臨床試験が進行中である。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26.[PUBMED Abstract]
- Zincke H, Bergstralh EJ, Blute ML, et al.: Radical prostatectomy for clinically localized prostate cancer: long-term results of 1,143 patients from a single institution. J Clin Oncol 12 (11): 2254-63, 1994.[PUBMED Abstract]
- Fall K, Garmo H, Andrén O, et al.: Prostate-specific antigen levels as a predictor of lethal prostate cancer. J Natl Cancer Inst 99 (7): 526-32, 2007.[PUBMED Abstract]
- Parekh DJ, Ankerst DP, Thompson IM: Prostate-specific antigen levels, prostate-specific antigen kinetics, and prostate cancer prognosis: a tocsin calling for prospective studies. J Natl Cancer Inst 99 (7): 496-7, 2007.[PUBMED Abstract]
- Mason MD, Sydes MR, Glaholm J, et al.: Oral sodium clodronate for nonmetastatic prostate cancer--results of a randomized double-blind placebo-controlled trial: Medical Research Council PR04 (ISRCTN61384873). J Natl Cancer Inst 99 (10): 765-76, 2007.[PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994.[PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994.[PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009.[PUBMED Abstract]
- Catalona WJ, Bigg SW: Nerve-sparing radical prostatectomy: evaluation of results after 250 patients. J Urol 143 (3): 538-43; discussion 544, 1990.[PUBMED Abstract]
- Catalona WJ, Basler JW: Return of erections and urinary continence following nerve sparing radical retropubic prostatectomy. J Urol 150 (3): 905-7, 1993.[PUBMED Abstract]
- Paulson DF, Moul JW, Walther PJ: Radical prostatectomy for clinical stage T1-2N0M0 prostatic adenocarcinoma: long-term results. J Urol 144 (5): 1180-4, 1990.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009.[PUBMED Abstract]
- Holmberg L, Bill-Axelson A, Helgesen F, et al.: A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 347 (11): 781-9, 2002.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer. N Engl J Med 370 (10): 932-42, 2014.[PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
- Wilt TJ: The Prostate Cancer Intervention Versus Observation Trial: VA/NCI/AHRQ Cooperative Studies Program #407 (PIVOT): design and baseline results of a randomized controlled trial comparing radical prostatectomy with watchful waiting for men with clinically localized prostate cancer. J Natl Cancer Inst Monogr 2012 (45): 184-90, 2012.[PUBMED Abstract]
- Wilt TJ, Jones KM, Barry MJ, et al.: Follow-up of Prostatectomy versus Observation for Early Prostate Cancer. N Engl J Med 377 (2): 132-142, 2017.[PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016.[PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016.[PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980.[PUBMED Abstract]
- Forman JD, Zinreich E, Lee DJ, et al.: Improving the therapeutic ratio of external beam irradiation for carcinoma of the prostate. Int J Radiat Oncol Biol Phys 11 (12): 2073-80, 1985.[PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986.[PUBMED Abstract]
- Pilepich MV, Bagshaw MA, Asbell SO, et al.: Definitive radiotherapy in resectable (stage A2 and B) carcinoma of the prostate--results of a nationwide overview. Int J Radiat Oncol Biol Phys 13 (5): 659-63, 1987.[PUBMED Abstract]
- Amdur RJ, Parsons JT, Fitzgerald LT, et al.: The effect of overall treatment time on local control in patients with adenocarcinoma of the prostate treated with radiation therapy. Int J Radiat Oncol Biol Phys 19 (6): 1377-82, 1990.[PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
- Asbell SO, Martz KL, Shin KH, et al.: Impact of surgical staging in evaluating the radiotherapeutic outcome in RTOG #77-06, a phase III study for T1BN0M0 (A2) and T2N0M0 (B) prostate carcinoma. Int J Radiat Oncol Biol Phys 40 (4): 769-82, 1998.[PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003.[PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003.[PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009.[PUBMED Abstract]
- Warde P, Mason M, Ding K, et al.: Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 378 (9809): 2104-11, 2011.[PUBMED Abstract]
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 33 (19): 2143-50, 2015.[PUBMED Abstract]
- Brundage M, Sydes MR, Parulekar WR, et al.: Impact of Radiotherapy When Added to Androgen-Deprivation Therapy for Locally Advanced Prostate Cancer: Long-Term Quality-of-Life Outcomes From the NCIC CTG PR3/MRC PR07 Randomized Trial. J Clin Oncol 33 (19): 2151-7, 2015.[PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018.[PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007.[PUBMED Abstract]
- Jones CU, Hunt D, McGowan DG, et al.: Radiotherapy and short-term androgen deprivation for localized prostate cancer. N Engl J Med 365 (2): 107-18, 2011.[PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011.[PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015.[PUBMED Abstract]
- Hanks GE, Hanlon AL, Schultheiss TE, et al.: Dose escalation with 3D conformal treatment: five year outcomes, treatment optimization, and future directions. Int J Radiat Oncol Biol Phys 41 (3): 501-10, 1998.[PUBMED Abstract]
- Wallner K, Roy J, Harrison L: Tumor control and morbidity following transperineal iodine 125 implantation for stage T1/T2 prostatic carcinoma. J Clin Oncol 14 (2): 449-53, 1996.[PUBMED Abstract]
- D'Amico AV, Coleman CN: Role of interstitial radiotherapy in the management of clinically organ-confined prostate cancer: the jury is still out. J Clin Oncol 14 (1): 304-15, 1996.[PUBMED Abstract]
- Ragde H, Blasko JC, Grimm PD, et al.: Interstitial iodine-125 radiation without adjuvant therapy in the treatment of clinically localized prostate carcinoma. Cancer 80 (3): 442-53, 1997.[PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: I-125 interstitial implantation for prostate cancer. What have we learned 10 years later? Cancer 63 (12): 2415-20, 1989.[PUBMED Abstract]
- Fuks Z, Leibel SA, Wallner KE, et al.: The effect of local control on metastatic dissemination in carcinoma of the prostate: long-term results in patients treated with 125I implantation. Int J Radiat Oncol Biol Phys 21 (3): 537-47, 1991.[PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999.[PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002.[PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002.[PUBMED Abstract]
- Blana A, Murat FJ, Walter B, et al.: First analysis of the long-term results with transrectal HIFU in patients with localised prostate cancer. Eur Urol 53 (6): 1194-201, 2008.[PUBMED Abstract]
- Ficarra V, Novara G: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1201-2, 2008.[PUBMED Abstract]
- Eastham JA: Editorial comment on: first analysis of the long-term results with transrectal HIFU in patients with localized prostate cancer. Eur Urol 53 (6): 1202-3, 2008.[PUBMED Abstract]
- Azzouzi AR, Vincendeau S, Barret E, et al.: Padeliporfin vascular-targeted photodynamic therapy versus active surveillance in men with low-risk prostate cancer (CLIN1001 PCM301): an open-label, phase 3, randomised controlled trial. Lancet Oncol 18 (2): 181-191, 2017.[PUBMED Abstract]
- Freedland SJ: Low-risk prostate cancer: to treat or not to treat. Lancet Oncol 18 (2): 156-157, 2017.[PUBMED Abstract]
- III期の前立腺がんの治療
-
概要
III期の前立腺がんは米国がん合同委員会のTNM(腫瘍、リンパ節、転移)分類により、以下のように定義される:[ 1 ]
IIIA期
- T1-2、N0、M0、前立腺特異抗原(PSA) ≥ 20、グリソンスコア ≤ 6-8。
IIIB期
- T3-4、N0、M0、すべてのPSA、グリソンスコア ≤ 6-8。
IIIC期
- すべてのT、N0、M0、すべてのPSA、グリソンスコア 9または10。
膀胱頸部への顕微鏡的浸潤による前立腺外への浸潤(T4)はT3aに含められる。
III期の前立腺がんの治療には、外照射療法(EBRT)、組織内密封小線源治療、および根治的前立腺全摘除術が用いられる。[ 2 ]所属リンパ節を評価して腫瘍が及んでいないことが明らかになっているかどうかによって、予後が大きく変わってくる。
リニアックを用いるEBRTは、III期の前立腺がん患者に対する最も一般的な治療法であり、大規模シリーズからは、腫瘍の局所制御および無病生存(DFS)を達成する点で成功が裏付けられている。[ 3 ][ 4 ]III期患者における根治的前立腺全摘除術の結果は、II期のがん患者における結果に比べて大幅に悪い。大きな腫瘍に対する組織内密封小線源治療の実施は、技術的に困難である。
治療計画に関して決定する前に、がん、年齢および併存する医学的疾患に関係した患者の症状を考慮すべきである。放射線療法を実施して20年間追跡した患者372人のシリーズでは、最終的に前立腺がんにより死亡したのは47%であったが、前立腺がんの証拠がない併発性疾患により死亡は44%であった。[ 4 ]
III期の前立腺がんに対する標準治療法の選択肢
III期の前立腺がんを有する患者に対する標準治療法の選択肢には以下のものがある:
- ホルモン療法併用または非併用の外照射療法(EBRT)。
- (放射線療法併用または非併用の)ホルモン操作療法。
- EBRT併用または非併用の根治的前立腺全摘除術。
- 注意深い経過観察または積極的サーベイランス/積極的モニタリング。
ホルモン療法併用または非併用の外照射療法(EBRT)
EBRT単独[ 3 ][ 4 ][ 5 ][ 6 ][ 7 ]、またはEBRTへの黄体形成ホルモン放出ホルモン(LH-RH)アゴニストまたは精巣摘除術の追加を検討すべきである。[ 8 ][ 9 ][ 10 ][ 11 ][ 12 ][ 13 ][ 14 ][ 15 ][ 16 ]尿道狭窄の発生率を抑えるため、経尿道的切除術から4~6週間後までは根治的放射線療法を延期すべきである。[ 17 ]
特に中等度または重度の基礎共存症を認めない男性では、放射線療法と併せて、ホルモン療法を検討すべきである。[ 8 ][ 9 ]その有用性をみる試験が、局所進行がん患者を対象に、いくつか実施されている。
証拠(ホルモン療法併用または非併用のEBRT):
- Radiation Therapy Oncology Group(RTOG)のRTOG-9413(NCT00769548)試験で、リンパ節転移の推定リスクが15%であるため全骨盤放射線療法を受けた患者では、全生存(OS)率およびPSAに基づく治療失敗率に有意差は認められなかった。[ 18 ];[ 19 ][証拠レベル:1iiDiii]
- 1件のランダム化試験において、局所進行非転移性前立腺がん(T1b-T2中分化型または低分化型腫瘍;悪性度を問わないT3腫瘍)の男性875人が、3ヵ月のLH-RHアゴニスト + 長期フルタミド(250mg、1日3回経口投与)を受けるEBRT併用群または非併用群にランダムに割り付けられた。男性の19%の腫瘍病期はT2であり、男性の78%の腫瘍病期はT3であった。[
20
][証拠レベル:1iiA]
- 10年時点で、全死亡率(29.6% vs 39.4%;差の95%信頼区間[CI]、0.8%-18.8%)および前立腺がん特異的死亡率(11.9% vs 23.9%;差の95%CI、4.9%-19.1%)は、いずれもホルモン療法と放射線療法の併用群の方が良好であった。
- フルタミドは、腫瘍がT2またはT3の状況では標準的な単独ホルモン療法とみなすことはできないが、この単独療法を適用したとしても、放射線療法により、DFSまたは腫瘍特異的生存の有益性がもたらされる。この解析は、フルタミドが平均余命およびがん特異的生存期間を短縮することはないという仮定に基づいている。放射線療法は最新の標準線量および技術で実施されたものではなかった。
- 別の試験で、アンドロゲン遮断療法(ADT:LH-RHアゴニストまたは精巣摘除術)とADT + 放射線療法(組織学的に陰性と判明しているリンパ節は除いて、骨盤全体、精嚢、外/内腸骨リンパ節への45Gyの照射を含む、「直交4門照射(4-field box technique)」による前立腺への65~69Gyの照射)が比較された。このカナダ国立がん研究所(NCIカナダ)による試験(NCIC CTG PR.3/MRC UKPRO7 [NCT00002633])では、高リスク(PSAが40ng/mLを上回るか、PSAが20ng/mLを上回りかつグリソンスコアが8以上)であり、臨床的および病理学的病期がN0、M0、かつT2(患者の12~13%)、T3(患者の83%)、およびT4(患者の4~5%)の患者1,205人をランダムに割り付けた。[
21
][
22
][証拠レベル:1iiA]
- 追跡期間中央値8年(最長 = 13年)で、OSはADT + 放射線療法群の方が優れていた(ハザード比[HR]死亡、0.77;95%CI、0.57-0.85;P = 0.001)。10年OS率は、ADT + 放射線療法群が55%であったのに対し、ADT単独群では49%であった。
- 放射線療法では腸および泌尿器の副作用が予想されていたが、生活の質(QOL)は、いずれの研究群でも24ヵ月を過ぎる頃には同程度であった。[ 23 ]
- RTOGが実施した1件のプロスペクティブ・ランダム化試験(RTOG-8531)では、T3、N0、またはすべてのT、N1で、M0の患者が前立腺および骨盤への放射線療法を受け、続いて放射線療法直後に補助療法としてゴセレリンを投与する群と再燃時にゴセレリンを投与する観察群にランダムに割り付けられた。補助療法としてゴセレリンを投与する群に割り付けられた患者では、放射線療法コースの最終週に投与を開始し、特に期限を設けずに、進行の徴候がみられるまで投与した。[
24
][証拠レベル:1iiA]
- 評価可能な患者945人の全集団における生命表法での10年OS率は、補助療法群で49% vs 経過観察群で39%であった(P=0.002)。生命表法での10年局所制御失敗率にも改善が認められた(23% vs 38%、P < 0.001)。
- 同様の試験が、European Organization for Research and Treatment of Cancer(EORTC)により実施されている。腫瘍がT1、T2(世界保健機関による悪性度3)、N0-NXまたはT3、T4、N0の患者が、骨盤/前立腺放射線療法群または同部位の放射線療法と同時に開始する3年間のゴセレリン(1ヵ月間は酢酸シプロテロンを併用)による補助療法群にランダムに割り付けられた。解析可能な患者401人が、中央値で9.1年間追跡された。[
10
][
25
][証拠レベル:1iiA, 1iiDii]
- 局所進行がんの患者における補助ホルモン療法の役割がAgency for Health Care Policy and Research(AHCPR;現在のAgency for Healthcare Research and Quality)によって解析されている。放射線療法単独と放射線療法 + 長期アンドロゲン抑制(LH-RHアゴニストまたは精巣摘除術)の併用を比較したランダム化臨床試験の証拠がメタアナリシスで評価された。ほとんどの患者の病期がより進行していたが、この研究には腫瘍塊が大きいT2bの患者も含まれていた。[
11
][証拠レベル:1iiA]
- このメタアナリシスでは、5年OSに差が認められ、放射線療法単独と比較して、放射線療法 + 長期アンドロゲン抑制の併用の方が良好であった(HR、0.631;95%CI、0.479-0.831)。[ 11 ]
- さらに、RTOGは、総腸骨節以下のリンパ節に転移を有するまたは有さない、塊が大きな局所腫瘍(T2b、T2c、T3、またはT4)の患者を対象とした研究(RTOG-8610)を実施した:456人の男性が、放射線療法単独群または放射線療法 + 放射線療法の8週間前に開始し、16週間継続するアンドロゲン除去療法群にランダムに割り付けられた。この試験では、短期ホルモン療法のみが評価され、AHCPRが解析した研究で実施されたような長期ホルモン療法は評価されなかった。[
12
][
28
]
- 10年時点で、OS率に統計的有意差は認められなかった;しかしながら、疾患特異的死亡率(23% vs 36%)およびDFS率(11% vs 3%)は、併用療法群の方が良好であった。[ 12 ][証拠レベル:1iiA]
- RTOG-8610試験とRTOG-8531試験のサブセット解析には、T3、N0、M0の患者575人が含まれており、短期ホルモン療法と比較した長期ホルモン療法では、生化学的DFS率および原因特異的生存率の改善がみられることが示された。[ 29 ]
- この知見は、RTOG-9202(NCT00767286)試験により確認されたが、放射線療法 + 28ヵ月間のアンドロゲン遮断療法は、10年疾患特異的生存率(23% vs 13%;P < 0.0001)が高いものの、OS率(53.9% vs 51.6%;P = 0.36)に差がみられなかったことが報告された。[
13
]
- 予定外で実施されたサブグループの事後解析により、高悪性度がんで、グリソンスコアが8~10の男性では、より長期のアンドロゲン遮断(28ヵ月 vs 4ヵ月)でOS率が高いこと(45% vs 32%;P = 0.0061)が確認された。
- ランダム化プロスペクティブ臨床試験で、LH-RHアゴニストによる18ヵ月間のアンドロゲン抑制では、OS率および疾患特異的生存率に関して36ヵ月間と同様な結果が得られるとみられる。[
30
][証拠レベル:1iiA、1iiB]この試験で、II期からIVA期(臨床病期がT3–T4、またはPSAが20ng/mLを上回るか、グリソンスコアが7を上回る)のがん男性630人に対して、35分割での70Gyの放射線照射単独に加え、酢酸ゴセレリンが計18ヵ月間または36ヵ月間投与された。
- 追跡期間中央値9.4年で、各試験群でのOS率(10年で62%;HR死亡 = 1.02;95%CI、0.81–1.29;P = 0.8)はほぼ同じであり、前立腺がん特異的生存率(HR前立腺がん死亡 = 0.95;95%CI、0.58-1.55;P = 0.8)も同様であった。
- 両試験群で総合的な生活の質はほぼ同じであったが、性的活動およびセックスへの関心は18ヵ月群がやや良好であった。[ 30 ][証拠レベル:1iiC]
- 同様に、局所進行前立腺がん患者を対象に早期ホルモン療法(術後補助または術前補助)と待機ホルモン療法(LH-RHアゴニストおよび/または抗アンドロゲン)を比較した7件のランダム化比較試験のメタアナリシスでは、前立腺摘除術、放射線療法、または注意深い経過観察あるいは積極的サーベイランス/積極的モニタリングのいずれの治療を受けたかどうかにかかわらず、早期治療を受けた患者に全死亡率の改善が示された(相対リスク、0.86;95%CI、0.82-0.91)。[ 31 ][証拠レベル:1iiA]
- 術前補助ホルモン療法の期間について、局所進行(T2b、T2c、T3、T4)非転移性がんの男性818人に対して放射線療法(所属リンパ節は含めないで、前立腺および精嚢に対して2Gy/日に分割して66Gy照射)を施行するランダム化試験(TROG96.01[ACTRN12607000237482])で検討されている。オープンラベルのデザインで、放射線療法単独、放射線療法の2ヵ月前から施行期間中にかけて計3ヵ月間の術前補助アンドロゲン遮断療法(NADT)(毎月のゴセレリン3.6mgの皮下投与 + フルタミド250mgの1日3回経口投与)、または放射線療法の5ヵ月前から施行期間中にかけて計6ヵ月間のNADTのいずれかの群に患者をランダムに割り付けた。[
14
][証拠レベル:1iiA]
- 追跡期間中央値10.6年後で、放射線療法単独群と放射線療法 + 3ヵ月のNADT群との間に統計的な有意差はみられなかった。
- しかしながら、6ヵ月のNADT群では、前立腺がん特異的死亡率および全死亡率が放射線療法単独群よりも良好なことが示された;10年全原因死亡率は、29.2% vs 42.5%(HR、0.63;95%CI、0.48-0.83;P = 0.0008)であった。
- 術前補助ホルモン療法の期間が、中リスクの前立腺がん(T1b-4、グリソンスコア 2-6、およびPSA > 10ng/mLであるが、100ng/mL以下;T1b-4、グリソンスコア 7、およびPSA < 20ng/mL;またはT1b-1c、グリソンスコア 8-10、およびPSA < 20ng/mL)で転移の証拠のない適格男性1,489人を対象にした別の試験(RTOG -9910[NCT00005044])で検討された。男性は、短期コースの術前補助アンドロゲン抑制(放射線療法前の8週間および放射線療法施行期間中の8週間にわたってLH-RHアゴニスト + ビカルタミドまたはフルタミド)または長期コースの術前補助アンドロゲン抑制(放射線療法前の28週間および放射線療法施行期間中の8週間)を受ける群にランダムに割り付けられた。両治療群とも、前立腺に対して70.2Gyを39分割で1日1回照射および腸骨リンパ節に対して46.8Gyを照射された。[
32
][証拠レベル:1iiAおよび証拠レベル:1iiB]
(放射線療法併用または非併用の)ホルモン操作療法
ホルモン操作療法(精巣摘除術またはLH-RHアゴニスト)は、III期の前立腺がんの治療に使用されることがある。[ 33 ][証拠レベル:1iiA]
局所進行腫瘍を有する男性において、精巣摘除術またはLH-RHアゴニストの効力が酢酸アビラテロンの追加により向上しうることを示唆するデータがある。ランダム化オープンラベルSTAMPEDE試験(NCT00268476)において、1,917人の男性(約95%が新たに診断された;約50%が転移性疾患を有し、約50%は局所進行またはリンパ節転移陽性疾患を有した)が、ADT単独またはADT + 酢酸アビラテロン(1,000mg、1日1回経口投与)およびプレドニゾロン(5mg、1日1回経口投与)で治療された。[ 34 ]6~9ヵ月後にリンパ節転移陰性非転移性疾患を有する男性に対して局所放射線療法が指示され、リンパ節転移陽性非転移性疾患を有する男性には任意とされた。ホルモン療法は2年経過時または進行時までと短縮された。研究参加者の約40%で放射線療法が計画された。
- 追跡期間中央値40ヵ月経過時に、アビラテロン研究群における3年OS率は83%であったのに比べ、ADT単独研究群では76%であった(HR死亡、0.63;95%CI、0.52-0.76;P < 0.001)。[ 34 ][証拠レベル:1iiA]転移性疾患 vs 非転移性疾患における相対的な治療の差について異質性の明確な証拠はなかったが、非転移性疾患の男性では絶対差がはるかに小さく、おそらく追跡期間が短かったため統計的有意差は示されなかった(HR死亡、0.75;95%CI、0.49-1.18)。
- ADT単独と比較したアビラテロンに伴う毒性の主要な追加の差は、高血圧(5% vs 1%)、血中アミノトランスフェラーゼ値のわずかな増加(6% vs 1%未満)、および呼吸障害(5% vs 2%)であった。
抗アンドロゲン単独療法も、局所進行性の前立腺がん患者に対する去勢術の代替法として評価されている。
証拠(非ステロイド性抗アンドロゲン単独療法 vs 外科的または内科的去勢):
- 1件の証拠の系統的レビューでは、11件のランダム化試験からの局所進行性、転移性、または局所療法後に再発した前立腺がん男性3,060人において、非ステロイド性抗アンドロゲン単独療法と外科的または内科的去勢が比較された。[ 35 ]単独療法としての非ステロイド性抗アンドロゲンの使用では、OSが低下し、臨床的進行および治療失敗の割合が増加した。[ 35 ][証拠レベル:1iiA]
証拠(精巣摘除術 vs LH-RHアゴニスト):
- 局所進行(T3およびT4)がんの男性480人を対象としたランダム化同等性研究では、去勢術による治療を受けた患者のOS期間中央値が70ヵ月であったのに対し、ビカルタミド(150mg/日)による治療を受けた患者のOS期間中央値は63.5ヵ月であった(HR、1.05;95%CI、0.81-1.36);これらの結果は、予め規定された同等性基準を満たさなかった。[ 36 ][証拠レベル:1iiA]
即時 vs 待機ホルモン療法
根治的前立腺全摘除術または根治的放射線療法に適しない患者またはこれらの治療を受ける意思のない患者を対象に、即時のホルモン療法が待機療法(すなわち、進行した時点でホルモン療法を開始する注意深い経過観察または積極的サーベイランス/積極的モニタリング)と比較されている。
証拠(即時 vs 待機ホルモン療法):
- 即時ホルモン療法(精巣摘除術またはLH-RHアゴニスト) vs 待機療法については、局所進行または無症候性転移性前立腺がんの男性を対象に、ランダム化試験で検討された。[
33
][証拠レベル:1iiA]
- 初期の結果では、即時治療群で良好なOSおよび前立腺がん特異的生存が示された。抄録に記載されたように、後にこの統計的有意差は失われた。[ 37 ]
- 病的骨折、脊髄圧迫、および尿管閉塞の発生率も、即時治療群の方が低かった。
- 他の試験では、III期またはIV期の前立腺がんの男性197人が、両側精巣摘除術を診断時に受ける群または症候性進行を認めた時点(または症状を引き起こす可能性が高いと考えられる新たな転移が認められた時点)で受ける群にランダムに割り付けられた。[
38
][証拠レベル:1iiA]
- 12年間の追跡で、OSに統計的有意差はみられなかった。
-
EORTC-30891試験(NCT01819285)で、新たに前立腺がんと診断された病期T0-4、N0-2、M0で、年齢中央値が73歳の患者985人が、アンドロゲン除去を直ちに受ける群または症状が現れた時点で受ける群にランダムに割り付けられた。この研究は、OSに関して即時治療と比較した場合の待機治療の非劣性を証明するようにデザインされた。[
39
][証拠レベル:1iiA]
- 追跡期間中央値7.8年で、待機治療群の患者の約50%がアンドロゲン遮断療法を開始していた。
- 即時治療群におけるOS期間中央値は7.4年、待機治療群では6.5年で、これは死亡のHRが1.25(95%CI、1.05-1.48)であることに対応しており、非劣性基準を満たさなかった。
継続 vs 間欠ホルモン療法
III期またはIV期前立腺がん患者に対する一次治療法として用いた場合、ホルモン療法によるアンドロゲン抑制は通常、疾患進行が認められるまで持続的に行われる。一部の研究者は、最大限の腫瘍減量を達成した後に、ホルモン感受性細胞による腫瘍の再増殖を許す治療を行わない期間を設ける戦略として間欠的アンドロゲン抑制を提案している。理論的には、この戦略によって、より長期間にわたって腫瘍をホルモン反応性にできる可能性がある。ある動物モデルでは、間欠的アンドロゲン抑制(IAD)によってホルモン感受性腫瘍のアンドロゲン依存期間を延長できることが示唆された。[ 40 ]
証拠(継続 vs 間欠ホルモン療法):
- 進行期または再発前立腺がん患者に対する継続的アンドロゲン遮断療法 vs IAD療法を比較した15件のランダム化試験の系統的レビューによると、8件の試験で報告されたOS率(HR、1.02;95%CI、0.93-1.11);5件の試験で報告された前立腺がん特異的生存率(HR、1.02;95%CI、0.87-1.19);または4件の試験で報告された無増悪生存率(HR、0.94;95%CI、0.84-1.05)に有意差はみられなかった。このメタアナリシスは、予め規定されたOSの非劣性基準を満たした(HR死亡、1.15について1.15の上方限界)。[
41
][証拠レベル:1iiA]しかしながら、15件の試験中、1件を除くすべての試験で予め規定された基準によるバイアスのリスクが不明であるか高かった。
- 患者報告のQOLにおける差はわずかしかみられなかったが、ほとんどの試験でIAD群の患者における良好な身体機能および性機能が示された。
EBRT併用または非併用の根治的前立腺全摘除術
EBRT併用または非併用(厳選された患者)で根治的前立腺全摘除術を使用することがある。[ 42 ]臨床的に臓器に限局したがんの男性の約40~50%では、前立腺被膜または切除断端を越えて病理的に進展していることが明らかになっているため、前立腺摘除術後に実施する補助放射線療法の役割が研究されている。
証拠(EBRT併用または非併用の根治的前立腺全摘除術):
- 病理病期がT3、N0、M0の男性425人を対象としたランダム化試験で、術後EBRT(前立腺窩に対して30-32分割で60~64Gy照射)が観察群と比較された。[
43
][
44
]
- 追跡期間中央値約12.5年後で、OSは放射線療法群の方が良好であった;HR死亡は0.72(95%CI、0.55-0.96;P = 0.023)であった。推定10年生存率は、放射線療法群で74%、対照群で66%であった。
- 推定10年無転移生存率は、それぞれ73%および65%(P = 0.016)であった。[ 44 ][証拠レベル:1iiA]
- 短期の合併症発生率は、放射線療法群の方が大幅に高かった:全合併症発生率は23.8% vs 11.9%、直腸合併症発生率は3.3% vs 0%、および尿道狭窄発生率は17.8% vs 9.5%であった。
- 術前(ネオアジュバント)ホルモン療法の役割は現時点では確立されていない。[ 45 ][ 46 ]また、ネオアジュバント・アンドロゲン除去により、形態学的変化が引き起こされ、切除断端および被膜浸潤の評価が複雑になることがある。[ 47 ]
対症療法
III期の患者の多くは尿路症状を抱えているため、治療では症状を抑えることが重要である。腫瘍の局所制御およびその後の症状を改善するために、以下の治療法が使用されることがある:
- 放射線療法。
- ホルモン操作療法。
- 症状緩和目的の手術(経尿道的前立腺切除術[TURP])。
- EBRT併用の組織内密封小線源治療。
- その他の方式の放射線療法(臨床評価段階)。
- エコーガイド下経皮的凍結手術(臨床評価段階)。
- 放射線療法。[ 3 ][ 4 ][ 5 ][ 6 ]コンピュータ断層撮影法ベースの三次元原体照射法の治療計画策定などの方法を用いて、正常組織への曝露を抑えるようにデザインされたEBRTが臨床評価段階にある。
- 前立腺がんの初期療法として使用される有効なホルモン操作療法には以下のものがある:
- 精巣摘除術。
- leuprolideまたはその他のLH-RHアゴニスト(ゴセレリンなど)の連日投与またはデポ製剤。これらの薬物は、腫瘍増悪を伴う場合がある。
- エストロゲン(米国では、もはやジエチルスチルベストロール[DES]は入手できない)。
- 非ステロイド性抗アンドロゲン(例えば、フルタミド、nilutamide、およびビカルタミド)またはステロイド性抗アンドロゲン(例えば、酢酸シプロテロン)。
III期またはIV期の前立腺がん男性(IV期患者の方が多い)において、種々の単剤ホルモン療法を比較したランダム化試験のメタアナリシスは、以下の結論に達している:[ 53 ][証拠レベル:1iiA]
- いずれかのLH-RHアゴニストを用いた場合の2年OS率は、精巣摘除術またはDES 3mg/日による治療と同程度である(HR、1.26;95%CI、0.92-1.39)。
- 非ステロイド性抗アンドロゲンを用いた場合の2年生存率は、精巣摘除術と比べてほぼ同じか劣っている(HR、1.22;95%CI、0.99-1.50)。
- 有害作用の代替として使用される治療中止の発生は、LH-RHアゴニスト(0~4%)の方が非ステロイド性抗アンドロゲン(4~10%)より少なかった。
- 症状緩和目的の手術(TURP)。
- 選択したT3患者には、組織内密封小線源治療とEBRTとの併用療法を行うが、これに関する情報はほとんどない。[ 54 ]
- その他の方式の放射線療法が臨床試験で採用されている。RTOGによるあるランダム化試験から、混合ビーム(中性子/光子)を用いた放射線療法では標準的な光子線療法と比べて局所制御および生存に改善がみられたことが報告された。[ 55 ]同グループによるその後のランダム化研究では、高速中性子線療法と標準的な光子線療法の比較が行われた。局所-領域の制御は、中性子放射療法により改善したものの、OSにおける差はみられなかったが、この試験の追跡期間は比較的短かった。マルチリーフコリメータを使用すると、合併症の発生は減少した。[ 56 ]陽子線治療は研究段階にある。[ 57 ]
- エコーガイド下経皮的凍結手術は、臨床評価段階にある。凍結手術は、冷凍プローブを用いて前立腺を間欠的に冷凍し、その後解凍させることによって、前立腺がん細胞を破壊する手術手技の1つである。[ 58 ][証拠レベル:3iiiC];[ 59 ];[ 60 ][証拠レベル:3iiiDiv]凍結手術は、標準の前立腺摘除術ほどは確立されておらず、長期治療成績も前立腺摘除術や放射線療法ほど確立されていない。重大な毒性作用としては、膀胱下尿道損傷、尿失禁、勃起不全および直腸損傷がある。凍結手術の手技は、開発段階にある。勃起不全はよくみられる。他の副作用の頻度および5年追跡時のがん制御率は、報告する施設間でばらつきがあり、手術や放射線療法のシリーズと比べて小規模である。[ 59 ][ 60 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26.[PUBMED Abstract]
- Paulson DF: Management of prostate malignancy. In: deKernion JB, Paulson DF, eds.: Genitourinary Cancer Management. Philadelphia, Pa: Lea and Febiger, 1987, pp 107-160.[PUBMED Abstract]
- Babaian RJ, Zagars GK, Ayala AG: Radiation therapy of stage C prostate cancer: significance of Gleason grade to survival. Semin Urol 8 (4): 225-31, 1990.[PUBMED Abstract]
- del Regato JA, Trailins AH, Pittman DD: Twenty years follow-up of patients with inoperable cancer of the prostate (stage C) treated by radiotherapy: report of a national cooperative study. Int J Radiat Oncol Biol Phys 26 (2): 197-201, 1993.[PUBMED Abstract]
- Pilepich MV, Johnson RJ, Perez CA, et al.: Prognostic significance of nodal involvement in locally advanced (stage C) carcinoma of prostate--RTOG experience. Urology 30 (6): 535-40, 1987.[PUBMED Abstract]
- Perez CA, Garcia D, Simpson JR, et al.: Factors influencing outcome of definitive radiotherapy for localized carcinoma of the prostate. Radiother Oncol 16 (1): 1-21, 1989.[PUBMED Abstract]
- Freeman JA, Lieskovsky G, Cook DW, et al.: Radical retropubic prostatectomy and postoperative adjuvant radiation for pathological stage C (PcN0) prostate cancer from 1976 to 1989: intermediate findings. J Urol 149 (5): 1029-34, 1993.[PUBMED Abstract]
- Kumar S, Shelley M, Harrison C, et al.: Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database Syst Rev (4): CD006019, 2006.[PUBMED Abstract]
- D'Amico AV, Chen MH, Renshaw AA, et al.: Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial. JAMA 299 (3): 289-95, 2008.[PUBMED Abstract]
- Bolla M, Van Tienhoven G, Warde P, et al.: External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 11 (11): 1066-73, 2010.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
- Roach M, Bae K, Speight J, et al.: Short-term neoadjuvant androgen deprivation therapy and external-beam radiotherapy for locally advanced prostate cancer: long-term results of RTOG 8610. J Clin Oncol 26 (4): 585-91, 2008.[PUBMED Abstract]
- Horwitz EM, Bae K, Hanks GE, et al.: Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 26 (15): 2497-504, 2008.[PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011.[PUBMED Abstract]
- Pilepich MV, Caplan R, Byhardt RW, et al.: Phase III trial of androgen suppression using goserelin in unfavorable-prognosis carcinoma of the prostate treated with definitive radiotherapy: report of Radiation Therapy Oncology Group Protocol 85-31. J Clin Oncol 15 (3): 1013-21, 1997.[PUBMED Abstract]
- Bolla M, Gonzalez D, Warde P, et al.: Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. N Engl J Med 337 (5): 295-300, 1997.[PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986.[PUBMED Abstract]
- Roach M, DeSilvio M, Lawton C, et al.: Phase III trial comparing whole-pelvic versus prostate-only radiotherapy and neoadjuvant versus adjuvant combined androgen suppression: Radiation Therapy Oncology Group 9413. J Clin Oncol 21 (10): 1904-11, 2003.[PUBMED Abstract]
- Pollack A: A call for more with a desire for less: pelvic radiotherapy with androgen deprivation in the treatment of prostate cancer. J Clin Oncol 21 (10): 1899-901, 2003.[PUBMED Abstract]
- Widmark A, Klepp O, Solberg A, et al.: Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 373 (9660): 301-8, 2009.[PUBMED Abstract]
- Warde P, Mason M, Ding K, et al.: Combined androgen deprivation therapy and radiation therapy for locally advanced prostate cancer: a randomised, phase 3 trial. Lancet 378 (9809): 2104-11, 2011.[PUBMED Abstract]
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer. J Clin Oncol 33 (19): 2143-50, 2015.[PUBMED Abstract]
- Brundage M, Sydes MR, Parulekar WR, et al.: Impact of Radiotherapy When Added to Androgen-Deprivation Therapy for Locally Advanced Prostate Cancer: Long-Term Quality-of-Life Outcomes From the NCIC CTG PR3/MRC PR07 Randomized Trial. J Clin Oncol 33 (19): 2151-7, 2015.[PUBMED Abstract]
- Pilepich MV, Winter K, Lawton CA, et al.: Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma--long-term results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys 61 (5): 1285-90, 2005.[PUBMED Abstract]
- Bolla M, Collette L, Blank L, et al.: Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 360 (9327): 103-6, 2002.[PUBMED Abstract]
- Zagars GK, Johnson DE, von Eschenbach AC, et al.: Adjuvant estrogen following radiation therapy for stage C adenocarcinoma of the prostate: long-term results of a prospective randomized study. Int J Radiat Oncol Biol Phys 14 (6): 1085-91, 1988.[PUBMED Abstract]
- Granfors T, Modig H, Damber JE, et al.: Combined orchiectomy and external radiotherapy versus radiotherapy alone for nonmetastatic prostate cancer with or without pelvic lymph node involvement: a prospective randomized study. J Urol 159 (6): 2030-4, 1998.[PUBMED Abstract]
- Pilepich MV, Winter K, John MJ, et al.: Phase III radiation therapy oncology group (RTOG) trial 86-10 of androgen deprivation adjuvant to definitive radiotherapy in locally advanced carcinoma of the prostate. Int J Radiat Oncol Biol Phys 50 (5): 1243-52, 2001.[PUBMED Abstract]
- Horwitz EM, Winter K, Hanks GE, et al.: Subset analysis of RTOG 85-31 and 86-10 indicates an advantage for long-term vs. short-term adjuvant hormones for patients with locally advanced nonmetastatic prostate cancer treated with radiation therapy. Int J Radiat Oncol Biol Phys 49 (4): 947-56, 2001.[PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018.[PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007.[PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015.[PUBMED Abstract]
- Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. The Medical Research Council Prostate Cancer Working Party Investigators Group. Br J Urol 79 (2): 235-46, 1997.[PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017.[PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014.[PUBMED Abstract]
- Iversen P, Tyrrell CJ, Kaisary AV, et al.: Bicalutamide monotherapy compared with castration in patients with nonmetastatic locally advanced prostate cancer: 6.3 years of followup. J Urol 164 (5): 1579-82, 2000.[PUBMED Abstract]
- Kirk D: Immediate vs. deferred hormone treatment for prostate cancer: how safe is androgen deprivation? [Abstract] BJU Int 86 (Suppl 3): 218-58, 2000.[PUBMED Abstract]
- Studer UE, Hauri D, Hanselmann S, et al.: Immediate versus deferred hormonal treatment for patients with prostate cancer who are not suitable for curative local treatment: results of the randomized trial SAKK 08/88. J Clin Oncol 22 (20): 4109-18, 2004.[PUBMED Abstract]
- Studer UE, Whelan P, Albrecht W, et al.: Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: European Organisation for Research and Treatment of Cancer (EORTC) Trial 30891. J Clin Oncol 24 (12): 1868-76, 2006.[PUBMED Abstract]
- Tombal B: Intermittent androgen deprivation therapy: conventional wisdom versus evidence. Eur Urol 55 (6): 1278-80, 2009.[PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015.[PUBMED Abstract]
- Walsh PC, Jewett HJ: Radical surgery for prostatic cancer. Cancer 45 (7 Suppl): 1906-11, 1980.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathologically advanced prostate cancer: a randomized clinical trial. JAMA 296 (19): 2329-35, 2006.[PUBMED Abstract]
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 181 (3): 956-62, 2009.[PUBMED Abstract]
- Witjes WP, Schulman CC, Debruyne FM: Preliminary results of a prospective randomized study comparing radical prostatectomy versus radical prostatectomy associated with neoadjuvant hormonal combination therapy in T2-3 N0 M0 prostatic carcinoma. The European Study Group on Neoadjuvant Treatment of Prostate Cancer. Urology 49 (3A Suppl): 65-9, 1997.[PUBMED Abstract]
- Fair WR, Cookson MS, Stroumbakis N, et al.: The indications, rationale, and results of neoadjuvant androgen deprivation in the treatment of prostatic cancer: Memorial Sloan-Kettering Cancer Center results. Urology 49 (3A Suppl): 46-55, 1997.[PUBMED Abstract]
- Bazinet M, Zheng W, Bégin LR, et al.: Morphologic changes induced by neoadjuvant androgen ablation may result in underdetection of positive surgical margins and capsular involvement by prostatic adenocarcinoma. Urology 49 (5): 721-5, 1997.[PUBMED Abstract]
- Adolfsson J: Deferred treatment of low grade stage T3 prostate cancer without distant metastases. J Urol 149 (2): 326-8; discussion 328-9, 1993.[PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010.[PUBMED Abstract]
- Chodak GW, Thisted RA, Gerber GS, et al.: Results of conservative management of clinically localized prostate cancer. N Engl J Med 330 (4): 242-8, 1994.[PUBMED Abstract]
- Whitmore WF: Expectant management of clinically localized prostatic cancer. Semin Oncol 21 (5): 560-8, 1994.[PUBMED Abstract]
- Shappley WV, Kenfield SA, Kasperzyk JL, et al.: Prospective study of determinants and outcomes of deferred treatment or watchful waiting among men with prostate cancer in a nationwide cohort. J Clin Oncol 27 (30): 4980-5, 2009.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Hasselblad V, et al.: Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 132 (7): 566-77, 2000.[PUBMED Abstract]
- Blasko JC, Grimm PD, Ragde H: Brachytherapy and Organ Preservation in the Management of Carcinoma of the Prostate. Semin Radiat Oncol 3 (4): 240-249, 1993.[PUBMED Abstract]
- Laramore GE, Krall JM, Thomas FJ, et al.: Fast neutron radiotherapy for locally advanced prostate cancer. Final report of Radiation Therapy Oncology Group randomized clinical trial. Am J Clin Oncol 16 (2): 164-7, 1993.[PUBMED Abstract]
- Russell KJ, Caplan RJ, Laramore GE, et al.: Photon versus fast neutron external beam radiotherapy in the treatment of locally advanced prostate cancer: results of a randomized prospective trial. Int J Radiat Oncol Biol Phys 28 (1): 47-54, 1994.[PUBMED Abstract]
- Shipley WU, Verhey LJ, Munzenrider JE, et al.: Advanced prostate cancer: the results of a randomized comparative trial of high dose irradiation boosting with conformal protons compared with conventional dose irradiation using photons alone. Int J Radiat Oncol Biol Phys 32 (1): 3-12, 1995.[PUBMED Abstract]
- Robinson JW, Saliken JC, Donnelly BJ, et al.: Quality-of-life outcomes for men treated with cryosurgery for localized prostate carcinoma. Cancer 86 (9): 1793-801, 1999.[PUBMED Abstract]
- Donnelly BJ, Saliken JC, Ernst DS, et al.: Prospective trial of cryosurgical ablation of the prostate: five-year results. Urology 60 (4): 645-9, 2002.[PUBMED Abstract]
- Aus G, Pileblad E, Hugosson J: Cryosurgical ablation of the prostate: 5-year follow-up of a prospective study. Eur Urol 42 (2): 133-8, 2002.[PUBMED Abstract]
- IV期の前立腺がんの治療
-
概要
IV期の前立腺がんは米国がん合同委員会のTNM(腫瘍、リンパ節、転移)分類により、以下のように定義される:[ 1 ]
IVA期
- すべてのT、N1、M0、すべての前立腺特異抗原(PSA)、すべてのグリソンスコア。
IVB期
- すべてのT、N0、M1、すべてのPSA、すべてのグリソンスコア。
膀胱頸部への顕微鏡的浸潤による前立腺外への浸潤(T4)はT3aに含められる。
治療の選択は以下の因子に左右される:
- 年齢。
- 併存する医学的疾患。
- 症状。
- 遠隔転移(骨転移が最も多い)の有無または所属リンパ節転移のみ。
最も一般的な症状は、尿路または骨転移巣から生じる。経尿道的前立腺切除術(TURP)または放射線療法による尿路からの症状の緩和および放射線療法またはホルモン療法による骨転移巣からの症状の緩和は、こうした患者に対処する上で重要である。ビスホスホネートが骨転移の管理に対して使用されることもある。[ 2 ]
IV期の前立腺がんに対する標準治療法の選択肢
IV期の前立腺がんを有する患者に対する標準治療法の選択肢には以下のものがある:
- ホルモン操作療法。
- 化学療法を併用するホルモン操作療法。
- ビスホスホネート。
- ホルモン療法併用または非併用の外照射療法(EBRT)。
- 症状緩和目的の放射線療法。
- TURPによる症状緩和目的の手術。
- 注意深い経過観察または積極的サーベイランス/積極的モニタリング。
ホルモン操作療法
ホルモン療法は、転移性前立腺がんに対する治療法の中心である。治癒することは、あるとしてもまれであるが、治療に対して著明な自覚的または他覚的な反応が、患者の大半にみられる。前立腺がんに対するホルモン療法の基礎は、精巣によるテストステロン産生を停止させる内科的または外科的去勢である。これは一般にアンドロゲン遮断療法(ADT)と呼ばれ、両側精巣摘除術またはゴナドトロピン放出ホルモン(GnRH)アゴニストもしくはアンタゴニストの投与により達成可能である。最も有効かつ純粋なホルモン療法アプローチでは、ADTと以下の薬の1つを組み合わせて使用する:
- 酢酸アビラテロン(アンドロゲン生合成に不可欠な酵素であるチトクロムP450c17の阻害薬)。
- アパルタミド(アンドロゲン受容体の競合的阻害薬)。
- エンザルタミド(アンドロゲン受容体シグナル伝達阻害薬)。
ランダム化比較試験によると、これらの薬のいずれか1つとADTの併用療法では、ADT単独より長い全生存期間が得られることが報告されている。
- ランダム化二重盲検試験のLATITUDE(NCT01715285)において、高リスク転移性去勢感受性前立腺がんの男性1,199人が、ADT + 酢酸アビラテロン(1,000mg、1日1回経口投与)およびプレドニゾン(5mg、1日1回経口投与)またはADT + アビラテロン-プレドニゾンプラセボのいずれかを投与された。[
3
]高リスク疾患は、次の3つの因子のうち2つ以上を有するものと定義された:グリソンスコアが8以上、骨病変が3つ以上、または測定可能な臓器転移。
- 中央値にして30.4ヵ月間追跡した後、この試験はアビラテロン研究群で明確な全生存(OS)の有益性が示されたために中止された:OS期間中央値は到達せず vs 34.7ヵ月(ハザード比[HR]、0.62;95%信頼区間[CI]、0.51-0.76;P < 0.001)。[ 3 ][証拠レベル:1iA]
- アビラテロン療法は忍容性が良好であったが、プラセボ研究群と比較してグレード3または4の高血圧および低カリウム血症といったミネラルコルチコイド作用の増加がみられた。
- 患者報告の転帰および健康関連のQOL(HRQOL)データを収集したところ、プラセボ群と比較して酢酸アビラテロン研究群では疼痛進行、前立腺がん関連症状、疲労、機能低下、および全般的なHRQOLにおける臨床的有益性が示された。[ 4 ][証拠レベル:1iC]
- ランダム化オープンラベルSTAMPEDE試験(NCT00268476)において、1,917人の男性(約95%が新たに診断された;約50%が転移性疾患を有し、約50%は局所進行またはリンパ節転移陽性疾患を有した)が、ADT単独またはADT + 酢酸アビラテロン(1,000mg、1日1回経口投与)およびプレドニゾロン(5mg、1日1回経口投与)で治療された。[
5
]6~9ヵ月後にリンパ節転移陰性非転移性疾患を有する男性に対して局所放射線療法が指示され、リンパ節転移陽性非転移性疾患を有する男性には任意とされた。ホルモン療法は2年経過時または進行時までと短縮された。研究参加者の約40%で放射線療法が計画された。
- 追跡期間中央値40ヵ月経過時に、アビラテロン研究群における3年OS率は83%であったのに比べ、ADT単独研究群では76%であった(HR死亡、0.63;95%CI、0.52-0.76;P < 0.001)。[ 5 ][証拠レベル:1iiA]転移性疾患 vs 非転移性疾患における相対的な治療の差について異質性の明確な証拠はなかったが、非転移性疾患の男性では絶対差がはるかに小さく、おそらく追跡期間が短かったため統計的有意差は示されなかった(HR死亡、0.75;95%CI、0.49-1.18)。
- ADT単独と比較したアビラテロンに伴う毒性の主要な追加の差は、高血圧(5% vs 1%)、血中アミノトランスフェラーゼ値のわずかな増加(6% vs 1%未満)、および呼吸障害(5% vs 2%)であった。
- ランダム化比較二重盲検第III相TITAN試験(NCT02489318)において、転移性去勢感受性前立腺がんの男性1,052人が、ADT単独またはADT + アパルタミド(240mg、1日1回経口投与)もしくはプラセボを受ける群にランダムに割り付けられた。[
6
]
- 2年OS率は、アパルタミド群が82.4%であったのと比較して、プラセボ群が73.5%であった(HR、0.67;95%CI、0.51−0.89)。
- X線検査での無増悪生存(PFS)率は、アパルタミド群が68.2%であったのと比較して、プラセボ群が47.5%であった(HR、0.48;95%CI、0.39-0.60)。
- グレード3または4の有害事象は、アパルタミド群患者の42.2%およびプラセボ群患者の40.8%で報告された。
- アパルタミドでは痙攣発作との関連が認められているため、痙攣発作の既往があるか、その素因がある男性はこの試験から除外された。
- ランダム化比較オープンラベル第III相ENZAMET試験(NCT02446405)において、去勢感受性前立腺がんの男性1,125人が、ADT単独またはADT + エンザルタミド(160mg、1日1回経口投与)を受ける群にランダムに割り付けられた。[
7
]
- 3年OS率は、併用療法群が80%であったのと比較して、ADT単独療法群が72%であった(HR、0.67;95%CI、0.52−0.86)。
- PSA PFS(HR、0.39、P < 0.001)および臨床的PFS(HR = 0.40、P < 0.001)も併用療法群が長かった。
- 重篤な有害事象は、エンザルタミド群患者の42%に報告されたのと比較して、単独療法群患者では34%に報告された。
- 治療は、エンザルタミド群でより多く中止され(33 vs 14イベント)、痙攣発作および疲労がエンザルタミド群でより一般的であった:エンザルタミド群の男性7人に痙攣発作がみられたのに対して(1%)、ADT単独群では認められなかった。
- 併用療法群男性の6%にグレード3または4の疲労が報告されたのに対して、ADT単独群では1%であった。
前立腺がんの初期療法として使用される有効なホルモン操作療法には以下のものがある:[ 8 ]
- 精巣摘除術単独またはSouthwest Oncology Group(SWOG-8894)試験でみられるようなアンドロゲン遮断薬との併用。
- leuprolideの連日投与またはデポ製剤などの黄体形成ホルモン放出ホルモン(LH-RH)アゴニスト。これらの薬物は単独で使用すると腫瘍増悪を伴うことがある;そのため、肝痛、尿管閉塞、または切迫脊髄圧迫が認められた場合は、初回から抗アンドロゲンの併用を検討すべきである。[ 9 ][ 10 ][ 11 ][ 12 ][証拠レベル:1iiA]
- leuprolide + フルタミド;[ 13 ]しかしながら、あるメタアナリシスでは、leuprolideに抗アンドロゲンを加えることに生存率の明らかな改善効果は認められていない。[ 14 ]
- エストロゲン(ジエチルスチルベストロール[DES]、クロロトリアニセン、エチニルエストラジオール、抱合型エストロゲン-USP、およびDES-二リン酸)。米国では、DESはもはや市販されていない。
複数のシリーズにおいて、治療前のPSA値が、ホルモン療法を受けている転移性前立腺がん患者の無増悪期間と逆相関している。ホルモン療法後にPSA値が検出できないレベルまで低下することで、無増悪状態の持続期間に関する情報が得られる;ただし、PSA低下が80%未満であれば、予測にはあまり役立たない可能性がある。[ 15 ]
精巣摘除術とエストロゲン投与とは結果がほぼ同じであり、いずれにするかは患者の希望や予測される副作用によって決める。エストロゲンは、特に高用量では、心血管疾患の発生また増悪と関連がある。DESが1mg/日であれば、高用量でみられるほどの高頻度で心血管合併症を伴うことはない;ただし、心血管毒性作用のために、DESの使用は少なくなってきている。
心理的意味合いにおいて、精巣摘除術は多くの患者にとって好ましくなく、患者の多くが有効であれば代替療法を選ぶことになる。[ 16 ]精巣摘除術とエストロゲン投与との併用療法は、いずれかを単独で行うより優れているとはいえないことが示されている。[ 17 ]
両側精巣摘除術またはLH-RHアゴニストによる治療後に、男性の多くがほてりを経験する。こうしたほてりは数年間続く可能性がある。[ 18 ]こうした症状の対処には、程度の差はあるもののDES、クロニジン、酢酸シプロテロンまたは酢酸メドロキシプロゲステロンを用いるとよいという報告がある。
ホルモン操作療法の1つで腫瘍増悪が認められた後は、他のいかなるホルモン操作療法に対しても客観的腫瘍反応がみられることはまれである。[ 19 ]しかしながら、フルタミド(aminoglutethimide投与の併用または非併用を問わず)を中止することで、PSA値が低下すること、および新しい治療を開始する前に、この反応についてモニターする必要が生じる場合があることを示唆する研究もある。[ 20 ][ 21 ][ 22 ]低用量プレドニゾンにより、患者の約33%の症状を緩和することができる。[ 23 ]アンドロゲン受容体阻害薬など、新しいホルモンによるアプローチは、ADTを施行したにもかかわらず腫瘍が増悪した後のOSと生活の質(QOL)を改善することが示されている。(詳しい情報については、本要約の再発前立腺がんのセクションを参照のこと。)
即時 vs 待機ホルモン療法
患者によっては無症候性の場合があり、即時の追加治療を実施しない注意深い経過観察が適切なことがある。
証拠(即時 vs 待機ホルモン療法):
- 局所進行前立腺がん患者を対象に早期ホルモン療法(術後補助または術前補助)と待機ホルモン療法(LH-RHアゴニストおよび/または抗アンドロゲン)を比較した7件のランダム化比較試験のメタアナリシスでは、前立腺摘除術、放射線療法、または注意深い経過観察あるいは積極的サーベイランス/積極的モニタリングのいずれの治療を受けたかどうかにかかわらず、早期治療を受けた患者に全死亡率の改善が示された(相対リスク、0.86;95%CI、0.82-0.91)。[ 24 ][証拠レベル:1iiA]
- 根治的前立腺全摘除術と骨盤リンパ節郭清術を受け、リンパ節転移が明らかになった(病期T1-2、N1、M0)男性98人を対象とした小規模なランダム化試験では、LH-RHアゴニストであるゴセレリンまたは精巣摘除術による即時継続ホルモン療法が、疾患進行が明らかになるまでの待機治療と比較された。[
25
][証拠レベル:1iA];[
26
]
- 中央値11.9年の追跡後では、即時補助療法群のOS(P = 0.04)および前立腺がん特異的生存(P = 0.004)の方が優れていた。
- 即時治療群の10年生存率は約80%であったのに対して、待機治療群では約60%であった。[ 27 ]
- これより2倍多くの患者をランダムに割り付けた別の試験(RTOG-8531)では、早期 vs 待機のホルモン操作療法でOSに差はみられなかった。[ 28 ]
- 所属リンパ節転移がみられるが臨床的な転移の証拠はない(すべてのT、N+、M0)男性のランダム化試験(EORTC-30846)でも、ゴセレリンまたは精巣摘除術による即時ホルモン療法が、臨床的な疾患進行に対する待機ホルモン療法と比較されている。234人の男性で、前立腺摘除術または前立腺放射線療法を受けたものはいなかった。[
29
][証拠レベル:1iiA]
- 追跡期間中央値8.7年で、待機 vs 即時ホルモン療法群のOSに対するHRは、1.23(95%CI、0.88-1.71)であった。
- 待機と即時ホルモン療法間でOSに統計的有意差は認められなかったが、この試験は、低度または中程度の差を識別するには検出力不足であった。
- 局所進行または無症候性転移性前立腺がんの男性を対象としたランダム化試験で、即時ホルモン療法(例えば、精巣摘除術またはLH-RHアゴニスト) vs 待機治療(例えば、進行時にホルモン療法を実施する注意深い経過観察)が比較された。[
30
][証拠レベル:1iiA]
- この初期結果では、OSおよび前立腺がん特異的生存が即時治療群で良好なことが示された。
- 病的骨折、脊髄圧迫、および尿管閉塞の発生率も、即時治療群の方が低かった。
- 他の試験では、III期またはIV期の前立腺がん男性197人が、両側精巣摘除術を診断時に受ける群または症候性進行を認めた時点(または症状を引き起こす可能性が高いと考えられる新たな転移が認められた時点)で受ける群にランダムに割り付けられた。[
31
][証拠レベル:1iiA]
- 12年の追跡期間に、OSにおける統計的有意差は確認されなかった。
黄体形成ホルモン放出ホルモン(LH-RH)アゴニストまたは抗アンドロゲン
IV期の前立腺がん患者に対してLH-RHアゴニストまたは抗アンドロゲンを用いた治療法では、他のホルモン療法と同程度の奏効率が得られている。[ 9 ][ 32 ]
証拠(LH-RHアゴニストまたは抗アンドロゲン):
- ランダム化試験で、すべてのT、すべてのN、M1の患者に対するLH-RHアゴニストのleuprolide(1mg/日を皮下投与[SQ])は、DES(3mg/日を経口投与)と同程度の有効性があることが明らかにされたが、女性化乳房、吐き気と嘔吐、および血栓塞栓症の発生が少なかった。[ 10 ]
- 他のランダム化研究で、LH-RHアゴニストのゴセレリンのデポ製剤は、精巣摘除術[ 11 ][ 33 ][ 34 ]またはDES 3mg/日と同程度の有効性があることが明らかにされた。[ 32 ]leuprolideのデポ製剤は、leuprolideの連日投与と同等の治療効果を有しており、1ヵ月用と3ヵ月用とがある。
- 1件の証拠の系統的レビューでは、11件のランダム化試験からの局所進行性、転移性、または局所療法後に再発した前立腺がん男性3,060人において、非ステロイド性抗アンドロゲン単独療法と外科的または内科的去勢が比較された。[ 35 ]単独療法としての非ステロイド性抗アンドロゲンの使用では、OSが低下し、臨床的進行および治療失敗の割合が増加した。[ 35 ][証拠レベル:1iiA]
- 転移性前立腺がん患者に対してDES 1mgの1日3回経口投与とフルタミド250mgの1日3回投与を比較した1件の小規模なランダム化研究では、両レジメンで奏効率は同程度であったが、DESを投与した場合の生存が優れていた。統計的有意のボーダーライン上にある多くの心血管および/または血栓塞栓毒性作用は、DES治療に関連していた。[ 36 ][証拠レベル:1iA]ホルモン療法の種々併用療法が試験されている。
最大アンドロゲン遮断療法(MAB)
外科的または内科的去勢後に副腎がアンドロゲンを産生し続けるということに基づき、去勢術に抗アンドロゲン療法を追加するケースシリーズ研究が実施された。こうしたケースシリーズから得られた有望な結果は、MABまたは完全アンドロゲン遮断療法として知られる戦略の幅広い使用につながった。しかしながら、その後のランダム化比較試験は、去勢術に抗アンドロゲン療法を補うことの効力に疑問を投げかけている。
証拠(MAB):
- 両側精巣摘除術に、抗アンドロゲンのフルタミドまたはプラセボのいずれかを併用した治療法を比較した大規模なランダム化比較試験では、OSに差は報告されなかった。[
37
][証拠レベル:1iA]
- MABは、より主観的な奏効率のエンドポイントを改善する可能性が示唆されているが、主としてフルタミド治療群において下痢および不良な感情機能が多くみられるため、プロスペクティブに評価したQOLは、フルタミド群の方がプラセボ群より不良であった。[ 38 ][証拠レベル:1iC]
- 患者8,275人を対象に従来の外科的または内科的去勢とMAB、つまり去勢術 + フルタミド、酢酸シプロテロン、またはnilutamideのような抗アンドロゲンの長期投与を比較した27件のランダム化試験のメタアナリシスでは、MABと関連して生存に統計的に有意な改善はみられなかった。[
14
][証拠レベル:1iA]
アンドロゲン抑制単独 vs アンドロゲン抑制 + nilutamideまたはフルタミドの試験についてサブセット解析で検討したところ、5年絶対生存率は、併用療法群の方が良好であった(2.9%良好、95%CI、0.3-5.5);しかしながら、アンドロゲン抑制単独 vs アンドロゲン抑制 + 酢酸シプロテロンの試験を検討したところ、5年絶対生存率の傾向は、併用療法群の方が不良であった(2.8%不良、95%CI、-7.6~+2.0)。[ 14 ]
- Agency for Health Care Policy and Research(現在のAgency for Healthcare Research and Quality)は、そのTechnology Evaluation Center、つまりBlue Cross and Blue Shield Associationのエビデンスベース医療センターで実施した単一ホルモン療法および全アンドロゲン遮断療法のランダム化臨床試験の入手可能な証拠について体系的レビューを実施した。III期またはIV期の前立腺がん男性(IV期患者の方が多い)において、種々の単剤ホルモン療法を比較したランダム化試験のメタアナリシスは、以下の結論に達している:[
39
][証拠レベル:1iiA]
- いずれかのLH-RHアゴニストを用いた場合の2年OS率は、精巣摘除術または毎日DES 3mgによる治療と同程度である(HR、1.26;95%CI、0.92-1.39)。
- 非ステロイド性抗アンドロゲンを用いた場合の2年生存率は、精巣摘除術と比べてほぼ同じか劣っている(HR、1.22;95%CI、0.99-1.50)。
- 有害作用の代替として使用される治療中止の発生は、LH-RHアゴニスト(0~4%)の方が非ステロイド性抗アンドロゲン(4~10%)より少なかった。
全アンドロゲン遮断療法は、単一ホルモン療法と同程度の効果しかなく、患者の忍容性も低かった。また、新たに無症候性転移性がんの診断を受けた患者は即時アンドロゲン除去療法を受けるべきか、または臨床徴候または進行したことを示す症状が現れるまで治療を延期すべきかを決定するには、証拠が不十分であると判断された。[ 40 ]
継続 vs 間欠ホルモン療法
III期またはIV期前立腺がん患者に対する一次治療法として用いた場合、ホルモン療法によるアンドロゲン抑制は、多くの場合に疾患進行が認められるまで持続的に行われる。また、最大限の腫瘍減量に続いて治療を行わない無治療期間を設ける戦略である、間欠的アンドロゲン抑制を施行することもできる。この戦略によって、より長期間にわたって腫瘍をホルモン反応性にできる可能性があると推測された。ある動物モデルでは、間欠的アンドロゲン抑制(IAD)によってホルモン感受性腫瘍のアンドロゲン依存期間を延長できることが示唆された。[ 41 ]しかしながら、ヒトを対象としたランダム化比較試験では、IADにより去勢抵抗性疾患の発生を遅らせるという仮説を裏付けることができなかった。IADに有益性があるとすれば、身体機能および性機能の領域にあるとみられる。
証拠(継続 vs 間欠ホルモン療法):
- 進行期または再発前立腺がん患者に対する継続的アンドロゲン遮断療法 vs IAD療法を比較した15件のランダム化試験の系統的レビューによると、8件の試験で報告されたOS率(HR、1.02;95%CI、0.93-1.11);5件の試験で報告された前立腺がん特異的生存率(HR、1.02;95%CI、0.87-1.19);または4件の試験で報告されたPFS率(HR、0.94;95%CI、0.84-1.05)に有意差はみられなかった。このメタアナリシスは、予め規定されたOSの非劣性基準を満たした(HR死亡、1.15について1.15の上方限界)。[
42
][証拠レベル:1iiA]しかしながら、15件の試験中、1件を除くすべての試験で予め規定された基準によるバイアスのリスクが不明であるか高かった。
- 患者報告のQOLにおける差はわずかしかみられなかったが、ほとんどの試験でIAD群の患者における良好な身体機能および性機能が示された。
化学療法を併用するホルモン操作療法
複数のランダム化試験で、化学療法の追加はADT単独と比較してOSを改善することが示されており、効力はADT + 酢酸アビラテロンを含むホルモン療法と同等のようである。しかしながら、2つのアプローチはランダム化研究で直接比較されていない。
転移性前立腺がんの第一選択管理で、長期ホルモン療法と併用するドセタキセルの追加が検証されており、ホルモン療法単独以上に結果が改善することが示されている。ホルモン感受性転移性前立腺がんに関するランダム化試験の証拠の系統的レビューおよびメタアナリシスにより、これらのデータが要約されている。[ 43 ]
証拠(化学療法を併用するホルモン操作療法):
- 3件のランダム化試験(3,206人の男性)を解析したところ、標準ケアへのドセタキセルの追加に関連したHR死亡は0.77(95%CI、0.68-0.87;P < 0.0001)で、これは4年生存率における9%(95%CI、5-14)の絶対的改善を示した。[ 43 ][証拠レベル:1iiA]
-
CHAARTED試験(NCT00309985)では、転移性ホルモン感受性前立腺がんの患者790人が、ドセタキセル(3週間ごとの75mg/m2静注[IV]を6サイクル実施)を併用するまたは併用しないADTを受ける群にランダムに割り付けられた。[
44
][
45
]以前の補助的ADTは、その継続期間が12ヵ月以内で、完了後12ヵ月以内に進行した場合は許容された。患者は大容積 vs 小容積の病変でプロスペクティブに層別化され、大容積は内臓転移の存在または4つ以上の骨病変で、少なくとも1つが脊柱または骨盤外に位置するものと定義された。この定義により、約65%の患者に大容積の病変が認められた。
- 追跡期間中央値53.7ヵ月経過時に、ADT + ドセタキセル群のOS期間中央値は57.6ヵ月で、ADT単独群では47.2ヵ月であった(HR死亡、0.72;95%CI、0.59-0.89;P = 0.0018)。[ 45 ][証拠レベル:1iiA]
- 大容積の病変を有する患者においてのみ生存の優位性が観察された。 大容積の病変を有する群では、OS期間中央値が明らかに改善した(61.2ヵ月 vs 34.4ヵ月)(HR、0.63;95%CI、0.50-0.79;P < 0.001)。しかしながら、小容積の病変を有する男性では生存期間における差は観察されなかった(OS期間中央値、63.5ヵ月 vs 到達せず)(HR、1.04;95%CI、0.70-1.55;P = 0.86)。効力の異質性に関する検証は統計的に有意であった(P = 0.033)。
- Functional Assessment of Cancer Therapy-Prostate(FACT-P)スケールで測定された2つの研究群間のQOLの比較では、12ヵ月間の計画された評価のいずれの時点でも予め定められた最小重要差を超えないことが明らかにされた。[ 46 ]
ビスホスホネート
ホルモン療法に加えて、ビスホスホネートによる補助療法が検証されている。[ 47 ]
証拠(ビスホスホネート):
- MRC-PR05で、骨転移を来し、標準ホルモン療法を開始している男性または奏効が得られている男性311人が、最長3年間投与する経口クロドロン酸ナトリウム(2,080mg/日)群またはこれとマッチさせたプラセボ群にランダムに割り付けられた。[
47
][証拠レベル:1iA]
- 追跡期間中央値11.5年で、OSはクロドロン酸群の方が良好であった:HR死亡は0.77(95%CI、0.60-0.98;P = 0.032)であった。
- 5年および10年生存率は、クロドロン酸群で30%および17%に対し、プラセボ群で21%および9%であった。
- 局所進行しているが非転移性の疾患を有する男性におけるある並行研究(MRC-PR04)では、クロドロン酸と関連する有益性は示されなかった。
-
CALGB-90202[NCT00079001]はランダム化比較試験であり、骨転移したアンドロゲン除去感受性前立腺がんの男性645人において、ゾレドロン酸(4週間ごとに4mg静注)とプラセボを比較した。ホルモン療法抵抗性で増悪した患者には、オープンラベルのゾレドロン酸が投与された。[
48
][証拠レベル:1iDiii]
- 最長7年の追跡後、2つの研究群間で、主要エンドポイントである骨関連事象(緩和目的の骨に対する放射線照射、臨床骨折、脊髄圧迫、骨手術、前立腺がんによる死亡)までの時間のリスクに差はみられなかった。
- PFSまたはOSにも差はみられなかった。
- 別の否定的なランダム化試験(STAMPEDE [NCT00268476])では、局所進行性(M0)または転移性(M1)前立腺がんで、長期のホルモン療法を開始していた男性1,245人が、2:1:1の比率で次の3つの治療群の1つにランダムに割り付けられた:標準ケア、セレコキシブ(400mg、1日2回、1年間)、およびセレコキシブ + ゾレドロン酸(4mg、静注、3週間のサイクルを6サイクル施行後、4週間のサイクルを2年間)。[
49
]
- 追跡期間中央値69ヵ月後、セレコキシブまたはセレコキシブ + ゾレドロン酸のいずれかに関連した生存の改善は検出されなかった。
- M1病変を有し、セレコキシブ + ゾレドロン酸を投与された患者の方が、M1病変を有し、標準ケアを受けた患者よりも生存が優れていた(HR死亡、0.78;95%CI、0.62-0.98)が、転移状態との相互作用についての公式の検証では統計的有意差を示さなかった;そのため、この予想外の結果は仮説生成型としてしか考えられない。
ビスホスホネートと骨転移リスクの低下
腫瘍が局所進行非転移性(T2-T4、N0-N1、M0)の患者は骨転移を来すリスクがあるため、ビスホスホネートがこのリスクを低下させる戦略の1つとして研究されている。しかしながら、第一世代のビスホスホネートであるクロドロン酸を高用量(2,080mg/日)で5年間経口投与するレジメンのプラセボ対照ランダム化試験(MRC-PR04)では、症候性骨転移までの期間または生存のいずれに関しても良好な効果はみられなかった。[ 50 ][証拠レベル:1iA]
ホルモン療法併用または非併用の外照射療法(EBRT)
EBRTは、厳選したM0の患者において治癒目的に使用されることがある。[ 51 ][ 52 ]尿道狭窄の発生率を抑えるため、TURP後4~6週間おいて根治的放射線療法を実施すべきである。[ 53 ]
EBRTに追加するホルモン療法を検討すべきである。[ 40 ][ 54 ]
証拠(ホルモン療法併用または非併用の放射線療法):
- Blue Cross and Blue Shield Association Technology Evaluation Center、つまりAgency for Healthcare Research and Quality(AHRQ)のエビデンスベース医療センターは、放射線療法単独と放射線療法 + 長期アンドロゲン抑制を比較したランダム化臨床試験で入手可能な証拠について系統的レビューを実施した。[
40
][証拠レベル:1iiA]試験対象となった集団には、大きなT2b腫瘍のある患者も含まれていた。
- このメタアナリシスによると、5年OSに差が認められ、放射線療法単独と比較した場合、放射線療法 + 長期アンドロゲン抑制(LH-RHアゴニストまたは精巣摘除術)の方が良好であった(HR、0.63;95%CI、0.48-0.83)。
- ランダム化プロスペクティブ臨床試験で、LH-RHアゴニストによる18ヵ月間のアンドロゲン抑制では、OS率および疾患特異的生存率に関して36ヵ月間と同様な結果が得られるとみられる。[
55
][証拠レベル:1iiA、1iiB]この試験で、II期からIVA期(臨床病期がT3–T4、またはPSAが20ng/mLを上回るか、グリソンスコアが7を上回る)のがん男性630人に対して、35分割での70Gyの放射線照射単独に加え、酢酸ゴセレリンが計18ヵ月間または36ヵ月間投与された。
- 追跡期間中央値9.4年で、各試験群でのOS率(10年で62%;HR死亡 = 1.02;95%CI、0.81–1.29;P = 0.8)はほぼ同じであり、前立腺がん特異的生存率(HR前立腺がん死亡 = 0.95;95%CI、0.58-1.55;P = 0.8)も同様であった。
- 両試験群で総合的な生活の質はほぼ同じであったが、性的活動およびセックスへの関心は18ヵ月群がやや良好であった。[ 55 ][証拠レベル:1iiC]
- 術前補助ホルモン療法の至適治療期間は研究されていない。局所進行(T2b、T2c、T3、T4)の男性818人を対象としたランダム化試験(TROG96.01[ACTRN12607000237482])において、非転移性がんに対して放射線療法(所属リンパ節は含めずに、前立腺および精嚢に対して2Gy/日に分割して66Gy照射)が実施された。放射線療法単独、放射線療法の2ヵ月前から施行期間中にかけて計3ヵ月間の術前補助アンドロゲン遮断療法(NADT)(毎月のゴセレリン3.6mgの皮下投与 + フルタミド250mgの1日3回経口投与)、または放射線療法の5ヵ月前から施行期間中にかけて計6ヵ月間のNADTのいずれかの群に患者をランダムに割り付けた。[
54
][証拠レベル:1iiA]
- 追跡期間中央値10.6年後で、放射線療法単独群と放射線療法 + 3ヵ月のNADT群との間に統計的な有意差はみられなかった。
- しかしながら、6ヵ月のNADT群では、前立腺がん特異的死亡率および全死亡率が放射線療法単独群よりも良好なことが示された;10年全原因死亡率は、29.2% vs 42.5%(HR、0.63;95%CI、0.48-0.83;P = 0.0008)であった。
- 術前補助ホルモン療法の期間が、中リスクの前立腺がん(T1b-4、グリソンスコア 2-6、およびPSA > 10ng/mLであるが、100ng/mL以下;T1b-4、グリソンスコア 7、およびPSA < 20ng/mL;またはT1b-1c、グリソンスコア 8-10、およびPSA < 20ng/mL)で転移の証拠のない適格男性1,489人を対象にした別の試験(RTOG -9910[NCT00005044])で検討された。男性は、短期コースの術前補助アンドロゲン抑制(放射線療法前の8週間および放射線療法施行期間中の8週間にわたってLH-RHアゴニスト + ビカルタミドまたはフルタミド)または長期コースの術前補助アンドロゲン抑制(放射線療法前の28週間および放射線療法施行期間中の8週間)を受ける群にランダムに割り付けられた。両治療群とも、前立腺に対して70.2Gyを39分割で1日1回照射および腸骨リンパ節に対して46.8Gyを照射された。[
56
][証拠レベル:1iiAおよび証拠レベル:1iiB]
症状緩和目的の放射線療法
8Gyの単回照射は、RTOG-9714(NCT00003162)試験で実証されたように、骨痛緩和およびQOLに対して多分割照射(3Gy×10)と同程度に有益であることが示されている。[ 57 ];[ 58 ][証拠レベル:1iiC](詳しい情報については、がん性疼痛に関するPDQ要約を参照のこと。)
経尿道的前立腺切除術(TURP)による症状緩和目的の手術
経尿道的前立腺切除術は、進行前立腺がんにおける緩和ケアの一部として尿路閉塞の症状緩和に有用な場合がある。
注意深い経過観察または積極的サーベイランス/積極的モニタリング
(選択した無症候性患者を対象に)即時に追加治療を実施しない慎重な経過観察。[ 59 ]
IV期の前立腺がんに対して臨床評価段階にある治療法の選択肢
IV期の前立腺がん患者に対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 即時の精巣摘除術を伴う根治的前立腺全摘除術。
- Mayo Clinicにおいて腫瘍がすべてのT、N1-3、M0で根治的前立腺全摘除術と精巣摘除術を同時に施行する治療を受けた患者を対象とした大規模シリーズに関する非対照レトロスペクティブ・レビューでは、局所進行と遠隔転移までの期間に関連性が認められた;しかしながら、OSの延長は実証されていない。[ 60 ]患者選択因子がこのような研究デザインの解釈を困難にしている。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Prostate. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 715–26.[PUBMED Abstract]
- Dearnaley DP, Sydes MR, Mason MD, et al.: A double-blind, placebo-controlled, randomized trial of oral sodium clodronate for metastatic prostate cancer (MRC PR05 Trial). J Natl Cancer Inst 95 (17): 1300-11, 2003.[PUBMED Abstract]
- Fizazi K, Tran N, Fein L, et al.: Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 377 (4): 352-360, 2017.[PUBMED Abstract]
- Chi KN, Protheroe A, Rodríguez-Antolín A, et al.: Patient-reported outcomes following abiraterone acetate plus prednisone added to androgen deprivation therapy in patients with newly diagnosed metastatic castration-naive prostate cancer (LATITUDE): an international, randomised phase 3 trial. Lancet Oncol 19 (2): 194-206, 2018.[PUBMED Abstract]
- James ND, de Bono JS, Spears MR, et al.: Abiraterone for Prostate Cancer Not Previously Treated with Hormone Therapy. N Engl J Med 377 (4): 338-351, 2017.[PUBMED Abstract]
- Chi KN, Agarwal N, Bjartell A, et al.: Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 381 (1): 13-24, 2019.[PUBMED Abstract]
- Davis ID, Martin AJ, Stockler MR, et al.: Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer. N Engl J Med 381 (2): 121-131, 2019.[PUBMED Abstract]
- Scott WW, Menon M, Walsh PC: Hormonal therapy of prostatic cancer. Cancer 45 (7 Suppl): 1929-36, 1980.[PUBMED Abstract]
- Parmar H, Edwards L, Phillips RH, et al.: Orchiectomy versus long-acting D-Trp-6-LHRH in advanced prostatic cancer. Br J Urol 59 (3): 248-54, 1987.[PUBMED Abstract]
- Leuprolide versus diethylstilbestrol for metastatic prostate cancer. The Leuprolide Study Group. N Engl J Med 311 (20): 1281-6, 1984.[PUBMED Abstract]
- Peeling WB: Phase III studies to compare goserelin (Zoladex) with orchiectomy and with diethylstilbestrol in treatment of prostatic carcinoma. Urology 33 (5 Suppl): 45-52, 1989.[PUBMED Abstract]
- Sharifi R, Soloway M: Clinical study of leuprolide depot formulation in the treatment of advanced prostate cancer.The Leuprolide Study Group. J Urol 143 (1): 68-71, 1990.[PUBMED Abstract]
- Crawford ED, Eisenberger MA, McLeod DG, et al.: A controlled trial of leuprolide with and without flutamide in prostatic carcinoma. N Engl J Med 321 (7): 419-24, 1989.[PUBMED Abstract]
- Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Prostate Cancer Trialists' Collaborative Group. Lancet 355 (9214): 1491-8, 2000.[PUBMED Abstract]
- Matzkin H, Eber P, Todd B, et al.: Prognostic significance of changes in prostate-specific markers after endocrine treatment of stage D2 prostatic cancer. Cancer 70 (9): 2302-9, 1992.[PUBMED Abstract]
- Cassileth BR, Soloway MS, Vogelzang NJ, et al.: Patients' choice of treatment in stage D prostate cancer. Urology 33 (5 Suppl): 57-62, 1989.[PUBMED Abstract]
- Byar DP: Proceedings: The Veterans Administration Cooperative Urological Research Group's studies of cancer of the prostate. Cancer 32 (5): 1126-30, 1973.[PUBMED Abstract]
- Karling P, Hammar M, Varenhorst E: Prevalence and duration of hot flushes after surgical or medical castration in men with prostatic carcinoma. J Urol 152 (4): 1170-3, 1994.[PUBMED Abstract]
- Small EJ, Vogelzang NJ: Second-line hormonal therapy for advanced prostate cancer: a shifting paradigm. J Clin Oncol 15 (1): 382-8, 1997.[PUBMED Abstract]
- Scher HI, Kelly WK: Flutamide withdrawal syndrome: its impact on clinical trials in hormone-refractory prostate cancer. J Clin Oncol 11 (8): 1566-72, 1993.[PUBMED Abstract]
- Sartor O, Cooper M, Weinberger M, et al.: Surprising activity of flutamide withdrawal, when combined with aminoglutethimide, in treatment of "hormone-refractory" prostate cancer. J Natl Cancer Inst 86 (3): 222-7, 1994.[PUBMED Abstract]
- Small EJ, Srinivas S: The antiandrogen withdrawal syndrome. Experience in a large cohort of unselected patients with advanced prostate cancer. Cancer 76 (8): 1428-34, 1995.[PUBMED Abstract]
- Tannock I, Gospodarowicz M, Meakin W, et al.: Treatment of metastatic prostatic cancer with low-dose prednisone: evaluation of pain and quality of life as pragmatic indices of response. J Clin Oncol 7 (5): 590-7, 1989.[PUBMED Abstract]
- Boustead G, Edwards SJ: Systematic review of early vs deferred hormonal treatment of locally advanced prostate cancer: a meta-analysis of randomized controlled trials. BJU Int 99 (6): 1383-9, 2007.[PUBMED Abstract]
- Messing EM, Manola J, Sarosdy M, et al.: Immediate hormonal therapy compared with observation after radical prostatectomy and pelvic lymphadenectomy in men with node-positive prostate cancer. N Engl J Med 341 (24): 1781-8, 1999.[PUBMED Abstract]
- Eisenberger MA, Walsh PC: Early androgen deprivation for prostate cancer? N Engl J Med 341 (24): 1837-8, 1999.[PUBMED Abstract]
- Messing EM, Manola J, Yao J, et al.: Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 7 (6): 472-9, 2006.[PUBMED Abstract]
- Lawton CA, Winter K, Grignon D, et al.: Androgen suppression plus radiation versus radiation alone for patients with stage D1/pathologic node-positive adenocarcinoma of the prostate: updated results based on national prospective randomized trial Radiation Therapy Oncology Group 85-31. J Clin Oncol 23 (4): 800-7, 2005.[PUBMED Abstract]
- Schröder FH, Kurth KH, Fosså SD, et al.: Early versus delayed endocrine treatment of pN1-3 M0 prostate cancer without local treatment of the primary tumor: results of European Organisation for the Research and Treatment of Cancer 30846--a phase III study. J Urol 172 (3): 923-7, 2004.[PUBMED Abstract]
- Immediate versus deferred treatment for advanced prostatic cancer: initial results of the Medical Research Council Trial. The Medical Research Council Prostate Cancer Working Party Investigators Group. Br J Urol 79 (2): 235-46, 1997.[PUBMED Abstract]
- Studer UE, Hauri D, Hanselmann S, et al.: Immediate versus deferred hormonal treatment for patients with prostate cancer who are not suitable for curative local treatment: results of the randomized trial SAKK 08/88. J Clin Oncol 22 (20): 4109-18, 2004.[PUBMED Abstract]
- Waymont B, Lynch TH, Dunn JA, et al.: Phase III randomised study of zoladex versus stilboestrol in the treatment of advanced prostate cancer. Br J Urol 69 (6): 614-20, 1992.[PUBMED Abstract]
- Vogelzang NJ, Chodak GW, Soloway MS, et al.: Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Zoladex Prostate Study Group. Urology 46 (2): 220-6, 1995.[PUBMED Abstract]
- Kaisary AV, Tyrrell CJ, Peeling WB, et al.: Comparison of LHRH analogue (Zoladex) with orchiectomy in patients with metastatic prostatic carcinoma. Br J Urol 67 (5): 502-8, 1991.[PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014.[PUBMED Abstract]
- Chang A, Yeap B, Davis T, et al.: Double-blind, randomized study of primary hormonal treatment of stage D2 prostate carcinoma: flutamide versus diethylstilbestrol. J Clin Oncol 14 (8): 2250-7, 1996.[PUBMED Abstract]
- Eisenberger MA, Blumenstein BA, Crawford ED, et al.: Bilateral orchiectomy with or without flutamide for metastatic prostate cancer. N Engl J Med 339 (15): 1036-42, 1998.[PUBMED Abstract]
- Moinpour CM, Savage MJ, Troxel A, et al.: Quality of life in advanced prostate cancer: results of a randomized therapeutic trial. J Natl Cancer Inst 90 (20): 1537-44, 1998.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Hasselblad V, et al.: Single-therapy androgen suppression in men with advanced prostate cancer: a systematic review and meta-analysis. Ann Intern Med 132 (7): 566-77, 2000.[PUBMED Abstract]
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
- Calais da Silva FE, Bono AV, Whelan P, et al.: Intermittent androgen deprivation for locally advanced and metastatic prostate cancer: results from a randomised phase 3 study of the South European Uroncological Group. Eur Urol 55 (6): 1269-77, 2009.[PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015.[PUBMED Abstract]
- Vale CL, Burdett S, Rydzewska LH, et al.: Addition of docetaxel or bisphosphonates to standard of care in men with localised or metastatic, hormone-sensitive prostate cancer: a systematic review and meta-analyses of aggregate data. Lancet Oncol 17 (2): 243-56, 2016.[PUBMED Abstract]
- Sweeney CJ, Chen YH, Carducci M, et al.: Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer. N Engl J Med 373 (8): 737-46, 2015.[PUBMED Abstract]
- Kyriakopoulos CE, Chen YH, Carducci MA, et al.: Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer: Long-Term Survival Analysis of the Randomized Phase III E3805 CHAARTED Trial. J Clin Oncol 36 (11): 1080-1087, 2018.[PUBMED Abstract]
- Morgans AK, Chen YH, Sweeney CJ, et al.: Quality of Life During Treatment With Chemohormonal Therapy: Analysis of E3805 Chemohormonal Androgen Ablation Randomized Trial in Prostate Cancer. J Clin Oncol 36 (11): 1088-1095, 2018.[PUBMED Abstract]
- Dearnaley DP, Mason MD, Parmar MK, et al.: Adjuvant therapy with oral sodium clodronate in locally advanced and metastatic prostate cancer: long-term overall survival results from the MRC PR04 and PR05 randomised controlled trials. Lancet Oncol 10 (9): 872-6, 2009.[PUBMED Abstract]
- Smith MR, Halabi S, Ryan CJ, et al.: Randomized controlled trial of early zoledronic acid in men with castration-sensitive prostate cancer and bone metastases: results of CALGB 90202 (alliance). J Clin Oncol 32 (11): 1143-50, 2014.[PUBMED Abstract]
- Mason MD, Clarke NW, James ND, et al.: Adding Celecoxib With or Without Zoledronic Acid for Hormone-Naïve Prostate Cancer: Long-Term Survival Results From an Adaptive, Multiarm, Multistage, Platform, Randomized Controlled Trial. J Clin Oncol 35 (14): 1530-1541, 2017.[PUBMED Abstract]
- Mason MD, Sydes MR, Glaholm J, et al.: Oral sodium clodronate for nonmetastatic prostate cancer--results of a randomized double-blind placebo-controlled trial: Medical Research Council PR04 (ISRCTN61384873). J Natl Cancer Inst 99 (10): 765-76, 2007.[PUBMED Abstract]
- Bagshaw MA: External radiation therapy of carcinoma of the prostate. Cancer 45 (7 Suppl): 1912-21, 1980.[PUBMED Abstract]
- Ploysongsang S, Aron BS, Shehata WM, et al.: Comparison of whole pelvis versus small-field radiation therapy for carcinoma of prostate. Urology 27 (1): 10-6, 1986.[PUBMED Abstract]
- Seymore CH, el-Mahdi AM, Schellhammer PF: The effect of prior transurethral resection of the prostate on post radiation urethral strictures and bladder neck contractures. Int J Radiat Oncol Biol Phys 12 (9): 1597-600, 1986.[PUBMED Abstract]
- Denham JW, Steigler A, Lamb DS, et al.: Short-term neoadjuvant androgen deprivation and radiotherapy for locally advanced prostate cancer: 10-year data from the TROG 96.01 randomised trial. Lancet Oncol 12 (5): 451-9, 2011.[PUBMED Abstract]
- Nabid A, Carrier N, Martin AG, et al.: Duration of Androgen Deprivation Therapy in High-risk Prostate Cancer: A Randomized Phase III Trial. Eur Urol 74 (4): 432-441, 2018.[PUBMED Abstract]
- Pisansky TM, Hunt D, Gomella LG, et al.: Duration of androgen suppression before radiotherapy for localized prostate cancer: radiation therapy oncology group randomized clinical trial 9910. J Clin Oncol 33 (4): 332-9, 2015.[PUBMED Abstract]
- Kaasa S, Brenne E, Lund JA, et al.: Prospective randomised multicenter trial on single fraction radiotherapy (8 Gy x 1) versus multiple fractions (3 Gy x 10) in the treatment of painful bone metastases. Radiother Oncol 79 (3): 278-84, 2006.[PUBMED Abstract]
- Chow E, Harris K, Fan G, et al.: Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol 25 (11): 1423-36, 2007.[PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010.[PUBMED Abstract]
- Zincke H: Extended experience with surgical treatment of stage D1 adenocarcinoma of prostate. Significant influences of immediate adjuvant hormonal treatment (orchiectomy) on outcome. Urology 33 (5 Suppl): 27-36, 1989.[PUBMED Abstract]
- 再発またはホルモン抵抗性前立腺がんの治療
-
概要
再発またはホルモン抵抗性前立腺がんにおける今後の治療の選択は、以下を含め多くの因子に左右される:
- 過去の治療。
- 再発部位。
- 共存症。
- 個々の患者に対する考慮事項。
根治的放射線療法は、前立腺摘除術後に局所的にのみ腫瘍が残存した患者に施行することができる。[ 1 ][ 2 ][ 3 ][ 4 ]1件のランダム化試験(RTOG-9601[NCT00002874])では、根治的前立腺全摘除術後に局所で前立腺がんが再発した男性において、放射線療法単独と比較して、放射線療法に高用量のビカルタミドを追加することにより、全生存(OS)および前立腺がん特異的生存の改善が示されている。[ 5 ]
- この試験では、T2期またはT3期腫瘍に対して最初に根治的前立腺全摘除術で治療され、検出可能な前立腺特異抗原(PSA)値が0.2~4.0ng/mLであったが、転移の証拠は認められなかった男性760人が、放射線(36分割で64.8Gy)とビカルタミド(150mg、PO、毎日)またはプラセボの24ヵ月間投与のいずれかを受ける群にランダムに割り付けられた。手術からPSAが検出可能となるまでの期間中央値は1.4年、手術からランダム化までの期間中央値は2.1年であった。追跡期間中央値は13年であった。
- 12年経過時の生命表法OS率は、ビカルタミド群で76.3% vs プラセボ群で71.3%(P = 0.04;ハザード比[HR]、0.77;95%信頼区間[CI]、0.59-0.99)であった。[ 5 ][証拠レベル:1iA]
- 12年経過時の前立腺がん特異的死亡率は5.8%(ビカルタミド群) vs 13.4%(プラセボ群)、(HR、0.49;95%CI、0.32-0.74;P < 0.001)であった。[ 5 ][証拠レベル:1iB]
- ほとんどの治療関連毒性は2群間で同様であったが、女性化乳房は例外で、ビカルタミド群の男性では69.7%に発生したのに対し、プラセボ群の男性における発生は10.9%であった。この副作用は乳房への予防的放射線照射により軽減できるが、二重盲検デザインのためにこの研究では用いられなかった。
根治的放射線療法の後に局所再発を来した患者を、前立腺摘除術により救助できることもある[ 6 ];しかしながら、初回に放射線療法を受けた患者のうち、局所再燃にとどまるのはわずか10%程度である。こうした患者はしばしば、ホルモン療法により長期間にわたってがんを抑制でき、局所コントロール失敗以後のがん特異的生存期間は中央値6年である。[ 7 ]
放射線療法後の再発に対する凍結壊死療法は、高い頻度で合併症発生率が高いことに関係していた。この凍結手術は現在、臨床評価段階にある。[ 8 ]
ホルモン療法は、初回に局所ないし所属リンパ節の手術または放射線療法を受け、播種性腫瘍となって再発したほとんどの患者の管理に使用される。(詳しい情報については、本要約のIV期の前立腺がんに対する標準治療法の選択肢のセクションを参照のこと。)
即時 vs 待機ホルモン療法
根治的前立腺全摘除術後の局所再発前立腺がんの設定における即時ホルモン療法(ビカルタミドまたは黄体形成ホルモン放出ホルモン[LH-RH]アゴニスト) + 放射線の使用に関する情報については、前立腺がんに対する治療法選択肢の概要のセクションを参照のこと。
PSAは、治癒目的の一次治療後に患者をモニターするためにしばしば使用され、PSA高値または上昇傾向は、無症候性の男性であっても追加治療の一般的な誘因となる。こうした状況がどれほど一般的であるかにかかわらず、無症候性の前立腺がんの男性に対して、PSA上昇によって実施した追加治療によりOSが延長するかどうかは不明である。証拠の質は限定されている。
- 根治的前立腺全摘除術後にPSA値が検出可能になることで、局所療法の失敗または転移のリスクが高い患者が特定される[
9
];しかしながら、治癒目的の初期治療後にPSAの高値または上昇傾向を認める患者のかなりの割合が、長期間にわたって臨床的に無症状のままである。[
10
]治癒目的の根治的前立腺全摘除術を施行し、平均5.3年追跡した2,000人近い男性を対象としたレトロスペクティブ解析では、315人(15%)の男性が生化学的再発の証拠である0.2ng/mL以上のPSA異常値を示した。[
11
]
- この315人の男性のうち、臨床的に再発の証拠が得られたのは103人(34%)であった。
- 生化学的再発から臨床的転移までの時間の中央値は8年であった。
- 腫瘍が転移した男性では、その後の死亡までの期間の中央値は5年であった。
- 根治目的の放射線療法後におけるPSAの持続的な高値または上昇傾向は、臨床的疾患再発の予後因子である可能性がある。しかしながら、既報のケースシリーズでは多岐にわたるPSAに基づく治療失敗の定義を用いている。米国放射線療法および腫瘍学会コンセンサス・パネル(American Society for Therapeutic Radiology and Oncology Consensus Panel)により開発されている基準もある。[ 12 ][ 13 ]OSに対するPSAを基にした治療失敗の種々の定義の意義は不明であり、放射線療法による治療を受けた患者では、外科的シリーズと同様に、生化学的再燃(PSA上昇のみ)の多くの例が臨床的に顕在化しない可能性がある。[ 14 ][ 15 ]
- 治癒目的の治療を受けたがPSAが上昇している患者におけるアンドロゲン遮断療法(ADT)に関する1件のランダム化試験(PMCC-VCOG-PR-0103[NCT00110162])で、即時 vs 待機療法に関連したOS改善の証拠が提供されている。[
16
]この研究には重大な欠点があった。
- 2群の男性が以下のようにオープンラベルの即時 vs 待機(少なくとも2年の延期)ADTにランダムに割り付けられた:
- グループ1には、治癒目的の治療後にPSA再燃を来した男性が含まれた(研究集団の89%)。
- グループ2には、年齢、共存症、または局所進行がんのために治癒目的の治療に適さないと考えられた無症候性の男性が含まれた(研究集団の11%)。
計画された患者の登録者数は750人であったが、登録のペースが遅かったため、試験は293人の患者で中止された。
- グループ1と2を合わせて、中央値で5年間追跡したところ、5年OS率は、待機ADT研究群で86.4% vs 即時ADT研究群で91.2%であった(ログランク、P = 0.047)。[ 16 ][証拠レベル:1iiA]ベースライン時の特徴について完全に調整した後のOSに対するHRは0.54(95%CI、0.27-1.06;P = 0.074)であった。
- グループ1単独(治癒目的の治療後にPSA再燃を来した男性、N = 261)では、推定5年生存率は待機 vs 即時ADTで78.2% vs 84.3%であった(ログランク、P = 0.10;完全調整HR = 0.59;95%CI、0.26-1.30、P = 0.19)。
- 毒性作用は、即時ADT研究群の方が待機療法と比較して強かった。重篤な(グレード4)有害事象は、即時ADT研究群患者の42%で報告されたのに対し、待機療法群の患者では31%で報告された。生活の質(QOL)は即時ADT群で6.1%低下した(小さいが臨床的に重要な低下と考えられた)のに対し、待機ADT群の低下は3%であった(取るに足らない低下と考えられた);しかし、この差は統計的に有意ではなかった(P = 0.14)。[ 16 ]待機療法群と比較して即時ADT群では、性的行動が低く、ホルモン関連症状(ほてりおよび乳頭痛または乳頭肥大)は臨床的および統計的に有意に不良であった。[ 17 ]
- 2群の男性が以下のようにオープンラベルの即時 vs 待機(少なくとも2年の延期)ADTにランダムに割り付けられた:
腫瘍再発に対するホルモン療法
継続 vs 間欠ホルモン療法
初回局所療法後の再発に対して治療を受ける男性の大多数が無症候であり、再発はPSAの上昇で検知される。生存率を低下させずに、QOLを改善し、患者がホルモン療法の副作用を経験する期間を短縮するために、継続的アンドロゲン遮断療法(継続的ADTつまりCAD)の代替として間欠的アンドロゲン遮断療法(IAD)を使用することが可能である。
- この重要な臨床的課題は、限局性前立腺がんに対する初回または救援放射線療法から1年以上経過し、PSA値に上昇(3ng/mLを超え、血清テストステロンも5nmol/Lを超える)が認められた男性1,386人を対象に、非劣性デザインのランダム化比較試験で検討された。[
18
][証拠レベル:1iiA、証拠レベル:1iiB、証拠レベル:1iiC]
- ADT群は、LH-RHアゴニスト(少なくとも最初の4週間は非ステロイド性抗アンドロゲンを併用)による8ヵ月間の治療サイクルからなり、PSA値が10ng/mLを超えた場合に再開された。この研究は、IAD群における7年OS率がCAD群と比較して8%低いことを(95%の信頼性で)識別する検出力を有していた。
- 追跡期間中央値6.9年(最大追跡期間、11.2年)後で、両群のOSは同程度であったため、研究は中止された(生存期間中央値、8.8年 vs 9.1年;HR死亡、1.02;95%CI、0.86-1.21)。この結果はプロスペクティブな非劣性の基準を満たした。
- レトロスペクティブ解析で、前立腺がん特異的死亡率も両群で同程度であった(HR、1.18;95%CI、0.90-1.55;P = 0.24)。さらに、IAD群は、ほてり、性的行動への欲求、および泌尿器症状のようなQOLのいくつかの項目で、CAD群より統計的有意に良好であった。IAD研究群の患者が受けた治療の期間は中央値で15.4ヵ月であったのに対して、CAD群では43.9ヵ月であった。
- この研究は、初回局所療法後のPSA高値に対して何らかのADTを開始することで、臨床的に症状が進行するまで治療を延期することに比べて、生存期間が延長するかどうかという未解決の課題には取り組んでいない。注目すべきことに、全死亡例の59%が前立腺がんとは無関係で、前立腺がんで死亡した患者はわずか14%であった。
- 進行期または再発前立腺がん患者に対するCAD vs IAD療法を比較した15件のランダム化試験の系統的レビューによると、8件の試験で報告されたOS率(HR、1.02;95%CI、0.93-1.11);5件の試験で報告された前立腺がん特異的生存率(HR、1.02;95%CI、0.87-1.19);または4件の試験で報告された無増悪生存(PFS)率(HR、0.94;95%CI、0.84-1.05)に有意差はみられなかった。このメタアナリシスは、予め規定されたOSの非劣性基準を満たした(HR、1.15について1.15の上方限界)。[
19
][証拠レベル:1iiA]しかしながら、15件の試験中、1件を除くすべての試験で予め規定された基準によるバイアスのリスクが不明であるか高かった。
- 患者報告のQOLにおける差はわずかしかみられなかったが、ほとんどの試験でIAD群の患者における良好な身体機能および性機能が示された。
非ステロイド性抗アンドロゲン単独療法 vs 外科的または内科的去勢
1件の証拠の系統的レビューでは、11件のランダム化試験からの局所進行性、転移性、または局所療法後に再発した前立腺がん男性3,060人において、非ステロイド性抗アンドロゲン単独療法と外科的または内科的去勢が比較された。[ 20 ]単独療法としての非ステロイド性抗アンドロゲンの使用では、OSが低下し、臨床的進行および治療失敗の割合が増加した。[ 20 ][証拠レベル:1iiA]
ホルモンによるアプローチ
上述したように、ホルモン抵抗性の転移性前立腺がん患者では、ドセタキセルまたはカバジタキセルによる化学療法、およびシプリューセル-Tによる免疫療法により、OS期間を延長できることが諸研究で示されている。それにもかかわらず、化学療法に加えてホルモン療法を受けた後に進行した男性でも、別の種類のホルモン療法による生存率の改善が示されている。転移性ホルモン抵抗性前立腺がんの管理では、いくつかの種類のホルモン療法が有効である。
各薬剤の直接比較は行われていないため、最初に使用すべき薬剤または使用すべき順序を判断するために有用な試験は存在しない。
転移性ホルモン不応性前立腺がん患者の間でも、予後および残留ホルモン感受性は均一ではない。このような症候性の骨病変を認める患者では、以下のようないくつかの因子が予後の悪化と関連している:不良なパフォーマンスステータス、高アルカリホスファターゼ、血清クレアチニン値異常、および過去のホルモン療法に対する短期奏効(1年未満)。[ 21 ]再燃患者またはホルモン不応性患者の治療開始時の絶対PSA値が、予後に重要であることは示されていない。[ 22 ]
アンドロゲン遮断併用療法を実施していてがんが進行した患者に、再発時に行うさまざまな2次ホルモン療法が奏効することもある。aminoglutethimide、ヒドロコルチゾン、フルタミド中止、プロゲステロン、ケトコナゾールおよびこのいずれかの併用により、治療した患者の14~60%においてPSA反応を認め、評価時に0~25%の臨床的反応が得られている。これらのPSA反応の持続時間は2~4ヵ月間となっている。[ 23 ]抗アンドロゲン(例えば、フルタミド、ビカルタミド、またはnilutamide)の中止と同時、または例えば、CLB-9583試験(NCT00002760)でみられるように、抗アンドロゲン中止の最初の試験後にPSAが上昇した時点で、ケトコナゾール + ヒドロコルチゾンを開始したとしても、生存率は同程度である。[ 24 ][証拠レベル:1iiA]化学療法を受けている男性におけるPSA値の変化が生存の予測因子となるかどうかに関しては相反するデータがある。[ 22 ][ 25 ]
一次治療として黄体形成ホルモンアゴニストまたはエストロゲンのいずれかにより治療した患者は、一般にテストステロン値が去勢者レベルに保たれる。Eastern Cooperative Oncology Group(ECOG)による1件の研究では、初回のアンドロゲン遮断を継続すると、すぐれた生存成績が得られたとしている;[ 9 ]しかしながら、これとは別のSWOG(以前のSouthwest Oncology Group)が実施した研究では、アンドロゲン遮断を継続することに利点は見出されていない。[ 26 ]
証拠(化学療法未実施の進行疾患に対するホルモンによるアプローチ):
- 酢酸アビラテロンは、チトクロムP450c17(CYP17)を遮断することで効果を発揮するアンドロゲン生合成阻害薬である。アビラテロンはミネラルコルチコイド作用を有し、体液貯留、浮腫、低カリウム血症、高血圧、および心機能不全の発生率増加をもたらす。加えて、アビラテロンは肝毒性に関連している。[
27
]しかし、他の療法に比べるとアビラテロンの毒性は少ない。二重盲検プラセボ対照試験では、ECOGパフォーマンスステータス(PS)が0~1で、化学療法を受けたことがなく、ホルモン抵抗性の病態に進行した(以前の抗アンドロゲン療法で血清テストステロンが50ng/dL未満の)男性1,088人に対してプレドニゾン(5mgを1日2回経口)に加えて、酢酸アビラテロン(1,000mgを1日1回経口)またはプラセボのいずれかを投与した。[
28
][
29
][証拠レベル:1iA]複合主要エンドポイントは、放射線診断によるPFSおよびOSであった。4回の連続的解析が予定された。
- 追跡期間中央値22.2ヵ月後の2回目の中間解析で、集約された有効性および安全性についてデータモニタリング委員会が評価した結果によって研究は中止され、盲検が解除された。その時点で、放射線診断によるPFSは事前に規定されたアビラテロンを支持する中止境界に達していた(PFS期間中央値、16.5ヵ月 vs 8.3ヵ月[HR、0.53;95%CI、0.45-0.62;P < 0.001])。
- 追跡期間中央値49.2ヵ月(最大60ヵ月)の4回目(最後)の解析で、酢酸アビラテロン研究群では65%、およびプラセボ研究群では71%が死亡していた(HR、0.81;95%CI、0.70-0.93;P = 0.033)。OS期間中央値は34.7ヵ月 vs 30.3ヵ月であった。[ 29 ][証拠レベル:1iA]
- 健康関連のQOLが悪化するまでの期間中央値は、Functional Assessment of Cancer Therapy-Prostate Version 4(FACT-P)総スコア(12.7ヵ月 vs 8.3ヵ月;HR、0.78;95%CI、0.66-0.92;P = 0.003)および前立腺がん特異的サブスケール(11.1ヵ月 vs 5.8ヵ月;HR、0.70;95%CI、0.60-0.83;P < 0.0001)による評価で、アビラテロン研究群において長かった。[ 30 ][証拠レベル:1iC]
- さらに、アビラテロン研究群の患者では、疼痛に対するアヘン製剤の使用、細胞毒性化学療法の開始、PS低下、およびPSA上昇までの時間において、中央値が統計的に有意に長かった。[ 28 ][ 30 ][証拠レベル:1iCおよび証拠レベル:1iDiii]
- アンドロゲン受容体シグナル伝達阻害薬であるエンザルタミドは、ADTを施行したにもかかわらず増悪した転移性前立腺がんの男性で、OSとQOLを改善することが示されている。PREVAIL(NCT01212991)研究では、ADTを施行したにもかかわらず転移性前立腺がんが再発した無症候または軽度の症状を認める男性1,717人が、エンザルタミド(160mgを1日1回経口)投与群 vs プラセボ群のいずれかにランダムに割り付けられた。[
31
][
32
][
33
][証拠レベル:1iA、証拠レベル:1iC]
- 中央値で22ヵ月の追跡後に、エンザルタミド研究群におけるOSの有益性のために、研究は中止された(HR、0.72;95%CI、0.6-0.84;P = 0.001)。死亡した男性の割合は28% vs 35%であり、OS期間中央値は32.4 vs 30.2ヵ月であった。
- FACT-Pスコアで測定された総合的なQOLが低下するまでの期間中央値は、エンザルタミドおよびプラセボ群でそれぞれ11.3ヵ月 vs 5.6ヵ月であり(P < 0.001)、臨床介入を必要とする最初の骨関連事象が発生するまでの期間の延期も示された。[ 31 ][ 32 ][証拠レベル:1iC、証拠レベル:1iDi]
- エンザルタミド群ではグレード3以上の有害事象がより多く発生し(43% vs 37%)、高血圧、疲労、転倒にみられた差が、この結果の主な原因であった。エンザルタミドの投与を受けた患者はプラセボ群の患者よりも平均で1年長い治療に割り付けられたため、エンザルタミド群の患者の方が奏効期間が長く、この差が有害事象の増加に寄与した可能性がある。
- エンザルタミドは、臨床的に非転移性のホルモン抵抗性前立腺がん(ホルモン療法を受けながらPSA倍加時間が10ヵ月以下であることと定義された)の設定でも検証されている。[
34
]
- 二重盲検第III相PROSPER試験(NCT02003924)において、画像検査で臨床的転移が認められないが、PSA値の上昇が急激な男性1,401人がエンザルタミド(160mgを1日1回経口)投与群またはプラセボ群に2:1の割合でランダムに割り付けられた。追跡期間が最大41ヵ月後で、主要エンドポイントの無転移生存率においてエンザルタミドが優れていることが示された:77% vs 51%(中央値36.6 vs 14.7ヵ月;HR、0.29;95%CI、0.24–0.35;P < 0.001)。[ 34 ][証拠レベル:1iDiii]
- 正式なOSデータは得られていなかったが、報告時点で、エンザルタミド群男性の11%が死亡していたのに対して、プラセボ群では13%であった。
- 健康関連の生活の質における低下率は両群で同じであった。
- グレード3+の毒性は、エンザルタミド群でより高頻度であった:31% vs 23%。
- 高血圧(12% vs 5%)、大心血管系イベント(5% vs 3%)、および精神的機能障害(5% vs 2%)などがエンザルタミド治療を受けた患者で以前に報告されているため、特に関心がもたれる有害事象のいくつかでも過剰が認められた。
- 進行のためにアビラテロンに切り替えた患者および去勢抵抗性の転移性前立腺がんでエンザルタミド投与中にPSAが上昇した患者におけるエンザルタミドの継続は、ランダム化PLATO試験(NCT01995513)で検証された戦略であり、PFS率または臨床的進行率が改善しないとみられた。[ 35 ][証拠レベル:1iDiii]
- アンドロゲン受容体の競合的阻害薬であるアパルタミドが臨床的に非転移性のホルモン抵抗性前立腺がん(ホルモン療法を受けながらPSA倍加時間が10ヵ月以下であることと定義された)の設定で検証されている。[
36
]
- この試験では、1,207人の男性が2:1の比率で、アパルタミドの連日投与(240mgを経口投与)またはプラセボのいずれかにランダムに割り付けられた。すべて人が以前のADTを継続した。追跡期間中央値20.3ヵ月の時点で、無転移生存期間はアパルタミド群で40.5ヵ月であったのに対し、プラセボ群では16.2ヵ月であった(HR、0.28;95%CI、0.23-0.35;P < 0.001)。[ 36 ][証拠レベル:1iDii]
- アパルタミド群ではOSの改善傾向がみられたが、報告時には統計的有意差までには至らなかった(HR、0.70;95%CI、0.47-1.04;P = 0.07)。
- アパルタミド治療に関連して多くの毒性作用が増加し、毒性作用には次のものが含まれた:骨折(11.7% vs 6.5%)、甲状腺機能低下症(8.1% vs 2.0%)、疲労(30.4% vs 21.1%)、高血圧(24.8% vs 19.8%)、発疹(23.8% vs 5.5%)、下痢(20.3% vs 15.1%)、体重減少(16.1% vs 6.3%)、関節痛(15.9% vs 7.5%)、および転倒(15.6% vs 9.0%)。
- 事前に規定された探索的解析で、全体的に評価した場合も、FACT-PおよびEuroQol five-dimension, three-level(EQ-5D-3L)質問票のサブスケールスコアのすべての要素で評価した場合も、経時的な生活の質は、アパルタミド群とプラセボ群で同程度であった。[ 37 ][証拠レベル:1iC]
証拠(化学療法実施済みの進行疾患に対するホルモンによるアプローチ):
- ドセタキセルによる治療後に生化学的または臨床的に進行した転移性前立腺がんの男性(N = 1,195)を対象に、酢酸アビラテロン(1,000mg)(n = 797)またはプラセボ(n = 398)のいずれかを毎日経口投与する群に2:1の比率でランダムに割り付けた(COU-AA-301 [NCT00638690])。両群とも、プレドニゾン(5mg 1日2回経口投与)を受けた。[
38
][証拠レベル:1iA]
- 追跡期間中央値12.8ヵ月後の中間解析で、アビラテロン群にOSの優位性が示されたことから、試験は中止された。この試験の最終報告は、追跡期間中央値20.2ヵ月を経過した後に発表された。
- OS期間中央値は、アビラテロン群の15.8ヵ月に対し、プラセボ群では11.2ヵ月であった(HR死亡、0.74;95%CI、0.64-0.86;P < 0.0001)。
- プラセボ群と比較して、アビラテロン群はまた、FACT-P QOLスコアで悪化するまでの期間中央値の延長(59.9週間 vs 36.1週間、P < 0.0001)およびベースライン時の機能的状態に障害が見られた男性におけるQOLの臨床的に重要な改善(48% vs 32%、P < 0.0001)に関連していた。[ 39 ][証拠レベル:1iC]
- また、エンザルタミドでは、過去にドセタキセルに加えて、ADTを受けた進行前立腺がん患者における生存期間の延長も示されている。二重盲検プラセボ対照試験で、男性1,129人がエンザルタミド(160mg/日の経口投与)群 vs プラセボ群に2:1の比率でランダムに割り付けられた。[
40
][
41
][
42
][
43
][証拠レベル:1iA、証拠レベル:1iC]
- 追跡期間中央値14.4ヵ月後に、1回予定されていた中間解析で、エンザルタミド研究群に主要エンドポイントであるOSの改善(OS期間中央値、18.4ヵ月;95%CI、17.3ヵ月-未到達 vs 13.6ヵ月;95%CI、11.3-15.8ヵ月;HR死亡、0.63;95%CI、0.53-0.75;P < 0.001)が認められたため、本研究は中止された。さらに、FACT-P質問票で評価されたQOLも、最初の骨関連事象までの時間と同様にエンザルタミド群の方が優れていた。[ 41 ][ 43 ]
- エンザルタミド研究群の男性800人のうち5人に痙攣発作がみられたのに対し、プラセボ群ではみられなかったことが報告された;ただし、エンザルタミドとの関係は不明である。報告された痙攣発作のうち、2人の患者には脳転移があり、1人の患者はリドカインの静脈内(IV)投与を受けた直後であったほか、1件の痙攣発作は目撃されたものではなかった。
骨転移の予防
疼痛性骨転移は、前立腺がん患者にとって大きな問題となりうる。緩和療法では、以下を含めて多くの戦略が研究されている:[ 44 ][ 45 ][ 46 ][ 47 ][ 48 ]
- 外照射療法(EBRT)。
- 骨親和性放射性核種(塩化ストロンチウム Sr 89[89Sr])。
- デノスマブ(破骨性機能を阻害するモノクローナル抗体)。
- 鎮痛剤。
- コルチコステロイド。
- ビスホスホネート。
(詳しい情報については、がん性疼痛に関するPDQ要約を参照のこと。)
証拠(骨転移に対して放射線療法を用いる緩和療法):
- 骨痛の緩和に対しては、EBRTが非常に有用な可能性がある。8Gyの単回照射は、骨痛緩和およびQOLに対して多分割照射(3Gy × 10)とほぼ同じ有益性を有することが示されており、例えば、RTOG-9714試験(NCT00003162)で認められた。[ 49 ][ 50 ][証拠レベル:1iiC]
証拠(骨転移に対して塩化ストロンチウムを用いる緩和療法):
89Srなどの放射性同位元素の使用は、一部の骨芽細胞性転移患者の症状緩和目的の治療として有効であることが分かっている。単剤としての89Srでは、治療を受けた患者の80%で骨痛が軽減することが報告されている。[ 51 ]
- ホルモン治療の甲斐なく疼痛を伴う前立腺がんの骨転移を来した男性を対象に、89Sr(150MBq:4mCi)のIV単回投与 vs 緩和目的のEBRTを比較する多施設ランダム化試験が実施された。[
52
][証拠レベル:1iiA];[
53
]
- 疼痛に対する主観的奏効率は、両群とも同程度であることが示された:89Sr群で34.7% vs EBRT単独群で33.3%。
- OSは、EBRT群の方が89Sr群よりも良好であった(P = 0.046;生存期間中央値、11.0ヵ月 vs 7.2ヵ月)。
- 主観的進行までの期間またはPFSでは、統計的有意差はみられなかった。
- 89SrをEBRTと併用した場合は、EBRT単独と比較して、疾患進行が遅くなり、鎮痛薬の必要性が減少することが示された。
証拠(デノスマブを用いる骨転移の緩和または予防):
- ホルモン療法抵抗性の前立腺がんで、少なくとも1ヵ所に骨転移が認められる男性を対象に、骨関連事象(病的骨折、脊髄圧迫、または緩和目的の骨に対する放射線療法または手術の必要性)の予防としてデノスマブとゾレドロン酸を比較したランダム化プラセボ対照試験(NCT00321620)がある。[
44
]
- この試験では、デノスマブの方がゾレドロン酸よりも有効性が高いことが報告された;研究中に初めて骨関連事象が発生するまでの期間は、中央値で20.7 vs 17.1ヵ月であった(HR、0.82;95%CI、0.71-0.95)。
- 重篤な有害事象はデノスマブ投与群の患者の63%で報告されたのに対し、ゾレドロン酸の患者では60%だった。顎の骨壊死の累積発生率は、両研究群ともに低かった(デノスマブ群で2% vs ゾレドロン酸群で1%)。グレード3~4の毒性が認められた。生存に差はみられなかった。低カルシウム血症の発生率は、デノスマブ群の方が高かった(13% vs 6%)。[ 54 ]
- 転移の証拠を認めない去勢抵抗性前立腺がんの男性1,432人を対象とした1件のランダム化プラセボ対照試験では、骨転移(症候性または無症候性のいずれか)の最初の証拠を予防するためにデノスマブを投与(4週間ごとに120mgを皮下投与)した。[
54
][証拠レベル:1iDiii]
- 中央値で20ヵ月の追跡後に、無骨転移生存期間中央値はデノスマブ群で29.5ヵ月 vs プラセボ群で25.2ヵ月であった(HR、0.85;95%CI、0.73-0.98;P = 0.028)。
- 症候性の骨転移は、デノスマブ群の患者69人(10%) vs プラセボ群の患者96人(13%)において報告された(HR、0.67;95%CI、0.49-0.92;P = 0.01)。
- 両群のOSに差はみられなかった。
- 骨壊死がデノスマブ群の男性33人(5%)に生じたが、プラセボ群ではみられなかった。低カルシウム血症はデノスマブ群の男性12人(2%) vs プラセボ群の男性2人(1%未満)であり、尿閉は同54人(8%) vs 31人(4%)であった。
再発前立腺がんに対する治療法の選択肢
再発前立腺がん患者に対する治療法の選択肢には以下のものがある:
- ホルモン療法。
- ホルモン抵抗性前立腺がんに対する化学療法。
- 免疫療法。
ホルモン抵抗性前立腺がんに対する化学療法
証拠(ホルモン抵抗性前立腺がんに対する化学療法):
- ホルモン抵抗性の前立腺がんで、プレドニゾン単剤による治療を受けた患者と比べて、ミトキサントロン + プレドニゾンによる治療を受けた患者において疼痛管理の改善を示したランダム化試験がある。[ 55 ]この両治療法のOSまたは総合的なQOLの測定値には、統計的有意差は認められなかった。
- ドセタキセルはミトキサントロンと比較してOSを改善することが示されている。 ホルモン不応性前立腺がん患者のランダム化試験において、ドセタキセル(75mg/m2、3週間ごと)とドセタキセル(30mg/m2の週1回を6週間ごとに5回)が、ミトキサントロン(12mg/m2、3週間ごと)と比較された。全患者が、経口プレドニゾンを服用した(5mgを1日2回)。ドセタキセル群の患者は、ドセタキセルを投与する治療前ごとに、高用量デキサメタゾンの投与も受けた(3週間レジメンの12時間前、3時間前、1時間前に8mgを投与;6週間ごとに5回のレジメンの1時間前に8mgを投与)。[
56
]
- 3年OS率は、3週間ごとのドセタキセル群(18.6%)の方が、ミトキサントロン群(13.5%、HR死亡、0.79;95%CI、0.67-0.93)より統計的に有意に優れていた。
- しかしながら、ドセタキセルを6週間ごとに5回投与するレジメンでは、このOS率は16.8%であり、ミトキサントロンより統計的有意に優れているとはいえなかった。
- QOLについても、ドセタキセル群の方がミトキサントロン群と比べて良好であった(P = 0.009)。[ 57 ][証拠レベル:1iiA、証拠レベル:1iiC]
- ホルモン不応性前立腺がん患者を含む別のランダム化試験で、3週間のレジメンのエストラムスチン(1~5日目に280mgを1日3回経口投与 + 血管内血栓予防のためワルファリンとアスピリン325mgを1日1回投与)とドセタキセル(2日目に60mg/m2をIV投与、デキサメタゾンを前投与[20mgを3回、前夜から開始])が、ミトキサントロン(12mg/m2を3週間ごとにIV投与) + プレドニゾン(5mgを1日1回投与)と比較された。[
58
][証拠レベル:1iiA]
- 追跡期間中央値32ヵ月後で、OS期間中央値は、エストラムスチン/ドセタキセル群が17.5ヵ月であったのに対し、ミトキサントロン群では15.6ヵ月であった(HR死亡、0.80;95%CI、0.67-0.97;P = 0.02)。
- 総合的QOLおよび疼痛緩和の測定値については、2つの治療群でほぼ同等であった。[ 59 ][証拠レベル:1iiC]
- ドセタキセルの2週間ごとのレジメンが3週間ごとのレジメンと比較されている。2週間ごとのレジメンではOSが良好と考えられ、血液毒性が少なかった。[
60
][証拠レベル:1iiA]
- この試験では、転移性ホルモン抵抗性前立腺がんの男性361人が進行まで2週間ごとのレジメン(50mg/m2のIV投与)または3週間ごとのレジメン(75mg/m2のIV投与)のいずれかでドセタキセルを投与する群にランダムに割り付けられた。すべての患者に対してプレドニゾロン(10mg/日経口投与)およびデキサメタゾン(7.5~8.0mg/日)も投与し、ドセタキセルの各投与の前日から投与後1~2日間継続した。ランダムに割り付けられた患者のうち15人(4.2%)が後ろ向き調査で不適格とみなされたか、同意を撤回したため、解析から除外された。
- 追跡期間中央値18ヵ月で、この研究の主要エンドポイントである治療失敗までの期間にわずかな差が認められた(5.6ヵ月[95%CI、5.0-6.2] vs 4.9ヵ月[95%CI、4.5-5.4];P = 0.014)。しかしながら、副次エンドポイントであるOS中央値において、2週間ごとのレジメンが優れている大きな差が認められた(19.5ヵ月[95%CI、15.9-23.1] vs 17.0ヵ月[95%CI、15.0 -19.1];P = 0.02)。
- 2週間ごとのレジメンでは、グレード3~4の好中球減少症の発生率が低く(36% vs 53%;P < 0.0001)、発熱性好中球減少症の発生率も低かった(4% vs 14%;P = 0.001)。
- ホルモン/去勢不応性の転移性前立腺がん(mCRPC)で以前に化学療法を受けていない患者において、カバジタキセルおよびドセタキセルでは、OSに関して同様の結果が得られるとみられた。[
61
]
- FIRSTANA試験(NCT01308567)では、mCRPCの男性1,168人が、疾患が増悪するまでカバジタキセル、20mg/m2、カバジタキセル、25mg/m2、またはドセタキセル、75mg/m2、IV、3週間ごと(+プレドニゾン、10mgの連日経口投与)を受けるようにランダムに割り付けられた(1:1:1の比率)。OS期間中央値は3つの研究群すべてでほぼ同じで、統計的有意差は認められず(それぞれ、24.5ヵ月 vs 25.2ヵ月 vs 24.3ヵ月)、生存曲線は実質的に重なり合っていた。[ 61 ][証拠レベル:1iiA]
- ただし、毒性作用については研究群間で異なっており、緊急治療を要する有害事象の発生率はそれぞれ、41.2%、60.1%、および46.0%であった。
- mCRPCで、ドセタキセルによる治療中または治療後に病勢が進行した患者を対象にしたランダム化試験(NCT00417079)において、カバジタキセルは、ミトキサントロンと比較して生存期間を延長することが示された。[
62
]この試験では、前記のような男性755人がプレドニゾン(10mgの連日経口投与)による治療を受けるとともに、カバジタキセル(25mg/m2のIV投与)またはミトキサントロン(12mg/m2のIV投与)のいずれかを3週間ごとに投与する群にランダムに割り付けられた。[
62
][証拠レベル:1iiA]
- OS期間中央値は、カバジタキセル群で15.1ヵ月、ミトキサントロン研究群で12.7ヵ月であった(HR死亡、0.70;95%CI、0.59-0.83;P < 0.0001)。
- mCRPCで以前にドセタキセルを投与されていた男性1,200人の類似した集団を対象にカバジタキセル(20mg/m2、IV、3週間ごと)とカバジタキセル(25mg/m2、IV、3週間ごと)を比較した非劣性デザインのランダム化試験では、低用量のカバジタキセルはOSに関して非劣性基準を満たした(HR死亡、1.024;CI、1.184で上方限界)が、毒性は低かった。[ 63 ][証拠レベル:1iiA]
主観的な症状の改善やPSA値の低下をもたらすと報告される他の化学療法レジメンには以下のものがある:[ 64 ][証拠レベル:3iiiDiii];[ 65 ]
- パクリタキセル。
- エストラムスチン/エトポシド。
- エストラムスチン/ビンブラスチン。
- エストラムスチン/パクリタキセル。
腫瘍が神経内分泌系分化を示す患者は、化学療法によく反応することを示唆している研究がある。[ 66 ]
免疫療法
シプリューセル-Tは、活性のある細胞免疫療法薬の1つで、ホルモン不応性の転移性前立腺がん患者でOS期間を延長することが示されている。シプリューセル-Tは、顆粒球マクロファージコロニー刺激因子と融合させた前立腺酸性ホスファターゼから構成される組換え型融合蛋白(PA2024)にex vivoで曝露させた自家末梢血単核細胞からなる。
副作用は、サイトカイン放出とおおむね一致した症状で、悪寒、発熱、頭痛、筋肉痛、発汗、およびインフルエンザ様症候群があり、通常は注入から最初の24時間以内にみられる。自己免疫疾患または二次悪性腫瘍の増加は確認されていない。[ 67 ]
証拠(免疫療法):
- 最大規模の試験(Immunotherapy for Prostate Adenocarcinoma Treatment:IMPACT試験[NCT00065442])で、ホルモン不応性の転移がん患者512人をシプリューセル-T投与群(n = 341) vs プラセボ投与群(n = 171)に2:1の比率でランダムに割り付け、60分かけて静脈内へ注入する治療を2週間ごとに計3回繰り返した。[
68
]臓器転移が認められる患者、病的骨折がある患者、またはECOGのパフォーマンスステータスが0~1より悪い患者は、研究から除外された。病勢進行が確認された時点で、シプリューセル-T群と同じ仕様だが、プラセボが用意された時点で凍結保存されていた細胞を使用して作成された注入薬を、医師の判断によりプラセボ群の患者にも投与することができた(このような輸注をプラセボ群の患者の63.7%が受けた)。疾患進行までの期間および疾患関連痛発生までの期間が当初の主要エンドポイントであったが、この主要エンドポイントは、同様なデザインの2件の以前の試験(以下に記述)で認められた生存差に基づいて、研究の盲検解除前に変更された。[
68
][証拠レベル:1iA]
- 追跡期間中央値34.1ヵ月後で、全死亡率は、シプリューセル-T群の61.6%に対して、プラセボ群では70.8%であった(HR死亡、0.78;95%CI、0.61-0.98;P = 0.03)。しかしながら、この生存率の改善に伴う抗腫瘍効果は測定できなかった。
- 病勢進行率では、研究群間に差は認められなかった。2011年におけるシプリューセル-Tの推定価格は、1ヵ月の治療コースで$93,000であった。このため、延命1年当たりの推定費用は約$276,000となる。[ 69 ]
- 同じ研究者らは、このIMPACT試験に先行して、ほぼ同じデザインで2件の小規模な試験(D9901およびD9902A [NCT00005947])を実施している。[
70
][
71
]
- この2件の類似試験は、シプリューセル-T群とプラセボ群に2:1の比率でランダムに割り付けられた計225人の患者が含まれ、両試験を合わせた結果は、IMPACT試験と同程度であった。HR死亡は、0.67(95%CI、0.49-0.91)であったが、無増悪期間の比では、統計的有意差に至らなかった。
低用量プレドニゾンは、一部の患者の症状を一時的に緩和しうる。[ 72 ]
証拠(緩和目的の低量プレドニゾン):
- アンドロゲン遮断療法(去勢またはLH-RHアゴニスト)後に疾患進行が認められた患者を対象に、プレドニゾン(5mgを1日4回投与)とフルタミド(250mgを1日3回投与)をランダム化比較する試験が実施された。[
73
]
- プレドニゾンおよびフルタミドにより得られたOS、症状に対する奏効、PSAに基づく奏効、および進行までの期間は同程度であった;しかしながら、プレドニゾンを投与した患者では、疼痛、吐き気と嘔吐、および下痢において統計的有意差が認められた。(がん性疼痛およびがん治療に関連した吐き気と嘔吐に関するPDQ要約を参照のこと;下痢に関する情報については、消化管の合併症に関するPDQ要約を参照のこと。)
現在、こうした患者に対する化学療法の意義を探る臨床試験が実施されている。[ 10 ][ 11 ][ 12 ][ 13 ][ 55 ][ 64 ][ 65 ][ 66 ]
放射性医薬品療法
アルファ線エミッター放射線療法
ラジウム Ra 223(223Ra)は、アルファ粒子(すなわち、ヘリウム核と同じように2個の陽子と2個の中性子が結合した粒子)を放出し、半減期は11.4日である。これを静脈内投与すると、新たに形成された骨間質に選択的に取り込まれる。高エネルギーのアルファ粒子の射程距離は100mcM未満と短い。前立腺がんが骨に転移した患者では、223RaによりOSの改善が得られた。
証拠(アルファ線エミッター放射線療法):
- プラセボ対照試験において、症候性去勢抵抗性前立腺がんで、2ヵ所以上に骨転移を認め、内臓転移は不明な男性921人が、2:1の比率で223Raを体重1kg当たり50kBqの線量で4週間ごとに6回投与する群とプラセボ群にランダムに割り付けられた。すべての研究参加者は、既にドセタキセルの投与を受けていたか、その投与に十分な健康状態ではなかったか、またはそれを拒否した。[
74
][
75
]
- OS期間中央値は、223Ra研究群の14.9ヵ月に対し、プラセボ群では11.3ヵ月であった(HR死亡、0.70;95%CI、0.58-0.83;P < 0.001)。[ 74 ][証拠レベル:1iA]
- 症候性の骨関連事象(33% vs 38%)および脊髄圧迫(4% vs 7%)の発生率にも、統計的に有意な改善がみられた。
- プロスペクティブに測定したQOLも223Ra研究群で良好であった(0~156のスケールで10ポイント以上の改善は、25% vs 16%;P = 0.02)。[ 74 ][証拠レベル:1iC]
- 4週間ごとに体重1kg当たり50kBqの線量の223Raを6回投与した場合でも、副作用はプラセボと同程度であった。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Trock BJ, Han M, Freedland SJ, et al.: Prostate cancer-specific survival following salvage radiotherapy vs observation in men with biochemical recurrence after radical prostatectomy. JAMA 299 (23): 2760-9, 2008.[PUBMED Abstract]
- Ray GR, Bagshaw MA, Freiha F: External beam radiation salvage for residual or recurrent local tumor following radical prostatectomy. J Urol 132 (5): 926-30, 1984.[PUBMED Abstract]
- Carter GE, Lieskovsky G, Skinner DG, et al.: Results of local and/or systemic adjuvant therapy in the management of pathological stage C or D1 prostate cancer following radical prostatectomy. J Urol 142 (5): 1266-70; discussion 1270-1, 1989.[PUBMED Abstract]
- Freeman JA, Lieskovsky G, Cook DW, et al.: Radical retropubic prostatectomy and postoperative adjuvant radiation for pathological stage C (PcN0) prostate cancer from 1976 to 1989: intermediate findings. J Urol 149 (5): 1029-34, 1993.[PUBMED Abstract]
- Shipley WU, Seiferheld W, Lukka HR, et al.: Radiation with or without Antiandrogen Therapy in Recurrent Prostate Cancer. N Engl J Med 376 (5): 417-428, 2017.[PUBMED Abstract]
- Moul JW, Paulson DF: The role of radical surgery in the management of radiation recurrent and large volume prostate cancer. Cancer 68 (6): 1265-71, 1991.[PUBMED Abstract]
- Schellhammer PF, Kuban DA, el-Mahdi AM: Treatment of clinical local failure after radiation therapy for prostate carcinoma. J Urol 150 (6): 1851-5, 1993.[PUBMED Abstract]
- Bales GT, Williams MJ, Sinner M, et al.: Short-term outcomes after cryosurgical ablation of the prostate in men with recurrent prostate carcinoma following radiation therapy. Urology 46 (5): 676-80, 1995.[PUBMED Abstract]
- Taylor CD, Elson P, Trump DL: Importance of continued testicular suppression in hormone-refractory prostate cancer. J Clin Oncol 11 (11): 2167-72, 1993.[PUBMED Abstract]
- Debruyne FJ, Murray R, Fradet Y, et al.: Liarozole--a novel treatment approach for advanced prostate cancer: results of a large randomized trial versus cyproterone acetate. Liarozole Study Group. Urology 52 (1): 72-81, 1998.[PUBMED Abstract]
- Eisenberger MA: Chemotherapy for prostate carcinoma. NCI Monogr (7): 151-63, 1988.[PUBMED Abstract]
- Pienta KJ, Redman B, Hussain M, et al.: Phase II evaluation of oral estramustine and oral etoposide in hormone-refractory adenocarcinoma of the prostate. J Clin Oncol 12 (10): 2005-12, 1994.[PUBMED Abstract]
- Hudes GR, Greenberg R, Krigel RL, et al.: Phase II study of estramustine and vinblastine, two microtubule inhibitors, in hormone-refractory prostate cancer. J Clin Oncol 10 (11): 1754-61, 1992.[PUBMED Abstract]
- Kuban DA, el-Mahdi AM, Schellhammer PF: Prostate-specific antigen for pretreatment prediction and posttreatment evaluation of outcome after definitive irradiation for prostate cancer. Int J Radiat Oncol Biol Phys 32 (2): 307-16, 1995.[PUBMED Abstract]
- Sandler HM, Dunn RL, McLaughlin PW, et al.: Overall survival after prostate-specific-antigen-detected recurrence following conformal radiation therapy. Int J Radiat Oncol Biol Phys 48 (3): 629-33, 2000.[PUBMED Abstract]
- Duchesne GM, Woo HH, Bassett JK, et al.: Timing of androgen-deprivation therapy in patients with prostate cancer with a rising PSA (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, non-blinded, phase 3 trial. Lancet Oncol 17 (6): 727-37, 2016.[PUBMED Abstract]
- Duchesne GM, Woo HH, King M, et al.: Health-related quality of life for immediate versus delayed androgen-deprivation therapy in patients with asymptomatic, non-curable prostate cancer (TROG 03.06 and VCOG PR 01-03 [TOAD]): a randomised, multicentre, non-blinded, phase 3 trial. Lancet Oncol 18 (9): 1192-1201, 2017.[PUBMED Abstract]
- Crook JM, O'Callaghan CJ, Duncan G, et al.: Intermittent androgen suppression for rising PSA level after radiotherapy. N Engl J Med 367 (10): 895-903, 2012.[PUBMED Abstract]
- Magnan S, Zarychanski R, Pilote L, et al.: Intermittent vs Continuous Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Oncol 1 (9): 1261-9, 2015.[PUBMED Abstract]
- Kunath F, Grobe HR, Rücker G, et al.: Non-steroidal antiandrogen monotherapy compared with luteinising hormone-releasing hormone agonists or surgical castration monotherapy for advanced prostate cancer. Cochrane Database Syst Rev (6): CD009266, 2014.[PUBMED Abstract]
- Fosså SD, Dearnaley DP, Law M, et al.: Prognostic factors in hormone-resistant progressing cancer of the prostate. Ann Oncol 3 (5): 361-6, 1992.[PUBMED Abstract]
- Kelly WK, Scher HI, Mazumdar M, et al.: Prostate-specific antigen as a measure of disease outcome in metastatic hormone-refractory prostate cancer. J Clin Oncol 11 (4): 607-15, 1993.[PUBMED Abstract]
- Small EJ, Vogelzang NJ: Second-line hormonal therapy for advanced prostate cancer: a shifting paradigm. J Clin Oncol 15 (1): 382-8, 1997.[PUBMED Abstract]
- Small EJ, Halabi S, Dawson NA, et al.: Antiandrogen withdrawal alone or in combination with ketoconazole in androgen-independent prostate cancer patients: a phase III trial (CALGB 9583). J Clin Oncol 22 (6): 1025-33, 2004.[PUBMED Abstract]
- Sridhara R, Eisenberger MA, Sinibaldi VJ, et al.: Evaluation of prostate-specific antigen as a surrogate marker for response of hormone-refractory prostate cancer to suramin therapy. J Clin Oncol 13 (12): 2944-53, 1995.[PUBMED Abstract]
- Hussain M, Wolf M, Marshall E, et al.: Effects of continued androgen-deprivation therapy and other prognostic factors on response and survival in phase II chemotherapy trials for hormone-refractory prostate cancer: a Southwest Oncology Group report. J Clin Oncol 12 (9): 1868-75, 1994.[PUBMED Abstract]
- Sternberg CN, Castellano D, Daugaard G, et al.: Abiraterone acetate for patients with metastatic castration-resistant prostate cancer progressing after chemotherapy: final analysis of a multicentre, open-label, early-access protocol trial. Lancet Oncol 15 (11): 1263-8, 2014.[PUBMED Abstract]
- Ryan CJ, Smith MR, de Bono JS, et al.: Abiraterone in metastatic prostate cancer without previous chemotherapy. N Engl J Med 368 (2): 138-48, 2013.[PUBMED Abstract]
- Ryan CJ, Smith MR, Fizazi K, et al.: Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 16 (2): 152-60, 2015.[PUBMED Abstract]
- Basch E, Autio K, Ryan CJ, et al.: Abiraterone acetate plus prednisone versus prednisone alone in chemotherapy-naive men with metastatic castration-resistant prostate cancer: patient-reported outcome results of a randomised phase 3 trial. Lancet Oncol 14 (12): 1193-9, 2013.[PUBMED Abstract]
- Beer TM, Armstrong AJ, Rathkopf DE, et al.: Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 371 (5): 424-33, 2014.[PUBMED Abstract]
- Loriot Y, Miller K, Sternberg CN, et al.: Effect of enzalutamide on health-related quality of life, pain, and skeletal-related events in asymptomatic and minimally symptomatic, chemotherapy-naive patients with metastatic castration-resistant prostate cancer (PREVAIL): results from a randomised, phase 3 trial. Lancet Oncol 16 (5): 509-21, 2015.[PUBMED Abstract]
- Beer TM, Armstrong AJ, Rathkopf D, et al.: Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 71 (2): 151-154, 2017.[PUBMED Abstract]
- Hussain M, Fizazi K, Saad F, et al.: Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 378 (26): 2465-2474, 2018.[PUBMED Abstract]
- Attard G, Borre M, Gurney H, et al.: Abiraterone Alone or in Combination With Enzalutamide in Metastatic Castration-Resistant Prostate Cancer With Rising Prostate-Specific Antigen During Enzalutamide Treatment. J Clin Oncol 36 (25): 2639-2646, 2018.[PUBMED Abstract]
- Smith MR, Saad F, Chowdhury S, et al.: Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 378 (15): 1408-1418, 2018.[PUBMED Abstract]
- Saad F, Cella D, Basch E, et al.: Effect of apalutamide on health-related quality of life in patients with non-metastatic castration-resistant prostate cancer: an analysis of the SPARTAN randomised, placebo-controlled, phase 3 trial. Lancet Oncol 19 (10): 1404-1416, 2018.[PUBMED Abstract]
- de Bono JS, Logothetis CJ, Molina A, et al.: Abiraterone and increased survival in metastatic prostate cancer. N Engl J Med 364 (21): 1995-2005, 2011.[PUBMED Abstract]
- Harland S, Staffurth J, Molina A, et al.: Effect of abiraterone acetate treatment on the quality of life of patients with metastatic castration-resistant prostate cancer after failure of docetaxel chemotherapy. Eur J Cancer 49 (17): 3648-57, 2013.[PUBMED Abstract]
- Scher HI, Fizazi K, Saad F, et al.: Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 367 (13): 1187-97, 2012.[PUBMED Abstract]
- Fizazi K, Scher HI, Miller K, et al.: Effect of enzalutamide on time to first skeletal-related event, pain, and quality of life in men with castration-resistant prostate cancer: results from the randomised, phase 3 AFFIRM trial. Lancet Oncol 15 (10): 1147-56, 2014.[PUBMED Abstract]
- Sternberg CN, de Bono JS, Chi KN, et al.: Improved outcomes in elderly patients with metastatic castration-resistant prostate cancer treated with the androgen receptor inhibitor enzalutamide: results from the phase III AFFIRM trial. Ann Oncol 25 (2): 429-34, 2014.[PUBMED Abstract]
- Cella D, Ivanescu C, Holmstrom S, et al.: Impact of enzalutamide on quality of life in men with metastatic castration-resistant prostate cancer after chemotherapy: additional analyses from the AFFIRM randomized clinical trial. Ann Oncol 26 (1): 179-85, 2015.[PUBMED Abstract]
- Fizazi K, Carducci M, Smith M, et al.: Denosumab versus zoledronic acid for treatment of bone metastases in men with castration-resistant prostate cancer: a randomised, double-blind study. Lancet 377 (9768): 813-22, 2011.[PUBMED Abstract]
- Scher HI, Chung LW: Bone metastases: improving the therapeutic index. Semin Oncol 21 (5): 630-56, 1994.[PUBMED Abstract]
- Dearnaley DP, Sydes MR, Mason MD, et al.: A double-blind, placebo-controlled, randomized trial of oral sodium clodronate for metastatic prostate cancer (MRC PR05 Trial). J Natl Cancer Inst 95 (17): 1300-11, 2003.[PUBMED Abstract]
- Ernst DS, Tannock IF, Winquist EW, et al.: Randomized, double-blind, controlled trial of mitoxantrone/prednisone and clodronate versus mitoxantrone/prednisone and placebo in patients with hormone-refractory prostate cancer and pain. J Clin Oncol 21 (17): 3335-42, 2003.[PUBMED Abstract]
- Saad F, Gleason DM, Murray R, et al.: Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 96 (11): 879-82, 2004.[PUBMED Abstract]
- Kaasa S, Brenne E, Lund JA, et al.: Prospective randomised multicenter trial on single fraction radiotherapy (8 Gy x 1) versus multiple fractions (3 Gy x 10) in the treatment of painful bone metastases. Radiother Oncol 79 (3): 278-84, 2006.[PUBMED Abstract]
- Chow E, Harris K, Fan G, et al.: Palliative radiotherapy trials for bone metastases: a systematic review. J Clin Oncol 25 (11): 1423-36, 2007.[PUBMED Abstract]
- Robinson RG: Strontium-89--precursor targeted therapy for pain relief of blastic metastatic disease. Cancer 72 (11 Suppl): 3433-5, 1993.[PUBMED Abstract]
- Oosterhof GO, Roberts JT, de Reijke TM, et al.: Strontium(89) chloride versus palliative local field radiotherapy in patients with hormonal escaped prostate cancer: a phase III study of the European Organisation for Research and Treatment of Cancer, Genitourinary Group. Eur Urol 44 (5): 519-26, 2003.[PUBMED Abstract]
- Porter AT, McEwan AJ, Powe JE, et al.: Results of a randomized phase-III trial to evaluate the efficacy of strontium-89 adjuvant to local field external beam irradiation in the management of endocrine resistant metastatic prostate cancer. Int J Radiat Oncol Biol Phys 25 (5): 805-13, 1993.[PUBMED Abstract]
- Smith MR, Saad F, Coleman R, et al.: Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 379 (9810): 39-46, 2012.[PUBMED Abstract]
- Tannock IF, Osoba D, Stockler MR, et al.: Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points. J Clin Oncol 14 (6): 1756-64, 1996.[PUBMED Abstract]
- Tannock IF, de Wit R, Berry WR, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med 351 (15): 1502-12, 2004.[PUBMED Abstract]
- Berthold DR, Pond GR, Soban F, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol 26 (2): 242-5, 2008.[PUBMED Abstract]
- Petrylak DP, Tangen CM, Hussain MH, et al.: Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer. N Engl J Med 351 (15): 1513-20, 2004.[PUBMED Abstract]
- Berry DL, Moinpour CM, Jiang CS, et al.: Quality of life and pain in advanced stage prostate cancer: results of a Southwest Oncology Group randomized trial comparing docetaxel and estramustine to mitoxantrone and prednisone. J Clin Oncol 24 (18): 2828-35, 2006.[PUBMED Abstract]
- Kellokumpu-Lehtinen PL, Harmenberg U, Joensuu T, et al.: 2-Weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase 3 trial. Lancet Oncol 14 (2): 117-24, 2013.[PUBMED Abstract]
- Oudard S, Fizazi K, Sengeløv L, et al.: Cabazitaxel Versus Docetaxel As First-Line Therapy for Patients With Metastatic Castration-Resistant Prostate Cancer: A Randomized Phase III Trial-FIRSTANA. J Clin Oncol 35 (28): 3189-3197, 2017.[PUBMED Abstract]
- de Bono JS, Oudard S, Ozguroglu M, et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 376 (9747): 1147-54, 2010.[PUBMED Abstract]
- Eisenberger M, Hardy-Bessard AC, Kim CS, et al.: Phase III Study Comparing a Reduced Dose of Cabazitaxel (20 mg/m(2)) and the Currently Approved Dose (25 mg/m(2)) in Postdocetaxel Patients With Metastatic Castration-Resistant Prostate Cancer-PROSELICA. J Clin Oncol 35 (28): 3198-3206, 2017.[PUBMED Abstract]
- Petrylak DP, Macarthur RB, O'Connor J, et al.: Phase I trial of docetaxel with estramustine in androgen-independent prostate cancer. J Clin Oncol 17 (3): 958-67, 1999.[PUBMED Abstract]
- Millikan RE: Chemotherapy of advanced prostatic carcinoma. Semin Oncol 26 (2): 185-91, 1999.[PUBMED Abstract]
- Amato RJ, Logothetis CJ, Hallinan R, et al.: Chemotherapy for small cell carcinoma of prostatic origin. J Urol 147 (3 Pt 2): 935-7, 1992.[PUBMED Abstract]
- Hall SJ, Klotz L, Pantuck AJ, et al.: Integrated safety data from 4 randomized, double-blind, controlled trials of autologous cellular immunotherapy with sipuleucel-T in patients with prostate cancer. J Urol 186 (3): 877-81, 2011.[PUBMED Abstract]
- Kantoff PW, Higano CS, Shore ND, et al.: Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 363 (5): 411-22, 2010.[PUBMED Abstract]
- Longo DL: New therapies for castration-resistant prostate cancer. N Engl J Med 363 (5): 479-81, 2010.[PUBMED Abstract]
- Higano CS, Schellhammer PF, Small EJ, et al.: Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 115 (16): 3670-9, 2009.[PUBMED Abstract]
- Small EJ, Schellhammer PF, Higano CS, et al.: Placebo-controlled phase III trial of immunologic therapy with sipuleucel-T (APC8015) in patients with metastatic, asymptomatic hormone refractory prostate cancer. J Clin Oncol 24 (19): 3089-94, 2006.[PUBMED Abstract]
- Tannock I, Gospodarowicz M, Meakin W, et al.: Treatment of metastatic prostatic cancer with low-dose prednisone: evaluation of pain and quality of life as pragmatic indices of response. J Clin Oncol 7 (5): 590-7, 1989.[PUBMED Abstract]
- Fosså SD, Slee PH, Brausi M, et al.: Flutamide versus prednisone in patients with prostate cancer symptomatically progressing after androgen-ablative therapy: a phase III study of the European organization for research and treatment of cancer genitourinary group. J Clin Oncol 19 (1): 62-71, 2001.[PUBMED Abstract]
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer. N Engl J Med 369 (3): 213-23, 2013.[PUBMED Abstract]
- Sartor O, Coleman R, Nilsson S, et al.: Effect of radium-223 dichloride on symptomatic skeletal events in patients with castration-resistant prostate cancer and bone metastases: results from a phase 3, double-blind, randomised trial. Lancet Oncol 15 (7): 738-46, 2014.[PUBMED Abstract]
- 前立腺がんに関する重要な参考文献
-
以下の参考文献は、PDQ Adult Treatment Editorial Boardのメンバーにより、前立腺がんの治療の分野において意義があることが確認されている。この一覧は、前立腺がんに関する現在の知見がまとめられており治療法の選択肢を決定する上で有用である重要な研究を読者に示すために提供されている。各参考文献の後には、その参考文献が引用されている本要約内のセクションが示されている。
- Beer TM, Armstrong AJ, Rathkopf DE, et al.: Enzalutamide in metastatic prostate cancer before chemotherapy.N Engl J Med 371 (5): 424-33, 2014.[PUBMED Abstract]
引用箇所:
- Berthold DR, Pond GR, Soban F, et al.: Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study.J Clin Oncol 26 (2): 242-5, 2008.[PUBMED Abstract]
引用箇所:
- Bill-Axelson A, Holmberg L, Garmo H, et al.: Radical prostatectomy or watchful waiting in early prostate cancer.N Engl J Med 370 (10): 932-42, 2014.[PUBMED Abstract]
引用箇所:
- de Bono JS, Oudard S, Ozguroglu M, et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial.Lancet 376 (9747): 1147-54, 2010.[PUBMED Abstract]
引用箇所:
- Lu-Yao GL, Albertsen PC, Moore DF, et al.: Outcomes of localized prostate cancer following conservative management.JAMA 302 (11): 1202-9, 2009.[PUBMED Abstract]
引用箇所:
- Mason MD, Parulekar WR, Sydes MR, et al.: Final Report of the Intergroup Randomized Study of Combined Androgen-Deprivation Therapy Plus Radiotherapy Versus Androgen-Deprivation Therapy Alone in Locally Advanced Prostate Cancer.J Clin Oncol 33 (19): 2143-50, 2015.[PUBMED Abstract]
引用箇所:
- Niraula S, Le LW, Tannock IF: Treatment of prostate cancer with intermittent versus continuous androgen deprivation: a systematic review of randomized trials.J Clin Oncol 31 (16): 2029-36, 2013.[PUBMED Abstract]
引用箇所:
- Parker C, Nilsson S, Heinrich D, et al.: Alpha emitter radium-223 and survival in metastatic prostate cancer.N Engl J Med 369 (3): 213-23, 2013.[PUBMED Abstract]
引用箇所:
- Potosky AL, Davis WW, Hoffman RM, et al.: Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study.J Natl Cancer Inst 96 (18): 1358-67, 2004.[PUBMED Abstract]
引用箇所:
- Pound CR, Partin AW, Eisenberger MA, et al.: Natural history of progression after PSA elevation following radical prostatectomy.JAMA 281 (17): 1591-7, 1999.[PUBMED Abstract]
引用箇所:
- Ryan CJ, Smith MR, Fizazi K, et al.: Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration-resistant prostate cancer (COU-AA-302): final overall survival analysis of a randomised, double-blind, placebo-controlled phase 3 study.Lancet Oncol 16 (2): 152-60, 2015.[PUBMED Abstract]
引用箇所:
- Scher HI, Fizazi K, Saad F, et al.: Increased survival with enzalutamide in prostate cancer after chemotherapy.N Engl J Med 367 (13): 1187-97, 2012.[PUBMED Abstract]
引用箇所:
- Seidenfeld J, Samson DJ, Aronson N, et al.: Relative effectiveness and cost-effectiveness of methods of androgen suppression in the treatment of advanced prostate cancer.Evid Rep Technol Assess (Summ) (4): i-x, 1-246, I1-36, passim, 1999.[PUBMED Abstract]
引用箇所:
- Sternberg CN, Castellano D, Daugaard G, et al.: Abiraterone acetate for patients with metastatic castration-resistant prostate cancer progressing after chemotherapy: final analysis of a multicentre, open-label, early-access protocol trial.Lancet Oncol 15 (11): 1263-8, 2014.[PUBMED Abstract]
引用箇所:
- Thompson IM, Tangen CM, Paradelo J, et al.: Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial.J Urol 181 (3): 956-62, 2009.[PUBMED Abstract]
引用箇所:
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer.N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
引用箇所:
- Beer TM, Armstrong AJ, Rathkopf DE, et al.: Enzalutamide in metastatic prostate cancer before chemotherapy.N Engl J Med 371 (5): 424-33, 2014.[PUBMED Abstract]
- 本要約の変更点(07/22/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、前立腺がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Timothy Gilligan, MD (Cleveland Clinic Taussig Cancer Institute)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Prostate Cancer Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/prostate/hp/prostate-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389471]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。


 画像を拡大する
画像を拡大する