ご利用について
医療専門家向けの本PDQがん情報要約では、成人中枢神経系腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
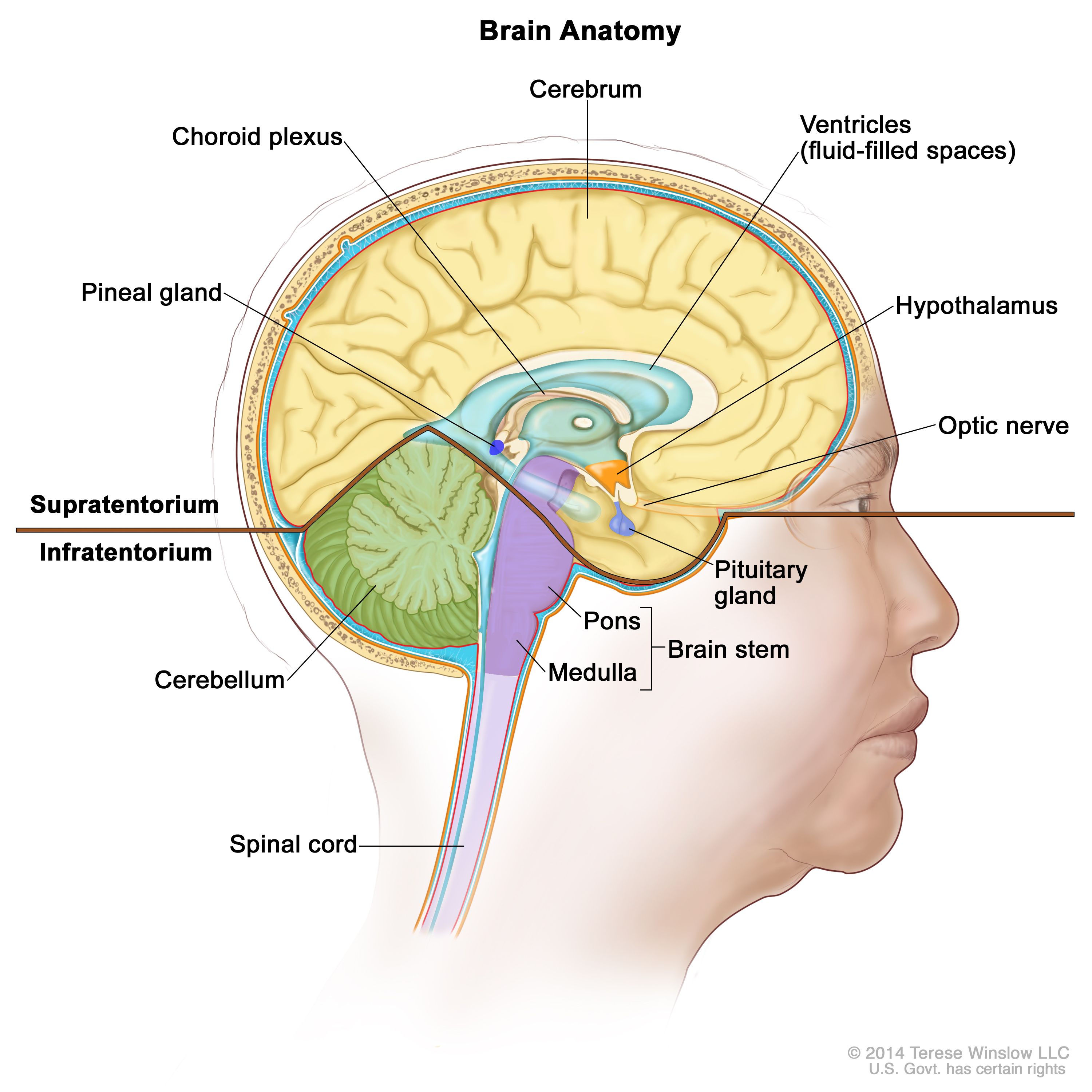
- 成人中枢神経系(CNS)腫瘍に関する一般情報
-
発生率および死亡率
脳腫瘍は、全原発性中枢神経系(CNS)腫瘍の85~90%を占める。[ 1 ]米国において、2020年に推定される脳腫瘍およびその他の神経系腫瘍の新規症例数および死亡数:[ 2 ]
2011年のSurveillance, Epidemiology, and End Results(SEER)データベースの利用可能な登録データによると、米国における原発浸潤性CNS腫瘍の合計発生率は10万人当たり年間6.4人であり、推定死亡率は10万人当たり年間4.3人であると示されている。[ 3 ]世界的には、2012年には新たに約256,213人の脳腫瘍およびその他のCNS腫瘍の症例が診断され、推定死亡数は189,382人であった。[ 4 ]
一般に、原発性CNS腫瘍の発生率は黒人よりも白人の方が高く、死亡率は女性より男性の方が高い。[ 1 ]
原発性脳腫瘍には、頻度の高い順に以下のものがある:[ 1 ]
原発性脊髄腫瘍には、頻度の高い順に以下のものがある:
原発性脳腫瘍が、中枢神経外へ拡がることはまれであるが、脳内転移や脊髄軸転移することはありうる。
臨床的特徴
さまざまな脳腫瘍の臨床症状は、症状および徴候と解剖学との関係を考慮することで、最もよく理解される。[ 1 ]
一般的な症状および徴候には以下のものがある:
痙攣発作は、テント上脳腫瘍患者の約20%に認められる症状であり、増殖速度が緩徐な腫瘍患者においては、臨床診断に数ヵ月から数年先行することがある。脳腫瘍の全患者中、原発性実質細胞腫瘍の70%および転移性脳腫瘍の40%は、臨床経過のいずれかの時点で痙攣発作を起こす。[ 8 ]
診断的評価
原発性、転移性、悪性、または良性のいずれの脳腫瘍も、類似の臨床症状を呈する膿瘍、動静脈奇形、梗塞など、他の占拠性病変と鑑別する必要がある。[ 9 ]
画像検査
造影コンピュータ断層撮影(CT)および磁気共鳴画像法(MRI)は、CNS新生物の診断において補完的な役割をもつ。[ 1 ][ 9 ][ 10 ]
治療後の画像診断では、単一光子放出型コンピュータ断層撮影(SPECT)およびポジトロン放射断層撮影(PET)が腫瘍再発と放射線壊死を鑑別する場合に有用である。[ 9 ]
生検
原発性脳腫瘍が疑われる診断を確定するには、針生検による手術前または外科的切除時にかかわらず、生検による確認がきわめて重要である。ただし、臨床像または放射線画像所見により良性腫瘍であることが明確に示される症例は、生検または治療を行わない積極的サーベイランスで管理できる場合があるため、例外とする。その他の症例では、放射線学的画像パターンは誤解を招くことがあるため、転移がんや感染症など、占拠性病変の他の原因を除外するためには、最も確実な生検が必要である。
CTまたはMRIガイド下の定位技術を用いると、脳内のほとんどすべての部位に針を安全かつ正確に刺入できる。
予後因子
びまん性グリオーマ(星細胞腫、乏突起膠腫、混合グリオーマ、膠芽腫)の強力な予後因子として、複数の遺伝子変異が近年明らかになっており、これらの変異は患者管理の指針になりうる。特異的な変異には以下のものがある:
予後不良となる他の予後因子には以下のものがある:[ 11 ][ 12 ]
放射線療法単独またはテモゾロミド化学療法単独のいずれかで治療された低悪性度グリオーマ患者318人を対象にした1件の探索的解析において、これらの予後因子の組み合わせから以下が実証された:[ 11 ]
- 1p/19qの両欠失が認められないIDH変異を有する患者において、放射線療法で治療された場合に、より長期の無増悪生存(PFS)(ハザード比、1.86;95%信頼区間、1.21-2.87;ログランク、P = 0.0043)が得られた。
- 1p/19qの両欠失が認められるIDH変異を有する患者とIDH野生型腫瘍を有する患者では、PFSにおける治療に依存した有意差は認められなかった。
- IDH野生型腫瘍を有する患者は、治療方法にかかわらず最も予後不良であった。
- 1p/19q両欠失が認められるIDH変異腫瘍患者は、最も予後良好であった。
- 低悪性度腫瘍におけるO6-メチルグアニン-DNAメチルトランスフェラーゼ(MGMT)プロモーター状態が、以下においてメチル化していた:
(詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療のセクションを参照のこと。)
関連する要約
詳しい情報については、以下のPDQ要約を参照のこと:
参考文献- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1700-49.[PUBMED Abstract]
- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed January 17, 2020.[PUBMED Abstract]
- Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2011. Bethesda, Md: National Cancer Institute, 2014. Also available online. Last accessed August 2, 2019.[PUBMED Abstract]
- Ferlay J, Soerjomataram I, Ervik M, et al.: GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide. Lyon, France: International Agency for Research on Cancer, 2013. IARC CancerBase No. 11. Available online. Last accessed October 18, 2019.[PUBMED Abstract]
- Schabet M: Epidemiology of primary CNS lymphoma. J Neurooncol 43 (3): 199-201, 1999.[PUBMED Abstract]
- Behin A, Hoang-Xuan K, Carpentier AF, et al.: Primary brain tumours in adults. Lancet 361 (9354): 323-31, 2003.[PUBMED Abstract]
- Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. Lyon, France: International Agency for Research on Cancer, 2000.[PUBMED Abstract]
- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. Philadelphia, Pa: WB Saunders Co, 2001, pp 1106-42.[PUBMED Abstract]
- Hutter A, Schwetye KE, Bierhals AJ, et al.: Brain neoplasms: epidemiology, diagnosis, and prospects for cost-effective imaging. Neuroimaging Clin N Am 13 (2): 237-50, x-xi, 2003.[PUBMED Abstract]
- Ricci PE: Imaging of adult brain tumors. Neuroimaging Clin N Am 9 (4): 651-69, 1999.[PUBMED Abstract]
- Baumert BG, Hegi ME, van den Bent MJ, et al.: Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1521-1532, 2016.[PUBMED Abstract]
- Reijneveld JC, Taphoorn MJ, Coens C, et al.: Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1533-1542, 2016.[PUBMED Abstract]
- 成人原発性CNS腫瘍の世界保健機関(WHO)分類
-
この分類は、世界保健機関(WHO)の中枢神経系(CNS)腫瘍の分類に基づいている。[ 1 ]WHOのアプローチは、普遍的に適用でき予後を考慮した妥当な細胞分類を構築する目的で、形態学、細胞遺伝学、分子遺伝学、および免疫学的マーカーを取り入れて相互に関係付けている。TNMに基づく分類を開発しようとする初期の試みは以下の理由で中止された:[ 2 ]
CNS腫瘍のWHO悪性度分類では、腫瘍の組織学的特徴に基づいた悪性度の尺度が確立されている。[ 3 ]組織学的悪性度は以下の通りである:
表1には、腫瘍型と悪性度をまとめている。[ 4 ]末梢神経系に限局する腫瘍は含まれていない。病理組織学、悪性度分類の方法、発生率、個々の腫瘍型に特異的な病因についての知見など、詳しい記述については他の資料に記載されている。[ 4 ][ 5 ]
表1.CNS腫瘍のWHO悪性度a I II III IV a Louis, DN, Ohgaki H, Wiestler, OD, Cavenee, WK.から許諾を得て転載:World Health Organization Classification of Tumours of the Central Nervous System.IARC, Lyon, 2007. 星細胞腫 上衣下巨細胞星細胞腫 X 毛様細胞性星細胞腫 X 毛様類粘液性星細胞腫 X びまん性星細胞腫 X 多形黄色星細胞腫 X 退形成性星細胞腫 X 膠芽腫 X 巨細胞膠芽腫 X 神経膠肉腫 X 乏突起膠細胞腫瘍 乏突起膠腫 X 退形成性乏突起膠腫 X 乏突起星細胞系腫瘍 乏突起星細胞腫 X 退形成性乏突起星細胞腫 X 上衣腫瘍 上衣下腫 X 粘液乳頭状上衣腫 X 上衣腫 X 退形成性上衣腫 X 脈絡叢腫瘍 脈絡叢乳頭腫 X 非定型脈絡叢乳頭腫 X 脈絡叢がん X その他の神経上皮腫瘍 血管中心性膠腫 X 第三脳室の脊索腫様グリオーマ X 神経細胞系および混合神経細胞-グリア系腫瘍 神経節細胞腫 X 神経節膠腫 X 退形成性神経節腫 X 線維形成性乳児星細胞腫および神経節膠腫 X 胚芽異形成性神経上皮腫瘍 X 中心性神経細胞腫 X 脳室外神経細胞腫 X 小脳脂肪神経細胞腫 X 脊髄傍神経節腫 X 乳頭状グリア神経細胞性腫瘍 X 第四脳室ロゼット形成性グリア神経細胞性腫瘍 X 松果体腫瘍 松果体細胞腫 X 中分化型松果体実質細胞腫瘍 X X 松果体芽細胞腫 X 松果体乳頭状腫瘍 X X 胎児性腫瘍 髄芽腫 X CNS原始神経外胚葉性腫瘍 X 非定型奇形腫様/ラブドイド腫瘍 X 脳神経および傍脊椎神経腫瘍 神経鞘腫 X 神経線維腫 X 末梢神経腫瘍 X X X 悪性末梢神経鞘腫瘍 X X X 髄膜腫瘍 髄膜腫 X 非定型髄膜腫 X 退形成性/悪性髄膜腫 X 血管周皮腫 X 退形成性血管周皮腫 X 血管芽細胞腫 X トルコ鞍部の腫瘍 頭蓋咽頭腫 X 神経下垂体顆粒細胞腫 X 下垂体細胞腫 X 腺下垂体の紡錘形膨大細胞腫 X ゲノムの変化
最近になって発見されたBRAFおよびイソクエン酸デヒドロゲナーゼ(IDH)1およびIDH2遺伝子における変異、およびゲノムの1p/19q両欠失は、グリオーマの特定のサブタイプにおける顕著な異常であるとみられる。これらの突然変異の存在を評価することは診断と予後を支援し、1p/19q両欠失に関して、化学療法に対する反応を予測する。
毛様細胞性星細胞腫(WHO分類悪性度I)では、KIAA1549とBRAF間の融合につながる7q34における縦列重複が、毛様細胞性星細胞腫の約70%にみられる。[ 6 ][ 7 ][ 8 ]BRAF(V600E)における活性化点突然変異がこれらの腫瘍のさらなる5~9%に認められるほか、一般に、RAFの変異が毛様細胞性星細胞腫の約80%に生じる。
BRAF V600E突然変異は、多形黄色星細胞腫および神経節膠腫などの他の良性グリオーマの変種で(約60%に)認められるが、BRAFの縦列重複はこれらのグリオーマの変種にはみられない。[ 9 ][ 10 ][ 11 ]
WHO分類悪性度IIおよびIIIのびまん性グリオーマ(星細胞腫、乏突起膠腫、および乏突起星細胞腫)の大半と膠芽腫(WHO分類悪性度IV)の5~10%は、IDH1のR132の位置か、またはまれに、IDH2(R172)の類似のコドンに点突然変異を有する。[ 12 ][ 13 ][ 14 ][ 15 ][ 16 ]IDH1またはIDH2突然変異の存在は強力な予後因子である。これらの変異腫瘍を有する患者は、WHO分類悪性度または組織学的亜型とは独立に、生存期間が有意に長くなる。
染色体1pおよび19qの欠失は転座イベントを介して発生し、[ 17 ]乏突起膠腫でよくみられる。1p/19qの両欠失は強力な予後因子であり、化学療法への反応を予測しうる。(詳しい情報については、本要約の退形成型乏突起膠腫の治療に関するセクションを参照のこと。)
これらの遺伝子変異は診断に有用となりうる。IDH1およびIDH2突然変異の存在によって、びまん性グリオーマを、しばしばBRAF遺伝子の変異を有する他のグリオーマの変種、および腫瘍性ではない反応性のアストロサイトーシスから鑑別できることがある。[ 18 ]グリオーマにおけるほとんど(90%)のIDH突然変異はR132Hの置換をもたらし、感度と特異度が高いモノクローナル抗体を使用して検出可能である。変異特異的なIDH1抗体を使用する迅速な免疫組織化学的分析は、診断的解析を支援できる。[ 19 ]
その他のCNS腫瘍は、特徴的なパターンのがん遺伝子の変化、腫瘍抑制遺伝子の変化、および染色体異常と関連している。一定の染色体異常を伴う家族性腫瘍症候群はグリオーマと関連している。
参考文献- Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. Lyon, France: International Agency for Research on Cancer, 2000.[PUBMED Abstract]
- Brain and Spinal Cord. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 857–69.[PUBMED Abstract]
- Kleihues P, Burger PC, Scheithauer BW: The new WHO classification of brain tumours. Brain Pathol 3 (3): 255-68, 1993.[PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD, et al.: The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 114 (2): 97-109, 2007.[PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD, et al., eds.: WHO Classification of Tumours of the Central Nervous System. 4th ed. Lyon, France: IARC Press, 2007.[PUBMED Abstract]
- Sievert AJ, Jackson EM, Gai X, et al.: Duplication of 7q34 in pediatric low-grade astrocytomas detected by high-density single-nucleotide polymorphism-based genotype arrays results in a novel BRAF fusion gene. Brain Pathol 19 (3): 449-58, 2009.[PUBMED Abstract]
- Pfister S, Janzarik WG, Remke M, et al.: BRAF gene duplication constitutes a mechanism of MAPK pathway activation in low-grade astrocytomas. J Clin Invest 118 (5): 1739-49, 2008.[PUBMED Abstract]
- Jones DT, Kocialkowski S, Liu L, et al.: Tandem duplication producing a novel oncogenic BRAF fusion gene defines the majority of pilocytic astrocytomas. Cancer Res 68 (21): 8673-7, 2008.[PUBMED Abstract]
- Dias-Santagata D, Lam Q, Vernovsky K, et al.: BRAF V600E mutations are common in pleomorphic xanthoastrocytoma: diagnostic and therapeutic implications. PLoS One 6 (3): e17948, 2011.[PUBMED Abstract]
- MacConaill LE, Campbell CD, Kehoe SM, et al.: Profiling critical cancer gene mutations in clinical tumor samples. PLoS One 4 (11): e7887, 2009.[PUBMED Abstract]
- Parsons DW, Jones S, Zhang X, et al.: An integrated genomic analysis of human glioblastoma multiforme. Science 321 (5897): 1807-12, 2008.[PUBMED Abstract]
- Yan H, Parsons DW, Jin G, et al.: IDH1 and IDH2 mutations in gliomas. N Engl J Med 360 (8): 765-73, 2009.[PUBMED Abstract]
- Dubbink HJ, Taal W, van Marion R, et al.: IDH1 mutations in low-grade astrocytomas predict survival but not response to temozolomide. Neurology 73 (21): 1792-5, 2009.[PUBMED Abstract]
- Sanson M, Marie Y, Paris S, et al.: Isocitrate dehydrogenase 1 codon 132 mutation is an important prognostic biomarker in gliomas. J Clin Oncol 27 (25): 4150-4, 2009.[PUBMED Abstract]
- Hartmann C, Hentschel B, Wick W, et al.: Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: implications for classification of gliomas. Acta Neuropathol 120 (6): 707-18, 2010.[PUBMED Abstract]
- Hartmann C, Meyer J, Balss J, et al.: Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1,010 diffuse gliomas. Acta Neuropathol 118 (4): 469-74, 2009.[PUBMED Abstract]
- Jenkins RB, Blair H, Ballman KV, et al.: A t(1;19)(q10;p10) mediates the combined deletions of 1p and 19q and predicts a better prognosis of patients with oligodendroglioma. Cancer Res 66 (20): 9852-61, 2006.[PUBMED Abstract]
- Camelo-Piragua S, Jansen M, Ganguly A, et al.: A sensitive and specific diagnostic panel to distinguish diffuse astrocytoma from astrocytosis: chromosome 7 gain with mutant isocitrate dehydrogenase 1 and p53. J Neuropathol Exp Neurol 70 (2): 110-5, 2011.[PUBMED Abstract]
- Capper D, Weissert S, Balss J, et al.: Characterization of R132H mutation-specific IDH1 antibody binding in brain tumors. Brain Pathol 20 (1): 245-54, 2010.[PUBMED Abstract]
- 成人原発性CNS腫瘍に対する治療法選択肢の概要
-
原発性CNS腫瘍
このセクションでは、原発性中枢神経系(CNS)腫瘍に対する全般的な治療法を取り上げる。(それぞれの腫瘍型に対する特定の治療選択肢については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療に関するセクションを参照のこと。)
放射線療法と化学療法の選択肢は、CNS腫瘍の組織像および解剖学的部位によって異なる。膠芽腫に対しては、切除、放射線療法、および化学療法による集学的治療が標準である。CNSグリオーマで退形成性星細胞腫、退形成性乏突起膠腫、および退形成性乏突起星細胞腫が占める割合はごく少ない;そのため、一般的に、これらの腫瘍に限定した第III相ランダム化試験は実用的ではない。これらの腫瘍の自然経過はさまざまで、組織学的および分子的因子に依存する;そのため、新たな治療ガイドラインの発表が続いている。一部の患者では、高悪性度(悪性度IIIおよびIV)グリオーマの治療において、カルムスチンを注入したポリマーウエハを手術で埋め込み、術後に外照射療法(EBRT)を併用する治療により一定の効果がみられる場合がある。[ 1 ]
原発性CNS腫瘍に対する標準治療法の選択肢には以下のものがある:
- 手術。
- 放射線療法。
- 化学療法。
- 積極的サーベイランス。
- 支持療法。
手術
ほとんどの部位における大半の型のCNS腫瘍には、患者の神経機能を温存し基礎的な健康を害さないという制約下で、一般に外科的完全切除またはほぼ完全な外科的切除を試みる。この実践は、腫瘍を切除された患者では生検しか受けていない患者よりも生存が良好であったという観察研究による証拠に基づいている。[ 2 ][ 3 ]切除の有益性はランダム化試験で検証されていない。腫瘍切除の決定を導く患者の相違を調整する試みにもかかわらず、選択バイアスが観察研究に影響している可能性がある。したがって、根治的手術と生検単独との治療成績の実際の差は、レトロスペクティブ研究で指摘されているほど大きくはない可能性がある。[ 3 ]
切除の実施に対する例外は、臨床証拠に基づいて診断される橋グリオーマなどの深部腫瘍の症例であり、約50%において初期手術を実施せずに治療される。それでも、ほとんどの場合は生検による診断が望ましい。到達することも切除することも困難な病変には、定位生検を用いることができる。
外科的切除の主な目標には以下のものがある:[ 4 ]
手術単独による原発性悪性実質内腫瘍の完全除去を達成できることは、まれである。したがって、実用的になるべく多くの腫瘍を切除することと機能状態の維持との間で平衡を保つ術中の技術が開発されている。例えば、協力の意志を示す患者では原発性グリオーマの定位切除による開頭術を実施でき、患者の覚醒中にリアルタイムで神経機能が評価される。[ 5 ]術中の神経学的評価の例には以下のものがある:
実施される手技の数と術後死亡率が関連している他のいくつかの専門的な手術[ 7 ][ 8 ]と同様に、原発性脳腫瘍に対する手術の後の術後死亡率もまた病院および/または外科医の数量と関連している。[ 9 ]1988年から2000年のNationwide Inpatient Sampleの退院データベース(米国の非連邦病院への入院の20%を占める)から、研究者らは以下の点を明らかにした:[ 9 ]
病院や外科医の数と転帰の関連に関する他の研究と同様に、これらの結果は多変量調整を行っていても、紹介パターンや自家保険、患者の選択などの交絡因子が残存するため、結果には因果関係がない可能性がある。
放射線療法
高悪性度腫瘍
放射線療法は高悪性度グリオーマ患者の治療に重要な役割を担っている。
証拠(術後放射線療法[PORT]):
- PORTと放射線療法なしを比較した5件のランダム化試験(+ 誕生日で割り付けを行った1試験)の系統的レビューおよびメタアナリシスにより、放射線療法の統計的に有意な生存の優位性が示された(リスク比、0.81;95%CI、0.74-0.88)。[ 10 ][証拠レベル:1iiA]
- 60Gy(6週間かけて30分割)と45Gy(4週間かけて25分割)を比較したランダム化試験により、前者の群における生存期間が優れていたことが明らかになった(生存期間中央値12ヵ月 vs 9ヵ月;ハザード比[HR]、0.81;95%CI、0.66-0.99)。悪性グリオーマに対するEBRTで受け入れられる標準線量は60Gyである。[ 11 ][証拠レベル:1iiA]
三次元原体照射療法(3D-CRT)または強度変調放射線療法(IMRT)のいずれかを使用したEBRTは、放射線療法の送達の点で受け入れ可能な技術と考えられる。標的容積の計画を立てるために、典型的に用いられるマージンは、MRIに基づいた容積(T1強調およびfluid-attenuated inversion recovery [FLAIR])に対して2~3cmである。
線量漸増を用いる放射線手術では、転帰が改善されていない。標準のEBRTに追加するブースト照射として放射線手術を検討したランダム化試験があるが、この試験ではブースト照射なしのEBRTと比較して生存、生活の質、または再燃パターンに改善はみられなかった。[ 12 ][ 13 ]
正常な脳組織を傷つけず腫瘍に高線量の放射線を局所的に送達するために近接照射療法が用いられている。しかしながら、このアプローチは高度な技術を必要とし、3D-CRTおよびIMRTの登場により、あまり用いられなくなっている。
低悪性度腫瘍
低悪性度グリオーマ(すなわち、低悪性度星細胞腫、乏突起膠腫、混合乏突起星細胞腫)患者に対する治療法の選択肢は、高悪性度腫瘍の症例におけるほど明らかではなく、観察、PORT、テモゾロミドによる化学療法などがある。
証拠(PORT vs 観察):
- European Organisation for Research and Treatment of Cancer(EORTC)により、EORTC-22845(MRC BR04)試験で低悪性度グリオーマ患者311人が放射線施行群 vs 観察群にランダムに割り付けられた。[ 14 ][ 15 ]中央病理診断のレビューでは、この試験の約25%の患者が高悪性度腫瘍であることが報告された。対照群患者のほとんどが進行時に放射線療法を受けた。
証拠(少なくとも1つ以上の高リスクの特徴を示す世界保健機関(WHO)悪性度IIの低悪性度腫瘍を有する患者に対するPORT vs テモゾロミド):
-
EORTC 22033-26033[NCT00182819]試験では、低悪性度グリオーマ(WHO悪性度IIの星細胞腫、乏突起星細胞腫、または乏突起膠腫)で少なくとも1つ以上の高リスクの特徴(40歳を超える年齢、進行性疾患、5cmを超える腫瘍の大きさ、正中線を越えた腫瘍、または神経学的症状)を示す患者707人が、放射線療法(n = 240)またはテモゾロミド化学療法(n = 237)のいずれかを受けるようにランダムに割り付けられた。放射線療法は原体照射法(最大50.4Gy;1日1.8Gy、週5日、最大6.5週間の28回照射)で実施された。化学療法は投与間隔を狭めた(dose-dense)テモゾロミド経口投与(21日間、1日75mg/m2で、28日ごとに繰り返し[1サイクル]、最大12サイクルの投与)であった。[
16
][
17
]
- PFS(主要エンドポイント)または健康関連の生活の質(HR-QOL)(副次エンドポイント)における有意差は認められなかった。
- 追跡期間中央値48ヵ月(四分位範囲[IQR]、31-56)時点で、PFS期間中央値は、テモゾロミド群で39ヵ月(95%CI、35-44)および放射線療法群で46ヵ月(95%CI、40-56)(未調整のHR、1.16;95%CI、0.9-1.5;P = 0.22)であった。[ 16 ][証拠レベル:1iiDiii]
- 分子的に定義された318人の患者を対象にした1件の探索的解析において、1p/19qの両欠失が認められないイソクエン酸デヒドロゲナーゼ(IDH遺伝子)変異を有する患者は、放射線療法で治療された場合に有意に長期のPFS(HR、1.86;95%CI、1.21-2.87;ログランク、P = 0.0043)を示したことが明らかにされた。
- 1p/19qの両欠失が認められるIDH変異を有する患者とIDH野生型腫瘍を有する患者では、PFSにおける治療に依存した有意差は認められなかった。
- IDH野生型腫瘍を有する患者は、治療方法にかかわらず最も予後不良であった。
- 1p/19q両欠失が認められるIDH変異腫瘍患者は、最も予後良好であった。
- O6-メチルグアニン-DNAメチルトランスフェラーゼ(MGMT)プロモーター状態が、以下においてメチル化していた:
疾患の進行、二次腫瘍、または再発
疾患の進行後の反復放射線の役割、または放射線誘発性がんの発生について明らかにするためのランダム化試験は行われていない。文献は小規模のレトロスペクティブケースシリーズしかなく、解釈が困難である。[ 18 ]神経認知的障害および放射線誘発性壊死のリスクがあるため、反復放射線を使用する決定は慎重に下す必要がある。放射線手術の利点の1つは、以前に照射を受けた脳組織に対して耐線量の限界を超える再照射が必要と考えられる再発腫瘍で、治療線量を送達できることである。
化学療法
全身化学療法
ニトロソ尿素カルムスチン([bis-chloroethylnitrosourea] BCNU)は長年、Radiation Therapy Oncology Group(RTOG)のランダム化試験(RTOG-8302)に基づいて、悪性グリオーマに対する手術および放射線療法に追加する標準化学療法剤であった。[ 19 ][証拠レベル:1iiA]12件のランダム化試験の患者レベルのメタアナリシスでは、悪性グリオーマに対してニトロソ尿素を含む化学療法レジメンを使用した場合に生存に若干の影響が確認された(統合HR死亡、0.85;95%CI、0.78-0.91)。[ 20 ]
EORTC-カナダ国立がん研究所が膠芽腫患者を対象に実施した大規模多施設試験(NCT00006353)で、放射線療法へのテモゾロミドの追加による生存の優位性が報告された。[ 21 ][ 22 ][証拠レベル:1iiA]これらの結果に基づき、BCNUに代わって経口テモゾロミドが悪性グリオーマの標準全身化学療法になった。(詳しい情報については、本要約の膠芽腫の治療に関するセクションを参照のこと。)
高リスク、低悪性度(WHO悪性度II)グリオーマ[ 23 ][証拠レベル:1iiA]および退形成型(WHO悪性度III)乏突起膠細胞腫瘍[ 24 ][ 25 ][証拠レベル:1iiA]に対するランダム化試験の長期成績は、手術後の放射線療法に対するプロカルバジン、ロムスチン(CCNU)、およびビンクリスチン(PCV)化学療法の追加が生存期間を延長することを明らかにしている。放射線およびPCV化学療法は治療に適しているとみなされる患者に対して検討すべきである。(詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療のセクションを参照のこと。)
局所化学療法(カルムスチンウエハ)
悪性グリオーマ関連死亡は、ほとんど常に、遠隔転移の結果ではなく頭蓋内病変の制御不能の結果であるため、全身への毒性作用を回避しながら大量の化学療法を送達するという発想は魅力的である。生分解性のカルムスチンウエハがこの目的で開発されている。ウエハは3.85%のカルムスチンを含有しており、開頭切除術時に腫瘍床の内層に最大で8個のウエハが埋め込まれ、2~3週間かけてウエハ1個当たり約7.7mgの総用量(患者1人当たり最大61.6mg)が意図される。
この局所への薬物送達方法に関する2件のランダム化プラセボ対照試験では、放射線療法単独に対してカルムスチンウエハに伴うOSの優位性が示されている。両試験で、年齢の上限は65歳であった。
証拠(カルムスチンウエハ):
- 1件の小規模な試験で、高悪性度グリオーマ患者32人が登録された後にカルムスチンウエハの継続的な利用に不足が生じたため、この試験は中止された。[ 26 ]
- 原発性悪性グリオーマ患者240人を対象とし、そのうち207人に膠芽腫を認めた1件の多施設研究では、より有益な情報が得られた。[ 27 ][ 28 ]患者は、初回手術時にカルムスチンウエハまたはプラセボウエハを埋め込まれ、その後に放射線療法(55~60Gy)を受けた。全身療法は退形成性乏突起膠腫の症例(n = 9)を除いて、再発まで許可されなかった。最初の試験とは異なり、患者の特徴は研究群間で十分に均衡がとられた。
- 両研究を統合した系統的レビューにより、[ 26 ][ 27 ][ 28 ]全死亡のHRは0.65;95%CI、0.48-0.86;P = 0.003と推定された。[ 29 ][証拠レベル:1iA]
積極的サーベイランス
場合によっては積極的サーベイランスが適切である。感度の高い神経画像ツールの使用が増えるにつれて、無症状の低悪性度髄膜腫の発見が増加しつつある;大多数は増殖がわずかなようであり、しばしば安全に経過観察可能であるため、腫瘍の成長が検出されるか、症状が現れるまで治療が延期される。[ 30 ][ 31 ]
支持療法
デキサメタゾン、マンニトール、およびフロセミドは、脳腫瘍に関連した腫瘍周囲の浮腫の治療に使用される。抗痙攣薬の使用は、痙攣発作がみられる患者に必須である。[ 4 ]
参考文献- Lallana EC, Abrey LE: Update on the therapeutic approaches to brain tumors. Expert Rev Anticancer Ther 3 (5): 655-70, 2003.[PUBMED Abstract]
- Laws ER, Parney IF, Huang W, et al.: Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg 99 (3): 467-73, 2003.[PUBMED Abstract]
- Chang SM, Parney IF, Huang W, et al.: Patterns of care for adults with newly diagnosed malignant glioma. JAMA 293 (5): 557-64, 2005.[PUBMED Abstract]
- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. Philadelphia, Pa: WB Saunders Co, 2001, pp 1106-42.[PUBMED Abstract]
- Meyer FB, Bates LM, Goerss SJ, et al.: Awake craniotomy for aggressive resection of primary gliomas located in eloquent brain. Mayo Clin Proc 76 (7): 677-87, 2001.[PUBMED Abstract]
- Sanai N, Mirzadeh Z, Berger MS: Functional outcome after language mapping for glioma resection. N Engl J Med 358 (1): 18-27, 2008.[PUBMED Abstract]
- Begg CB, Cramer LD, Hoskins WJ, et al.: Impact of hospital volume on operative mortality for major cancer surgery. JAMA 280 (20): 1747-51, 1998.[PUBMED Abstract]
- Birkmeyer JD, Finlayson EV, Birkmeyer CM: Volume standards for high-risk surgical procedures: potential benefits of the Leapfrog initiative. Surgery 130 (3): 415-22, 2001.[PUBMED Abstract]
- Barker FG, Curry WT, Carter BS: Surgery for primary supratentorial brain tumors in the United States, 1988 to 2000: the effect of provider caseload and centralization of care. Neuro Oncol 7 (1): 49-63, 2005.[PUBMED Abstract]
- Laperriere N, Zuraw L, Cairncross G, et al.: Radiotherapy for newly diagnosed malignant glioma in adults: a systematic review. Radiother Oncol 64 (3): 259-73, 2002.[PUBMED Abstract]
- Bleehen NM, Stenning SP: A Medical Research Council trial of two radiotherapy doses in the treatment of grades 3 and 4 astrocytoma. The Medical Research Council Brain Tumour Working Party. Br J Cancer 64 (4): 769-74, 1991.[PUBMED Abstract]
- Tsao MN, Mehta MP, Whelan TJ, et al.: The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for malignant glioma. Int J Radiat Oncol Biol Phys 63 (1): 47-55, 2005.[PUBMED Abstract]
- Souhami L, Seiferheld W, Brachman D, et al.: Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys 60 (3): 853-60, 2004.[PUBMED Abstract]
- Karim AB, Afra D, Cornu P, et al.: Randomized trial on the efficacy of radiotherapy for cerebral low-grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int J Radiat Oncol Biol Phys 52 (2): 316-24, 2002.[PUBMED Abstract]
- van den Bent MJ, Afra D, de Witte O, et al.: Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 366 (9490): 985-90, 2005.[PUBMED Abstract]
- Baumert BG, Hegi ME, van den Bent MJ, et al.: Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1521-1532, 2016.[PUBMED Abstract]
- Reijneveld JC, Taphoorn MJ, Coens C, et al.: Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 17 (11): 1533-1542, 2016.[PUBMED Abstract]
- Paulino AC, Mai WY, Chintagumpala M, et al.: Radiation-induced malignant gliomas: is there a role for reirradiation? Int J Radiat Oncol Biol Phys 71 (5): 1381-7, 2008.[PUBMED Abstract]
- Walker MD, Green SB, Byar DP, et al.: Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery. N Engl J Med 303 (23): 1323-9, 1980.[PUBMED Abstract]
- Stewart LA: Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials. Lancet 359 (9311): 1011-8, 2002.[PUBMED Abstract]
- Stupp R, Mason WP, van den Bent MJ, et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352 (10): 987-96, 2005.[PUBMED Abstract]
- Stupp R, Hegi ME, Mason WP, et al.: Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 10 (5): 459-66, 2009.[PUBMED Abstract]
- Buckner JC, Pugh SL, Shaw EG, et al.: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG, and SWOG. [Abstract] J Clin Oncol 32 (Suppl 5): A-2000, 2014.[PUBMED Abstract]
- van den Bent MJ, Brandes AA, Taphoorn MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31 (3): 344-50, 2013.[PUBMED Abstract]
- Cairncross G, Wang M, Shaw E, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31 (3): 337-43, 2013.[PUBMED Abstract]
- Valtonen S, Timonen U, Toivanen P, et al.: Interstitial chemotherapy with carmustine-loaded polymers for high-grade gliomas: a randomized double-blind study. Neurosurgery 41 (1): 44-8; discussion 48-9, 1997.[PUBMED Abstract]
- Westphal M, Hilt DC, Bortey E, et al.: A phase 3 trial of local chemotherapy with biodegradable carmustine (BCNU) wafers (Gliadel wafers) in patients with primary malignant glioma. Neuro-oncol 5 (2): 79-88, 2003.[PUBMED Abstract]
- Westphal M, Ram Z, Riddle V, et al.: Gliadel wafer in initial surgery for malignant glioma: long-term follow-up of a multicenter controlled trial. Acta Neurochir (Wien) 148 (3): 269-75; discussion 275, 2006.[PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008.[PUBMED Abstract]
- Nakamura M, Roser F, Michel J, et al.: The natural history of incidental meningiomas. Neurosurgery 53 (1): 62-70; discussion 70-1, 2003.[PUBMED Abstract]
- Yano S, Kuratsu J; Kumamoto Brain Tumor Research Group: Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg 105 (4): 538-43, 2006.[PUBMED Abstract]
- 腫瘍型別の原発性中枢神経系腫瘍の治療
-
表2.腫瘍型別の原発性中枢神経系腫瘍の治療 腫瘍型 標準治療法の選択肢 星細胞腫 —脳幹グリオーマ 放射線療法 —松果体星細胞腫瘍 手術 + 放射線療法 より悪性度の高い腫瘍には、手術 + 放射線療法および化学療法 —毛様細胞性星細胞腫 手術単独 手術とその後の放射線療法 —びまん性星細胞腫(WHO悪性度II) 手術と場合により放射線療法 手術とその後の放射線療法および化学療法 —退形成性星細胞腫(WHO悪性度III) 手術 + 放射線療法と場合により化学療法 手術 + 化学療法 —膠芽腫 手術 + 放射線療法および化学療法 手術 + 放射線療法 カルムスチンを注入したポリマーの埋め込み 放射線療法および同時化学療法 乏突起膠細胞腫瘍 —乏突起膠腫 手術と場合により放射線療法 手術と放射線療法および化学療法 —退形成性乏突起膠腫 手術 + 放射線療法と場合により化学療法 混合型グリオーマ 手術 + 放射線療法と場合により化学療法 上衣腫瘍 —悪性度IおよびIIの上衣腫瘍 手術単独 手術とその後の放射線療法 —退形成性上衣腫 手術 + 放射線療法 胎児性腫瘍 —髄芽腫 手術 + 頭蓋脊髄放射線療法 松果体実質細胞腫瘍 手術 + 放射線療法(松果体細胞腫) 手術 + 放射線療法および化学療法(松果体芽細胞腫) 髄膜腫瘍 —悪性度Iの髄膜腫 積極的サーベイランスと治療の延期 手術 定位放射線手術 手術 + 放射線療法 分割放射線療法 —悪性度IIおよびIIIの髄膜腫および血管外皮腫 手術 + 放射線療法 胚細胞腫瘍 多数の要因に応じて治療を決定 トルコ鞍部の腫瘍 —頭蓋咽頭腫 手術単独 腫瘍減量術 + 放射線療法 星細胞腫の治療
脳幹グリオーマの治療
脳幹グリオーマ患者の予後は比較的不良で、組織型(生検を実施している場合)、腫瘍部位、および腫瘍進展度との相関が認められる。複数の研究における患者の全生存期間中央値は44~74週となっている。
脳幹グリオーマに対する標準治療法の選択肢には以下のものがある:
- 放射線療法。
松果体星細胞腫瘍の治療
退形成性の程度に応じて、松果体星細胞腫の患者の予後はさまざまである。高悪性度腫瘍の患者では、予後がさらに不良になる。
松果体星細胞腫に対する標準治療法の選択肢には以下のものがある:
- 松果体星細胞腫には、手術 + 放射線療法。
- より悪性度の高い腫瘍には、手術 + 放射線療法および化学療法。
毛様細胞性星細胞腫の治療
この星細胞腫は、世界保健機関(WHO)悪性度Iの腫瘍として分類されており、しばしば治癒可能である。
毛様細胞性星細胞腫に対する標準治療法の選択肢には以下のものがある:
- 腫瘍をすべて切除できる場合、手術のみでよい。
- 残存腫瘍の存在が分かっている場合、または疑われる場合は手術後に放射線療法を実施する。
びまん性星細胞腫の治療
このWHO悪性度IIの星細胞腫は、毛様細胞性星細胞腫より治癒率が低いことが多い。
びまん性星細胞腫(WHO悪性度II)に対する標準治療法の選択肢には以下のものがある:
- 手術と場合により放射線療法。
- 手術とその後の放射線療法および化学療法。
手術後に放射線療法を施行する時期については、議論が続いている。(詳しい情報については、本要約の成人中枢神経系腫瘍に対する治療法選択肢の概要セクション内、放射線療法セクションの低悪性度腫瘍を参照のこと。)
一部の医師は、年齢が40歳未満でCTスキャンで造影が認められないなど、患者が低リスクと考えられる臨床的因子を有している場合に、手術を単独で施行する。[ 2 ]
証拠(手術とその後の放射線療法および化学療法):
- 1986年にRadiation Therapy Oncology Group(RTOG)が開始したランダム化試験(RTOG 9802[NCT00003375])の長期追跡結果に基づいて、低悪性度(WHO悪性度II)腫瘍を有し高リスクと考えられる患者には、放射線療法とその後のビンクリスチン(PCV)化学療法6サイクルの施行が治療選択肢として推奨される。[
3
][証拠レベル:1iiA]この試験では、高リスクで低悪性度のグリオーマ患者、具体的には生検あるいは亜全摘術を受けた18~39歳の患者か、または40歳以上の患者が、54Gyの放射線療法または放射線療法とその後のPCV化学療法6サイクルのいずれかにランダムに割り付けられた。
- 放射線療法にPCVを追加すると、PFS中央値が4.0年から10.4年に延長し(P = 0.002;ハザード比[HR]、0.50)、OS中央値が7.8年から13.3年に延長した(P = 0.03;HR、0.59)。
- 特に留意すべきことに、RTOG 9802研究には、星細胞腫、乏突起膠腫、混合型乏突起星細胞腫など、さまざまな腫瘍の患者が登録されていた。
びまん性グリオーマにおけるイソクエン酸デヒドロゲナーゼ(IDH)1およびIDH2の突然変異の発見は、高リスクと考えられる患者の特定に大きく寄与してきた。いくつもの大規模なレトロスペクティブ研究により、IDH1およびIDH2突然変異が生存の改善に関する強力な独立予後因子であることが実証されている。[ 5 ][ 6 ][ 7 ][ 8 ][ 9 ]WHO悪性度IIおよびIIIのグリオーマの大半にはIDH1およびIDH2の突然変異がみられるため、[ 6 ][ 10 ][ 11 ]IDH1およびIDH2突然変異の存在は高リスクの評価に含めるべきである。RTOG 9802試験から得られる分子的相関データは、PCVの追加から最も利益を得る患者に関して示唆的であると考えられるが、現時点では報告が行われていない。
退形成性星細胞腫の治療
退形成性星細胞腫(WHO悪性度III)の患者では、標準的局所療法による治癒率が低い。
退形成性星細胞腫に対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法と場合により化学療法。
- 手術 + 化学療法。
退形成性星細胞腫のサブセットは侵攻性である;これらの腫瘍は多くの場合、膠芽腫と同じく、手術および放射線、さらにしばしば化学療法を併用して管理する。しかし、これらの腫瘍に対する至適治療法は確立されていない。退形成性グリオーマの患者に限定した第III相ランダム化試験(NCT00626990およびNCT00887146)は、現在患者の登録中である;しかし、有効性データは利用できない。化学療法による治療を受けた膠芽腫患者の生存改善を退形成性星細胞腫の患者に外挿できるかどうかは不明である。
IDH1およびIDH2の突然変異は退形成性星細胞腫の50~70%でみられ、独立して生存の有意な改善に関連する。[ 6 ][ 9 ]IDH1およびIDH2突然変異状態の評価は、治療選択肢に関する決定の指針になりうる。
証拠(手術 + 放射線療法または化学療法):
- 退形成性グリオーマ患者(すなわち、星細胞腫144人、乏突起星細胞腫91人、および乏突起膠腫39人)において術後放射線療法単独が、術後化学療法単独と比較されており、腫瘍進行時にはもう一方の治療法にクロスオーバーされる。139人の患者が放射線療法の施行群にランダムに割り付けられ、残りの135人がPCVまたは単剤のテモゾロミドのいずれかによる32週間コースの化学療法群にランダムに割り付けられた(2:1:1のランダム化)。[ 12 ][証拠レベル:1iiAおよび1iiD]
退形成性星細胞腫の患者は、標準治療法に新しい治療法を追加することにより、局所制御の改善を図る臨床試験に適している。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
膠芽腫の治療
膠芽腫(WHO悪性度IV)患者では、標準的局所療法を用いても治癒率はきわめて低い。
O6-メチルグアニン-DNAメチルトランスフェラーゼ(MGMT)DNA修復酵素遺伝子のプロモーターのメチル化は、新たに診断された膠芽腫における生存の改善に関する独立予後因子である。[ 13 ][ 14 ]MGMTプロモーターメチル化とそれに伴うDNA修復酵素の不活性は、テモゾロミド化学療法に対する反応も予測しうる。[ 13 ]ただし、MGMTプロモーターメチル化が予測マーカーであることを示す臨床データはそれほど確かなものではない。(RTOG-0525[NCT00304031]試験に関する詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクション内、星細胞腫の治療セクションの膠芽腫の治療を参照のこと。)
新規に診断された膠芽腫患者に対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法および化学療法。
- 手術 + 放射線療法。
- カルムスチンを注入したポリマーを最初の手術中に埋め込む。
- 放射線療法および同時化学療法。
新たに膠芽腫と診断された患者に対する標準治療法は、手術の後に放射線療法とテモゾロミド連日投与を同時に施行し、その後にテモゾロミドによる治療を6サイクル続ける方法である。放射線療法とテモゾロミドにベバシズマブを追加しても、OSは改善されなかった。
証拠(手術 + 放射線療法および化学療法):
- 標準治療法は、EORTCおよびNational Cancer Institute of Canada(NCIC)が実施した大規模な多施設共同ランダム化試験(NCT00006353)に基づいている。この試験では、放射線療法単独との比較で、放射線療法とテモゾロミドの同時併用の生存利益が報告された。[
15
][
16
][証拠レベル:1iiA]この研究では、膠芽腫患者573人が腫瘍容積に2~3cmのマージンを加えて照射する標準の放射線単独(60Gy、6週間かけて1回2Gyの分割照射)またはテモゾロミド(放射線療法中は1日当たり75mg/m2を最大49日間経口投与、続いて4週間休薬した後、28日ごとに5日間連日投与を初回サイクルは150mg/m2の用量で、その後200mg/m2に増量して最大6サイクルの投与)との併用を受ける群にランダムに割り付けられた。
- 放射線療法-テモゾロミド併用群ではOSが統計的に有意に優れていた(HR死亡、0.6;95%信頼区間[CI]、0.5-0.7;3年OSは放射線療法-テモゾロミド群で16.0% vs 放射線療法単独群で4.4%)。
- EORTC-NCIC試験に対するコンパニオン分子相関サブセット研究により、プロモーターDNAメチル化によるMGMT DNA修復遺伝子のエピジェネティックサイレンシングは、新たに膠芽腫と診断された患者のOS延長に関係しているという強いエビデンスが得られた。[ 13 ]
- 新たに膠芽腫と診断された患者を対象に長期にわたる(投与間隔を短縮した)テモゾロミド投与により治療反応が増強されるかどうかを検証するために、RTOG、EORTC、およびNorth Central Cancer Therapy Groupが実施した多施設共同ランダム化第III相試験RTOG 0525(NCT00304031)において、標準補助テモゾロミド治療(28日サイクルの1~5日目に投与)と投与間隔短縮スケジュール(28日サイクルの1~21日目に投与)が比較された。すべての患者が手術を受けた後に、放射線療法と同時にテモゾロミドを毎日投与する治療を受けた。その後、患者は標準補助テモゾロミド群または投与間隔短縮テモゾロミド群のいずれかにランダムに割り付けられた。[ 14 ][証拠レベル:1iiA]
証拠(手術および化学放射線と場合によりベバシズマブ):
2013年に、新たに膠芽腫と診断された患者を対象にベバシズマブを検討した次の2件の多施設共同第III相ランダム化二重盲検プラセボ対照試験から、最終データが報告された:RTOG 0825(NCT00884741)およびRoche社が治験依頼者となったAVAglio(NCT00943826)。[ 17 ][ 18 ][証拠レベル:1iA]ベバシズマブはどちらの試験でもOSを改善しなかった。
両試験では顕著なクロスオーバーがみられた。RTOG 0825の約40%の患者およびAVAglioの約30%の患者が、病勢進行の最初の徴候がみられた時点でベバシズマブ治療を受けた。
- RTOG 0825(NCT00884741):患者は標準治療(テモゾロミドを用いた化学放射線療法)または標準治療 + ベバシズマブのいずれかにランダムに割り付けられた。OSおよびPFSが複合主要エンドポイントであった。[ 17 ][証拠レベル:1iA]
- AVAglio(NCT00943826):患者は標準治療(テモゾロミドを用いた化学放射線療法)または標準治療 + ベバシズマブのいずれかにランダムに割り付けられた。OSおよびPFSが複合主要エンドポイントであった。[ 18 ][証拠レベル:1iA]
この2件の試験は、健康関連の生活の質(HRQoL)および神経認知的転帰判定で相反する結果となった。AVAglio試験で必須のHRQoL評価では、ベバシズマブ治療患者にHRQoLの改善が認められたが、任意であったRTOG 0825研究におけるベバシズマブ治療患者では、患者報告のHRQoLおよび神経認知的機能により大きな低下が示された。このような相違の原因は不明である。
これらの結果を基にすれば、新たに膠芽腫と診断されたすべての患者にとって標準治療へのベバシズマブの追加が有益なことを示す確定的な証拠はない。特定のサブグループがベバシズマブ追加により利益を得る可能性はあるが、まだ明確にはなっていない。
膠芽腫患者は、標準治療法に新しい治療法を追加することにより、局所制御の改善を図る臨床試験に適している。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
乏突起膠細胞腫瘍の治療
乏突起膠腫の治療
乏突起膠腫(WHO悪性度II)の患者は、びまん性星細胞腫の患者より予後がおおむね良好である。特に、1p/19q両欠失を認める乏突起膠腫患者は、はるかに生存期間が長い。[ 3 ]乏突起膠腫のほとんどはやがて進行する。
乏突起膠腫に対する標準治療法の選択肢には以下のものがある:
- 手術と場合により放射線療法。
- 手術と放射線療法および化学療法。
手術後に放射線療法を施行する時期については、議論が続いている。低悪性度のグリオーマを有し、手術を受けた患者300人を対象とした研究(EORTC-22845)で、放射線療法または注意深い経過観察のいずれかに患者をランダムに割り付けたところ、2群間でOSに差はみられなかった。[ 1 ][証拠レベル:1iiA](詳しい情報については、本要約の成人中枢神経系腫瘍に対する治療法選択肢の概要セクション内、放射線療法セクションの低悪性度腫瘍を参照のこと。)
高リスクと考えられる低悪性度(WHO悪性度II)腫瘍に対しては、高リスク低悪性度グリオーマに関するランダム化試験であるRTOG 9802の長期追跡結果に基づいて、放射線療法とその後のPCV化学療法6サイクルが推奨される治療選択肢である。[ 3 ][証拠レベル:1iiA](詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクション内、星細胞腫の治療セクションのびまん性星細胞腫の治療を参照のこと。)
特に留意すべきことに、RTOG 9802研究には、星細胞腫、乏突起膠腫、混合型乏突起星細胞腫などの多様な腫瘍を有する患者が登録されていた;レトロスペクティブなサブセット解析では、乏突起膠細胞腫瘍のみがPCVの追加の恩恵を被るようであった。[ 4 ](詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクション内、星細胞腫の治療セクションのびまん性星細胞腫の治療を参照のこと。)
びまん性グリオーマにおける生存を有意に改善する独立した予後因子であるIDH1およびIDH2の突然変異の発見は、高リスクと考えられる患者の特定に大きく寄与してきた。(詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクション内、星細胞腫の治療セクションのびまん性星細胞腫の治療を参照のこと。)加えて、WHO悪性度IIの乏突起膠腫には高い割合で1p/19qの両欠失が認められ、これは生存の改善に関する強力な予後因子である。[ 19 ][ 20 ][ 21 ]したがって、IDH1およびIDH2の突然変異と、1p/19qの両欠失の存在は、高リスク患者の評価に含めるべきである。RTOG 9802試験から得られる分子的相関データは、PCVの追加から最も利益を得る患者に関して示唆的であると考えられるが、現時点では報告が行われていない。
退形成性乏突起膠腫の治療
退形成性乏突起膠腫(WHO悪性度III)の患者では、標準的局所療法による治癒率が低いが、予後は退形成性星細胞腫の患者よりおおむね良好である。1p/19qの両欠失を示す患者では、予後が特に良好であり、この変異はこれらの腫瘍の大半に生じる。退形成性グリオーマの患者に限定した第III相ランダム化試験(NCT00626990およびNCT00887146)は、現在患者の登録中である;しかしながら、有効性データはまだ利用できない。(詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクション内、星細胞腫の治療セクションの退形成性星細胞腫の治療を参照のこと。)このような患者は、新しい治療法を追加することにより、局所制御の改善を図る臨床試験に適している。
現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
退形成性乏突起膠腫に対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法と場合により化学療法。[ 22 ]
証拠(手術とその後の放射線療法、場合により化学療法):
- EORTCの第III相ランダム化研究であるBrain Tumor Group Study 26951(NCT00002840)から得られた追跡期間11.7年の成熟した結果により、退形成性乏突起膠細胞腫瘍の患者において、放射線療法後の6サイクルの補助PCV化学療法では、放射線療法単独と比較してOSおよびPFSが延長することが実証された。[ 23 ][証拠レベル:1iiA]
- 対照的に、RTOGの試験(RTOG-9402 [NCT00002569])では、8週間の強化PCV化学療法レジメンと直後の浸潤領域プラス放射線療法を受けた治療群と放射線療法単独の治療群の間で生存中央値に差がみられなかった。[ 24 ]
- 退形成性グリオーマ患者(星細胞腫144人、乏突起星細胞腫91人、および乏突起膠腫39人を含む)において術後放射線療法単独が、術後化学療法単独と比較されており、腫瘍進行時にはもう一方の治療法にクロスオーバーされる。139人の患者が放射線療法の施行群にランダムに割り付けられ、残りの135人がPCVまたは単剤のテモゾロミドのいずれかによる32週間コースの化学療法群にランダムに割り付けられた(2:1:1のランダム化)。[ 12 ][証拠レベル:1iiAおよび1iiD]
これらのデータに基づいて、1p/19q両欠失の退形成性乏突起膠細胞腫患者では、放射線療法単独はもはや十分な治療とは考えられないため、放射線療法単独(対照群)、テモゾロミドと放射線療法の併用、およびテモゾロミド単独(探索群)に患者をランダムに割り付けたCODEL(NCT00887146)研究は中止された。[ 25 ]形成性乏突起膠細胞腫におけるテモゾロミドとPCV化学療法は比較されていないが、悪性度3の退形成性グリオーマの設定では、PCV化学療法とテモゾロミドの間に生存差はみられなかった。[ 12 ][ 26 ]
放射線と化学療法の併用が逐次併用療法よりも治療成績が優れていることは示されていない。
退形成性乏突起膠腫には高い割合でIDH1およびIDH2突然変異と1p/19q両欠失が認められ、これらはいずれも生存改善の強力な予後因子である。(詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療内、星細胞腫の治療セクションのびまん性星細胞腫の治療を参照のこと。)[ 23 ][ 24 ]加えてPCV化学療法は、前述の第III相試験のレトロスペクティブ解析で予測的であることが示されている。したがって、これらの分子マーカーの評価は退形成性乏突起膠腫に対する管理法の意思決定を支援する可能性がある。
混合型グリオーマの治療
乏突起星細胞腫(WHO悪性度II)および退形成性乏突起星細胞腫(WHO悪性度III)を含む混合グリオーマの患者の予後は、IDH1遺伝子とIDH2遺伝子、および1p/19q染色体の状態に基づいて、大きなばらつきがある。[ 27 ][ 28 ][ 29 ]したがって、グループとしてのこれらの腫瘍に対する至適治療法は定まっていない。腫瘍のサブセットはWHO悪性度IIIの星細胞腫またはWHO悪性度IVの膠芽腫に類似した転帰をたどることがあるため、星細胞腫の場合と同様に治療されることが多い。これらの既知の強力な予後分子マーカーに対する検査を実施すべきであり、この検査はリスク評価と後続する管理の参考になりうる。
混合グリオーマに対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法と場合により化学療法。
(星細胞腫に関する詳しい情報については、本要約の腫瘍型別の原発性中枢神経系腫瘍の治療セクションの星細胞腫セクションを参照のこと。)
上衣腫瘍の治療
上衣腫瘍(WHO悪性度I)と上衣腫(WHO悪性度II)、すなわち、上衣下腫および粘液乳頭状上衣腫は、しばしば治癒可能である。
悪性度IおよびIIの上衣腫瘍に対する標準治療法の選択肢には以下のものがある:
- 腫瘍をすべて切除できる場合、手術のみでよい。
- 残存腫瘍の存在が分かっている場合、または疑われる場合は手術後に放射線療法を実施する。
退形成性上衣腫(WHO悪性度III)患者の予後はさまざまで、腫瘍部位および腫瘍進展度に依存する。必ずというわけではないが、退形成性上衣腫の患者は、悪性度がより低い上衣腫瘍の患者より予後不良であることが多い。
退形成性上衣腫に対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法。[ 30 ]
胎児性腫瘍(髄芽腫)の治療
髄芽腫は主に小児に発生するが、成人に生じることもある。[ 31 ](詳しい情報については、小児髄芽腫およびその他の中枢神経系胚芽腫の治療に関するPDQ要約を参照のこと。)
髄芽腫に対する標準治療法の選択肢には以下のものがある:
- 予後良好な患者には手術 + 頭蓋脊髄放射線療法。[ 32 ]
臨床評価段階にある髄芽腫の治療選択肢
臨床評価段階にある治療法の選択肢には以下のものがある:
- 予後不良な患者に対して手術 + 頭蓋脊髄放射線療法、およびさまざまな化学療法レジメンが評価されている。[ 32 ]
松果体実質細胞腫瘍の治療
松果体細胞腫(WHO悪性度II)、松果体芽細胞腫(WHO悪性度IV)、および中間的な分化を示す松果体実質細胞腫瘍は、特別な配慮を要する多様な腫瘍である。松果体細胞腫は緩徐に増殖する腫瘍で、予後は多様である。
松果体芽細胞腫はより急速に増殖する腫瘍で、これらの腫瘍の患者は予後不良である。中間的な分化を示す松果体実質細胞腫瘍の増殖と臨床的行動は予測不可能である。
松果体実質細胞腫瘍に対する標準治療法の選択肢には以下のものがある:
髄膜腫瘍の治療
切除可能であれば、WHO悪性度Iの髄膜腫は一般に治癒可能である。感度の高い神経画像ツールの使用が増えるにつれて、無症状の低悪性度髄膜腫の発見が増加しつつある。ほとんどは増殖がわずかなようであり、しばしば安全に経過観察可能であるため、腫瘍が成長するか、症状が現れるまで治療が延期される。[ 33 ][ 34 ]
髄膜腫瘍に対する標準治療法の選択肢には以下のものがある:
- 特に偶然発見された無症状の腫瘍に対しては、治療を延期する積極的サーベイランス。[ 33 ][ 34 ]
- 手術。
- 3cm未満の腫瘍に対する定位放射線手術。
- 残存腫瘍の存在が分かっている場合または疑われる患者、または以前の手術後の再発を認める患者などの選択された症例においては、手術 + 放射線療法。
- 腫瘍が切除不能な患者に対する分割放射線療法。[ 35 ]
WHO悪性度IIの髄膜腫(非定型、明細胞性、脊索腫様)、WHO悪性度IIIの髄膜腫(退形成性/悪性、ラブドイド、乳頭状)、および血管外皮腫は、完全切除できることが少なく、増殖能が大きいため、これらの患者の予後は低悪性度の髄膜腫患者より不良である。
悪性度IIおよびIIIの髄膜腫および血管外皮腫に対する標準治療法の選択肢には以下のものがある:
- 手術 + 放射線療法。
胚細胞腫瘍の治療
胚細胞腫瘍 - 胚細胞腫、胎児性がん、絨毛がん、および奇形腫を含む - 患者の予後および治療は、腫瘍の組織型、腫瘍部位、生物学的マーカーの有無および量、外科的切除可能性に依存する。
トルコ鞍部の腫瘍の治療
頭蓋咽頭腫(WHO悪性度I)は、治癒可能な場合が多い。
頭蓋咽頭腫に対する標準治療法の選択肢には以下のものがある:
- 腫瘍をすべて切除できる場合、手術のみでよい。
- 腫瘍が切除不能であれば減量手術 + 放射線療法。
原発性CNS腫瘍に対して臨床評価段階にある治療法の選択肢
治癒可能であることがまれなCNS腫瘍または切除不能なCNS腫瘍の患者は、臨床試験に組み入れることを検討すべきである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
陽子線治療などの重粒子線は、理論的に周囲の脳組織を傷つけず腫瘍床に高線量の電離放射線を送達する利点を有する。この研究段階の技術に関するデータは予備的で、広範な利用はできない。
CNS腫瘍患者に対して臨床評価段階にある新たな生物学的治療には以下のものがある:[ 36 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- van den Bent MJ, Afra D, de Witte O, et al.: Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 366 (9490): 985-90, 2005.[PUBMED Abstract]
- Kaye AH, Walker DG: Low grade astrocytomas: controversies in management. J Clin Neurosci 7 (6): 475-83, 2000.[PUBMED Abstract]
- Buckner JC, Pugh SL, Shaw EG, et al.: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: RTOG 9802 with Alliance, ECOG, and SWOG. [Abstract] J Clin Oncol 32 (Suppl 5): A-2000, 2014.[PUBMED Abstract]
- Buckner JC, Shaw E, Pugh S, et al.: R9802: Phase III study of radiation therapy with or without procarbazine, CCNU, and vincristine (PCV) in low-grade glioma: Results by histologic type. [Abstract] Neuro-Oncology 16 (Suppl 5): A-AT-13, v11, 2014.[PUBMED Abstract]
- Parsons DW, Jones S, Zhang X, et al.: An integrated genomic analysis of human glioblastoma multiforme. Science 321 (5897): 1807-12, 2008.[PUBMED Abstract]
- Yan H, Parsons DW, Jin G, et al.: IDH1 and IDH2 mutations in gliomas. N Engl J Med 360 (8): 765-73, 2009.[PUBMED Abstract]
- Dubbink HJ, Taal W, van Marion R, et al.: IDH1 mutations in low-grade astrocytomas predict survival but not response to temozolomide. Neurology 73 (21): 1792-5, 2009.[PUBMED Abstract]
- Sanson M, Marie Y, Paris S, et al.: Isocitrate dehydrogenase 1 codon 132 mutation is an important prognostic biomarker in gliomas. J Clin Oncol 27 (25): 4150-4, 2009.[PUBMED Abstract]
- Hartmann C, Hentschel B, Wick W, et al.: Patients with IDH1 wild type anaplastic astrocytomas exhibit worse prognosis than IDH1-mutated glioblastomas, and IDH1 mutation status accounts for the unfavorable prognostic effect of higher age: implications for classification of gliomas. Acta Neuropathol 120 (6): 707-18, 2010.[PUBMED Abstract]
- Hartmann C, Meyer J, Balss J, et al.: Type and frequency of IDH1 and IDH2 mutations are related to astrocytic and oligodendroglial differentiation and age: a study of 1,010 diffuse gliomas. Acta Neuropathol 118 (4): 469-74, 2009.[PUBMED Abstract]
- Watanabe T, Nobusawa S, Kleihues P, et al.: IDH1 mutations are early events in the development of astrocytomas and oligodendrogliomas. Am J Pathol 174 (4): 1149-53, 2009.[PUBMED Abstract]
- Wick W, Hartmann C, Engel C, et al.: NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 27 (35): 5874-80, 2009.[PUBMED Abstract]
- Hegi ME, Diserens AC, Gorlia T, et al.: MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 352 (10): 997-1003, 2005.[PUBMED Abstract]
- Gilbert MR, Wang M, Aldape KD, et al.: Dose-dense temozolomide for newly diagnosed glioblastoma: a randomized phase III clinical trial. J Clin Oncol 31 (32): 4085-91, 2013.[PUBMED Abstract]
- Stupp R, Mason WP, van den Bent MJ, et al.: Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 352 (10): 987-96, 2005.[PUBMED Abstract]
- Stupp R, Hegi ME, Mason WP, et al.: Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial. Lancet Oncol 10 (5): 459-66, 2009.[PUBMED Abstract]
- Gilbert MR, Dignam JJ, Armstrong TS, et al.: A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med 370 (8): 699-708, 2014.[PUBMED Abstract]
- Chinot OL, Wick W, Mason W, et al.: Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med 370 (8): 709-22, 2014.[PUBMED Abstract]
- Fallon KB, Palmer CA, Roth KA, et al.: Prognostic value of 1p, 19q, 9p, 10q, and EGFR-FISH analyses in recurrent oligodendrogliomas. J Neuropathol Exp Neurol 63 (4): 314-22, 2004.[PUBMED Abstract]
- Smith JS, Perry A, Borell TJ, et al.: Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas, astrocytomas, and mixed oligoastrocytomas. J Clin Oncol 18 (3): 636-45, 2000.[PUBMED Abstract]
- Okamoto Y, Di Patre PL, Burkhard C, et al.: Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol 108 (1): 49-56, 2004.[PUBMED Abstract]
- van den Bent MJ, Chinot O, Boogerd W, et al.: Second-line chemotherapy with temozolomide in recurrent oligodendroglioma after PCV (procarbazine, lomustine and vincristine) chemotherapy: EORTC Brain Tumor Group phase II study 26972. Ann Oncol 14 (4): 599-602, 2003.[PUBMED Abstract]
- van den Bent MJ, Brandes AA, Taphoorn MJ, et al.: Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 31 (3): 344-50, 2013.[PUBMED Abstract]
- Cairncross G, Wang M, Shaw E, et al.: Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: long-term results of RTOG 9402. J Clin Oncol 31 (3): 337-43, 2013.[PUBMED Abstract]
- Gilbert MR: Minding the Ps and Qs: perseverance and quality studies lead to major advances in patients with anaplastic oligodendroglioma. J Clin Oncol 31 (3): 299-300, 2013.[PUBMED Abstract]
- Brada M, Stenning S, Gabe R, et al.: Temozolomide versus procarbazine, lomustine, and vincristine in recurrent high-grade glioma. J Clin Oncol 28 (30): 4601-8, 2010.[PUBMED Abstract]
- Jiao Y, Killela PJ, Reitman ZJ, et al.: Frequent ATRX, CIC, FUBP1 and IDH1 mutations refine the classification of malignant gliomas. Oncotarget 3 (7): 709-22, 2012.[PUBMED Abstract]
- Killela PJ, Reitman ZJ, Jiao Y, et al.: TERT promoter mutations occur frequently in gliomas and a subset of tumors derived from cells with low rates of self-renewal. Proc Natl Acad Sci U S A 110 (15): 6021-6, 2013.[PUBMED Abstract]
- Killela PJ, Pirozzi CJ, Healy P, et al.: Mutations in IDH1, IDH2, and in the TERT promoter define clinically distinct subgroups of adult malignant gliomas. Oncotarget 5 (6): 1515-25, 2014.[PUBMED Abstract]
- Oya N, Shibamoto Y, Nagata Y, et al.: Postoperative radiotherapy for intracranial ependymoma: analysis of prognostic factors and patterns of failure. J Neurooncol 56 (1): 87-94, 2002.[PUBMED Abstract]
- Brandes AA, Ermani M, Amista P, et al.: The treatment of adults with medulloblastoma: a prospective study. Int J Radiat Oncol Biol Phys 57 (3): 755-61, 2003.[PUBMED Abstract]
- Brandes AA, Franceschi E, Tosoni A, et al.: Long-term results of a prospective study on the treatment of medulloblastoma in adults. Cancer 110 (9): 2035-41, 2007.[PUBMED Abstract]
- Nakamura M, Roser F, Michel J, et al.: The natural history of incidental meningiomas. Neurosurgery 53 (1): 62-70; discussion 70-1, 2003.[PUBMED Abstract]
- Yano S, Kuratsu J; Kumamoto Brain Tumor Research Group: Indications for surgery in patients with asymptomatic meningiomas based on an extensive experience. J Neurosurg 105 (4): 538-43, 2006.[PUBMED Abstract]
- Debus J, Wuendrich M, Pirzkall A, et al.: High efficacy of fractionated stereotactic radiotherapy of large base-of-skull meningiomas: long-term results. J Clin Oncol 19 (15): 3547-53, 2001.[PUBMED Abstract]
- Fine HA: Promising new therapies for malignant gliomas. Cancer J 13 (6): 349-54, 2007 Nov-Dec.[PUBMED Abstract]
- Fecci PE, Mitchell DA, Archer GE, et al.: The history, evolution, and clinical use of dendritic cell-based immunization strategies in the therapy of brain tumors. J Neurooncol 64 (1-2): 161-76, 2003 Aug-Sep.[PUBMED Abstract]
- Newton HB: Molecular neuro-oncology and development of targeted therapeutic strategies for brain tumors. Part 1: Growth factor and Ras signaling pathways. Expert Rev Anticancer Ther 3 (5): 595-614, 2003.[PUBMED Abstract]
- Kew Y, Levin VA: Advances in gene therapy and immunotherapy for brain tumors. Curr Opin Neurol 16 (6): 665-70, 2003.[PUBMED Abstract]
- Chiocca EA, Aghi M, Fulci G: Viral therapy for glioblastoma. Cancer J 9 (3): 167-79, 2003 May-Jun.[PUBMED Abstract]
- 脊髄軸の原発腫瘍の治療
-
手術と放射線療法が脊髄軸の腫瘍を治療するために使用される第一治療法である;治療法の選択肢は、腫瘍の組織学によって異なる。[ 1 ]原発性脊髄腫瘍に対する化学療法の経験は限られている;これらの腫瘍タイプに対する比較臨床試験は報告されていない。[ 1 ][ 2 ]化学療法は、原発性または転移腫瘍からの軟髄膜への転移および脳脊髄液細胞診陽性を示す患者のほとんどに適応とされる。[ 1 ]ほとんどの患者が、特に放射線療法を受けている場合には、コルチコステロイドによる治療を必要とする。
治癒可能であることがまれな脊髄軸腫瘍または切除不能な脊髄軸腫瘍の患者は、臨床試験に組み入れることを検討すべきである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Cloughesy T, Selch MT, Liau L: Brain. In: Haskell CM: Cancer Treatment. 5th ed. Philadelphia, Pa: WB Saunders Co, 2001, pp 1106-42.[PUBMED Abstract]
- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1700-49.[PUBMED Abstract]
- 転移性脳腫瘍
-
成人転移性脳腫瘍に関する一般情報
脳への転移は少なくとも10対1の割合で原発性新生物を上回り、がん患者の20~40%で発生して、その後の生存期間中央値は一般的に6ヵ月未満である。[ 1 ]米国内のがん登録で脳への転移を記述したものはないため、その正確な発生率は不明であるが、米国では毎年98,000~170,000の新規症例が診断されると推定されている。[ 2 ][ 3 ]小さな転移巣を発見する磁気共鳴画像法(MRI)の性能および全身療法の改善による生存期間の延長のために、この数は増加している可能性がある。[ 1 ][ 2 ]
脳転移がよくみられる原発腫瘍と、その影響を受ける患者の割合は、以下の通りである:[ 1 ][ 2 ]
脳への転移の80%は大脳半球で生じ、15%は小脳、5%は脳幹で生じる。[ 2 ]脳への転移は70%を超える症例で多発性であるが、単発の転移も発生する。[ 1 ]
上咽頭部のがんが脳神経に沿って、または頭蓋底の孔を経由して直接進展することによって、脳に病変が及ぶこともある。硬膜転移の割合は、あらゆる脳転移の9%にも及ぶ。
臨床的特徴
がん患者における脳への転移の診断は、以下に基づく:
患者は、以下のいずれかの症状を訴えることがある:
しばしば、家族や友人が以下に気付くこともある:
診断的評価
身体診察により、客観的神経学的所見が示されることもあれば、軽微な認知的変化しか示さないこともある。多発性病変の存在および原発腫瘍転移の好発傾向は、脳転移の診断を下すのに十分な場合がある。
脳に病変がある場合、以前にがんを発症しているという理由だけで転移であると考えてはならない;このような思い込みによって、治癒可能な腫瘍を適切に治療できないという結果になりかねない。
画像検査
造影剤を用いるコンピュータ断層撮影スキャンまたはガドリニウムを用いたMRIは、転移の診断において大変感度が高い。ポジトロン放射断層撮影スキャンおよびスペクトロスコピーによる評価は、大脳への転移を診断し、その他の頭蓋内病変と鑑別するための新たな手段である。[ 4 ]
生検
孤立性病変の場合または原発腫瘍との関係に疑念がある場合は、脳生検(切除または定位生検による)が必要であろう。
転移性脳腫瘍の治療
脳転移を来した患者に対する至適療法には絶えず進展がみられる。[ 1 ][ 2 ][ 5 ]転移性脳腫瘍の管理には、以下の治療法が用いられている:
脳転移症例のほとんどが多発性の転移を有するため、歴史的に全脳放射線療法(WBRT)が治療の中心となってきた;しかしながら、定位放射線手術が次第によく用いられるようになっている。放射線手術の役割が定まりつつある。WBRTと併用した定位放射線手術が評価されている。
原発腫瘍不明の転移巣からの組織採取、または症状に関して支配的な病変で腫瘤により重大な影響を及ぼしている場合の減圧に対して手術が適応となる。
化学療法は通常、ほとんどの患者では初回治療法とならない;しかしながら、化学感受性腫瘍から脳への転移を来した患者の治療には、何らかの役割を有する可能性があり、転移性精巣胚細胞腫瘍に対する放射線と併用する場合には治癒の可能性すらある。[ 1 ][ 6 ]転移性腫瘍の髄膜転移に対しては、髄腔内化学療法も使用される。
転移が1~4個の患者に対する治療
転移が1~4個の患者に対する標準治療法の選択肢
がん患者の約10~15%で、脳への転移が1つある。放射線療法は、これらの患者に対する症状緩和の中心である。頭蓋外腫瘍の進度は、脳の病変の治療に影響する。広範で活発な全身疾患が認められる場合は、手術を行っても全生存(OS)に対する便益はほとんどもたらされない。頭蓋外腫瘍が安定しており微小な患者では、外科的切除後に放射線療法を行う集学的治療を検討できる。しかしながら、発表されている文献で明確な指針を示すものはない。
転移が1~4個の患者に対する標準治療法の選択肢には以下のものがある:
- WBRTと場合により外科的切除。
- WBRTと場合により定位放射線手術。
- 局所治療単独(外科的切除または定位放射線手術)。
証拠(転移が1~4個の患者に対する治療):
- 3件のランダム化試験で、計195人の患者を、単発性脳転移の切除後のWBRT vs WBRT単独のいずれかにランダムに割り付けて調査した。[ 7 ][ 8 ][ 9 ]外科的切除に適切な患者を必然的に選択することになる過程は、各試験における切除の少なさを説明しうる。最初の試験[ 7 ][証拠レベル:1iiD]は単一施設で実施され、1人の外科医がすべての患者を選択し、手術した。
- 単発性脳転移を切除後のWBRTの必要性が研究されている。[ 11 ]患者は術後WBRT群または切除後にそれ以上の治療を受けない群のいずれかにランダムに割り付けられた。
- 単発性脳転移に対して手術または定位放射線手術を行った後の観察とWBRTを比較した別の1件のランダム化研究は、19人の患者が登録した後、登録のペースが遅かったため中止された;したがって、この試験からはほとんど何も推論できない。[ 12 ]
- Radiation Therapy Oncology Group(RTOG)の研究(RTOG-9508)では、最大径4cmの転移が1~3個ある患者333人が定位的ブースト照射を併用する、または併用しないWBRT(3週間かけて37.5Gy)にランダムに割り付けられた。[
13
]治療が必要な全身疾患が活発な患者は除外された。研究集団全員と単発性転移を有する患者186人の両方で予め定義された仮説により、主要エンドポイントはOSとされた(2つの別個の仮説に対するP値の統計的調整は行われていない)。[
13
][すべての研究集団に対する証拠レベル:1iiDiiおよび単発性転移を有する患者に対する証拠レベル1iiA]
- 併用療法群の平均OSは5.7ヵ月で、WBRT単独群の平均OSは6.5ヵ月であった(P = 0.14)。
- 併用療法を用いたすべての集団において局所制御が良好であった。
- 追跡期間6ヵ月で、カルノフスキーのパフォーマンスステータス(不正確で主観的であるため、不確実なエンドポイントと考えられる)は、併用療法群の方が優れていたが、治療群間に精神状態の差は認められなかった。両治療群で急性および遅発性の毒性作用はほぼ同じであった。生活の質は評価されなかった。
- 第III相ランダム化試験では、安定した固形腫瘍患者を対象に、限定された数の脳転移に対する手術または放射線手術後の補助WBRTと経過観察が比較された。[ 14 ][証拠レベル:1iiC]
- 計358人が参加した2件の試験のメタアナリシスによると、WBRT + 定位放射線手術群とWBRT単独群の間で、OSに統計的に有意な差はみられなかった(HR、0.82;95%CI、0.65-1.02)。[ 15 ][証拠レベル:1iiDiii]
完全記憶能力の標準検査を用いた学習および神経認知を主要エンドポイントとした研究は、WBRT群における治療成績が不良であったため、データおよび安全性モニタリング委員会の指示で中止された。[ 16 ][証拠レベル:1iiD]
こうした一連の情報を考慮すると、局所治療 + WBRTまたは局所治療単独を施行して連続的なMRIによる綿密な経過観察を実施しながら、臨床的に適応となった場合に救助療法を開始することが、妥当な治療選択肢と考えられる。各アプローチのプラス面とマイナス面を患者と話し合うべきである。
さまざまな主要エンドポイントを用いてデザインされた数件のランダム化試験によって、局所治療後にWBRTが必要かどうかが検討されている。結果は以下のように要約できる:[ 16 ][ 17 ][ 18 ]
- 研究は一貫して、局所治療へのWBRTの追加によって疾患進行および脳内の新たな転移のリスクが低下することを示している。
- WBRTの追加はOSを改善しない。
- 頭蓋内病変の進行リスク低下は、機能状態または神経学的状態の改善を意味するわけではなく、神経学的悪化による死亡リスクが低下するようにも思われない。
- 局所治療単独を受けた患者の約半数以上には最終的にWBRTまたは放射線手術などの救助療法が必要となるのに対して、前もってWBRTを受けた患者で救助療法が必要になるのは約1/4である。
- WBRTに関連する良好な局所制御がQOLに及ぼす影響は報告されておらず、依然として未解決の問題となっている。
軟髄膜がん腫症(LC)
LCは、がん患者全体の約5%に発生する。軟髄膜に浸潤するがんでは、以下のものが特に一般的である:
診断では、神経脊髄軸画像と脳脊髄液(CSF)細胞診が併用される。OS中央値は10~12週間の範囲である。
LCの管理には以下のものがある:
転移性非小細胞肺がん患者149人のシリーズでは、細胞学的に証明されたLC、パフォーマンスステータス不良、CSF内蛋白高値、初回CSF白血球数高が生存の有意な予後不良因子であった。[ 19 ]患者は、髄腔内化学療法、WBRT、または上皮成長因子受容体チミジンキナーゼ-1を含む積極的治療、あるいは脳室腹腔短絡術を受けた。
転移性乳がんおよびLCの患者38人を対象としたレトロスペクティブシリーズでは、LC症例の割合は以下の乳がんサブタイプごとに多様であった:[ 20 ]
トリプルネガティブ乳がん患者は、転移性乳がん診断とLC発症の間隔が短かった。生存中央値は、乳がんサブタイプ全体で違いはなかった。HER2陽性LC患者におけるトラスツズマブの髄腔内注入の検討も症例報告で報告されている。[ 21 ]
参考文献- Patchell RA: The management of brain metastases. Cancer Treat Rev 29 (6): 533-40, 2003.[PUBMED Abstract]
- Mehta M, Vogelbaum MA, Chang S, et al.: Neoplasms of the central nervous system. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1700-49.[PUBMED Abstract]
- Hutter A, Schwetye KE, Bierhals AJ, et al.: Brain neoplasms: epidemiology, diagnosis, and prospects for cost-effective imaging. Neuroimaging Clin N Am 13 (2): 237-50, x-xi, 2003.[PUBMED Abstract]
- Schaefer PW, Budzik RF, Gonzalez RG: Imaging of cerebral metastases. Neurosurg Clin N Am 7 (3): 393-423, 1996.[PUBMED Abstract]
- Soffietti R, Cornu P, Delattre JY, et al.: EFNS Guidelines on diagnosis and treatment of brain metastases: report of an EFNS Task Force. Eur J Neurol 13 (7): 674-81, 2006.[PUBMED Abstract]
- Ogawa K, Yoshii Y, Nishimaki T, et al.: Treatment and prognosis of brain metastases from breast cancer. J Neurooncol 86 (2): 231-8, 2008.[PUBMED Abstract]
- Patchell RA, Tibbs PA, Walsh JW, et al.: A randomized trial of surgery in the treatment of single metastases to the brain. N Engl J Med 322 (8): 494-500, 1990.[PUBMED Abstract]
- Vecht CJ, Haaxma-Reiche H, Noordijk EM, et al.: Treatment of single brain metastasis: radiotherapy alone or combined with neurosurgery? Ann Neurol 33 (6): 583-90, 1993.[PUBMED Abstract]
- Mintz AH, Kestle J, Rathbone MP, et al.: A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis. Cancer 78 (7): 1470-6, 1996.[PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008.[PUBMED Abstract]
- Patchell RA, Tibbs PA, Regine WF, et al.: Postoperative radiotherapy in the treatment of single metastases to the brain: a randomized trial. JAMA 280 (17): 1485-9, 1998.[PUBMED Abstract]
- Roos DE, Wirth A, Burmeister BH, et al.: Whole brain irradiation following surgery or radiosurgery for solitary brain metastases: mature results of a prematurely closed randomized Trans-Tasman Radiation Oncology Group trial (TROG 98.05). Radiother Oncol 80 (3): 318-22, 2006.[PUBMED Abstract]
- Andrews DW, Scott CB, Sperduto PW, et al.: Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases: phase III results of the RTOG 9508 randomised trial. Lancet 363 (9422): 1665-72, 2004.[PUBMED Abstract]
- Soffietti R, Kocher M, Abacioglu UM, et al.: A European Organisation for Research and Treatment of Cancer phase III trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery: quality-of-life results. J Clin Oncol 31 (1): 65-72, 2013.[PUBMED Abstract]
- Patil CG, Pricola K, Sarmiento JM, et al.: Whole brain radiation therapy (WBRT) alone versus WBRT and radiosurgery for the treatment of brain metastases. Cochrane Database Syst Rev 9: CD006121, 2012.[PUBMED Abstract]
- Chang EL, Wefel JS, Hess KR, et al.: Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial. Lancet Oncol 10 (11): 1037-44, 2009.[PUBMED Abstract]
- Aoyama H, Shirato H, Tago M, et al.: Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases: a randomized controlled trial. JAMA 295 (21): 2483-91, 2006.[PUBMED Abstract]
- Kocher M, Soffietti R, Abacioglu U, et al.: Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. J Clin Oncol 29 (2): 134-41, 2011.[PUBMED Abstract]
- Lee SJ, Lee JI, Nam DH, et al.: Leptomeningeal carcinomatosis in non-small-cell lung cancer patients: impact on survival and correlated prognostic factors. J Thorac Oncol 8 (2): 185-91, 2013.[PUBMED Abstract]
- Torrejón D, Oliveira M, Cortes J, et al.: Implication of breast cancer phenotype for patients with leptomeningeal carcinomatosis. Breast 22 (1): 19-23, 2013.[PUBMED Abstract]
- Bartsch R, Berghoff AS, Preusser M: Optimal management of brain metastases from breast cancer. Issues and considerations. CNS Drugs 27 (2): 121-34, 2013.[PUBMED Abstract]
- 再発成人CNS腫瘍の治療
-
再発CNS腫瘍の患者は治癒可能であることがまれであり、臨床試験に組み入れることを検討すべきである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
再発CNS腫瘍に対する標準治療法の選択肢には以下のものがある:
化学療法
局所化学療法(カルムスチンウエハ)
再発悪性グリオーマの治療におけるカルムスチンウエハが研究されているが、生存への影響は初回診断および切除時ほど明確ではない。
証拠(局所化学療法):
全身化学療法
原発性悪性脳腫瘍の再発時には、全身療法(例えば、テモゾロミド、ロムスチン、またはプロカルバジン、ニトロソ尿素、PCVの併用で、これらの薬物投与を過去に受けていない患者が対象)が用いられている。しかしながら、この治療法は対照研究では検証されていない。患者選択因子は治療成績の決定において大きな役割を果たしている可能性が高いため、治療が生存に及ぼす影響は不明である。
抗血管新生療法
2009年に、米国食品医薬品局(FDA)は、進行性膠芽腫患者に対するベバシズマブ単剤療法に加速承認を与えた。 この適応はFDAの加速承認プログラムの下で与えられたもので、このプログラムは、重篤または命を脅かす病気または疾患を想定した医薬品を承認する根拠として、特定の代理エンドポイント、つまり生存または不可逆的な合併症以外の臨床エンドポイントに対する効果の使用を可能にする。
この承認は、歴史的対照単群または非比較の2件の第II相試験で観察された客観的奏効率改善の実証に基づいていた。[ 3 ][ 4 ][証拠レベル:3iiiDiv]これらのデータおよびFDA承認に基づいて、ベバシズマブ単剤療法は再発膠芽腫に対する標準治療となっている。
証拠(抗血管新生療法):
- 再発多形性膠芽腫(GBM)患者167人をベバシズマブ単剤療法またはベバシズマブとイリノテカンの併用療法のいずれかにランダムに割り付けたオープンラベル多施設共同非比較第II相研究について、FDAは独立して審査したが[ 3 ]、ベバシズマブ単剤療法群(n = 85)からの有効性データのみが薬剤承認の裏付けに使用された。
- 再発膠芽腫患者56人をベバシズマブ単剤で治療した他の単群単一施設試験について、FDAは独立して評価した。[ 4 ]
しかしながら、現時点では、ベバシズマブを用いた膠芽腫の治療により疾患関連症状などの健康転帰の改善または生存延長を示すプロスペクティブ・ランダム化比較試験からのデータは得られていない。
放射線療法
ランダム化試験が行われていないため、疾患の進行または放射線誘発性がんの発生後の反復放射線の役割もまた十分に明らかにされていない。文献は小規模のレトロスペクティブケースシリーズに限られているため、解釈が困難である。[ 5 ]神経認知的障害および放射線壊死のリスクがあるため、決定は慎重に下す必要がある。
手術
一部の患者では再発CNS腫瘍の再切除が用いられる。しかしながら、ほとんどの患者は状態が悪いか、技術的に手術不能の腫瘍であるために再切除は受けられない。証拠は、十分に健康で技術的に減量手術が行える程度に小さい腫瘍を有する患者に関する、対照のない研究およびケースシリーズに限られている。再手術 vs 患者選択が生存に及ぼす影響は不明である。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Brem H, Piantadosi S, Burger PC, et al.: Placebo-controlled trial of safety and efficacy of intraoperative controlled delivery by biodegradable polymers of chemotherapy for recurrent gliomas. The Polymer-brain Tumor Treatment Group. Lancet 345 (8956): 1008-12, 1995.[PUBMED Abstract]
- Hart MG, Grant R, Garside R, et al.: Chemotherapeutic wafers for high grade glioma. Cochrane Database Syst Rev (3): CD007294, 2008.[PUBMED Abstract]
- Friedman HS, Prados MD, Wen PY, et al.: Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol 27 (28): 4733-40, 2009.[PUBMED Abstract]
- Kreisl TN, Kim L, Moore K, et al.: Phase II trial of single-agent bevacizumab followed by bevacizumab plus irinotecan at tumor progression in recurrent glioblastoma. J Clin Oncol 27 (5): 740-5, 2009.[PUBMED Abstract]
- Paulino AC, Mai WY, Chintagumpala M, et al.: Radiation-induced malignant gliomas: is there a role for reirradiation? Int J Radiat Oncol Biol Phys 71 (5): 1381-7, 2008.[PUBMED Abstract]
- 本要約の変更点(01/22/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
成人中枢神経系(CNS)腫瘍に関する一般情報
新規症例数および死亡数の推定値に関する統計が2020年度用に更新された(引用、参考文献2としてAmerican Cancer Society)。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、成人中枢神経系腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Adult Central Nervous System Tumors Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/brain/hp/adult-brain-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389419]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する