ご利用について
医療専門家向けの本PDQがん情報要約では、成人の消化管間質腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 消化管間質腫瘍(GIST)に関する一般情報
-
疫学
GISTは全消化管(GI)腫瘍の1%未満であるが、消化管間葉系腫瘍としては最も一般的な腫瘍である。[ 1 ]米国では、毎年3,300~6,000例の新規GIST症例が発生すると推定されている。[ 2 ]Surveillance, Epidemiology, and End Results(SEER)登録データに基づく研究によると、1992年から2000年の米国におけるGISTの年齢調整年間発生率は、100万人当たり6.8例であった。[ 3 ]しかしながら、真の発生率は明らかではなく、その理由の一部には、腫瘍の多くが、特徴的なKITまたは血小板由来増殖因子受容体α(PDGFRA)遺伝子突然変異に関して、検査されていないことが挙げられる。また、一般集団におけるGISTは直径がほんの2~3mmと小さく、緩徐進行型の腫瘍が多く、これらはがん登録には含まれていない。[ 4 ][ 5 ]GISTの分布はすべての地域および民族集団でほぼ等しく、男性と女性が等しく罹患する。ほとんどの患者は50~80歳の間に発症する。[ 6 ] 大多数のGISTは散発性であるが、KIT遺伝子(または、まれにCarney-Stratakis症候群におけるコハク酸デヒドロゲナーゼ遺伝子)における特徴的な遺伝的変異と関連するまれな家族性GISTも存在する。家族性GISTは多発性原発腫瘍として発生することもある。
臨床像および診断的評価
GISTは消化管のあらゆる部位に生じうるが、胃または小腸に最も好発する。米国がん合同委員会(AJCC)のCancer Staging Manualでは、以下のように大まかな分布が記載されている:[ 7 ]
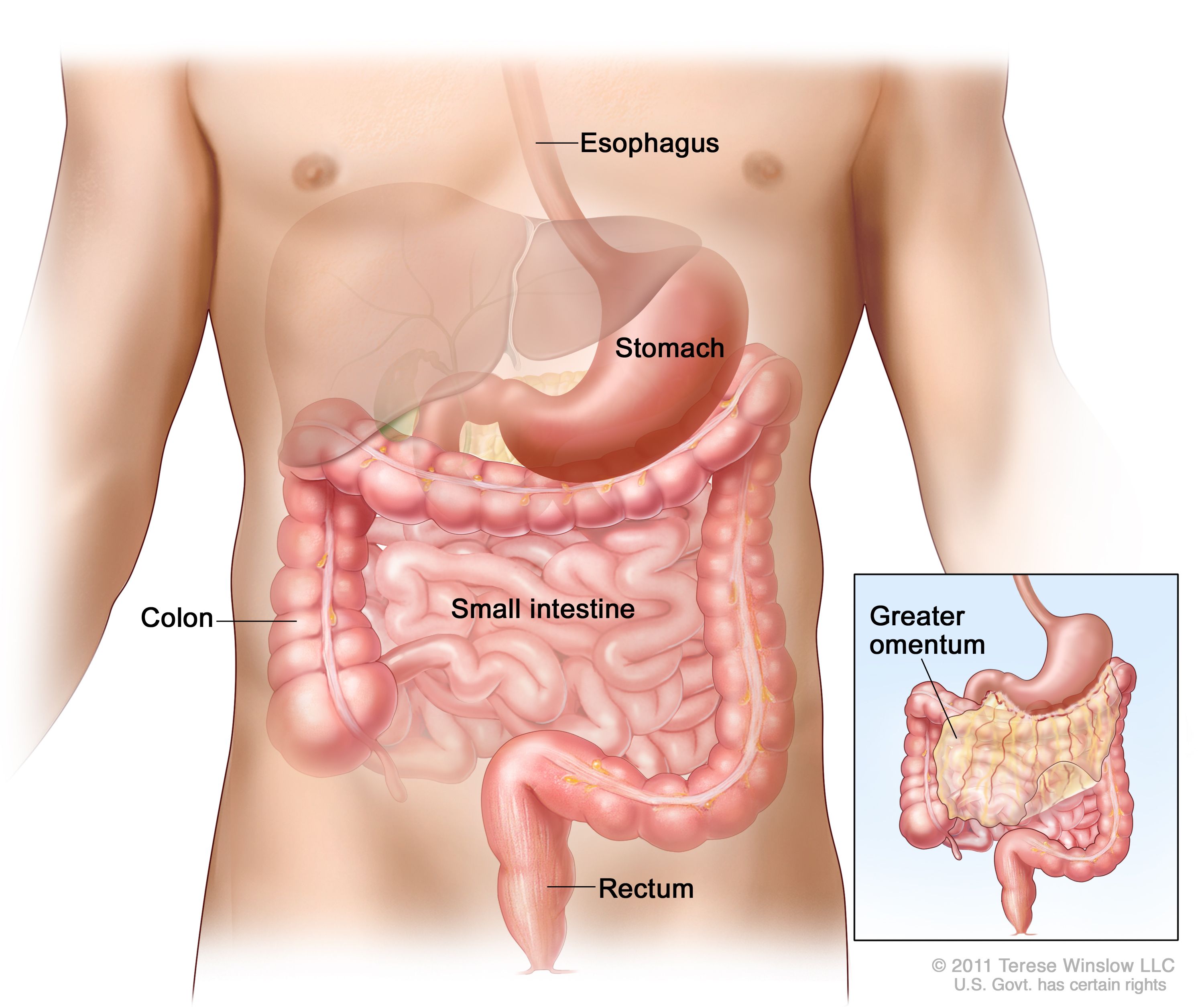
消化管間質腫瘍(GIST)は消化管の内部または付近のどの部位にも発生することがある。 さらに頻度は低いが、GISTは虫垂、胆嚢、膵臓、後腹膜腔のほか、傍膣組織や前立腺周囲組織に発生することもある。[ 8 ]胃GISTの約20~25%および小腸GISTの40~50%は、臨床的に侵攻性である。[ 9 ][ 10 ]患者の約10~25%が転移性疾患を有すると推定されている。[ 9 ][ 11 ]
GIST患者の臨床所見は、腫瘍の解剖学的部位や腫瘍径、侵攻性によってさまざまである。[ 12 ]GISTの最も一般的な症状は、急性(下血や吐血)または慢性の消化管出血であり、貧血を引き起こす。[ 10 ]
GIST患者はまた以下の症状を呈する:
この他の臨床症状としては、以下のものがある:[ 2 ]
手術、放射線学的検査、または内視鏡検査中に比較的小さな病変が偶然発見されることがある。これらの偶発的に発見される腫瘍の自然史および症候性疾患に進行する頻度は不明である。小さなGIST腫瘍の大多数は症状が現れる病期にまで進行しないであろう。例えば、GISTと無関係の原因で死亡した成人98人に対する連続した系統的剖検シリーズでは、症例の22.5%で、組織学的にGISTと診断された肉眼的に認識可能な胃腫瘍(1mm~6mm)がみつかった。[ 5 ]26人の患者では分析用に十分なDNAが入手でき、13人の患者にKIT遺伝子のエクソン11に複数の突然変異およびPDGFRA遺伝子に1つの突然変異が認められた。
200例のGIST症例を対象とした1件のレトロスペクティブ研究では、悪性疾患の典型的な臨床症状として肝転移および/または腹腔内播種が挙げられた。リンパ節転移および肺やその他の腹部外の部位への転移はまれであった。[ 11 ]進行性疾患は、肺や骨といった遠隔部位への転移を伴うことがある。脳転移はまれである。[ 2 ]
GISTは、すべての腹腔内非上皮性悪性腫瘍の鑑別診断に含めるべきである。診断のための介入方法としては、以下が用いられる:[ 12 ]
病期分類に有用な検査としては、以下が挙げられる:
ほとんどの腫瘍が粘膜層より深い層に発生し、消化管壁内発育型であるため、上部消化管のGISTを発見するには、細針穿刺吸引生検を伴う超音波内視鏡検査が有用である。[ 12 ][ 13 ][ 14 ]
病理学および分子遺伝学
GISTは典型的に消化管壁筋層内に発生し、腫瘍径は1cm未満から40cmを超えるものまでさまざまであるが、臨床的に診断される場合の平均腫瘍径は約5cmである。[ 2 ]小さなGISTは、漿膜下や壁内に(または頻度は低いが腸管腔内にポリープ状の)充実性腫瘤を形成しうる。大きな腫瘍は、複数の筋層に拡がりながら消化管の外側面に癒着した外部腫瘤(external masses)を形成する傾向がある。[ 2 ]GISTの形態学はきわめて多様である;腫瘍は以下の細胞から形成される:[ 8 ]
GISTは、細胞分裂能が非常に低い小さい腫瘍(以前はしばしば平滑筋腫と指定されていた)から細胞分裂能の高い大きな腫瘍(以前はしばしば平滑筋肉腫と指定されていた)に至るまで、一連の広範な組織学的パターンを包括的に含んでいる。[ 7 ]不確かではあるものの、GISTはカハール介在細胞(ICC)またはその幹細胞様前駆体に由来すると考えられている。[ 15 ][ 16 ]
GISTに最も一般的に用いられるマーカーは、ICCにより発現されるマーカーのCD117抗原である。GISTの約95%が、KIT受容体チロシンキナーゼのエピトープであるCD117抗原陽性である。[ 2 ][ 9 ]しかしながら、他の間葉性新生物でもCD117抗原に対して弱い反応が起こるため、CD117免疫組織化学はGISTに特異的ではない;したがって、鑑別が難しい症例では形態学的検査とともに他の免疫染色法の使用が必須である。[ 17 ]また、病理研究室でマーカーの発現を高めるために抗原賦活化法が用いられている場合は、CD117染色で偽陽性が出てしまうことがある。[ 18 ]GISTの形態学は比較的広範であるため、鑑別診断には、腹部に発生する間葉性、神経性、および神経内分泌の数種の新生物が含まれており、以下のようなものがある:[ 8 ]
GISTの約85%では、KITまたはPDGFRAの2つの受容体チロシンキナーゼの1つにがん原性変異が見られる。[ 2 ][ 10 ]これら受容体チロシンキナーゼのいずれかの構成的活性化が、GISTの発生機序において中心的役割を演じている。[ 15 ][ 19 ]検出可能なKITまたはPDGFRA突然変異が見られない野生型腫瘍は、全GISTの12~15%を占める。神経線維腫症1型(NF1)やCarney三徴、その他の家族性疾患をはじめとする症候性疾患の状況で発生するGISTは5%未満である。[ 2 ][ 20 ][ 21 ][ 22 ]GISTの治療にはメシル酸イマチニブ、またはイマチニブ耐性GISTの症例においてはスニチニブリンゴ酸塩などのKIT/PDGFRAチロシンキナーゼ阻害剤(TKI)による特異的分子標的治療が利用できるため、GISTの正確な同定が非常に重要である。[ 1 ][ 10 ][ 17 ]
リスク評価および予後
特定のキナーゼ変異の確認はGISTの初期の臨床経過を判断するために役立つが、臨床所見が見られる場合の予後は、キナーゼ変異以外の遺伝子的イベントの影響を受けるようである。新たに診断された原発GISTの進行リスクを評価するための最新の推奨は、キナーゼ阻害剤が臨床で用いられる以前からのデータによるレトロスペクティブ研究に基づく、以下の3つのパラメータ(表1を参照のこと)に依存する:[ 2 ][ 23 ][ 24 ][ 25 ][ 26 ]
表1.有糸分裂指数、腫瘍径、および腫瘍の位置別の原発GISTのリスク層別化a 有糸分裂指数、hpf 腫瘍径、cm 進行性疾患の部位およびリスク(%) GIST = 消化管間質腫瘍;hpf = 高倍率視野、初期画像で細胞分裂能が最も高いと思われる領域で評価。 aAnnual review of pathology by ANNUAL REVIEWS, INC. Reproduced with permission of ANNUAL REVIEWS, INC., in the format Internet posting via Copyright Clearance Center.[ 2 ] b少数の症例。 胃 空腸/回腸 十二指腸 直腸 50視野当たり5以下 ≤2 なし(0) なし(0) なし(0) なし(0) >2 ≤5 超低リスク(1.9) 低リスク(4.3) 低リスク(8.3) 低リスク(8.5) >5 ≤10 低リスク(3.6) 中リスク(24) (データ不十分) (データ不十分) >10 中リスク(12) 高リスク(52) 高リスク(34) 高リスク(57)b 50視野当たり5超 ≤2 なしb 高リスクb (データ不十分) 高リスク(54) >2 ≤5 中リスク(16) 高リスク(73) 高リスク(50) 高リスク(52) >5 ≤10 高リスク(55) 高リスク(85) (データ不十分) (データ不十分) >10 高リスク(86) 高リスク(90) 高リスク(86) 高リスク(71) 生存率
腹腔内の他の肉腫と比較して、GIST患者の手術単独後の生存率は良好である。[ 27 ]TKIが使用される以前に実施された、200人の患者を対象とした1件のレトロスペクティブ研究において、原発GISTで肉眼的病変を完全切除された患者(N = 80)の疾患特異的5年生存率は54%で、生存を予測した因子は腫瘍径であった;全疾患特異的5年生存率は35%であった。[ 11 ]TKI使用以前の他の研究でも、GISTを完全切除された患者に対して40~63%の5年生存率が報告された。
上記の表1で引用した200人の患者のレトロスペクティブ研究では、7%に孤立性局所再発および47%に転移が認められた。[ 11 ]GISTの再燃部位は通常、腹膜、肝臓、またはその双方を含む腹腔内である;真の局所再発はまれで、画像検査では検出されない広範囲に及ぶ腹腔内再発が典型的である。[ 27 ]転移性GIST患者(N = 94)の疾患特異的生存期間中央値は19ヵ月であった。[ 11 ]転移性GIST患者119人を対象にした1件のレトロスペクティブ研究において、GISTが転移性となった場合、キナーゼ遺伝子型は全生存を予測しなかったことが明らかにされた。[ 28 ]
イマチニブ投与患者の再発までの期間中央値は2年である。[ 27 ]
追跡
GISTを切除された患者において転移性または再発疾患の有無を確認する最も適切な検査および検査の頻度は、追跡戦略が臨床的転帰に及ぼす影響が不明であるため、明確に定義されていない。したがって、追跡の推奨は、専門家の意見および腫瘍部位、腫瘍径、有糸分裂指数を考慮に入れた臨床判断に基づいている。限局性疾患を手術で治療された患者のルーチンの追跡スケジュールは、施設間で異なる場合があり、腫瘍のリスク状態に依存する。[ 18 ]3~6ヵ月ごとに腹部/骨盤CTが実施されることがあるが、超低リスク病変にはルーチンの追跡検査が不要である可能性もある。[ 18 ]
切除不能、転移性、または再発疾患に対して全身療法を受けている患者における治療効果のモニタリングには、CTまたは18F-FDG PETが用いられる。[ 27 ]18F-FDG PETはまた、TKI耐性の確認に有用な場合がある。18F-FDG PETをTKI治療のモニタリングに用いる場合には、キナーゼ阻害剤投与前にしばしばベースラインのFDG PETが実施される。18F-FDG PET画像検査はGISTに対するイマチニブの活性の検出がCT画像検査よりもはるかに早いため、18F-FDG PETによるGISTの画像検査はイマチニブ治療への反応を迅速に評価するための有用な診断法である;18-FDGへの腫瘍の結合活性の低下は、イマチニブ単回投与後わずか24時間で検出されることがある。[ 12 ]
関連する要約
(小児のおける消化管間質腫瘍に関する情報については、小児消化管間質腫瘍の治療に関するPDQ要約を参照のこと。)
参考文献- Judson I, Demetri G: Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 18 (Suppl 10): x20-4, 2007.[PUBMED Abstract]
- Corless CL, Heinrich MC: Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 3: 557-86, 2008.[PUBMED Abstract]
- Tran T, Davila JA, El-Serag HB: The epidemiology of malignant gastrointestinal stromal tumors: an analysis of 1,458 cases from 1992 to 2000. Am J Gastroenterol 100 (1): 162-8, 2005.[PUBMED Abstract]
- Kawanowa K, Sakuma Y, Sakurai S, et al.: High incidence of microscopic gastrointestinal stromal tumors in the stomach. Hum Pathol 37 (12): 1527-35, 2006.[PUBMED Abstract]
- Agaimy A, Wünsch PH, Hofstaedter F, et al.: Minute gastric sclerosing stromal tumors (GIST tumorlets) are common in adults and frequently show c-KIT mutations. Am J Surg Pathol 31 (1): 113-20, 2007.[PUBMED Abstract]
- Nowain A, Bhakta H, Pais S, et al.: Gastrointestinal stromal tumors: clinical profile, pathogenesis, treatment strategies and prognosis. J Gastroenterol Hepatol 20 (6): 818-24, 2005.[PUBMED Abstract]
- Gastrointestinal stromal tumor. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 523–9.[PUBMED Abstract]
- Corless CL, Fletcher JA, Heinrich MC: Biology of gastrointestinal stromal tumors. J Clin Oncol 22 (18): 3813-25, 2004.[PUBMED Abstract]
- Joensuu H: Gastrointestinal stromal tumor (GIST). Ann Oncol 17 (Suppl 10): x280-6, 2006.[PUBMED Abstract]
- Miettinen M, Lasota J: Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 130 (10): 1466-78, 2006.[PUBMED Abstract]
- DeMatteo RP, Lewis JJ, Leung D, et al.: Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 231 (1): 51-8, 2000.[PUBMED Abstract]
- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer : Principles & Practice of Oncology. 11th ed. Philadelphia, Pa: Wolters Kluwer, 2019, pp 895-906.[PUBMED Abstract]
- Nickl NJ: Gastrointestinal stromal tumors: new progress, new questions. Curr Opin Gastroenterol 20 (5): 482-7, 2004.[PUBMED Abstract]
- Vander Noot MR, Eloubeidi MA, Chen VK, et al.: Diagnosis of gastrointestinal tract lesions by endoscopic ultrasound-guided fine-needle aspiration biopsy. Cancer 102 (3): 157-63, 2004.[PUBMED Abstract]
- Hirota S, Isozaki K, Moriyama Y, et al.: Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279 (5350): 577-80, 1998.[PUBMED Abstract]
- Kindblom LG, Remotti HE, Aldenborg F, et al.: Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 152 (5): 1259-69, 1998.[PUBMED Abstract]
- Antonescu CR: Targeted therapy of cancer: new roles for pathologists in identifying GISTs and other sarcomas. Mod Pathol 21 (Suppl 2): S31-6, 2008.[PUBMED Abstract]
- Casali PG, Jost L, Reichardt P, et al.: Gastrointestinal stromal tumors: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 19 (Suppl 2): ii35-8, 2008.[PUBMED Abstract]
- Heinrich MC, Corless CL, Duensing A, et al.: PDGFRA activating mutations in gastrointestinal stromal tumors. Science 299 (5607): 708-10, 2003.[PUBMED Abstract]
- Andersson J, Sihto H, Meis-Kindblom JM, et al.: NF1-associated gastrointestinal stromal tumors have unique clinical, phenotypic, and genotypic characteristics. Am J Surg Pathol 29 (9): 1170-6, 2005.[PUBMED Abstract]
- Agaimy A, Pelz AF, Corless CL, et al.: Epithelioid gastric stromal tumours of the antrum in young females with the Carney triad: a report of three new cases with mutational analysis and comparative genomic hybridization. Oncol Rep 18 (1): 9-15, 2007.[PUBMED Abstract]
- Carney JA: Gastric stromal sarcoma, pulmonary chondroma, and extra-adrenal paraganglioma (Carney Triad): natural history, adrenocortical component, and possible familial occurrence. Mayo Clin Proc 74 (6): 543-52, 1999.[PUBMED Abstract]
- Miettinen M, Sobin LH, Lasota J: Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 29 (1): 52-68, 2005.[PUBMED Abstract]
- Miettinen M, Makhlouf H, Sobin LH, et al.: Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up. Am J Surg Pathol 30 (4): 477-89, 2006.[PUBMED Abstract]
- Miettinen M, Kopczynski J, Makhlouf HR, et al.: Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Pathol 27 (5): 625-41, 2003.[PUBMED Abstract]
- Miettinen M, Furlong M, Sarlomo-Rikala M, et al.: Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the rectum and anus: a clinicopathologic, immunohistochemical, and molecular genetic study of 144 cases. Am J Surg Pathol 25 (9): 1121-33, 2001.[PUBMED Abstract]
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.[PUBMED Abstract]
- Gold JS, van der Zwan SM, Gönen M, et al.: Outcome of metastatic GIST in the era before tyrosine kinase inhibitors. Ann Surg Oncol 14 (1): 134-42, 2007.[PUBMED Abstract]
- GISTの細胞分類および分子分類
-
消化管間質腫瘍(GIST)はカハール介在細胞(ICC)またはその幹細胞様前駆体に由来すると考えられている。[ 1 ][ 2 ]ICCは、消化管自律神経系と平滑筋細胞間で消化管運動と自律神経機能を調整するペースメーカーのような中間細胞である。[ 3 ][ 4 ]KIT-陽性およびKIT-依存性のICCは、消化管全体にわたって腸筋神経叢および固有筋層の周囲に存在する。ICCまたはその幹細胞様前駆体は、KITシグナル伝達が阻害されると平滑筋細胞に分化できる。[ 5 ]
GISTの約95%が、ICCにより発現される、KIT受容体チロシンキナーゼのエピトープであるCD117抗原陽性である。[ 6 ]しかしながら、他の間葉性新生物でもCD117抗原に対して弱い反応が起こるため、CD117免疫組織化学はGISTに特異的ではない。したがって、GISTを他の間葉性、神経性、および神経内分泌の新生物と鑑別するには、他の免疫マーカーのほか、腫瘍の解剖学的位置および形態学に照らして、腫瘍のCD117免疫染色を慎重に解釈すべきである。[ 6 ]プロテインキナーゼCθおよびDOG1の免疫組織化学染色法はGISTと他の間葉系腫瘍(特にKIT陰性の腫瘍)を鑑別するのに有用である。[ 6 ][ 7 ][ 8 ][ 9 ]DOG1(GIST 1で発見された)は、GISTで強く発現し、まれに他の軟部組織腫瘍でも発現が認められる機能不明の蛋白である。[ 9 ]
GISTの約85%では、KITまたは血小板由来増殖因子受容体α(PDGFRA)の2つの受容体チロシンキナーゼの1つにがん原性変異が見られる。[ 6 ]これら受容体チロシンキナーゼのいずれかの構成的活性化が、GISTの発生機序において中心的役割を演じている。[ 1 ][ 10 ]GISTの治療にはメシル酸イマチニブ、またはイマチニブ耐性GISTの症例においてはスニチニブリンゴ酸塩などのKIT/PDGFRAチロシンキナーゼ阻害剤(TKI)による特異的分子標的治療が利用できるため、遺伝子型解析を用いたGISTの正確な同定が非常に重要である。[ 11 ][ 12 ][ 13 ]
GISTは以下のサブグループの1つ(場合によっては、複数のサブグループ)に分類される:
参考文献- Hirota S, Isozaki K, Moriyama Y, et al.: Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279 (5350): 577-80, 1998.[PUBMED Abstract]
- Kindblom LG, Remotti HE, Aldenborg F, et al.: Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 152 (5): 1259-69, 1998.[PUBMED Abstract]
- Maeda H, Yamagata A, Nishikawa S, et al.: Requirement of c-kit for development of intestinal pacemaker system. Development 116 (2): 369-75, 1992.[PUBMED Abstract]
- Huizinga JD, Thuneberg L, Klüppel M, et al.: W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity. Nature 373 (6512): 347-9, 1995.[PUBMED Abstract]
- Torihashi S, Nishi K, Tokutomi Y, et al.: Blockade of kit signaling induces transdifferentiation of interstitial cells of cajal to a smooth muscle phenotype. Gastroenterology 117 (1): 140-8, 1999.[PUBMED Abstract]
- Corless CL, Heinrich MC: Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 3: 557-86, 2008.[PUBMED Abstract]
- Blay P, Astudillo A, Buesa JM, et al.: Protein kinase C theta is highly expressed in gastrointestinal stromal tumors but not in other mesenchymal neoplasias. Clin Cancer Res 10 (12 Pt 1): 4089-95, 2004.[PUBMED Abstract]
- Duensing A, Joseph NE, Medeiros F, et al.: Protein Kinase C theta (PKCtheta) expression and constitutive activation in gastrointestinal stromal tumors (GISTs). Cancer Res 64 (15): 5127-31, 2004.[PUBMED Abstract]
- West RB, Corless CL, Chen X, et al.: The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol 165 (1): 107-13, 2004.[PUBMED Abstract]
- Heinrich MC, Corless CL, Duensing A, et al.: PDGFRA activating mutations in gastrointestinal stromal tumors. Science 299 (5607): 708-10, 2003.[PUBMED Abstract]
- Judson I, Demetri G: Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 18 (Suppl 10): x20-4, 2007.[PUBMED Abstract]
- Heinrich MC, Corless CL, Demetri GD, et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 21 (23): 4342-9, 2003.[PUBMED Abstract]
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002.[PUBMED Abstract]
- Stenman G, Eriksson A, Claesson-Welsh L: Human PDGFA receptor gene maps to the same region on chromosome 4 as the KIT oncogene. Genes Chromosomes Cancer 1 (2): 155-8, 1989.[PUBMED Abstract]
- O'Riain C, Corless CL, Heinrich MC, et al.: Gastrointestinal stromal tumors: insights from a new familial GIST kindred with unusual genetic and pathologic features. Am J Surg Pathol 29 (12): 1680-3, 2005.[PUBMED Abstract]
- Antonescu CR, Besmer P, Guo T, et al.: Acquired resistance to imatinib in gastrointestinal stromal tumor occurs through secondary gene mutation. Clin Cancer Res 11 (11): 4182-90, 2005.[PUBMED Abstract]
- Wasag B, Debiec-Rychter M, Pauwels P, et al.: Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site. Mod Pathol 17 (8): 889-94, 2004.[PUBMED Abstract]
- Debiec-Rychter M, Wasag B, Stul M, et al.: Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity. J Pathol 202 (4): 430-8, 2004.[PUBMED Abstract]
- Medeiros F, Corless CL, Duensing A, et al.: KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol 28 (7): 889-94, 2004.[PUBMED Abstract]
- Sakurai S, Hasegawa T, Sakuma Y, et al.: Myxoid epithelioid gastrointestinal stromal tumor (GIST) with mast cell infiltrations: a subtype of GIST with mutations of platelet-derived growth factor receptor alpha gene. Hum Pathol 35 (10): 1223-30, 2004.[PUBMED Abstract]
- Wardelmann E, Hrychyk A, Merkelbach-Bruse S, et al.: Association of platelet-derived growth factor receptor alpha mutations with gastric primary site and epithelioid or mixed cell morphology in gastrointestinal stromal tumors. J Mol Diagn 6 (3): 197-204, 2004.[PUBMED Abstract]
- Pauls K, Merkelbach-Bruse S, Thal D, et al.: PDGFRalpha- and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology 46 (2): 166-75, 2005.[PUBMED Abstract]
- Carney JA: Gastric stromal sarcoma, pulmonary chondroma, and extra-adrenal paraganglioma (Carney Triad): natural history, adrenocortical component, and possible familial occurrence. Mayo Clin Proc 74 (6): 543-52, 1999.[PUBMED Abstract]
- Andersson J, Sihto H, Meis-Kindblom JM, et al.: NF1-associated gastrointestinal stromal tumors have unique clinical, phenotypic, and genotypic characteristics. Am J Surg Pathol 29 (9): 1170-6, 2005.[PUBMED Abstract]
- Agaimy A, Pelz AF, Corless CL, et al.: Epithelioid gastric stromal tumours of the antrum in young females with the Carney triad: a report of three new cases with mutational analysis and comparative genomic hybridization. Oncol Rep 18 (1): 9-15, 2007.[PUBMED Abstract]
- Kang DY, Park CK, Choi JS, et al.: Multiple gastrointestinal stromal tumors: Clinicopathologic and genetic analysis of 12 patients. Am J Surg Pathol 31 (2): 224-32, 2007.[PUBMED Abstract]
- Tamborini E, Bonadiman L, Greco A, et al.: A new mutation in the KIT ATP pocket causes acquired resistance to imatinib in a gastrointestinal stromal tumor patient. Gastroenterology 127 (1): 294-9, 2004.[PUBMED Abstract]
- Chen LL, Sabripour M, Andtbacka RH, et al.: Imatinib resistance in gastrointestinal stromal tumors. Curr Oncol Rep 7 (4): 293-9, 2005.[PUBMED Abstract]
- Debiec-Rychter M, Cools J, Dumez H, et al.: Mechanisms of resistance to imatinib mesylate in gastrointestinal stromal tumors and activity of the PKC412 inhibitor against imatinib-resistant mutants. Gastroenterology 128 (2): 270-9, 2005.[PUBMED Abstract]
- GISTの病期情報
-
消化管間質腫瘍(GIST)の正式な病期分類システムは、米国がん合同委員会(AJCC)の病期分類マニュアル(American Joint Committee on Cancer [AJCC] Staging Manual)で利用できる。しかしながら、実際には、リスク評価が臨床的特徴により決定される場合は、AJCC病期分類はルーチンには実施されていない。[ 1 ]
参考文献- Gastrointestinal stromal tumor. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 523–9.[PUBMED Abstract]
- GISTに対する治療法選択肢の概要
-
消化管間質腫瘍(GIST)患者の管理とは、病理医や腫瘍内科医、外科医、画像診断の専門家間の綿密な協力を獲得する集学的な試みである。[ 1 ]
治療法としては、病変の進展度とチロシンキナーゼ阻害剤(TKI)に対する腫瘍の感受性に応じて、手術および/またはTKIの使用が挙げられる。高リスク腫瘍の患者では再発が一般的であるが(表1を参照のこと)、限局性腫瘍の完全切除は長期の無病生存(DFS)と関連しうる。[ 2 ][証拠レベル:3iiiDii]GISTは化学療法薬への感受性が低いため、標準化学療法は用いられない。[ 3 ][ 4 ][ 5 ][ 6 ]GIST患者の管理において放射線療法が役割を担うことはまれである;放射線療法はときに、限局性の巨大肝転移を有するか、腹壁または骨盤壁に固着した単一の大きな転移病変を有する患者の疼痛管理に用いられる。[ 1 ][証拠レベル:2Div]腫瘍が2cm以下で、高倍率視野50視野当たりの有糸分裂指数が5以下の場合に手術が必要であるかどうかについては、議論の余地がある。このような腫瘍が進行および転移する割合は低いと考えられているが[ 7 ]、正確な絶対割合は不明である。内視鏡サーベイランスが選択肢の1つである。
外科的療法
手術は典型的に、以下のタイプの患者に対する初期治療である:
- 転移を認めない原発GIST患者。
- 腫瘍が技術的に切除可能で、罹病のリスクが受け入れられる程度である患者。
GISTの外科的治療における目標は、無傷の偽被膜(pseudocapsule)および顕微鏡的切除断端陰性を伴う肉眼的完全切除である。[ 4 ]GISTではリンパ節転移がまれであるため、臨床的に転移が認められないリンパ節のリンパ節郭清は不要である。
GISTの管理における腹腔鏡手術の役割を研究したプロスペクティブ・ランダム化試験は実施されていないが、以下に記す数件の研究では、胃腫瘍でこの外科的アプローチの役割が示されている:
- 腫瘍径0.5cm~10.5cmの胃腫瘍患者33人を対象にした1件のレトロスペクティブ研究では、腹腔鏡手術によりすべての肉眼的腫瘍の切除に成功しており、入院期間が短く、罹病率が低かった。平均13ヵ月の追跡で再発は観察されなかった。[ 8 ][証拠レベル:3iiDii]
- 60人の患者を対象にした別のレトロスペクティブ研究において、腹腔鏡下または腹腔鏡補助下で2cm~5cmのGISTを切除したところ、超低リスク群および低リスク群の5年DFSは100%であったのに対し、中リスク群および高リスク群の5年DFSは89.9%であった;腫瘍径が4cm未満の腫瘍では局所または遠隔再発は観察されなかった。[ 9 ][証拠レベル:3iiDi]
- 胃GIST(平均腫瘍径 = 4.4cm)を腹腔鏡下または腹腔内視鏡で切除し、プロスペクティブに集められたデータベースで確認された連続50人の患者を対象にした別の研究では、46人の患者(92%)が平均36ヵ月の追跡時に無病状態であることが明らかにされた。[ 10 ][証拠レベル:3iiDi]
かろうじて切除可能と考えられるが、大きな腫瘍またはアプローチが困難な小さなGISTを有する患者には、イマチニブの術前補助療法を用いることができる。また、切除不能と考えられる原発限局性GIST患者は、しばしばイマチニブで治療される。[ 4 ][ 11 ]
化学療法
TKIによる分子標的治療が出現する以前に行われていた、従来の細胞毒性化学療法を用いてGISTを治療する努力は、実質的に無益であった。[ 1 ]化学療法に対するGISTの極端な抵抗性は、一部には、化学療法薬がGIST細胞において細胞内治療濃度に達することを妨げる細胞内排出ポンプである、MDR-1(多剤耐性-1)遺伝子産物のP糖蛋白、およびMRP1(多剤耐性蛋白-1)の発現増加が原因の可能性がある。[ 1 ][ 12 ]標準化学療法はGISTの一次治療には全く効果がないと、一般的に意見が一致している。[ 4 ][ 5 ][ 6 ]
チロシンキナーゼ阻害剤療法
TKIはGISTの管理に革命をもたらした。TKIのメシル酸イマチニブは、切除不能、転移性、または再発GISTの第一選択治療として用いられる。完全奏効はまれであるが、イマチニブ開始後、転移性または切除不能GIST患者の大多数で部分奏効または疾患の安定化が得られる。生存期間中央値は、イマチニブ療法の出現以降、2年未満から5年を超えるまでに伸びている。[ 13 ]
腫瘍体積を縮小させるためのイマチニブの術前補助療法は、切除により許容できない罹病のリスクが考えられる非常に大きな原発GIST患者に用いられることがある。[ 11 ]原発GISTの切除後によく見られる再発をイマチニブにより減少させられるかどうかを判断するため、イマチニブを補助的に投与する追加治療が研究される予定である。[ 4 ]
イマチニブ療法中止後の疾患進行が報告されているため、切除不能または転移性疾患を有する患者では、疾患が進行せず、患者の耐容性が許す限り、TKIによる治療がしばしば無期限に続けられる。[ 1 ][ 14 ]少なくとも1年間のイマチニブ療法後に疾患が安定している進行性GIST患者58人がイマチニブの継続(n = 26)または中止(n = 32)(疾患が進行した場合には再開)にランダムに割り付けられた1件の多施設試験において、各群のそれぞれ8人および26人の患者で中央値で18ヵ月および6.1ヵ月時に進行が認められた(P < 0.0001)。しかしながら、イマチニブ中止群で進行した患者26人中24人では、イマチニブを再開すると再び奏効が得られた。[ 14 ][証拠レベル:1iiDiii]2群間で全生存率(OS)、イマチニブ耐性の発生、またはQOLにおける差は認められなかった。[ 14 ][証拠レベル:1iiAおよび1iiC]
薬物の投与量および投与スケジュール
切除不能または転移性GIST患者は、メシル酸イマチニブ400mg/日の初回用量で治療し、フッ素18-フルオロデオキシグルコース-ポジトロン放射断層撮影(18F-FDG PET)またはコンピュータ断層撮影で治療効果をモニタリングする;進行性疾患の患者には、400mg、1日2回への用量増加が適切であると考えられるが、イマチニブ療法の開始から2ヵ月以内に進行する患者を救える可能性は低い。[ 4 ][ 15 ][ 16 ][ 17 ]KITエクソン9変異を有するGIST患者には、800mg/日の初回用量が適切であろう。[ 18 ]イマチニブの投与量を増加させても疾患が急速に進行する場合は、イマチニブ耐性が一次性であると考えられるが、これが起こるのは患者の20%未満のようである;一部の研究者は、一次性のイマチニブ耐性を伴うGISTにはKITが関与しない別のがん原性シグナル伝達経路に突然変異が存在すると推測している。[ 1 ][ 19 ][ 20 ]
イマチニブで治療される患者の大多数では、初期反応が得られた後に遅発性のイマチニブ耐性が発生するために、最終的には疾患が進行する。ほとんどの症例では、遅発性の耐性は、KITをコードする配列の別の部分における二次性の変異と関連している。[ 20 ][ 21 ]
比較的高用量のイマチニブで増悪する切除不能GIST患者には一般的に、経口のTKIであるスニチニブリンゴ酸塩が投与され、局所増悪を来した患者は切除の候補者となる。[ 22 ]スニチニブはイマチニブと比較して特異性が低く、KITおよびPDGFRだけでなく、血管内皮増殖因子受容体(VEGFR 1-3)やFMS様チロシンキナーゼ3(FLT3)、コロニー刺激因子1受容体(CSF-1R)、RETも阻害し、抗血管新生活性を示す。[ 23 ][ 24 ][ 25 ]GISTを治療するため、ほかにも多くの標的治療薬が開発中であり、これには、さまざまなキナーゼ阻害剤、IPI-504などの熱ショックタンパク質90(Hsp90)阻害剤、mTOR阻害剤のRAD001、ヒストン脱アセチル化酵素阻害剤が挙げられる。[ 3 ][ 26 ]
イマチニブまたはスニチニブによる治療は、患者に臨床的生存利益が認められ、疾患が安定している限り継続できる。[ 4 ]
キナーゼ阻害剤への反応
KITおよびPDGFRA突然変異解析は、選択的TKIを用いた治療を受けている切除不能、転移性、または再発GIST患者におけるキナーゼ阻害剤への反応を予測する場合に役立つ場合がある。[ 18 ][ 27 ][ 28 ][ 29 ][ 30 ]しかしながら、データは予備的であり、治療法を決定するために突然変異解析が日常的に行われているわけではない。現在のところ、突然変異解析に基づいた治療法の決定によりOSが改善するという証拠はない。768人の患者に400mg~800mg/日の用量でイマチニブを投与した4件の試験では、腫瘍の遺伝子型は客観的完全奏効および部分奏効(表2を参照のこと)と相関している。[ 3 ]これら768人の遺伝子型が調べられたGISTについて、KITエクソン11変異、KITエクソン9変異、および野生型(KITまたはPDGFRA変異を認めない)GISTに対する客観的奏効率はそれぞれ、71%、38%、および28%(加重平均値)であった;イマチニブ療法に対する一次耐性率はそれぞれ、5%、16%、および23%であった。
表2.チロシンキナーゼの遺伝子型とイマチニブ療法への反応との関係a European Phase I/II B-2222 Phase II European/Australasian Phase III North American Phase III N = サンプル数、観察数;NR = 報告なし。 aAnnual review of pathology by ANNUAL REVIEWS, INC. Reproduced with permission of ANNUAL REVIEWS, INC., in the format Internet posting via Copyright Clearance Center.[ 3 ] b[証拠レベル:1iiA、1iiDii、1iiDiv(Phase I)および2A;2Div(Phase II)]c[証拠レベル:1iiDiv]d[証拠レベル:1iiAおよび1iiDiii]e[証拠レベル:1iiDiv] b[証拠レベル:1iiA、1iiDii、1iiDiv(Phase I)および2A;2Div(Phase II)]c[証拠レベル:1iiDiv]d[証拠レベル:1iiAおよび1iiDiii]e[証拠レベル:1iiDiv] b[証拠レベル:1iiA、1iiDii、1iiDiv(Phase I)および2A;2Div(Phase II)]c[証拠レベル:1iiDiv]d[証拠レベル:1iiAおよび1iiDiii]e[証拠レベル:1iiDiv] b[証拠レベル:1iiA、1iiDii、1iiDiv(Phase I)および2A;2Div(Phase II)]c[証拠レベル:1iiDiv]d[証拠レベル:1iiAおよび1iiDiii]e[証拠レベル:1iiDiv] fB-2222についてはSouthwest Oncology Group(SWOG)基準、残りの試験についてはRECIST基準(Response Evaluation Criteria in Solid Tumors)により完全奏効または部分奏効を定義;評価不可能な患者を除外。 gKIT 9群および野生型群(KITまたはPDGFRA変異を認めない)と比較して統計的に有意な差。 研究参加者 (N = 37) (N = 127) (N = 377) (N = 324) 客観的奏効f KITエクソン11 83 (24) 83g(85) 70g(248) 67g(211) KITエクソン9 25 (4) 48 (23) 35 (58) 40 (25) 野生型 33 (6) 0 (9) 25 (52) 39 (33) 進行性疾患 KITエクソン11 4 5 3 NR KITエクソン9 0 17 17 NR 野生型 33 56 19 NR キナーゼ遺伝子型は無増悪生存(PFS)およびOSと相関するようである。KITエクソン11変異を有するGIST患者に対する腫瘍増悪までの期間(TTP)中央値は、KITエクソン9または野生型のキナーゼ遺伝子型のGIST患者に対するTTP中央値よりも1年以上長いことが報告されている;KITエクソン11変異患者のOSについても、他の一般的な遺伝子型のサブセットと比較すると、同様の恩恵が報告されている。[ 3 ]European/Australasian Phase III Trialのサブセット解析において、KITエクソン9変異を有するGIST患者のPFSは、患者がイマチニブ400mg/日で治療された場合と比較して800mg/日で治療された場合に有意に良好であり(P = 0.0013)、相対リスクが61%低下したことが明らかにされた。[ 18 ][証拠レベル:1iiDiii]したがって、すべてではないものの一部のGISTの専門家は、ルーチンの腫瘍タイピングおよびKITエクソン9変異の有無に基づくイマチニブ投与量の選択を推奨している。[ 3 ][ 4 ]
薬物副作用とその他の考慮事項
イマチニブ療法と関連する最も一般的な毒性作用(これらはすべて、長期の治療で改善しうる)には以下のものがある:[ 5 ][ 16 ][ 17 ][ 34 ][ 35 ]
- 体液貯留(特に眼窩周囲浮腫や末梢浮腫;ときに胸水または腹水)。
- 下痢。
- 吐き気(食事と一緒に投与すると減弱しうる)。
- 疲労。
- 筋痙攣。
- 腹痛。
- 発疹。
- 軽い(大球性)貧血。
(上述の毒性作用のいくつかに関する詳しい情報については、リンパ浮腫[浮腫]、消化管の合併症[下痢]、がん治療に関連した吐き気と嘔吐、疲労[疲労および貧血]、およびがん性疼痛に関するPDQ要約を参照のこと。)
イマチニブにより致死的副作用が発現し、最大限の支持療法でも管理できない患者には、スニチニブによる治療を考慮される。[ 4 ]スニチニブと関連する一般的な副作用には以下のものがある:[ 22 ][ 36 ]
- 疲労。
- 吐き気と嘔吐。
- 貧血。
- 好中球減少。
- 下痢。
- 腹痛。
- 粘膜炎。
- 食欲不振。
- 皮膚または毛髪の変色。
- 甲状腺機能低下症(無症候性甲状腺機能低下症を発見するには、一般的にTSHによる甲状腺機能のモニタリングが推奨される)。
(上述のいくつかに関する詳しい情報については、がん医療における栄養に関するPDQ要約を参照のこと。)
これらより頻度が低い毒性作用としては、出血、発熱、および手足症候群が挙げられる。[ 22 ]
スニチニブによる治療は、心毒性を引き起こすこともある。イマチニブ耐性転移性GISTの治療におけるスニチニブの効力を研究する第I/II相試験のレトロスペクティブ研究では、反復サイクルのスニチニブを投与された患者75人中8%がうっ血性心不全を経験し、47%が高血圧(>150/100mm Hg)を発症した;少なくとも10%以上の左室駆出率の低下が患者の28%に認められた。[ 37 ][証拠レベル:3iiB]
多くの他の薬物や特定の果物ジュース(例、グレープフルーツ、ザクロ)は、イマチニブやスニチニブなどのTKIの代謝に関与する主要な酵素であるチトクロムP450アイソザイム3A4(CYP450 3A4)を誘導または阻害することで、これらTKIの血漿濃度を変化させることがある。[ 4 ][ 38 ][ 39 ][ 40 ][ 41 ][ 42 ]CYP450 3A4の濃度に影響する薬物を投与されている患者では、TKIの用量修正またはCYP450 3A4に影響しない医薬品への代替が必要な場合がある。
参考文献- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer : Principles & Practice of Oncology. 11th ed. Philadelphia, Pa: Wolters Kluwer, 2019, pp 895-906.[PUBMED Abstract]
- Judson I, Demetri G: Advances in the treatment of gastrointestinal stromal tumours. Ann Oncol 18 (Suppl 10): x20-4, 2007.[PUBMED Abstract]
- Corless CL, Heinrich MC: Molecular pathobiology of gastrointestinal stromal sarcomas. Annu Rev Pathol 3: 557-86, 2008.[PUBMED Abstract]
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.[PUBMED Abstract]
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002.[PUBMED Abstract]
- Edmonson JH, Marks RS, Buckner JC, et al.: Contrast of response to dacarbazine, mitomycin, doxorubicin, and cisplatin (DMAP) plus GM-CSF between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Cancer Invest 20 (5-6): 605-12, 2002.[PUBMED Abstract]
- Miettinen M, Sobin LH, Lasota J: Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 29 (1): 52-68, 2005.[PUBMED Abstract]
- Huguet KL, Rush RM, Tessier DJ, et al.: Laparoscopic gastric gastrointestinal stromal tumor resection: the mayo clinic experience. Arch Surg 143 (6): 587-90; discussion 591, 2008.[PUBMED Abstract]
- Otani Y, Furukawa T, Yoshida M, et al.: Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 139 (4): 484-92, 2006.[PUBMED Abstract]
- Novitsky YW, Kercher KW, Sing RF, et al.: Long-term outcomes of laparoscopic resection of gastric gastrointestinal stromal tumors. Ann Surg 243 (6): 738-45; discussion 745-7, 2006.[PUBMED Abstract]
- Bonvalot S, Eldweny H, Péchoux CL, et al.: Impact of surgery on advanced gastrointestinal stromal tumors (GIST) in the imatinib era. Ann Surg Oncol 13 (12): 1596-603, 2006.[PUBMED Abstract]
- Plaat BE, Hollema H, Molenaar WM, et al.: Soft tissue leiomyosarcomas and malignant gastrointestinal stromal tumors: differences in clinical outcome and expression of multidrug resistance proteins. J Clin Oncol 18 (18): 3211-20, 2000.[PUBMED Abstract]
- Blanke CD, Demetri GD, von Mehren M, et al.: Long-term results from a randomized phase II trial of standard- versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT. J Clin Oncol 26 (4): 620-5, 2008.[PUBMED Abstract]
- Blay JY, Le Cesne A, Ray-Coquard I, et al.: Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French Sarcoma Group. J Clin Oncol 25 (9): 1107-13, 2007.[PUBMED Abstract]
- Verweij J, Casali PG, Zalcberg J, et al.: Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 364 (9440): 1127-34, 2004.[PUBMED Abstract]
- Verweij J, van Oosterom A, Blay JY, et al.: Imatinib mesylate (STI-571 Glivec, Gleevec) is an active agent for gastrointestinal stromal tumours, but does not yield responses in other soft-tissue sarcomas that are unselected for a molecular target. Results from an EORTC Soft Tissue and Bone Sarcoma Group phase II study. Eur J Cancer 39 (14): 2006-11, 2003.[PUBMED Abstract]
- Benjamin RS, Rankin C, Fletcher C, et al.: Phase III dose-randomized study of imatinib mesylate (STI571) for GIST: Intergroup S0033 early results. [Abstract] Proceedings of the American Society of Clinical Oncology 22: A-3271, 2003.[PUBMED Abstract]
- Debiec-Rychter M, Sciot R, Le Cesne A, et al.: KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 42 (8): 1093-103, 2006.[PUBMED Abstract]
- Kindblom LG, Meis-Kindblom J, Bümming P, et al.: Incidence, prevalence, phenotype and biologic spectrum of gastrointestinal stromal cell tumors (GIST): a population-based study of 600 cases. [Abstract] Ann Oncol 13 (Suppl 5): A-577O, 157, 2002..[PUBMED Abstract]
- Gramza AW, Corless CL, Heinrich MC: Resistance to Tyrosine Kinase Inhibitors in Gastrointestinal Stromal Tumors. Clin Cancer Res 15 (24): 7510-7518, 2009.[PUBMED Abstract]
- Desai J, Shankar S, Heinrich MC, et al.: Clonal evolution of resistance to imatinib in patients with metastatic gastrointestinal stromal tumors. Clin Cancer Res 13 (18 Pt 1): 5398-405, 2007.[PUBMED Abstract]
- Demetri GD, van Oosterom AT, Garrett CR, et al.: Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 368 (9544): 1329-38, 2006.[PUBMED Abstract]
- O'Farrell AM, Abrams TJ, Yuen HA, et al.: SU11248 is a novel FLT3 tyrosine kinase inhibitor with potent activity in vitro and in vivo. Blood 101 (9): 3597-605, 2003.[PUBMED Abstract]
- Mendel DB, Laird AD, Xin X, et al.: In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors: determination of a pharmacokinetic/pharmacodynamic relationship. Clin Cancer Res 9 (1): 327-37, 2003.[PUBMED Abstract]
- Murray LJ, Abrams TJ, Long KR, et al.: SU11248 inhibits tumor growth and CSF-1R-dependent osteolysis in an experimental breast cancer bone metastasis model. Clin Exp Metastasis 20 (8): 757-66, 2003.[PUBMED Abstract]
- Wagner AJ, Morgan JA, Chugh R, et al.: Inhibition of heat shock protein 90 (Hsp90) with the novel agent IPI-504 in metastatic GIST following failure of tyrosine kinase inhibitors (TKIs) or other sarcomas: clinical results from phase I trial. [Abstract] J Clin Oncol 26 (suppl 15): A-10503, 2008.[PUBMED Abstract]
- Singer S, Rubin BP, Lux ML, et al.: Prognostic value of KIT mutation type, mitotic activity, and histologic subtype in gastrointestinal stromal tumors. J Clin Oncol 20 (18): 3898-905, 2002.[PUBMED Abstract]
- Kim TW, Lee H, Kang YK, et al.: Prognostic significance of c-kit mutation in localized gastrointestinal stromal tumors. Clin Cancer Res 10 (9): 3076-81, 2004.[PUBMED Abstract]
- Andersson J, Bümming P, Meis-Kindblom JM, et al.: Gastrointestinal stromal tumors with KIT exon 11 deletions are associated with poor prognosis. Gastroenterology 130 (6): 1573-81, 2006.[PUBMED Abstract]
- Antonescu CR: Targeted therapy of cancer: new roles for pathologists in identifying GISTs and other sarcomas. Mod Pathol 21 (Suppl 2): S31-6, 2008.[PUBMED Abstract]
- Debiec-Rychter M, Dumez H, Judson I, et al.: Use of c-KIT/PDGFRA mutational analysis to predict the clinical response to imatinib in patients with advanced gastrointestinal stromal tumours entered on phase I and II studies of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer 40 (5): 689-95, 2004.[PUBMED Abstract]
- Heinrich MC, Corless CL, Demetri GD, et al.: Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 21 (23): 4342-9, 2003.[PUBMED Abstract]
- Heinrich MC, Shoemaker JS, Corless CL, et al.: Correlation of target kinase genotype with clinical activity of imatinib mesylate (IM) in patients with metastatic GI stromal tumors (GISTs) expressing KIT (KIT+). [Abstract] J Clin Oncol 23 (Suppl 16): A-7, 3s, 2005.[PUBMED Abstract]
- Dagher R, Cohen M, Williams G, et al.: Approval summary: imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors. Clin Cancer Res 8 (10): 3034-8, 2002.[PUBMED Abstract]
- van Oosterom AT, Judson I, Verweij J, et al.: Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 358 (9291): 1421-3, 2001.[PUBMED Abstract]
- Wolter P, Stefan C, Decallonne B, et al.: The clinical implications of sunitinib-induced hypothyroidism: a prospective evaluation. Br J Cancer 99 (3): 448-54, 2008.[PUBMED Abstract]
- Chu TF, Rupnick MA, Kerkela R, et al.: Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib. Lancet 370 (9604): 2011-9, 2007.[PUBMED Abstract]
- Frye RF, Fitzgerald SM, Lagattuta TF, et al.: Effect of St John's wort on imatinib mesylate pharmacokinetics. Clin Pharmacol Ther 76 (4): 323-9, 2004.[PUBMED Abstract]
- Dutreix C, Peng B, Mehring G, et al.: Pharmacokinetic interaction between ketoconazole and imatinib mesylate (Glivec) in healthy subjects. Cancer Chemother Pharmacol 54 (4): 290-4, 2004.[PUBMED Abstract]
- de Groot JW, Zonnenberg BA, Plukker JT, et al.: Imatinib induces hypothyroidism in patients receiving levothyroxine. Clin Pharmacol Ther 78 (4): 433-8, 2005.[PUBMED Abstract]
- Bolton AE, Peng B, Hubert M, et al.: Effect of rifampicin on the pharmacokinetics of imatinib mesylate (Gleevec, STI571) in healthy subjects. Cancer Chemother Pharmacol 53 (2): 102-6, 2004.[PUBMED Abstract]
- O'Brien SG, Meinhardt P, Bond E, et al.: Effects of imatinib mesylate (STI571, Glivec) on the pharmacokinetics of simvastatin, a cytochrome p450 3A4 substrate, in patients with chronic myeloid leukaemia. Br J Cancer 89 (10): 1855-9, 2003.[PUBMED Abstract]
- 切除可能な原発GIST
-
消化管間質腫瘍(GIST)の外科的療法における一般原則には以下のものがある:
- 腫瘍径が2cm以上のすべてのGISTはきまって切除される;腫瘍径が2cm未満で偶然発見されたGISTの管理については、議論の余地が残されている。肉眼的病変はすべて完全切除されたものの、切除断端が顕微鏡的に陽性の場合に、患者が再切除を受けるべきであるという証拠はない;これらの患者には、注意深い経過観察およびイマチニブの補助的投与が適切であろう。[ 1 ][ 2 ]一般に、腫瘍径が5cm以下の胃GISTは、腹腔鏡ウェッジ切除術で切除される。GISTが局所領域リンパ節に転移することはまれであるため、広範囲のリンパ節切除または広範囲切除が適応となることはまれである。これらの腫瘍の偽被膜は脆弱なため、手術中は偽被膜を破裂させないよう注意が必要である(偽被膜の破裂は腹膜播種の原因となる)。
- 限局性病変を完全切除されたGIST患者に対する術後補助イマチニブを用いる治療が研究段階にある。これらの患者は、外科的切除後の再燃および死亡リスクに関しては非常に不均質な集団である(表1を参照のこと)。肉眼的完全切除後の再燃リスクは、分裂像数、腫瘍径、腫瘍部位によっては、かなり高くなることがある。2件の試験の結果から、限局性原発GISTの完全切除後に投与する補助イマチニブは再発を減少させることが示唆されている。[
3
][
4
]ただし、補助療法による再発率の改善が、生存率の改善につながるかどうかは不明である。それに加えて、補助イマチニブの最適期間は明らかにされていない。
1件の単群オープンラベル多施設第II相研究(ACOSOG-Z9000)において、患者は再発リスクの高い(10cmを超える腫瘍径、腫瘍破裂、または5つ未満の腹腔内転移)KIT発現原発GISTの肉眼的完全切除を受け、イマチニブを1年間毎日投与された。胃GIST(50%)および小腸GIST(42%)で腫瘍径中央値が13cmであった患者107人が、追跡期間中央値4年の時点で評価可能であった。1年、2年、3年全生存(OS)率はそれぞれ、99%、97%、97%であったのに対し、1年、2年、3年無再発生存(RFS)率はそれぞれ、94%、73%、61%であった。[ 4 ][証拠レベル:3iiiDiii]
1件のランダム化二重盲検第III相試験(ACOSOG-Z9001)では、腫瘍径が少なくとも3cm以上で、KITを発現している原発GISTを肉眼的に完全切除された患者713人が、1年間のイマチニブ(400mg/日)またはプラセボで治療された。[ 3 ]この試験の当初の主要エンドポイントはOSであった。しかしながら、進行性または再発疾患に対するイマチニブの効力の結果、GISTによる全死亡率は低いことが明確になった時点で、エンドポイントは研究者によりRFSに変更された。試験はその後、イマチニブ群に割り付けられた患者の1年RFSが98%であったのに対し、プラセボ群に割り付けられた患者の1年RFSは83%であった(HR = 0.35;95%信頼区間[CI]、0.22-0.53;P < 0.0001)ことを示す中間解析の結果が得られたため、早期に中止された。この試験では生活の質(QOL)が測定されなかったため、RFSの延長が患者のQOL改善につながったかどうかは不明である。2群間でOSの差は観察されなかったが、これはおそらく試験の追跡期間がかなり短く、クロスオーバーデザインであったためであろう。[ 3 ][証拠レベル:1iDii]試験の48ヵ月経過時には、当初のイマチニブ治療群患者359人中5人(約1%)が死亡し、当初のプラセボ投与群患者354人中8人(約2%)が死亡した(P = 0.47)。イマチニブは、再燃時でも同様に十分治療できる、1つの再発腫瘍を有する患者において、再発を単に遅らせただけかもしれない。実際、両群のRFS曲線は約30ヵ月の追跡後は収束しているようであった。RFSの改善がOSの改善につながるかどうかという問題への解答は、現在進行中のIntergroup試験(EORTC-62024)(患者を2年間の補助イマチニブ vs 観察にランダムに割り付け、OSを主要エンドポイントとした)で明らかになるであろう。
補助イマチニブの全般的な影響については現在のところ不明確であるため、患者と意思決定を共有することが重要である。イマチニブを1年以上投与すると費用が高くなるため、患者が自己負担で支払わなければならない金額の情報は、検討を伝える際に有用な場合がある。[ 5 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.[PUBMED Abstract]
- Otani Y, Furukawa T, Yoshida M, et al.: Operative indications for relatively small (2-5 cm) gastrointestinal stromal tumor of the stomach based on analysis of 60 operated cases. Surgery 139 (4): 484-92, 2006.[PUBMED Abstract]
- Dematteo RP, Ballman KV, Antonescu CR, et al.: Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet 373 (9669): 1097-104, 2009.[PUBMED Abstract]
- DeMatteo RP, Owzar K, Antonescu CR, et al.: Efficacy of adjuvant imatinib mesylate following complete resection of localized, primary gastrointestinal stromal tumor (GIST) at high risk of recurrence: the U.S. Intergroup phase II trial ACOSOG Z9000. [Abstract] American Society of Clinical Oncology 2008 Gastrointestinal Cancers Symposium, 25-27 January 2008, Orlando, FL. A-8, 2008.[PUBMED Abstract]
- Kelley RK, Venook AP: Nonadherence to imatinib during an economic downturn. N Engl J Med 363 (6): 596-8, 2010.[PUBMED Abstract]
- 切除不能な原発GIST
-
イマチニブの術前補助療法が評価段階にある。イマチニブの術前補助療法は、非常に大きな原発消化管間質腫瘍(GIST)または予後不良な位置にある小さなGIST(切除すると許容できない罹病や機能的欠損のリスクが考えられる)を有する患者に対して外科的療法が実施可能となるまで用いられ、それは6~12ヵ月に及ぶこともある。[ 1 ][ 2 ]この状況におけるイマチニブの生存利益について扱った比較試験は実施されていないため、イマチニブの術前補助療法が全生存(OS)に及ぼす影響は不明である。イマチニブの術前補助療法により手術不能を手術可能に転換できた割合でさえも明確に定義されていない。したがって、イマチニブの術前補助療法の優位性は、現在のところ理論的なものである。
突然変異解析は、イマチニブ腫瘍減量療法前に感受性のない突然変異を除外するため、またはイマチニブ初回用量の増量が潜在的に必要なKITエクソン9変異が腫瘍に認められるかどうかを判断するために役立つであろう。[ 1 ][ 3 ]追跡は短い間隔で実施し、できる限りフッ素18-フルオロデオキシグルコース-ポジトロン放射断層撮影(18F-FDG PET)を用いて治療への反応を評価する。[ 1 ][ 4 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.[PUBMED Abstract]
- Bonvalot S, Eldweny H, Péchoux CL, et al.: Impact of surgery on advanced gastrointestinal stromal tumors (GIST) in the imatinib era. Ann Surg Oncol 13 (12): 1596-603, 2006.[PUBMED Abstract]
- Debiec-Rychter M, Sciot R, Le Cesne A, et al.: KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 42 (8): 1093-103, 2006.[PUBMED Abstract]
- Gayed I, Vu T, Iyer R, et al.: The role of 18F-FDG PET in staging and early prediction of response to therapy of recurrent gastrointestinal stromal tumors. J Nucl Med 45 (1): 17-21, 2004.[PUBMED Abstract]
- 転移性または再発GIST
-
転移性または再発消化管間質腫瘍(GIST)患者の一次治療は、チロシンキナーゼ阻害剤(TKI)を用いた内科的治療である;一部の症例では、外科的療法を追加することができる。これらの治療に反応しない転移性または再発腫瘍患者は、臨床試験の候補者になりうる。
- 転移性または再発疾患患者には、イマチニブによる治療が標準である。初回用量は400mg~600mg/日であるが、KITエクソン9変異が見られる腫瘍の患者は例外で800mg/日の投与を受ける。[
1
]治療への反応は、コンピュータ断層撮影(CT)、磁気共鳴画像法(MRI)、またはフッ素18-フルオロデオキシグルコース-ポジトロン放射断層撮影(18F-FDG PET)により評価される。[
2
][
3
][
4
][
5
][
6
]治療は通常、疾患進行または許容できない毒性作用がなければ、無期限に継続される。[
3
][
7
]
治癒不能進行性GIST患者746人を対象にした1件の第III相ランダム化試験では、一次全身療法として実施した比較的高用量のイマチニブ800mg/日の治療は、低用量の400mg/日の治療を上回る優位性を示さなかった;客観的奏効率、無増悪生存期間、または全生存期間(OS)における統計的有意差は観察されなかった。[ 8 ][証拠レベル:1iiA;1iiDiii;および1iiDiv]
しかしながら、進行性GIST患者946人を対象に用量選択について調査した第II相ランダム化試験(EORTC-62005[NCT00685828I])では、377人の患者から採取したGISTの治療前標本を分析し、KIT遺伝子突然変異の有無が調べられた;腫瘍にKITエクソン9変異が発現しており、イマチニブ800mg/日の投与で治療された患者では、(400mg/日投与と比較して)有意に優れたPFS(P = 0.0013)が得られ、相対リスクは61%低下した。[ 1 ][証拠レベル:1iiDiii]
低用量のイマチニブ(すなわち、400mg-600mg/日)でKITエクソン9変異のない腫瘍が増悪する場合は、イマチニブの用量を800mg/日(分割投与)に増量できる。また、イマチニブ耐性の管理には、患者は低用量のイマチニブ投与からスニチニブ投与に直接切り替えられる。[ 9 ]
- 腫瘍増悪またはイマチニブに不耐の場合、第二選択の標準療法は、スニチニブ、50mg/日の用量で4週間投与/2週間休薬のレジメンで構成される。あるいは、37.5mg/日の用量のレジメンが用いられることもある。[
10
]スニチニブ療法への反応はイマチニブ療法と同様に、CT、MRI、または18F-FDG PETにより評価し、治療は通常、疾患進行または許容できない毒性作用がなければ、無期限に継続される。[
2
][
3
][
11
]
イマチニブ耐性GIST患者312人を対象にしたランダム化比較試験において、放射線学的評価に基づく腫瘍増悪までの期間中央値は、スニチニブ治療群(27.3週間、95%信頼区間[CI]、16.0-32.1)の方がプラセボ投与群(6.4週間、95%CI、4.4-10.0;ハザード比[HR] = 0.33;95%CI、0.23-0.47;P < 0.0001)よりも4倍以上長かった。全生存も同様にスニチニブ治療群患者(死亡のHR = 0.49;95%CI、0.29-0.83)の方が優れていた。[ 10 ][証拠レベル:1iA]
疾患増悪が限局性の患者は、耐えられる用量でイマチニブまたはスニチニブを継続すべきであると示唆されている。大容積腫瘍に対しイマチニブを投与されている患者では、5%に血小板減少を伴わない腫瘍出血のリスクがある[ 12 ][ 13 ];したがって、高リスクの大きな腫瘍を有する患者は、イマチニブ療法の開始から4~8週間はヘモグロビン値低下の証拠がないか、きわめて綿密にモニタリングされる。持続性の過剰な毒性が見られる症例ではTKI療法の用量減量、投与中断、または中止が必要な場合があるため、TKI療法を受けている患者はすべて、腫瘍の反応および副作用を綿密にモニタリングされる。また、CYP450 3A4の濃度に影響する薬物を投与されている患者では、TKIの用量修正またはCYP450 3A4の濃度に影響しない医薬品への代替が必要な場合がある。[ 3 ]
- 一部のGIST患者では再発を遅らせるか、回避する試みとして内科的療法に手術が追加されることがあるが、転移性GISTにおけるこの治療アプローチの生存利益はランダム化臨床試験で未だ証明されていない。
切除不能原発または転移性GISTに対し、手術とともにキナーゼ阻害剤の投与も受けた連続69人の患者を対象にしたレトロスペクティブ研究において、疾患が安定したか、増悪が限局性であった患者では減量手技後の生存期間が延長したことが明らかにされた。[ 14 ]この集団のGIST患者について、手術後に疾患安定、限局性増悪、全身性進行を示した患者のそれぞれ78%、25%、7%では疾患の証拠が認められなかった;12ヵ月PFSは疾患安定、限局性増悪、全身性進行を示した患者で80%、33%、0%であった一方、12ヵ月OSは同じ患者のサブセットで95%、86%、0%であった。[ 14 ][証拠レベル:3iiDiiおよび3iiA]この研究の著者らは、全身性進行を示した患者に対する手術は症状緩和目的に限定すべきであると結論付けた。
全体では、転移性または再発GISTの管理における手術の適応には、以下が挙げられる:[ 3 ]
- 安定した疾患(すなわち、TKI療法により疾患が安定または縮小しており、肉眼的切除が可能な場合)。
- 限局性疾患増悪(すなわち、TKI療法で初期に反応が見られた後に増悪している[遅発性の薬物耐性を示す]孤立性腫瘍が認められるが、他の部位の病変は安定したままである)。
- 出血、穿孔、閉塞、膿瘍などの腫瘍学的緊急。
最初の2つの適応症(1および2)は、比較的疾患が安定しているために選択される進行性疾患の患者サブセットを示している。したがって、ケースシリーズで記述されている良好な治療成績は、手術による真の生存利益というよりもむしろ主に選択バイアスの結果である可能性がある。イマチニブ二次耐性が発生するまでの期間中央値は約2年と明らかにされているため[ 15 ]、イマチニブ/スニチニブ投与患者における転移性または再発疾患の手術は2年以内に実施すべきであることが示唆されている。ほとんどの専門家は、TKI療法で疾患安定が得られた6~12ヵ月後に手術を検討すべきであると推奨している。[ 3 ]手術後も薬物療法が継続される場合がある。全身性疾患進行を示す患者は内科的に管理され、臨床試験への登録が考えられる。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Debiec-Rychter M, Sciot R, Le Cesne A, et al.: KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours. Eur J Cancer 42 (8): 1093-103, 2006.[PUBMED Abstract]
- Casali PG, Dei Tos AP, Gronchi A: Gastrointestinal stromal tumor. In: DeVita VT Jr, Lawrence TS, Rosenberg SA, et al., eds.: DeVita, Hellman, and Rosenberg's Cancer : Principles & Practice of Oncology. 11th ed. Philadelphia, Pa: Wolters Kluwer, 2019, pp 895-906.[PUBMED Abstract]
- Demetri GD, Benjamin RS, Blanke CD, et al.: NCCN Task Force report: management of patients with gastrointestinal stromal tumor (GIST)--update of the NCCN clinical practice guidelines. J Natl Compr Canc Netw 5 (Suppl 2): S1-29; quiz S30, 2007.[PUBMED Abstract]
- Blanke CD, von Mehren M, Joensuu H, et al.: Evaluation of the safety and efficacy of an oral molecularly-targeted therapy, STI157, in patients (pts) with unresectable or metastatic gastrointestinal stromal tumors (GISTs) expressing c-kit (CD117). [Abstract] Proceedings of the American Society of Clinical Oncology 20: A-1, 1a, 2001.[PUBMED Abstract]
- van Oosterom AT, Judson I, Verweij J, et al.: Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 358 (9291): 1421-3, 2001.[PUBMED Abstract]
- Choi H, Charnsangavej C, Faria SC, et al.: Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. J Clin Oncol 25 (13): 1753-9, 2007.[PUBMED Abstract]
- Blay JY, Le Cesne A, Ray-Coquard I, et al.: Prospective multicentric randomized phase III study of imatinib in patients with advanced gastrointestinal stromal tumors comparing interruption versus continuation of treatment beyond 1 year: the French Sarcoma Group. J Clin Oncol 25 (9): 1107-13, 2007.[PUBMED Abstract]
- Blanke CD, Rankin C, Demetri GD, et al.: Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 26 (4): 626-32, 2008.[PUBMED Abstract]
- Rutkowski P, Nowecki Z, Nyckowski P, et al.: Surgical treatment of patients with initially inoperable and/or metastatic gastrointestinal stromal tumors (GIST) during therapy with imatinib mesylate. J Surg Oncol 93 (4): 304-11, 2006.[PUBMED Abstract]
- Demetri GD, van Oosterom AT, Garrett CR, et al.: Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 368 (9544): 1329-38, 2006.[PUBMED Abstract]
- Prior JO, Montemurro M, Orcurto MV, et al.: Early prediction of response to sunitinib after imatinib failure by 18F-fluorodeoxyglucose positron emission tomography in patients with gastrointestinal stromal tumor. J Clin Oncol 27 (3): 439-45, 2009.[PUBMED Abstract]
- Demetri GD, von Mehren M, Blanke CD, et al.: Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med 347 (7): 472-80, 2002.[PUBMED Abstract]
- Dagher R, Cohen M, Williams G, et al.: Approval summary: imatinib mesylate in the treatment of metastatic and/or unresectable malignant gastrointestinal stromal tumors. Clin Cancer Res 8 (10): 3034-8, 2002.[PUBMED Abstract]
- Raut CP, Posner M, Desai J, et al.: Surgical management of advanced gastrointestinal stromal tumors after treatment with targeted systemic therapy using kinase inhibitors. J Clin Oncol 24 (15): 2325-31, 2006.[PUBMED Abstract]
- Verweij J, Casali PG, Zalcberg J, et al.: Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial. Lancet 364 (9440): 1127-34, 2004.[PUBMED Abstract]
- 転移性または再発疾患患者には、イマチニブによる治療が標準である。初回用量は400mg~600mg/日であるが、KITエクソン9変異が見られる腫瘍の患者は例外で800mg/日の投与を受ける。[
1
]治療への反応は、コンピュータ断層撮影(CT)、磁気共鳴画像法(MRI)、またはフッ素18-フルオロデオキシグルコース-ポジトロン放射断層撮影(18F-FDG PET)により評価される。[
2
][
3
][
4
][
5
][
6
]治療は通常、疾患進行または許容できない毒性作用がなければ、無期限に継続される。[
3
][
7
]
- 抵抗性/不応性GIST
-
最終的には、消化管間質腫瘍(GIST)患者において、ほぼ例外なくイマチニブとスニチニブ双方への耐性が発生する。耐性が起こった場合の標準治療法はなく、患者には研究的治療を考慮すべきである。さらなる経口TKIが研究段階にある。例えば、1件の予備的ケースシリーズでは、ニロチニブが生物活性を示しているが、生存への影響については不明である。[ 1 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Montemurro M, Schöffski P, Reichardt P, et al.: Nilotinib in the treatment of advanced gastrointestinal stromal tumours resistant to both imatinib and sunitinib. Eur J Cancer 45 (13): 2293-7, 2009.[PUBMED Abstract]
- 本要約の変更点(07/22/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、成人の消化管間質腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Russell S. Berman, MD(New York University School of Medicine)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Gastrointestinal Stromal Tumors Treatment (Adult).Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/soft-tissue-sarcoma/hp/gist-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389157]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する