ご利用について
医療専門家向けの本PDQがん情報要約では、小児頭蓋外胚細胞腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 小児頭蓋外胚細胞腫瘍(GCT)に関する一般情報
-
小児および青年のがん患者の生存において、劇的な改善が達成されている。[ 1 ]1975年から2010年の間に、小児がんの死亡率は50%以上低下した。[ 1 ]2002年から2010年の間に、急性リンパ芽球性白血病、急性骨髄性白血病、ホジキンおよび非ホジキンリンパ腫、神経芽腫、中枢神経系腫瘍、および性腺腫瘍の小児および青年では、がん死亡率が1975年から1998年までと比較して年間2.4%ずつ低下し続けている(1998年から2001年に横ばい状態になっている)。[ 1 ]小児および青年がん生存者では、がん治療による晩期合併症(晩期障害)が持続したり、治療から数ヵ月または数年経過後に発現したりすることがあるため、綿密なモニタリングが必要である。(小児および青年がん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)のPDQ要約を参照のこと。)
GCTは原始胚細胞から発生し、胚形成期に卵黄嚢から腸間膜を経由して性腺に移動する(図1を参照)。[ 2 ][ 3 ]小児の頭蓋外GCTは、以下の2つの型に分類できる:
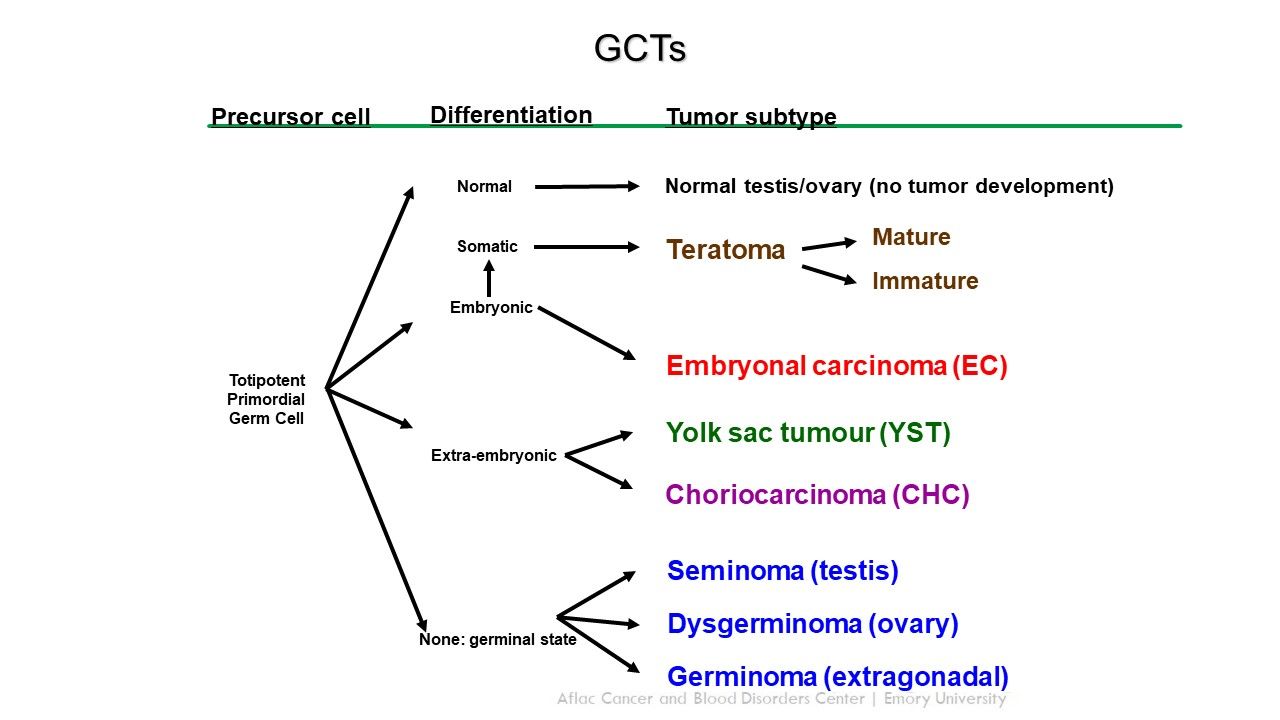
図1.原始胚細胞からの頭蓋外胚細胞の発生。Credit: Thomas Olson, M.D. ほとんどの小児性腺外GCTは正中部位(すなわち、頭頸部、仙尾骨部、縦隔、後腹膜)に発生する;正中線部位の発生は原始胚細胞の異常な胎性の遊走を示している。
小児の頭蓋外GCTは、おおまかに以下のように分類される:
(頭蓋内GCTの治療に関する情報については、小児中枢神経系胚細胞腫瘍の治療に関するPDQ要約を参照のこと。)
発生率
小児GCTは、15歳未満の小児にみられることはまれであり、この年齢層のがんに占める割合は約3%である。[ 4 ][ 5 ][ 6 ][ 7 ]胎児/新生児の年齢集団では、ほとんどの頭蓋外GCTが良性奇形腫で、頭頸部、仙尾骨、および後腹膜を含む正中線部位に生じる。[ 8 ]この年齢集団に発生する悪性奇形腫の割合は小さいにもかかわらず、周産期の腫瘍では、胎児水腫および早産により引き起こされる合併症発生率が高い。[ 9 ][ 10 ][ 11 ]
思春期に発症する頭蓋外GCTの発生率は、15~19歳の青年におけるがんの約14%を占める。
5歳ごとの年齢層別および性別の頭蓋外GCTの発生率を表1に示す。
表1.年齢グループ別および性別ごとの頭蓋外胚細胞腫瘍の発生率a 0~4歳 5~9歳 10~14歳 15~19歳 aSurveillance, Epidemiology, and End Results(SEER)の9つの対象地域 + ロサンゼルスにおける1986年から1995年までの小児100万人当たりの発生率である。 男性 7 0.3 1.4 31 女性 5.8 2.4 7.8 25.3 がん素因
異常な停留精巣(潜伏精巣)の存在は精巣腫瘍の発症リスクに関連し、そのリスクは精巣が正常な個人よりも3.7~7.5倍高くなる。[ 12 ]性腺形成不全にみられるように、腹部内性腺(abdominal gonad)におけるY染色体物質の存在もまた、性腺GCT、特に性腺芽細胞腫の発症リスクを増加させる。[ 13 ][ 14 ]
小児頭蓋外GCTの組織学的分類
小児の頭蓋外GCTは、さまざまな組織像から構成され、おおまかに以下のように分類できる:
頭蓋外GCTの組織学的特徴は不均質で、原発腫瘍の部位、患者の性別と年齢によって異なる。[ 15 ][ 16 ]低年齢の小児に発生する組織学的に同一のGCTは、青年および若年成人に発生するものとは生物学的特徴が異なる。[ 17 ]
成熟奇形腫
成熟奇形腫は、性腺または性腺外部位に発生する。この成熟奇形腫は、小児のGCTで最も多くみられる組織学的亜型である。[ 11 ][ 18 ][ 19 ][ 20 ]成熟奇形腫は、通常、外胚葉、中胚葉、および内胚葉の胚細胞層由来の高分化組織を含み、腫瘍内にいずれの組織型も認められ可能性がある。
成熟奇形腫は良性であるが、インスリン、成長ホルモン、アンドロゲン、およびプロラクチンといった酵素またはホルモンを分泌する成熟奇形腫もある。[ 21 ][ 22 ]
未熟奇形腫
未熟奇形腫は、外胚葉、中胚葉、および内胚葉の胚細胞層由来の組織を含むが、主に神経上皮である未熟な組織も存在する。未熟奇形腫は、腫瘍標本中にみられる未熟神経組織の量に基づき、グレード0~3に分類される。[ 23 ]高悪性度腫瘍は、卵黄嚢腫瘍の病巣をもつ可能性が高い。[ 24 ]未熟奇形腫は悪性の挙動を示し、転移することがある。
未熟奇形腫は、主として幼児の性腺外部位および思春期が近い女児の卵巣に発生するが、腫瘍の悪性度と患者の年齢との間に相関関係はない。[ 24 ][ 25 ]未熟奇形腫の中には、酵素またはバソプレシンのようなホルモンを分泌するものもある。[ 26 ]
悪性GCT
GCTは胚細胞起源の悪性組織を含み、まれに体細胞起源の組織を含むことがある。孤立性の悪性腫瘍の成分は、大部分が成熟しているか、または未成熟な奇形腫のごく一部をなす。[ 25 ][ 27 ]
小児、青年、および若年成人の悪性胚細胞腫瘍は、おおまかに部位によって分類できる(表2を参照のこと)。青年および若年成人の男性では、胚細胞腫(精巣および縦隔セミノーマ)が多くみられ、女性では、卵巣未分化胚細胞腫が多くみられる。
表2.小児、青年、および若年成人における悪性胚細胞腫瘍の組織学a 悪性胚細胞成分 部位 E = 性腺外;O = 卵巣;T = 精巣。 aModified from Perlman et al.[ 28 ] セミノーマ T 未分化胚細胞腫 O 胚細胞腫 E 卵黄嚢腫瘍(内胚葉洞腫瘍) E、O、T 絨毛がん E、O、T 胎児性がん E、T 混合型胚細胞腫瘍 E、O、T GCTの生物学
小児および青年では、生物学的に異なる以下のGCTの亜型がみられる:
分析されている小児GCTの検体はきわめて少ない。小児のGCTと成人のGCTにおける生物学的な差は、絶対的ではない可能性があり、リスクを予測する生物学的因子は明らかになっていない。[ 29 ][ 30 ][ 31 ]
精巣GCT
- 小児(11歳未満):精巣奇形腫および悪性精巣GCTはいずれも小児期の早い時期に確認される。悪性腫瘍は、純粋な卵黄嚢腫瘍(内胚葉洞腫瘍としても知られる)で構成される場合がよくあり、一般的には二倍体または四倍体で、若年成人における精巣腫瘍の特徴である12番染色体短腕の同腕染色体(i12p)が最大で約44%に認められる。[ 29 ][ 32 ][ 33 ][ 34 ][ 35 ][ 36 ]この腫瘍群にみる染色体異常の再発には、1番染色体短腕、4番染色体長腕、および6番染色体長腕の欠失、そして1番染色体長腕、3番染色体、および20番染色体長腕の過剰が報告されている。[ 34 ][ 35 ][ 36 ][ 37 ]
- 青年および若年成人(11歳以上):青年および若年成人集団における精巣GCTでは、ほとんど常にi12pが認められ[ 38 ][ 39 ][ 40 ][ 41 ]、異数体である。[ 32 ][ 41 ]
卵巣GCT
卵巣GCTは主として青年および若年成人女性にみられる。卵巣GCTのほとんどは良性の成熟奇形腫(皮様嚢胞腫)であるが、女性では、未熟奇形腫、未分化胚細胞腫、卵黄嚢腫瘍、および混合型GCTといった悪性GCTの混成群が確かに発生する。悪性卵巣GCTでは、12番染色体の短腕の複製過多がよくみられる。[ 42 ]
性腺外頭蓋外GCT
性腺外頭蓋外GCTは、脳および性腺以外で発生する。
- 小児(11歳未満):これらの腫瘍は一般的に出生時または幼児期にみられる。これらの腫瘍のほとんどは、仙尾骨部に発生する良性奇形腫であるため、Surveillance, Epidemiology, and End Results(SEER)データには含まれていない。[ 43 ][ 44 ]これらの腫瘍の少数例に悪性卵黄嚢腫瘍の組織像が認められる;しかしながら、その腫瘍には、若い男性の精巣に発生する腫瘍に認められるものと類似した細胞遺伝学的異常が認められることがある。[ 33 ][ 34 ][ 35 ][ 37 ]8歳未満の小児における縦隔GCTでは、幼児における仙尾骨および精巣腫瘍と同じ遺伝子上の過剰および欠失がみられる。[ 45 ][ 46 ][ 47 ]
- 年長の小児、青年、および若年成人(11歳以上):年長の小児および青年における性腺外GCTの原発部位では、縦隔内が最も一般的である。[ 19 ]
小児の性腺外頭蓋外GCTと関連している可能性のある遺伝または環境による危険因子に関するデータは、ほとんど得られていない。以下の症候群の患者は、性腺外頭蓋外GCTのリスクが高い:
- クラインフェルター症候群—縦隔GCTのリスクが高い。[ 48 ][ 49 ][ 50 ]小児腫瘍学グループ(COG)のChildhood Cancer Research NetworkからGCTの患者が確認された。この研究の29人の患者は縦隔原発腫瘍を有し、9人の患者(31%)はクラインフェルター症候群を有した。疾病予防管理センターの大規模な2013 WONDERデータベースにおいて、GCTを有する患者の3%にクラインフェルター症候群が認められたのに対し(70%が縦隔)、一般集団の男性におけるクラインフェルター症候群の報告は0.2%であった。[ 51 ]
- スワイヤー症候群—性腺芽細胞腫およびセミノーマのリスクが高い。[ 52 ][ 53 ]
- ターナー症候群—性腺芽細胞腫および未分化胚細胞腫のリスクが高い。[ 54 ][ 55 ]
臨床的特徴
小児の頭蓋外GCTは、精巣、卵巣、縦隔、後腹膜、仙骨、尾骨、頭頸部など、多くの部位に発生する(図2を参照のこと)。[ 8 ]初発時には、各部位に特異的な臨床的特徴がみられる。
良性の奇形腫および未熟奇形腫は閉塞による罹病および死亡の原因となりうる(すなわち、頭頸部の奇形腫)。早産児および新生児では、頭頸部の奇形腫および未熟奇形腫によって重大な気道障害が引き起こされる可能性がある。単施設の報告では、ex-utero intrapartum treatment(EXIT)法を用いることで気道障害が克服されたと記載されている。[ 8 ]奇形腫の完全切除は達成しうる。

図2.脳以外の身体部分における頭蓋外胚細胞腫瘍の種類。これには、精巣、卵巣、仙尾骨(通常は尾骨から生じ、仙骨を含む)、縦隔、および後腹膜が含まれる。 診断的評価および病期評価
GCTの診断的評価には、画像検査および腫瘍マーカー測定がある。疑わしい症例では、手術および/または生検の前に腫瘍マーカーにより診断が示唆されることがある。この情報を集学的チームが使用することで、適切な治療を選択することができる。
腫瘍マーカー
卵黄嚢腫瘍はα-フェトプロテイン(AFP)を産生し、β-ヒト絨毛性ゴナドトロピン(β-hCG)はすべての絨毛がんと一部の胚細胞腫(セミノーマおよび未分化胚細胞腫)および胎児性がんによって産生されるため、これらの物質の血清濃度が上昇する。悪性GCTの小児のほとんどに卵黄嚢腫瘍の成分が認められ、AFP値が上昇しているため[ 56 ][ 57 ]、治療中に連続的にモニターすることで、治療に対する反応が評価しやすくなる。[ 25 ][ 27 ][ 56 ]良性の奇形腫および未熟奇形腫では、AFPおよびβ-hCGの産生量がわずかに上昇することがある。
胎児の肝臓はAFPを産生し、生後1年間の乳児では、GCTの存在とは無関係に、血清AFP値が上昇している。正常な範囲が記述されている。[ 58 ][ 59 ]AFPの血清中消失半減期は5~7日、β-hCGの血清中消失半減期は1~2日である。データは限られているとしても、悪性GCTの小児患者に対しては、全例で化学療法の各サイクルで腫瘍マーカーを測定している。初回化学療法後、腫瘍マーカーが一時的な上昇を示す場合がある。[ 60 ]1件のCOG研究で、GCTに対して化学療法を受けた小児におけるAFP値が測定された。AFPの低下は、AFPが2サイクルの化学療法後に正常化した場合は自動的に十分であると定義され、AFP低下の半減期が化学療法の開始後7日以下であれば十分であると算出された。他のAFPの低下は不十分であると定義された。累積再燃率は、AFPが十分に低下した患者(n = 117)で11%およびAFPの低下が不十分であった患者(n = 14)で38%であった。[ 61 ][証拠レベル:3iiA]
画像検査
画像検査としては、以下のものが考えられる:
- 胸部のコンピュータ断層撮影(CT)スキャン。
- 原発部位のCTまたは磁気共鳴画像法(MRI)。
- 臨床的に適応であれば、放射性核種骨スキャン。
- 臨床的に適応であれば、脳のMRI。
予後因子
頭蓋外GCTの予後因子は多くの状況に左右され、以下のものがある(歴史的な国内GCT試験から得た):[ 56 ][ 62 ][ 63 ][ 64 ]
- 年齢(例、低年齢小児 vs 青年)。
- 病期。
- 原発部位。
- 治療に対する腫瘍マーカーの低下(AFPおよびβ-hCG)。
- 組織像(例えば、セミノーマ vs 非セミノーマ)。
- 性腺形成不全の存在。
予後因子をより良く同定するため、小児および青年における悪性頭蓋外GCTに関する米国の5試験および英国の2試験からのデータが、Malignant Germ Cell Tumor International Collaborativeにより併合された。目的は、化学療法を受けた若年患者519人における重要な予後因子を確認することであり、診断時年齢、病期、および原発部位とともに、治療前のAFP値と組織像が組み込まれた。[ 65 ][証拠レベル:3iiiDii]若年の小児および青年において、これらの因子に関して年齢を焦点にした本研究では、予後因子に以下のものが含まれていた( 図3を参照のこと):[ 65 ]
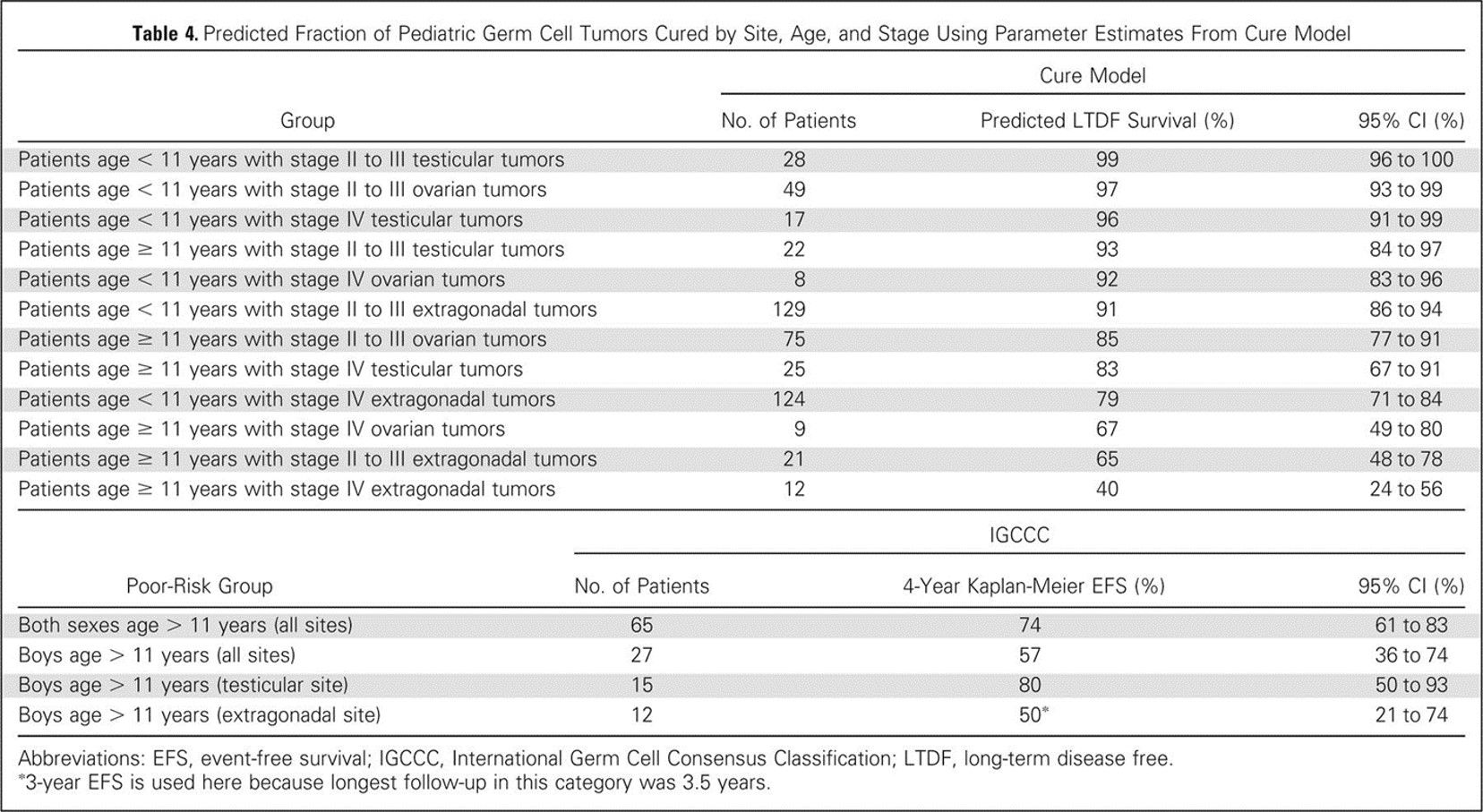
図3.Cure Modelからのパラメータ推定値を用いた小児胚細胞腫瘍の部位、年齢、および病期ごとの治癒の予測割合。許諾を得て掲載。© 2015 American Society of Clinical Oncology.All rights reserved.Frazier AL, Hale JP, Rodriguez-Galindo C, et al: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States.J Clin Oncol, Vol. 33 (Issue 2), 2015: 195-201. 卵巣非ディスジャーミノーマ性腫瘍(ovarian nondysgerminomatous tumor)の性腺形成不全の存在は不良な転帰に関連している。COGのAGCT0132研究からの報告では、性腺形成不全と卵巣非ディスジャーミノーマがみられた7人の患者の3年イベントフリー生存率は推定で67%であったのに対し、性腺形成不全がみられなかった卵巣非ディスジャーミノーマ性腫瘍を有する患者100人では89%であった。[ 14 ]これらの異発生の性腺にはY染色体物質が含まれており、Y染色体物質が認められる腹部内性腺は腫瘍を発症するリスクが高い。[ 12 ][ 13 ]French Society of Pediatric Oncologyからの報告では、非ディスジャーミノーマとは対照的に、卵巣未分化胚細胞腫患者48人中7人で性腺形成不全が確認された。追跡期間中央値14年で、患者全員が生存していた。[ 67 ]
小児のデータはほとんど存在しないが、成人での研究によると、化学療法の初回サイクル後の上昇した腫瘍マーカーの不十分な低下は不良な予後所見であることが示されている。[ 68 ][ 69 ]
(小児性腺外頭蓋外GCTの予後および予後因子に関する詳しい情報については、本要約の小児における成熟奇形腫および未熟奇形腫の治療、小児における悪性性腺GCTの治療、および小児における悪性性腺外頭蓋外GCTの治療のセクションを参照のこと。)
治療後のフォローアップ
頭蓋外GCT小児のモニタリングには、医師の判断により、以下の検査および処置を実施してもよい:
- AFPおよびβ-hCG。6ヵ月間(リスクが最も高い期間)は、AFPおよびβ-hCGの値を毎月1回モニターし、その後は3ヵ月に1回として、計2年間継続する(仙尾骨部奇形腫では3年間)。低リスクおよび中リスクGCTを有する患者を対象にしたCOG試験において、診断時に腫瘍マーカーが高かった48人の患者がサーベイランス期間中に再燃した。再燃時(中央審査後)に、再燃の48例中47例(98%)は腫瘍マーカーの上昇により発見された。[ 70 ][証拠レベル:3iiiDi]
- 画像検査。
- 治療完了時点でMRI/CTを実施してもよい。
- 原発部位のガイド下画像法検査(guided imaging)は最初の1年間は3ヵ月ごとに、2年目は6ヵ月ごとに実施される。セミノーマおよび未分化胚細胞腫は晩期に再発することがあるため、画像検査スケジュールの延長が必要な場合がある。
- 年1回の胸部X線検査。
診断時に腫瘍マーカーが正常な場合は、医師の判断により、以下の検査および処置を実施してもよい:
- 画像検査。胚細胞腫では、超音波検査またはCT/MRIを2年間は3ヵ月おきに、その後の5年間は毎年1回実施してもよい。
参考文献- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- Dehner LP: Gonadal and extragonadal germ cell neoplasia of childhood. Hum Pathol 14 (6): 493-511, 1983.[PUBMED Abstract]
- McIntyre A, Gilbert D, Goddard N, et al.: Genes, chromosomes and the development of testicular germ cell tumors of adolescents and adults. Genes Chromosomes Cancer 47 (7): 547-57, 2008.[PUBMED Abstract]
- Miller RW, Young JL, Novakovic B: Childhood cancer. Cancer 75 (1 Suppl): 395-405, 1995.[PUBMED Abstract]
- Ries LA, Smith MA, Gurney JG, et al., eds.: Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. Bethesda, Md: National Cancer Institute, SEER Program, 1999. NIH Pub.No. 99-4649. Also available online. Last accessed January 31, 2020.[PUBMED Abstract]
- Poynter JN, Amatruda JF, Ross JA: Trends in incidence and survival of pediatric and adolescent patients with germ cell tumors in the United States, 1975 to 2006. Cancer 116 (20): 4882-91, 2010.[PUBMED Abstract]
- Kaatsch P, Häfner C, Calaminus G, et al.: Pediatric germ cell tumors from 1987 to 2011: incidence rates, time trends, and survival. Pediatrics 135 (1): e136-43, 2015.[PUBMED Abstract]
- Dharmarajan H, Rouillard-Bazinet N, Chandy BM: Mature and immature pediatric head and neck teratomas: A 15-year review at a large tertiary center. Int J Pediatr Otorhinolaryngol 105: 43-47, 2018.[PUBMED Abstract]
- Isaacs H: Perinatal (fetal and neonatal) germ cell tumors. J Pediatr Surg 39 (7): 1003-13, 2004.[PUBMED Abstract]
- Heerema-McKenney A, Harrison MR, Bratton B, et al.: Congenital teratoma: a clinicopathologic study of 22 fetal and neonatal tumors. Am J Surg Pathol 29 (1): 29-38, 2005.[PUBMED Abstract]
- Alexander VR, Manjaly JG, Pepper CM, et al.: Head and neck teratomas in children--A series of 23 cases at Great Ormond Street Hospital. Int J Pediatr Otorhinolaryngol 79 (12): 2008-14, 2015.[PUBMED Abstract]
- Thorup J, McLachlan R, Cortes D, et al.: What is new in cryptorchidism and hypospadias--a critical review on the testicular dysgenesis hypothesis. J Pediatr Surg 45 (10): 2074-86, 2010.[PUBMED Abstract]
- Huang H, Wang C, Tian Q: Gonadal tumour risk in 292 phenotypic female patients with disorders of sex development containing Y chromosome or Y-derived sequence. Clin Endocrinol (Oxf) 86 (4): 621-627, 2017.[PUBMED Abstract]
- Dicken BJ, Billmire DF, Krailo M, et al.: Gonadal dysgenesis is associated with worse outcomes in patients with ovarian nondysgerminomatous tumors: A report of the Children's Oncology Group AGCT 0132 study. Pediatr Blood Cancer 65 (4): , 2018.[PUBMED Abstract]
- Hawkins EP: Germ cell tumors. Am J Clin Pathol 109 (4 Suppl 1): S82-8, 1998.[PUBMED Abstract]
- Schneider DT, Calaminus G, Koch S, et al.: Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 42 (2): 169-75, 2004.[PUBMED Abstract]
- Horton Z, Schlatter M, Schultz S: Pediatric germ cell tumors. Surg Oncol 16 (3): 205-13, 2007.[PUBMED Abstract]
- Göbel U, Calaminus G, Engert J, et al.: Teratomas in infancy and childhood. Med Pediatr Oncol 31 (1): 8-15, 1998.[PUBMED Abstract]
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999.[PUBMED Abstract]
- Harms D, Zahn S, Göbel U, et al.: Pathology and molecular biology of teratomas in childhood and adolescence. Klin Padiatr 218 (6): 296-302, 2006 Nov-Dec.[PUBMED Abstract]
- Tomlinson MW, Alaverdian AA, Alaverdian V: Testosterone-producing benign cystic teratoma with virilism. A case report. J Reprod Med 41 (12): 924-6, 1996.[PUBMED Abstract]
- Kallis P, Treasure T, Holmes SJ, et al.: Exocrine pancreatic function in mediastinal teratomata: an aid to preoperative diagnosis? Ann Thorac Surg 54 (4): 741-3, 1992.[PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976.[PUBMED Abstract]
- Heifetz SA, Cushing B, Giller R, et al.: Immature teratomas in children: pathologic considerations: a report from the combined Pediatric Oncology Group/Children's Cancer Group. Am J Surg Pathol 22 (9): 1115-24, 1998.[PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999.[PUBMED Abstract]
- Lam SK, Cheung LP: Inappropriate ADH secretion due to immature ovarian teratoma. Aust N Z J Obstet Gynaecol 36 (1): 104-5, 1996.[PUBMED Abstract]
- Göbel U, Calaminus G, Schneider DT, et al.: The malignant potential of teratomas in infancy and childhood: the MAKEI experiences in non-testicular teratoma and implications for a new protocol. Klin Padiatr 218 (6): 309-14, 2006 Nov-Dec.[PUBMED Abstract]
- Perlman EJ, Hawkins EP: Pediatric germ cell tumors: protocol update for pathologists. Pediatr Dev Pathol 1 (4): 328-35, 1998 Jul-Aug.[PUBMED Abstract]
- Palmer RD, Foster NA, Vowler SL, et al.: Malignant germ cell tumours of childhood: new associations of genomic imbalance. Br J Cancer 96 (4): 667-76, 2007.[PUBMED Abstract]
- Palmer RD, Barbosa-Morais NL, Gooding EL, et al.: Pediatric malignant germ cell tumors show characteristic transcriptome profiles. Cancer Res 68 (11): 4239-47, 2008.[PUBMED Abstract]
- Poynter JN, Hooten AJ, Frazier AL, et al.: Associations between variants in KITLG, SPRY4, BAK1, and DMRT1 and pediatric germ cell tumors. Genes Chromosomes Cancer 51 (3): 266-71, 2012.[PUBMED Abstract]
- Oosterhuis JW, Castedo SM, de Jong B, et al.: Ploidy of primary germ cell tumors of the testis. Pathogenetic and clinical relevance. Lab Invest 60 (1): 14-21, 1989.[PUBMED Abstract]
- Silver SA, Wiley JM, Perlman EJ: DNA ploidy analysis of pediatric germ cell tumors. Mod Pathol 7 (9): 951-6, 1994.[PUBMED Abstract]
- Perlman EJ, Cushing B, Hawkins E, et al.: Cytogenetic analysis of childhood endodermal sinus tumors: a Pediatric Oncology Group study. Pediatr Pathol 14 (4): 695-708, 1994 Jul-Aug.[PUBMED Abstract]
- Schneider DT, Schuster AE, Fritsch MK, et al.: Genetic analysis of childhood germ cell tumors with comparative genomic hybridization. Klin Padiatr 213 (4): 204-11, 2001 Jul-Aug.[PUBMED Abstract]
- Bussey KJ, Lawce HJ, Olson SB, et al.: Chromosome abnormalities of eighty-one pediatric germ cell tumors: sex-, age-, site-, and histopathology-related differences--a Children's Cancer Group study. Genes Chromosomes Cancer 25 (2): 134-46, 1999.[PUBMED Abstract]
- Perlman EJ, Valentine MB, Griffin CA, et al.: Deletion of 1p36 in childhood endodermal sinus tumors by two-color fluorescence in situ hybridization: a pediatric oncology group study. Genes Chromosomes Cancer 16 (1): 15-20, 1996.[PUBMED Abstract]
- Rodriguez E, Houldsworth J, Reuter VE, et al.: Molecular cytogenetic analysis of i(12p)-negative human male germ cell tumors. Genes Chromosomes Cancer 8 (4): 230-6, 1993.[PUBMED Abstract]
- Bosl GJ, Ilson DH, Rodriguez E, et al.: Clinical relevance of the i(12p) marker chromosome in germ cell tumors. J Natl Cancer Inst 86 (5): 349-55, 1994.[PUBMED Abstract]
- Mostert MC, Verkerk AJ, van de Pol M, et al.: Identification of the critical region of 12p over-representation in testicular germ cell tumors of adolescents and adults. Oncogene 16 (20): 2617-27, 1998.[PUBMED Abstract]
- van Echten J, Oosterhuis JW, Looijenga LH, et al.: No recurrent structural abnormalities apart from i(12p) in primary germ cell tumors of the adult testis. Genes Chromosomes Cancer 14 (2): 133-44, 1995.[PUBMED Abstract]
- Riopel MA, Spellerberg A, Griffin CA, et al.: Genetic analysis of ovarian germ cell tumors by comparative genomic hybridization. Cancer Res 58 (14): 3105-10, 1998.[PUBMED Abstract]
- Malogolowkin MH, Mahour GH, Krailo M, et al.: Germ cell tumors in infancy and childhood: a 45-year experience. Pediatr Pathol 10 (1-2): 231-41, 1990.[PUBMED Abstract]
- Marsden HB, Birch JM, Swindell R: Germ cell tumours of childhood: a review of 137 cases. J Clin Pathol 34 (8): 879-83, 1981.[PUBMED Abstract]
- Dal Cin P, Drochmans A, Moerman P, et al.: Isochromosome 12p in mediastinal germ cell tumor. Cancer Genet Cytogenet 42 (2): 243-51, 1989.[PUBMED Abstract]
- Aly MS, Dal Cin P, Jiskoot P, et al.: Competitive in situ hybridization in a mediastinal germ cell tumor. Cancer Genet Cytogenet 73 (1): 53-6, 1994.[PUBMED Abstract]
- Schneider DT, Schuster AE, Fritsch MK, et al.: Genetic analysis of mediastinal nonseminomatous germ cell tumors in children and adolescents. Genes Chromosomes Cancer 34 (1): 115-25, 2002.[PUBMED Abstract]
- Dexeus FH, Logothetis CJ, Chong C, et al.: Genetic abnormalities in men with germ cell tumors. J Urol 140 (1): 80-4, 1988.[PUBMED Abstract]
- Nichols CR, Heerema NA, Palmer C, et al.: Klinefelter's syndrome associated with mediastinal germ cell neoplasms. J Clin Oncol 5 (8): 1290-4, 1987.[PUBMED Abstract]
- Lachman MF, Kim K, Koo BC: Mediastinal teratoma associated with Klinefelter's syndrome. Arch Pathol Lab Med 110 (11): 1067-71, 1986.[PUBMED Abstract]
- Williams LA, Pankratz N, Lane J, et al.: Klinefelter syndrome in males with germ cell tumors: A report from the Children's Oncology Group. Cancer 124 (19): 3900-3908, 2018.[PUBMED Abstract]
- Coutin AS, Hamy A, Fondevilla M, et al.: [Pure 46XY gonadal dysgenesis] J Gynecol Obstet Biol Reprod (Paris) 25 (8): 792-6, 1996.[PUBMED Abstract]
- Amice V, Amice J, Bercovici JP, et al.: Gonadal tumor and H-Y antigen in 46,XY pure gonadal dysgenesis. Cancer 57 (7): 1313-7, 1986.[PUBMED Abstract]
- Tanaka Y, Sasaki Y, Tachibana K, et al.: Gonadal mixed germ cell tumor combined with a large hemangiomatous lesion in a patient with Turner's syndrome and 45,X/46,X, +mar karyotype. Arch Pathol Lab Med 118 (11): 1135-8, 1994.[PUBMED Abstract]
- Kota SK, Gayatri K, Pani JP, et al.: Dysgerminoma in a female with turner syndrome and Y chromosome material: A case-based review of literature. Indian J Endocrinol Metab 16 (3): 436-40, 2012.[PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000.[PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992.[PUBMED Abstract]
- Wu JT, Book L, Sudar K: Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 15 (1): 50-2, 1981.[PUBMED Abstract]
- Blohm ME, Vesterling-Hörner D, Calaminus G, et al.: Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol 15 (2): 135-42, 1998 Mar-Apr.[PUBMED Abstract]
- Vogelzang NJ, Lange PH, Goldman A, et al.: Acute changes of alpha-fetoprotein and human chorionic gonadotropin during induction chemotherapy of germ cell tumors. Cancer Res 42 (11): 4855-61, 1982.[PUBMED Abstract]
- O'Neill AF, Xia C, Krailo MD, et al.: α-Fetoprotein as a predictor of outcome for children with germ cell tumors: A report from the Malignant Germ Cell International Consortium. Cancer 125 (20): 3649-3656, 2019.[PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004.[PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004.[PUBMED Abstract]
- Göbel U, Schneider DT, Calaminus G, et al.: Multimodal treatment of malignant sacrococcygeal germ cell tumors: a prospective analysis of 66 patients of the German cooperative protocols MAKEI 83/86 and 89. J Clin Oncol 19 (7): 1943-50, 2001.[PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015.[PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997.[PUBMED Abstract]
- Duhil de Bénazé G, Pacquement H, Faure-Conter C, et al.: Paediatric dysgerminoma: Results of three consecutive French germ cell tumours clinical studies (TGM-85/90/95) with late effects study. Eur J Cancer 91: 30-37, 2018.[PUBMED Abstract]
- Motzer RJ, Nichols CJ, Margolin KA, et al.: Phase III randomized trial of conventional-dose chemotherapy with or without high-dose chemotherapy and autologous hematopoietic stem-cell rescue as first-line treatment for patients with poor-prognosis metastatic germ cell tumors. J Clin Oncol 25 (3): 247-56, 2007.[PUBMED Abstract]
- Fizazi K, Pagliaro L, Laplanche A, et al.: Personalised chemotherapy based on tumour marker decline in poor prognosis germ-cell tumours (GETUG 13): a phase 3, multicentre, randomised trial. Lancet Oncol 15 (13): 1442-50, 2014.[PUBMED Abstract]
- Fonseca A, Xia C, Lorenzo AJ, et al.: Detection of Relapse by Tumor Markers Versus Imaging in Children and Adolescents With Nongerminomatous Malignant Germ Cell Tumors: A Report From the Children's Oncology Group. J Clin Oncol 37 (5): 396-402, 2019.[PUBMED Abstract]
- 小児頭蓋外GCTの病期情報
-
他の小児固形腫瘍と同様に、病期は悪性胚細胞腫瘍(GCT)患者の治療成績に直接影響する。[ 1 ][ 2 ][ 3 ]米国で主に多く用いられている病期分類システムは、以下のものである:[ 4 ]
COGによる精巣GCTの病期分類(11歳未満の患者)
表3には、COG AGCT1531(NCT03067181)試験による精巣GCTの病期分類が記述されている。
表3.COG AGCT1531試験による精巣GCTの病期分類a、b 病期 病変の範囲 COG = 小児腫瘍学グループ;CT = コンピュータ断層撮影;GCT = 胚細胞腫瘍。 aAGCT1531試験には、50歳未満の男性が適格である。 bCOG試験には、精巣GCTの15歳未満の患者が含まれている。データは不十分であるが、11~15歳の患者は、成人の精巣ガイドラインに従うとより適切に病期分類できる。(成人精巣GCTの病期分類に関する詳しい情報については、精巣腫瘍の治療に関するPDQ要約を参照のこと。) I期 (1)腫瘍が精巣に限局し、高位精巣摘除術により完全切除され、顕微鏡的切除縁が陰性である;(2)腫瘍被膜が、針生検、切開生検、または腫瘍破裂によって破られていない。経陰嚢的精巣摘除術を受け、腫瘍被膜が破れておらず、内鼠径輪(internal ring)のレベルまで精索を除去した患者はI期である。精巣完全摘除と精索除去を同時の手術で実施し、凍結切片分析のために切除生検を受けた患者もI期に指定できる;(3)精巣を越えて拡がる病変の証拠が臨床的、放射線学的、または組織学的に認められない;(4)多層撮像法(multiplanar imaging)での最大短軸径が1cm未満のすべてのリンパ節。(注:1~2cmのリンパ節は4~6週間後に短期間の追跡検査が必要である。4~6週間経過時にリンパ節に変化が見られなければ[1~2cm]、生検を検討するか、化学療法群に移動させる。大きくなっていれば、化学療法群に移動させる。) II期 (1)腫瘍被膜のin situでの破裂を伴う精巣完全摘除(術前針生検および切開生検、または術中の腫瘍被膜破裂を含む);(2)陰嚢または精索の高い位置(近位端から5cm未満)の顕微鏡的病変。適切な半減期で腫瘍マーカーが正常化または低下しないこと;(3)リンパ節転移陰性。 III期 (1)後腹膜リンパ節転移が認められるが、臓側または腹腔外への転移は認められない;(2)リンパ節が2cm以上または多層撮像CTでリンパ節の短軸が1cmを超えるが2cm未満で、4~6週間経過時の再検査で消失しないもの。 IV期 (1)肝、肺、骨、脳などへの遠隔転移を認める。 精巣GCTの病期分類(11歳以上の患者)
11歳以上の男性における精巣GCTに対する米国がん合同委員会の病期分類基準に関する詳しい情報については、精巣腫瘍の治療に関するPDQ要約を参照のこと。
15歳未満の男性を対象に病期を決定する小児胚細胞腫瘍の試験では、後腹膜リンパ節郭清は必要とされていない。精巣GCTの青年期男性に関するデータは限られている。後腹膜リンパ節郭清は、成人の精巣GCT試験では病期分類と治療の両方に用いられる。[ 5 ]
15歳を超える男性では、I期の腫瘍および転移腫瘍のみがみられる。転移腫瘍には、IGCCCに従ってリスクが割り当てられる。[ 6 ]
COGによる卵巣GCTの病期分類
表4には、COG AGCT1531(NCT03067181)試験による卵巣GCTの病期分類が記述されている。
表4.COG AGCT1531試験による卵巣GCTの病期分類a 病期 病変の範囲 COG = 小児腫瘍学グループ;CT = コンピュータ断層撮影;GCT = 胚細胞腫瘍。 a両側卵巣腫瘍は他の病期基準が満たされている限り、どの病期にもなりうる。腫瘍は最も進行した特徴を有する卵巣に合わせて病期分類される。 I期 (1)腫瘍被膜の破裂を伴わずに切除された卵巣腫瘍;(2)部分的なまたは完全な被膜外浸潤の証拠が認められない;(3)腹膜細胞診で悪性細胞が陰性;(4)腹膜表面および大網に病変がないことが手術記録で示されているか、外観に異常がある場合の生検で組織学が陰性;(5)多層撮像ですべてのリンパ節の短軸径が1cm未満であるか、生検で陰性が証明される。(注:1~2cmのリンパ節は4~6週間後に短期間の追跡検査が必要である。4~6週間経過時にリンパ節に変化が見られなければ[1~2cm]、生検を検討するか、化学療法群に移動させる。大きくなっていれば、化学療法群に移動させる。) II期 (1)完全切除されているが、術前生検、腫瘍被膜のin situでの破裂、または組織診断で部分的なまたは完全な被膜外浸潤の存在が認められる卵巣腫瘍;(2)腹腔鏡手術により切除された10cmを超える腫瘍;(3)腫瘍が切除のために多くの部分に分割されており、浸潤について被膜が評価できない;(4)腹膜細胞診で悪性細胞が陰性となる必要がある;(5)リンパ節、腹膜表面、および大網に病変がないことが手術記録で示されているか、外観に異常がある場合の生検で組織学が陰性。 III期 (1)リンパ節が2cm以上または多層撮像CTでリンパ節の短軸が1cmを超えるが2cm未満で、4~6週間経過時の再検査で消失しないもの;(2)肉眼的残存病変を残して生検されたか切除された卵巣腫瘍;(3)腹水の細胞診で悪性細胞(未熟奇形腫を含む)が陽性;(4)悪性細胞(未熟奇形腫を含む)が陽性のリンパ節;(5)悪性細胞(未熟奇形腫を含む)が陽性の腹腔内播種。 III~X 他の点ではCOG基準でI期またはII期であるが、以下を伴う患者:(1)腹膜細胞診を実施していない;(2)多層撮像で短軸が1cmを超えるリンパ節の生検を実施していない;(3)異常な腹膜表面または大網のサンプル採取を実施していない;(4)最初の手技で卵巣摘出術しか受けていない患者について、2回目の手技で外科的病期分類の完了が遅れた者。 IV期 (1)肝実質への転移性疾患(表面の播種はIII期である)または腹膜腔外部の他の臓器(骨、肺、または脳)への転移および胸水の細胞診が陽性。 FIGOによる卵巣GCTの病期分類
この他に婦人科腫瘍医が頻繁に使用する卵巣GCTの病期分類システムは、FIGOによる病期分類で、診断時における適切な外科的病期分類に基づいている。[ 7 ](詳しい情報については、卵巣胚細胞腫瘍の治療に関するPDQ要約を参照のこと。)この分類システムは、一部の小児センターでも用いられており[ 2 ]、表5に記述されている。
表5.卵巣がんのFIGO病期分類a 病期 説明 FIGO = 国際産科婦人科連合。 a出典:Prat et al.[ 8 ] I期 卵巣に限局した腫瘍。 IA期 一側の卵巣に限局した腫瘍(被膜の破綻なし);卵巣表面に腫瘍が認められない;腹水または腹腔洗浄液に悪性細胞が認められないこと。 IB期 両側の卵巣に限局した腫瘍(被膜の破綻なし);卵巣表面に腫瘍が認められない;腹水または腹腔洗浄液に悪性細胞が認められないこと。 IC期 一側または両側の卵巣に限局した腫瘍で、以下のいずれかを伴う: IC1期 外科的な漏出を来す。 IC2期 手術前に被膜が破綻しているか、卵巣表面に腫瘍が認められる。 IC3期 腹水または腹腔洗浄液に悪性細胞が認められる。 II期 一側または両側の卵巣に腫瘍があり、骨盤内(分界線より下方)への進展を認めるか、原発性腹膜がんがみられる。 IIA期 がんの進展および/または播種が、子宮および/または卵管に及んでいる。 IIB期 がんが他の骨盤腹腔内組織に進展している。 III期 腫瘍が一側または両側の卵巣に及んでいるか原発性腹膜がんであり、骨盤外に腹腔内播種が細胞学的または組織学的に確認される、および/または後腹膜リンパ節への転移が認められる。 IIIA1期 後腹膜リンパ節転移のみ陽性(細胞学的または組織学的に証明される): IIIA1期(i) リンパ節の最大径が10mm以下。 IIIA1期(ii) リンパ節の最大径が10mmを超える。 IIIA2期 顕微鏡下で骨盤外(分界線より上方)の腹膜播種を認め、場合によっては後腹膜リンパ節転移陽性である。 IIIB期 最大径が2cm以下の骨盤外肉眼的腹膜転移で、場合によっては後腹膜リンパ節への転移が認められる。 IIIC期 最大径が2cmを超える骨盤外肉眼的腹膜転移で、場合によっては後腹膜リンパ節への転移が認められる(肝臓および脾臓の被膜に腫瘍が進展しているが、いずれの臓器も実質に浸潤していない場合を含む)。 IV期 腹膜転移以外の遠隔転移を認める。 IVA期 細胞診陽性の胸水を認める。 IVB期 実質内に転移および腹腔外臓器(鼠径リンパ節および腹腔外のリンパ節を含む)に転移している。 上述の卵巣の病期分類システムでは、特定のガイドラインを遵守する必要がある。しかしながら、小児のあるグループ間共同研究試験では、卵巣腫瘍患者131人中2人でしかガイドラインは遵守されなかった。[ 9 ]1件の単一施設のレトロスペクティブ研究では、卵巣腫瘍患者44人中2人でしかガイドラインは遵守されなかった。[ 10 ]
COGによる性腺外頭蓋外GCTの病期分類
表6には、COG AGCT1531(NCT03067181)試験による性腺外頭蓋外GCTの病期分類が記述されている。
表6.COG AGCT1531試験による性腺外頭蓋外GCTの病期分類 病期 病変の範囲 COG = 小児腫瘍学グループ;CT = コンピュータ断層撮影;GCT = 胚細胞腫瘍。 I期 (1)仙尾骨部に対する尾骨切除術を含めて、すべての部位における完全切除;(2)腫瘍切除断端が陰性で被膜は無傷である必要がある;(3)腹腔または後腹膜に浸潤した腫瘍について、腹水または洗浄液の細胞診を実施し、悪性細胞が陰性でなければならない;(4)腹部、骨盤、および胸部の画像検査でリンパ節が1cm以下。(注:1~2cmのリンパ節は4~6週間後に短期間の追跡検査が必要である。4~6週間経過時にリンパ節に変化が見られなければ[1~2cm]、生検を検討するか、化学療法群に移動させる。大きくなっていれば、化学療法群に移動させる。腹腔または後腹膜に浸潤した腫瘍について、腹水または洗浄液の細胞診を実施し、悪性細胞が陰性でなければならない。) II期 (1)顕微鏡的残存病変;(2)術前生検、術中生検、顕微鏡的残存病変、または被膜破裂の病理学的証拠を伴う肉眼的完全切除;(3)腹部、骨盤、および胸部画像検査でのリンパ節転移陰性。腹水が陰性。 III期 (1)肉眼的残存病変または生検のみ;(2)腫瘍切除でリンパ節転移陽性。リンパ節が2cm以上または多層撮像CTでリンパ節の短軸が1cmを超えるが2cm未満で、4~6週間経過時の再検査で消失しないもの。 IV期 肝、肺、骨、脳などへの遠隔転移を認める。 参考文献- Ablin AR, Krailo MD, Ramsay NK, et al.: Results of treatment of malignant germ cell tumors in 93 children: a report from the Childrens Cancer Study Group. J Clin Oncol 9 (10): 1782-92, 1991.[PUBMED Abstract]
- Mann JR, Pearson D, Barrett A, et al.: Results of the United Kingdom Children's Cancer Study Group's malignant germ cell tumor studies. Cancer 63 (9): 1657-67, 1989.[PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992.[PUBMED Abstract]
- Brodeur GM, Howarth CB, Pratt CB, et al.: Malignant germ cell tumors in 57 children and adolescents. Cancer 48 (8): 1890-8, 1981.[PUBMED Abstract]
- de Wit R, Fizazi K: Controversies in the management of clinical stage I testis cancer. J Clin Oncol 24 (35): 5482-92, 2006.[PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997.[PUBMED Abstract]
- Cannistra SA: Cancer of the ovary. N Engl J Med 329 (21): 1550-9, 1993.[PUBMED Abstract]
- Prat J; FIGO Committee on Gynecologic Oncology: Staging classification for cancer of the ovary, fallopian tube, and peritoneum. Int J Gynaecol Obstet 124 (1): 1-5, 2014.[PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an intergroup study. J Pediatr Surg 39 (3): 424-9; discussion 424-9, 2004.[PUBMED Abstract]
- Madenci AL, Levine BS, Laufer MR, et al.: Poor adherence to staging guidelines for children with malignant ovarian tumors. J Pediatr Surg 51 (9): 1513-7, 2016.[PUBMED Abstract]
- 小児の頭蓋外GCTに対する治療法選択肢の概要
-
小児の頭蓋外胚細胞腫瘍(GCT)は、きわめて不均一である。治療の有益性および限界は、組織像の違いに関連している。例えば、成熟奇形腫および未熟奇形腫のような小児GCTは、化学療法に反応しないことがある。
臨床的因子に基づいて、頭蓋外GCTに対して適切な治療として、以下のいずれかを含めてもよい:
- 外科的切除後、腫瘍再発に対する綿密なモニタリング。
- 最初に外科的切除後、プラチナ製剤をベースとした化学療法。
- 診断のための腫瘍生検および術前のプラチナ製剤をベースとした化学療法後、根治的腫瘍切除。[ 1 ]
長期生存の可能性を最大に高めると同時に、治療に関係する長期の後遺症(例えば、二次性白血病、不妊症、聴力障害、および腎機能障害)を来す可能性を最小に抑えるために、悪性頭蓋外GCTの小児は、このような希少腫瘍の治療経験が豊富な小児がんセンターで治療を受ける必要がある。
手術
手術は治療で不可欠な要素である。それぞれの腫瘍型に応じて特定の治療が検討される。
手術と観察
すべての悪性度の未熟奇形腫が部位にかかわらず完全切除された患者、および限局性の、完全切除された(I期の)セミノーマおよび非セミノーマGCT(精巣および卵巣)患者では、追加治療は必要ないであろう;ただし、綿密なモニタリングが重要である。[ 2 ][ 3 ]観察と待機アプローチでは、再発腫瘍が遅滞なく確実に発見されるようにスケジュール通りの継続的な身体診察、腫瘍マーカーの測定、および原発腫瘍の画像診断が必要である。
化学療法
有効な化学療法が利用可能になる前は、手術および放射線療法による悪性頭蓋外GCTの小児の3年生存率は15~20%であったが[ 4 ][ 5 ][ 6 ]、限局性精巣腫瘍の低年齢男児では、外科的切除単独で良好な結果が得られていた。[ 7 ][ 8 ]頭蓋外GCTの小児および青年のほとんどで、シスプラチンをベースにした化学療法により、転帰が著しく改善している;現在では、5年生存率が85%近い。
米国では、悪性非セミノーマGCTの成人および小児のいずれにも用いられる標準化学療法レジメンには、シスプラチン、エトポシド、およびブレオマイシンがある。成人患者では、治療の全期間にわたりブレオマイシンを週1回投与する(ブレオマイシン、エトポシド、およびシスプラチン[BEP])。[ 9 ][ 10 ][ 11 ][ 12 ]米国の小児試験には、精巣GCTの15歳以下の患者および卵巣および性腺外GCTの21歳以下の患者が含まれた。患者は、各サイクルの1日目にのみブレオマイシンを投与された(シスプラチン、エトポシド、およびブレオマイシン[PEb])。[ 13 ][ 14 ]英国では、16歳未満の小児を対象にカルボプラチン、エトポシド、およびブレオマイシンの併用療法(JEb)の臨床試験が実施され、原発部位および病期ごとのイベントフリー生存率(EFS)がPEbとほぼ同じであることが報告された。[ 15 ][ 16 ]成人向けBEPおよび小児向けPEbおよびJEbの化学療法の用法・用量については、表7を参照のこと。[ 9 ][ 10 ][ 11 ][ 13 ][ 14 ]成人と小児の試験の両方で、青年被験者の数は少なかった;青年(11歳以上)に対する最適な治療法は不明である。[ 17 ]
JEbの使用に伴う耳毒性および腎毒性は、PEbを使用した場合より少ないとみられている。[ 15 ]小児腫瘍学グループ(COG)およびChildren's Cancer and Leukaemia Groupにより同時期に実施された胚細胞腫瘍研究からのデータのレトロスペクティブ・メタアナリシスにおいて、多変量治癒モデルでは4年EFS率に差は示されなかった。4年EFS率は、シスプラチンレジメンを受けた患者(n = 620)で86%(95%信頼区間[CI]、83%-89%)、およびカルボプラチンレジメンを受けた患者(n = 163)で86%(95%CI、79%-90%)であった(P = 0.87)。[ 18 ][証拠レベル:3iiA]しかしながら、ランダム化小児GCT試験では、PEbとJEbは比較されていない。
表7.成人向けBEPおよび小児向けPEbおよびJEb化学療法の用法・用量の比較 レジメン ブレオマイシン エトポシド シスプラチン カルボプラチン BEP = ブレオマイシン、エトポシド、およびシスプラチン;GFR = 糸球体濾過値;JEb = カルボプラチン、エトポシド、およびブレオマイシン;PEb = シスプラチン、エトポシド、およびブレオマイシン。 成人BEP(21日ごと)[ 11 ][ 19 ] 1、8、15日目に30単位/m2(最大30単位) 1~5日目に100 mg/m2 1~5日目に20mg/m2 小児向けPEb(21日ごと)[ 13 ][ 14 ] 1日目に15単位/m2(最大30単位) 1~5日目に100 mg/m2 1~5日目に20mg/m2 小児向けJEb(21~28日ごと)[ 15 ] 3日目に15単位/m2(最大30単位) 1~3日目に120mg/m2 2日目に600mg/m2またはGFRに基づく投与 COG(以前はChildren's Cancer GroupおよびPediatric Oncology Group)により数件の試験が実施された。[ 2 ][ 13 ][ 14 ]これらの試験では、限局性性腺GCTの治療としてPEbの使用[ 13 ]、および予後不良な特徴を有する患者に対する強化レジメンが調査された。戦略には大量シスプラチン(200mg/m2)およびシクロホスファミドまたは保護剤のアミフォスチンが含まれた。[ 14 ][ 20 ]これらの戦略で生存または毒性作用の低下に有意な効果を示したものはなかった。
放射線療法
男性の精巣および縦隔セミノーマおよび女性の卵巣未分化胚細胞腫は放射線に感受性を示すが、晩期合併症(晩期障害)が知られているため放射線療法が推奨されることはまれである。
小児頭蓋外GCTに対する組織型別の治療法の選択肢
表8は、頭蓋外GCTの小児に対する治療法選択肢の概要を示している。原発部位別の治療の詳細および臨床条件を以下のセクションで述べる。
表8.小児の頭蓋外胚細胞腫瘍(GCT)に対する治療法の選択肢 組織像 治療法の選択肢 BEP = ブレオマイシン(週1回)、エトポシド、およびシスプラチン;JEb = カルボプラチン、エトポシド、およびブレオマイシン;PEb = シスプラチン、エトポシド、およびブレオマイシン(各サイクルの1日目にのみブレオマイシンを投与)。 aII~IV期未熟奇形腫の患児の治療において、化学療法が有効であることは示されていない。しかしながら、これらの患者における化学療法の役割は系統的に研究されていない。思春期後の患者では、化学療法が標準治療のままであるが、研究は限られている。[ 21 ] b I期疾患と報告されたが、厳密な外科的病期分類ガイドラインに従っていなかった思春期前の女性では、化学療法(PEb)を標準治療とみなすことができる。[ 13 ] c I期疾患を有する思春期後の女性で、手術後の観察による戦略は確立されていない。この治療戦略は臨床試験(AGCT1531[NCT03067181])で研究段階にある。 成熟奇形腫 仙尾骨以外の部位 手術と観察 仙尾骨部位 手術と観察 未熟奇形腫 手術と観察(I期) 手術と観察または化学療法(II~IV期)a 小児の悪性性腺GCT: 小児の悪性精巣GCT: 思春期前男性の悪性精巣GCT 手術と観察(I期) 手術と化学療法(PEb)(II~IV期) 思春期後男性の悪性精巣GCT 詳しい情報については、精巣腫瘍の治療に関するPDQ要約を参照のこと。 小児の悪性卵巣GCT: 卵巣の未分化胚細胞腫 手術と観察(I期) 手術と化学療法(PEb)(II~IV期) 思春期前の女性では胚細胞腫以外の悪性卵巣GCT(卵黄嚢および混合型GCT) 手術と観察(I期)b(卵巣未熟奇形腫の治療に関する情報については、本要約の小児の悪性卵巣GCTのセクションを参照のこと) 手術と化学療法(PEb)(I期およびII~IV期) 思春期後の女性では胚細胞腫以外の悪性卵巣GCT(卵黄嚢および混合型GCT) 手術と化学療法(BEP)(I期)c(II~IV期) 最初に切除不能な胚細胞腫以外の悪性卵巣GCT(卵黄嚢および混合型GCT) 生検後に化学療法と手術(最初に切除不能な腫瘍) 小児の悪性性腺外頭蓋外GCT: 思春期前の小児の悪性性腺外頭蓋外GCT 手術と化学療法(PEbまたはJEb)(I~II期) 手術と化学療法(PEbまたはJEb)(III~IV期) 生検後に化学療法と可能であれば手術(III~IV期) 思春期後の小児の悪性性腺外頭蓋外GCT 手術 化学療法(BEP) 化学療法後に残存腫瘍を切除するための手術 臨床試験への登録 小児の再発悪性GCT 手術単独 術前補助または補助化学療法を併用する手術 GCT以外の腫瘍を含むGCT(悪性転換を伴う奇形腫)
他のGCT以外の体細胞性腫瘍を含むGCTの治療は複雑で、治療の指針となるデータはほとんど存在しない。青年では、奇形腫で中枢の原始神経外胚葉性腫瘍および肉腫が認められている。[ 22 ][ 23 ]Italian Pediatric Germ Cell Tumorグループは、神経芽腫や横紋筋肉腫のような体細胞性悪性腫瘍が奇形腫に内在する悪性GCT患者14人を確認した(頭蓋外GCTの2%未満)。[ 24 ]
GCT以外の腫瘍を含むGCTに対する至適治療戦略は、未だ確定しておらず、悪性GCTとGCT以外の腫瘍に対して個別の治療が必要なことがある。
小児がん治療に関する特別な考慮事項
小児および青年におけるがんはまれであるが、小児がんの全発生率は1975年以降、徐々に増加している。[ 25 ]小児および青年のがん患者は、小児期および青年期に発生するがんの治療経験を有する専門家から構成される集学的チームのある医療機関に紹介すべきである。この集学的チームアプローチでは、至適な生存期間およびQOLが達成できる治療、支持療法、およびリハビリテーションを小児が確実に受けられるように、以下の医療専門家の技能を連携させている:
- プライマリケア医。
- 小児外科医。
- 放射線腫瘍医。
- 小児腫瘍医および血液専門医。
- リハビリテーション専門家。
- 小児専門看護師。
- 社会福祉士。
- チャイルドライフ専門員。
- 心理士。
米国小児科学会は、小児がん施設とそれらが小児がん患者の治療において担う役割に関するガイドラインを概説している。[ 26 ]このような小児がん施設では、小児および青年に発生するほとんどのがん種を対象に臨床試験が行われており、これらの試験に参加する機会がほとんどの患者および家族に与えられている。小児および青年のがんに関する臨床試験は一般に、現在標準とされている治療法と、それより効果的であると思われる治療法とを比較するようデザインされる。小児がんの治癒的治療の特定でなされた進歩のほとんどは、臨床試験を通して達成されている。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999.[PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999.[PUBMED Abstract]
- Schlatter M, Rescorla F, Giller R, et al.: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group. J Pediatr Surg 38 (3): 319-24; discussion 319-24, 2003.[PUBMED Abstract]
- Kurman RJ, Norris HJ: Endodermal sinus tumor of the ovary: a clinical and pathologic analysis of 71 cases. Cancer 38 (6): 2404-19, 1976.[PUBMED Abstract]
- Chretien PB, Milam JD, Foote FW, et al.: Embryonal adenocarcinomas (a type of malignant teratoma) of the sacrococcygeal region. Clinical and pathologic aspects of 21 cases. Cancer 26 (3): 522-35, 1970.[PUBMED Abstract]
- Billmire DF, Grosfeld JL: Teratomas in childhood: analysis of 142 cases. J Pediatr Surg 21 (6): 548-51, 1986.[PUBMED Abstract]
- Hawkins EP, Finegold MJ, Hawkins HK, et al.: Nongerminomatous malignant germ cell tumors in children. A review of 89 cases from the Pediatric Oncology Group, 1971-1984. Cancer 58 (12): 2579-84, 1986.[PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992.[PUBMED Abstract]
- de Wit R, Roberts JT, Wilkinson PM, et al.: Equivalence of three or four cycles of bleomycin, etoposide, and cisplatin chemotherapy and of a 3- or 5-day schedule in good-prognosis germ cell cancer: a randomized study of the European Organization for Research and Treatment of Cancer Genitourinary Tract Cancer Cooperative Group and the Medical Research Council. J Clin Oncol 19 (6): 1629-40, 2001.[PUBMED Abstract]
- Gershenson DM, Morris M, Cangir A, et al.: Treatment of malignant germ cell tumors of the ovary with bleomycin, etoposide, and cisplatin. J Clin Oncol 8 (4): 715-20, 1990.[PUBMED Abstract]
- Williams SD, Birch R, Einhorn LH, et al.: Treatment of disseminated germ-cell tumors with cisplatin, bleomycin, and either vinblastine or etoposide. N Engl J Med 316 (23): 1435-40, 1987.[PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997.[PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004.[PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004.[PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000.[PUBMED Abstract]
- Stern JW, Bunin N: Prospective study of carboplatin-based chemotherapy for pediatric germ cell tumors. Med Pediatr Oncol 39 (3): 163-7, 2002.[PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015.[PUBMED Abstract]
- Frazier AL, Stoneham S, Rodriguez-Galindo C, et al.: Comparison of carboplatin versus cisplatin in the treatment of paediatric extracranial malignant germ cell tumours: A report of the Malignant Germ Cell International Consortium. Eur J Cancer 98: 30-37, 2018.[PUBMED Abstract]
- Einhorn LH, Williams SD, Loehrer PJ, et al.: Evaluation of optimal duration of chemotherapy in favorable-prognosis disseminated germ cell tumors: a Southeastern Cancer Study Group protocol. J Clin Oncol 7 (3): 387-91, 1989.[PUBMED Abstract]
- Marina N, Chang KW, Malogolowkin M, et al.: Amifostine does not protect against the ototoxicity of high-dose cisplatin combined with etoposide and bleomycin in pediatric germ-cell tumors: a Children's Oncology Group study. Cancer 104 (4): 841-7, 2005.[PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976.[PUBMED Abstract]
- Ehrlich Y, Beck SD, Ulbright TM, et al.: Outcome analysis of patients with transformed teratoma to primitive neuroectodermal tumor. Ann Oncol 21 (9): 1846-50, 2010.[PUBMED Abstract]
- Rice KR, Magers MJ, Beck SD, et al.: Management of germ cell tumors with somatic type malignancy: pathological features, prognostic factors and survival outcomes. J Urol 192 (5): 1403-9, 2014.[PUBMED Abstract]
- Terenziani M, D'Angelo P, Bisogno G, et al.: Teratoma with a malignant somatic component in pediatric patients: the Associazione Italiana Ematologia Oncologia Pediatrica (AIEOP) experience. Pediatr Blood Cancer 54 (4): 532-7, 2010.[PUBMED Abstract]
- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010.[PUBMED Abstract]
- Corrigan JJ, Feig SA; American Academy of Pediatrics: Guidelines for pediatric cancer centers. Pediatrics 113 (6): 1833-5, 2004.[PUBMED Abstract]
- 小児における成熟奇形腫および未熟奇形腫の治療
-
成熟奇形腫および未熟奇形腫は主として、新生児、幼児の仙尾骨部位、思春期女児の卵巣に発生する。頻度は少ないが、これらの腫瘍は、4歳未満の男児の精巣領域、青年の縦隔、および他の部位にもみられる。[ 1 ][ 2 ][ 3 ]
奇形腫に対する一次治療は手術であり、腫瘍が仙尾骨以外または仙尾骨のいずれの部位に発生したかに依存する。仙尾部奇形腫に対する手術の選択肢は複雑である。術後に成熟または未熟奇形腫が残存する小児患者の数は非常に少ない。
成熟奇形腫の治療
成熟奇形腫(仙尾骨以外の部位)に対する標準治療法の選択肢
仙尾骨以外の部位に発生した成熟奇形腫に対する標準治療法の選択肢には以下のものがある:
- 手術と観察。
縦隔の成熟奇形腫を含めた成熟奇形腫の小児では、手術による治療と観察が可能で、優れた予後が得られる。[ 1 ][ 4 ]精巣以外の成熟奇形腫の小児153人を対象としたレビューによると、腫瘍を完全切除した場合の6年無再燃生存率は96%であったのに対し、腫瘍の切除が不完全であった場合は55%であった。[ 2 ]
新生児における頭頸部胚細胞腫瘍(GCT)は、集学的チームによる治療を行うべきである。頭頸部GCTのほとんどは良性であるが生命を脅かすことがあり、特に新生児においては外科医に重大な難題をもたらす。[ 5 ]腫瘍によっては悪性腫瘍の成分が発生することがあり、治療戦略を変更させうる。[ 6 ][ 7 ]
思春期前の精巣における成熟奇形腫は、比較的よくみられる良性病変であり、精巣温存術を適用できる可能性がある。[ 8 ]
成熟奇形腫(仙尾骨部位)に対する標準治療法の選択肢
新生児、乳児、および4歳未満の小児が診断される良性および悪性のGCTのほとんどで、仙尾骨領域が原発腫瘍部位である。これらの腫瘍は男児よりも女児に好発する;3:1~4:1の比率が報告されている。[ 9 ]
仙尾骨腫瘍は、小児の年齢、腫瘍の位置、および悪性腫瘍の可能性に関連して、以下の2つの臨床パターンで現れる:[ 1 ]
- 新生児型:新生児の腫瘍は、出生時に仙骨部位から膨隆して現れ、通常は成熟または未熟奇形腫である。
- 乳児・低年齢小児型:乳児および低年齢小児における腫瘍は、仙骨盤領域に触知可能な腫瘤として現れ、膀胱および直腸を圧迫する。これらの骨盤腫瘍は、悪性である可能性が非常に高い。
発症時に小児の年齢が高くなるほど、奇形腫に加えて悪性腫瘍成分が認められる可能性が高くなる。初期の調査では、仙尾骨腫瘍診断時における年齢が2ヵ月を超える場合の悪性腫瘍の割合が女児で48%、男児で67%であったのに対し、診断時における年齢が2ヵ月未満の場合の悪性腫瘍の発生率は女児で7%、男児で10%であったと明らかにされた。[ 10 ]骨盤部位の原発腫瘍は予後不良因子であると報告されているが、それは出生時に腫瘍が見過ごされたために診断が遅れた結果、または初回手術時の切除が不完全であったためである可能性が高い。[ 10 ][ 11 ][ 12 ][ 13 ]
仙尾骨部位に発生した成熟奇形腫に対する標準治療法の選択肢には以下のものがある:
- 手術と観察。
手術は治療で不可欠な要素である。腫瘍再発の可能性を最小限に抑えるためには、尾骨の完全切除が不可欠である。[ 2 ]
良性成熟奇形腫および未熟奇形腫と診断された新生児は切除成功後、α-フェトプロテイン(AFP)レベルの予想される生理学的な正常化が確実に達成され、腫瘍再燃の早期発見が容易になるように、追跡検査および連続的な血清AFP測定により数年間綿密に観察される。[ 14 ][ 15 ]いくつかのグループにより、これらの良性腫瘍では10~21%に及ぶかなりの割合の再発が報告されており、ほとんどの再燃は切除後3年以内に発生している。[ 9 ][ 14 ][ 16 ][ 17 ]
標準的な追跡スケジュールは存在しないが、すべての小児で3年間にわたり腫瘍マーカーを頻繁に測定する。再発腫瘍では、43~50%の症例が悪性で、卵黄嚢腫瘍が最も多くにみられる組織型である。早期発見することで、再発悪性GCTは、手術と化学療法により治療可能で、成功率が高い(全生存率、92%)。[ 18 ]長期生存者では、便秘、大便および尿失禁、および心理学的に容認できない美容上の瘢痕など、広範な手術による合併症についてモニターする。[ 19 ]
未熟奇形腫の治療
未熟奇形腫に対する治療法の選択肢
未熟奇形腫に対する治療法の選択肢には以下のものがある:
- 手術と観察(I期)。
- 手術と観察または化学療法(II~IV期)。化学療法の使用については見解が一致していない(詳しい情報については、未熟奇形腫に対する化学療法の役割に関する証拠を参照のこと)。
未熟奇形腫に対する治療法選択肢は、疾患の病期により異なる。
I期
未熟奇形腫の乳児および低年齢小児で、腫瘍が完全切除できる場合は予後が優れている。[ 16 ][ 20 ][ 21 ]このような患者に対して、現在の標準治療は、手術と観察である。
証拠(I期に対する手術と観察):
- 手術単独アプローチが、Pediatric Oncology GroupおよびChildren's Cancer Groupによる研究で検討された。外科的切除とその後の注意深い観察を用いて、未熟奇形腫患者の治療が行われた。[
22
]
- 卵巣の未熟奇形腫を切除した小児および青年のほとんどは、悪性度には関係なく、血清AFPレベルが高い場合または卵黄嚢腫瘍の顕微鏡的病巣が存在する場合でも、手術単独で治癒した。
- この研究では、3年イベントフリー生存(EFS)率が卵巣腫瘍の患者で97.8%、精巣腫瘍の患者で100%、性腺外腫瘍の患者で80%であったことが示された。
II~IV期
小児において化学療法の使用を支持する臨床試験は、この分野があまり研究されていないため、存在しない。小児における未熟奇形腫は主に手術と観察で管理される。成人では、1976年以降、手術とその後の化学療法が標準治療アプローチとなっている。[ 23 ]小児では、成人向け化学療法の使用を支持する臨床試験は存在しない。
証拠(未熟奇形腫に対する化学療法の役割):
- 1976年に発表された生殖に関する記事で、未熟奇形腫を有するほとんどの女性が手術と化学療法で治療されたことが報告された;このアプローチは思春期後の女性において依然として標準的な実践となっている。[ 23 ]
- 英国における15歳以下の小児患者の報告により、未熟奇形腫は化学療法に反応を示さなかったことが明らかにされた。[ 24 ]
- Malignant Germ Cell Tumor International Collaborative(MaGIC)からの報告で、未熟奇形腫の小児患者98人および成人患者81人からのデータが解析された。90人の小児患者は手術のみを受けた。成人患者は81人全員が補助化学療法を受けた。[
25
][証拠レベル:3iiiA]
- 5年EFS率は小児患者で91%および成人患者で98%であった;全生存率は小児患者で83%および成人患者で93%であった。
- 悪性度Iの腫瘍を有する患者では再燃は認められなかった。悪性度IIの腫瘍を有した成人患者1人のみが化学療法後に再燃した。しかしながら、組織学的悪性度IIIの腫瘍を有した患者だけは再発リスクが高かった。
- すべての小児の悪性度III、I/II期腫瘍に対する5年EFS率は92%であった;悪性度III、III期の腫瘍に対する5年EFS率は52%であった。成人の悪性度III、I/II期腫瘍に対する5年EFS率は91%であった;悪性度III、III/IV期の腫瘍に対する5年EFS率は65%であった。
化学療法による卵巣の未熟奇形腫の治療に関しては、追加の研究が必要である。(思春期後の女性における卵巣の未熟奇形腫の治療に関する詳しい情報については、卵巣胚細胞腫瘍の治療に関するPDQ要約を参照のこと。)
未熟奇形腫に対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
- AGCT1531(NCT03067181)(GCTの小児および成人患者の治療における積極的なサーベイランス、ブレオマイシン、カルボプラチン、エトポシド、またはシスプラチン):小児腫瘍学グループのI期(国際産科婦人科連合[FIGO]のIA期およびIB期)、悪性度2または3、およびAFP値が1,000ng/mL未満である卵巣の純粋細胞型未熟奇形腫(ovarian pure-cell immature teratomas)を有する患者が、この試験で手術と観察に適格である。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999.[PUBMED Abstract]
- Göbel U, Calaminus G, Engert J, et al.: Teratomas in infancy and childhood. Med Pediatr Oncol 31 (1): 8-15, 1998.[PUBMED Abstract]
- Pinkerton CR: Malignant germ cell tumours in childhood. Eur J Cancer 33 (6): 895-901; discussion 901-2, 1997.[PUBMED Abstract]
- Schneider DT, Calaminus G, Reinhard H, et al.: Primary mediastinal germ cell tumors in children and adolescents: results of the German cooperative protocols MAKEI 83/86, 89, and 96. J Clin Oncol 18 (4): 832-9, 2000.[PUBMED Abstract]
- Dharmarajan H, Rouillard-Bazinet N, Chandy BM: Mature and immature pediatric head and neck teratomas: A 15-year review at a large tertiary center. Int J Pediatr Otorhinolaryngol 105: 43-47, 2018.[PUBMED Abstract]
- Bernbeck B, Schneider DT, Bernbeck B, et al.: Germ cell tumors of the head and neck: report from the MAKEI Study Group. Pediatr Blood Cancer 52 (2): 223-6, 2009.[PUBMED Abstract]
- Alexander VR, Manjaly JG, Pepper CM, et al.: Head and neck teratomas in children--A series of 23 cases at Great Ormond Street Hospital. Int J Pediatr Otorhinolaryngol 79 (12): 2008-14, 2015.[PUBMED Abstract]
- Metcalfe PD, Farivar-Mohseni H, Farhat W, et al.: Pediatric testicular tumors: contemporary incidence and efficacy of testicular preserving surgery. J Urol 170 (6 Pt 1): 2412-5; discussion 2415-6, 2003.[PUBMED Abstract]
- Rescorla FJ, Sawin RS, Coran AG, et al.: Long-term outcome for infants and children with sacrococcygeal teratoma: a report from the Childrens Cancer Group. J Pediatr Surg 33 (2): 171-6, 1998.[PUBMED Abstract]
- Altman RP, Randolph JG, Lilly JR: Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey-1973. J Pediatr Surg 9 (3): 389-98, 1974.[PUBMED Abstract]
- Ablin AR, Krailo MD, Ramsay NK, et al.: Results of treatment of malignant germ cell tumors in 93 children: a report from the Childrens Cancer Study Group. J Clin Oncol 9 (10): 1782-92, 1991.[PUBMED Abstract]
- Marina N, Fontanesi J, Kun L, et al.: Treatment of childhood germ cell tumors. Review of the St. Jude experience from 1979 to 1988. Cancer 70 (10): 2568-75, 1992.[PUBMED Abstract]
- Baranzelli MC, Kramar A, Bouffet E, et al.: Prognostic factors in children with localized malignant nonseminomatous germ cell tumors. J Clin Oncol 17 (4): 1212, 1999.[PUBMED Abstract]
- Huddart SN, Mann JR, Robinson K, et al.: Sacrococcygeal teratomas: the UK Children's Cancer Study Group's experience. I. Neonatal. Pediatr Surg Int 19 (1-2): 47-51, 2003.[PUBMED Abstract]
- Egler RA, Gosiengfiao Y, Russell H, et al.: Is surgical resection and observation sufficient for stage I and II sacrococcygeal germ cell tumors? A case series and review. Pediatr Blood Cancer 64 (5): , 2017.[PUBMED Abstract]
- Gonzalez-Crussi F, Winkler RF, Mirkin DL: Sacrococcygeal teratomas in infants and children: relationship of histology and prognosis in 40 cases. Arch Pathol Lab Med 102 (8): 420-5, 1978.[PUBMED Abstract]
- Gabra HO, Jesudason EC, McDowell HP, et al.: Sacrococcygeal teratoma--a 25-year experience in a UK regional center. J Pediatr Surg 41 (9): 1513-6, 2006.[PUBMED Abstract]
- De Corti F, Sarnacki S, Patte C, et al.: Prognosis of malignant sacrococcygeal germ cell tumours according to their natural history and surgical management. Surg Oncol 21 (2): e31-7, 2012.[PUBMED Abstract]
- Derikx JP, De Backer A, van de Schoot L, et al.: Long-term functional sequelae of sacrococcygeal teratoma: a national study in The Netherlands. J Pediatr Surg 42 (6): 1122-6, 2007.[PUBMED Abstract]
- Valdiserri RO, Yunis EJ: Sacrococcygeal teratomas: a review of 68 cases. Cancer 48 (1): 217-21, 1981.[PUBMED Abstract]
- Carter D, Bibro MC, Touloukian RJ: Benign clinical behavior of immature mediastinal teratoma in infancy and childhood: report of two cases and review of the literature. Cancer 49 (2): 398-402, 1982.[PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999.[PUBMED Abstract]
- Norris HJ, Zirkin HJ, Benson WL: Immature (malignant) teratoma of the ovary: a clinical and pathologic study of 58 cases. Cancer 37 (5): 2359-72, 1976.[PUBMED Abstract]
- Mann JR, Gray ES, Thornton C, et al.: Mature and immature extracranial teratomas in children: the UK Children's Cancer Study Group Experience. J Clin Oncol 26 (21): 3590-7, 2008.[PUBMED Abstract]
- Pashankar F, Hale JP, Dang H, et al.: Is adjuvant chemotherapy indicated in ovarian immature teratomas? A combined data analysis from the Malignant Germ Cell Tumor International Collaborative. Cancer 122 (2): 230-7, 2016.[PUBMED Abstract]
- 小児の悪性性腺GCTの治療
-
小児悪性精巣GCT
思春期前男性の悪性精巣GCT
小児の精巣胚細胞腫瘍(GCT)は、ほとんど4歳未満の男児にのみ発生する。[ 1 ][ 2 ]低年齢男児では、経陰嚢生検が鼠径リンパ節転移のリスクをもたらす可能性があるため、精巣腫瘤を評価するために最初に行う外科的アプローチが重要となる。[ 3 ][ 4 ]初めに精索を高位結紮して行う高位精巣摘除術が、選択すべき手法である。[ 5 ]
コンピュータ断層撮影または磁気共鳴画像法による評価は、腫瘍マーカーの上昇によって得られる追加情報とともに、病期分類に適切とみられている。低年齢男児における精巣GCTの病期分類で、後腹膜リンパ節郭清は有益でない。[ 3 ][ 4 ]したがって、リンパ節郭清に伴って発生する可能性のある合併症(例えば、勃起不能および逆行性射精)のリスクを冒す根拠はない。[ 6 ][ 7 ]
GCTでは、診断時における手術の役割は年齢および部位により異なり、個別に判断しなければならない。悪性精巣GCTはすべて切除すべきである。切除に続いて、化学療法後に残存した腫瘤の摘除を実施すべきである。
思春期前男性の悪性GCTに対する標準治療法の選択肢
思春期前(11歳未満)男性の悪性GCTに対する標準治療法の選択肢には以下のものがある:
思春期前男性の悪性GCTに対する治療法選択肢は、病期により異なる。
I期
切除後の腫瘍マーカーの正常化を証明するには、手術と綿密なフォローアップ観察が必要である。[ 3 ][ 8 ]
証拠(思春期前男性におけるI期疾患に対する手術と観察):
- Children's Cancer Group(CCG)/Pediatric Oncology Group(POG)の臨床試験では、10歳以下のI期の精巣腫瘍の男児を対象に手術後の観察を評価した。[
3
][
4
]
- この治療戦略により、6年イベントフリー生存(EFS)率が82%に達した。
- 再発した男児に対して、標準用量のシスプラチン、エトポシド、およびブレオマイシン(PEb)による4サイクルの救助療法を行ったところ、6年生存率は100%であった。
- 15歳未満のI期腫瘍の男児80人を対象にしたその後の小児腫瘍学グループ(COG)の研究には、11~15歳で手術と観察で治療された男児15人が含まれていた。[
9
][証拠レベル:3iiA]
- 診断時に11歳未満の男児65人の4年EFS率は80%で、11歳以上の男児15人では48%であった(P < 0.01)。すべての患者が最終的に救助され、4年全生存(OS)率は100%であった。
- 予後良好因子は、より若年であること、純粋な卵黄嚢腫瘍の存在、および原発腫瘍によるリンパ血管性浸潤が認められないことであった。
- 成人の精巣腫瘍病期分類システムでは、リンパ血管性浸潤が認められる患者はIB期に分類される。コホート全体では、リンパ血管性浸潤が認められる患者の4年EFS率は低かった(62% vs 84%)。
- 精巣GCTでほとんどがI期の10歳未満の男児128人を対象としたドイツの研究(MAHO 98)でも、手術とその後の経過観察が評価された。[
10
][証拠レベル:3iiA]
- 高位精巣摘除術後にIA期に病期分類された卵黄嚢腫瘍の患者は49人であった。IA期ではリンパ血管性浸潤の証拠が認められない。このグループの5年EFS率は95%で、5年OS率は100%であった;再燃した患者は2人だけで、化学療法後に治癒した。
- 最初に経陰嚢的精巣摘除術を受け、病理学的にリンパ血管性浸潤がないことが確認された患者(手術が行われていなければ、IA期と考えられた)は12人であった。10人の患者が観察されたが、有害事象は発生しなかった。2人の患者(17%)が再燃したが、化学療法後は持続的寛解を維持した。片側陰嚢切除術(hemiscrotectomy)を受けた患者はいなかった。長年の問題は、経陰嚢的精巣摘除術では化学療法または片側陰嚢切除術(hemiscrotectomy)が必要となるかどうかということである。この研究の患者は少数であったものの、後者のデータからリンパ血管性浸潤が認められなければ、観察が適切である可能性が示唆されている。
II~IV期
手術と4サイクルの標準PEbによる化学療法が、II~IV期疾患を有する思春期前男性に対する一般的な治療レジメンである。このレジメンで治療を受けた患者では、OS転帰が90%を超えており、治療の縮小を検討できる可能性が示唆される。[ 11 ][ 12 ]
手術と4~6サイクルのカルボプラチン、エトポシド、およびブレオマイシン(JEb)による治療が代替の治療レジメンとなる。[ 8 ]
改訂されたリスク層別化がMalignant Germ Cell Tumor International Consortiumにより開発された(図3を参照のこと)。[ 13 ]
証拠(思春期前男性におけるII~IV期疾患に対する手術と化学療法):
- CCG/POG臨床試験では、II期腫瘍の診断後に4サイクルのPEbによる治療を受けた10歳未満の男児を評価した。[
11
]
- 6年EFSおよびOSの割合は100%であった。
- 同様なCCG/POG臨床試験では、III期およびIV期の精巣腫瘍の男児および青年男性(14歳以下)に対して、外科的切除とその後の4サイクルの標準用量PEbまたは高用量PEb(HD-PEb)による治療を施行した。[
12
]
- 15歳未満のIII期およびIV期の腫瘍の男性では、6年生存転帰が100%であった。
- 15歳未満の男性の6年EFS率は、III期の腫瘍で100%、IV期の腫瘍で94%であった。
- HD-PEb療法の使用により、これらの男児の転帰は改善しなかったが、耳毒性の発生率が確実に増加した。
- ヨーロッパの研究者によっても、精巣GCTの男児に対して、I期の腫瘍には手術と観察、II期、III期、およびIV期の腫瘍にはJEbのほか、シスプラチンを含む化学療法レジメンを用いることで優れた転帰が報告されている。[ 6 ][ 8 ]
- COGによる第III相単一群試験(AGCT0132[NCT00053352])では、210人の中リスク患者(II~IV期の精巣腫瘍、II~III期の卵巣腫瘍、I~II期の性腺外腫瘍、またはI期の性腺腫瘍でその後に再発が見られた)が、4サイクルよりもむしろ3サイクルのPEbを受け、投与スケジュールは1サイクル当たり5日から3日に圧縮された。パラメトリック比較モデルでは、観察されるEFS率が92%を大きく下回ることはないと規定された。[
14
][証拠レベル:2Di]
- 4年EFS率は89%(95%信頼区間、83%-92%)で、これは比較モデルの92%の閾値を大きく下回った(P = 0.08)。
- 事後解析では、EFS率が2件の以前の研究において4サイクルのPEbで治療された同様の患者と比較された。新たに診断された患者181人における4年EFS率は87%で、歴史的コホートの同等の小児92人における92%と比較された(P = 0.15)。
- 4年EFS率は病期と有意に関連していた(I期、100%;II期、92%;III期、85%;およびIV期、54%;P < 0.001)。
- これらのデータから、PEbのサイクル数を4サイクルから3サイクルに減らす治療は支持されていない。
思春期後男性の悪性精巣GCT
思春期前男性に対する前述の治療法選択肢は、思春期後男性に対して厳密には適用できない可能性がある。特に、後腹膜リンパ節郭清は、転移性精巣GCTを治療するための化学療法後の残存腫瘍のある患者の治療に対してきわめて重要な役割[ 15 ]を果たしている可能性がある。[ 16 ][ 17 ]1件のメタアナリシスにより、11歳を超える患者は再発リスクが高かったことが示された。[ 13 ]GCTの11~15歳の男性の数は少ない;これらの患者は成人の基準に従って治療すべきであろう。(思春期後男性における悪性精巣GCTの治療に関する詳しい情報については、精巣腫瘍の治療に関するPDQ要約を参照のこと。)
思春期後男性の悪性精巣GCTに対する標準治療法の選択肢
思春期後男性の悪性精巣GCTの治療に関する情報については、精巣腫瘍の治療に関するPDQ要約を参照のこと。
悪性精巣GCTに対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
- AGCT1531(NCT03067181)(GCTの小児および成人患者の治療における積極的なサーベイランス、ブレオマイシン、カルボプラチン、エトポシド、またはシスプラチン):この試験の目的は、標準リスクのGCTを有する患者に対する治療の効力を維持しながら毒性を低下させることである。I期の悪性GCTを有する患者(低リスク、年齢0~50歳)は手術と観察で治療される。中リスクのGCTを有する患者は、シスプラチンまたはカルボプラチンとブレオマイシンおよびエトポシドを受ける群にランダムに割り付けられる。11歳未満の小児は各サイクルにブレオマイシンを投与され、11歳以上の小児は週1回ブレオマイシンを投与される。純型セミノーマまたは未分化胚細胞腫を有する患者はこの試験では除外される。
- AGCT1532(NCT02582697)(中リスクおよび予後不良な転移性GCTを有する患者に対する加速投与 vs 標準投与のBEP化学療法のランダム化第3相試験):ブレオマイシン、エトポシド、およびシスプラチン(BEP)の3週間ごとに4サイクルの投与は、依然として中リスクおよび予後不良な転移性GCTに対する標準の第一選択化学療法となっている。BEPは、シスプラチンとエトポシドのサイクルを3週間ごとの代わりに2週間ごとにすることで加速投与が可能である。Australian and New Zealand Urogenital and Prostate Cancer Trials Groupは、加速投与BEPと標準投与BEPを比較する試験を実施している。この研究の目的は、中リスクおよび予後不良な転移性GCTに対する第一選択化学療法として、加速投与BEPが標準投与のBEPより優れているかどうかを判定することである。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
小児の悪性卵巣GCT
小児および青年における卵巣新生物の大部分は胚細胞由来である。[ 1 ]低年齢女児では、卵巣GCTは非常にまれであるが、約8~9歳の小児で発生率の上昇がみられるようになり、成人期を通して上昇が続く。[ 1 ]
小児の悪性卵巣GCTは、胚細胞腫(未分化胚細胞腫)と胚細胞腫以外の悪性GCT(すなわち、卵黄嚢がん、混合型GCT、絨毛がん、および胎児性がん)に分類できる。
(卵巣に発生する小児の成熟奇形腫および未熟奇形腫に関する詳しい情報については、本要約の成熟奇形腫の治療のセクションを、また思春期後女性の卵巣GCTの治療に関する詳しい情報については、卵巣胚細胞腫瘍の治療に関するPDQ要約を参照のこと。)
卵巣の未分化胚細胞腫
卵巣の未分化胚細胞腫に対する標準治療法の選択肢
卵巣の未分化胚細胞腫に対する標準治療法の選択肢には以下のものがある:
卵巣の未分化胚細胞腫に対する治療法選択肢は、病期により異なる。
I期
I期の卵巣未分化胚細胞腫に対しては、子宮と対側の卵巣を温存する片側卵管卵巣摘出術および綿密な経過観察により通常治癒が達成できる。[ 8 ][ 18 ][ 19 ][ 20 ][ 21 ]3件の連続したFrench Society of Pediatric Oncology研究(TGM-85、TGM-90、およびTGM-95)において、15人の患者がI期と確認され、すべての患者が生存した。[ 22 ]1998年以前に、8人の患者が補助放射線療法または化学療法で治療された。診療の変更後(1998年以降)、7人の患者が手術と観察を受けた。7人の患者のうち1人(14%)に腫瘍が発生したが、化学療法による治療に反応した。[ 22 ][証拠レベル:3iiA]
II~IV期
精巣のセミノーマのように、進行期の卵巣未分化胚細胞腫は、手術と放射線療法で治癒する可能性が高いが、これらの若い患者における成長および受胎能への影響のほか、治療によって誘発される二次悪性腫瘍のリスクがあるため[ 23 ][ 24 ]、手術の補助療法としての化学療法がより魅力的になっている。[ 25 ][ 26 ]腫瘍の完全切除は進行期未分化胚細胞腫における目標である;プラチナ製剤をベースにした化学療法は切除を容易にするために術前に、または生命構造を犠牲にする外科的処置を回避するために術後(減量手術後)に投与されることがある。[ 21 ]French Society of Pediatric Oncologyからの報告には、19歳未満の女児48人(年齢中央値、12.8歳)が登録された;20人の患者が限局性腫瘍を有し、28人の患者が局所領域腫瘍を有し、転移を来した患者はなかった。7人の患者が傍大動脈リンパ節転移陽性であった。47人の患者が初回手術を受けた。1998年以前は、進行期腫瘍を有するすべての患者が放射線療法を受けていた。診療の変更後(1998年以降)、患者はプラチナ製剤をベースにした化学療法で治療された。5年EFS率は91%で、5年OS率は100%であった。重度の副作用は認められず、数人の患者が後年に妊娠した。[ 22 ][証拠レベル:3iiA]このアプローチにより高い治癒率が得られ、未分化胚細胞腫患者のほとんどで月経機能および受胎能が温存される。[ 25 ][ 27 ]Malignant Germ Cell Tumor International Consortiumによる未分化胚細胞腫患者のメタアナリシスでは、シスプラチンによる治療を受けた患者(n = 70)(5年EFS率、93%;OS率、96%)とカルボプラチンによる治療を受けた患者(n = 56)(5年EFS率、96%;OS率、96%)で差が認められなかった。[ 28 ]
胚細胞腫以外の悪性卵巣GCT
卵巣GCTの治療には集学的アプローチが必須である。臨床上の意思決定には、外科のさまざまな種類の専門医および小児腫瘍医が関与しなければならない。小児卵巣GCTに対する外科的アプローチはしばしば、生殖機能が温存できるという期待によって導かれる。
胚細胞腫以外の悪性卵巣GCTに対する標準治療法の選択肢
思春期前女性における胚細胞腫以外の悪性卵巣GCTに対する標準治療法の選択肢には以下のものがある:
思春期後女性における胚細胞腫以外の悪性卵巣GCTに対する標準治療法の選択肢には以下のものがある:
最初に切除不能な胚細胞腫以外の悪性卵巣GCTに対する標準治療法の選択肢には以下のものがある:
未分化胚細胞腫または未熟奇形腫以外の卵巣悪性GCTの治療には、一般に外科的切除と補助化学療法が含まれる。[ 29 ][ 30 ]
診断時における手術の役割は年齢および部位により異なり、個別に判断しなければならない。卵巣GCTの小児における腹腔鏡検査の使用については、研究が不十分である。
I期と判定する小児向け外科ガイドラインが公表されている。[ 31 ]病期を判定する成人向け外科ガイドラインは、さらに広範囲となっている。(思春期後女性の卵巣GCTの病期分類に関する詳しい情報については、卵巣胚細胞腫瘍の治療に関するPDQ要約の卵巣胚細胞腫瘍の病期情報セクションを参照のこと。)真のI期を判定するには、厳密な外科的病期分類ガイドラインに従う必要がある。これまで、小児および成人のいずれの研究も、総合的な病期分類ガイドラインに従って行われたことがない。厳密な外科的病期分類ガイドラインに従わない場合は、手術とその後の観察よりも、手術とその後の化学療法が標準治療である。[ 8 ][ 11 ][ 32 ]小児GCTに対する外科療法の目標は、生殖機能の温存である。保存的手術を選択する場合は、補助化学療法により高い治癒率が得られるため、厳密な外科的ガイドラインを遵守する必要はない。[ 33 ]
小児では、シスプラチン(PEb)またはカルボプラチン(JEb)を用いる化学療法レジメンが使用され、成功を収めている。[ 8 ][ 11 ][ 12 ][ 18 ]卵巣GCTの若年女性では、BEPが多く使用されるレジメンである。[ 34 ][ 35 ]BEPはPEbとは異なり、毎週1回のブレオマイシンを追加している。このアプローチにより高い治癒率が得られ、非未分化胚細胞腫患者のほとんどで月経機能および受胎能が温存される。[ 30 ][ 32 ](BEP、PEb、およびJEbの用法・用量に関する詳しい情報については、表7を参照のこと。)
手術と観察
I期疾患を有する思春期前後女性において、厳密な外科的病期分類ガイドラインに従う場合は、手術とその後の観察が適切な治療選択となる可能性がある。
証拠(思春期前女性におけるI期疾患に対する手術と観察):
手術と化学療法
改訂されたリスク層別化がMalignant Germ Cell Tumor International Consortiumにより開発された(図3を参照のこと)。[ 13 ]
I期卵巣腫瘍を有するとされる思春期前後女性において、厳密な外科的病期分類ガイドラインに従わない場合は、手術とその後の化学療法(4サイクルのPEb)が適切な治療選択であり、95%のEFS率およびOS率が得られる。[ 11 ][ 12 ]
I期卵巣腫瘍を有するとされる思春期後女性において、切除後の化学療法は依然として標準治療となっている。思春期後女性において、手術後の観察による戦略は確立されていない;この治療戦略はAGCT1531(NCT03067181)試験において研究段階にある。
II期、III期、またはIV期卵巣腫瘍を有する思春期前および思春期後女性において、手術と化学療法は標準治療と考えられている。低年齢(思春期前)の女児の治療には手術と4~6サイクルの標準PEbによる化学療法が用いられ[ 11 ][ 12 ]、思春期後の女児の治療にはBEPによる化学療法が用いられる。[ 34 ][ 35 ]腫瘍マーカーが正常化した患者では、4サイクルのPEb後に画像検査を行い、残存腫瘍があれば切除する。手術後に生存腫瘍が残存している患者は難治性と考えられる。
その他に、(すべての患者が15歳未満であった1件の研究で実証されているように)手術と4~6サイクルのJEbによる化学療法が治療選択肢となる。[ 8 ]
最初は切除不能な腫瘍
通常は、卵巣GCTの一次切除が試みられる。隣接臓器に損傷を与える過度のリスクを伴わずに卵巣の一次切除が不可能なまれな例での適切な戦略は、診断のための生検の後に化学療法を実施し、腫瘤が残存している患者ではその後に手術を施行することである。
悪性卵巣GCTに対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
- AGCT1531(NCT03067181)(GCTの小児および成人患者の治療における積極的なサーベイランス、ブレオマイシン、カルボプラチン、エトポシド、またはシスプラチン):この試験の目的は、標準リスクのGCTを有する患者に対する治療の効力を維持しながら毒性を低下させることである。I期の悪性GCTを有する患者(低リスク、年齢0~50歳)は手術と観察で治療される。中リスクのGCTを有する患者は、シスプラチンまたはカルボプラチンとブレオマイシンおよびエトポシドを受ける群にランダムに割り付けられる。11歳未満の小児は各サイクルにブレオマイシンを投与され、11歳以上の小児は週1回ブレオマイシンを投与される。純型セミノーマまたは未分化胚細胞腫を有する患者はこの試験では除外される。
- AGCT1532(NCT02582697)(中リスクおよび予後不良な転移性GCTを有する患者に対する加速投与 vs 標準投与のBEP化学療法のランダム化第3相試験):ブレオマイシン、エトポシド、およびシスプラチン(BEP)の3週間ごとに4サイクルの投与は、依然として中リスクおよび予後不良な転移性GCTに対する標準の第一選択化学療法となっている。BEPは、シスプラチンとエトポシドのサイクルを3週間ごとの代わりに2週間ごとにすることで加速投与が可能である。Australian and New Zealand Urogenital and Prostate Cancer Trials Groupは、加速投与BEPと標準投与BEPを比較する試験を実施している。この研究の目的は、中リスクおよび予後不良な転移性GCTに対する第一選択化学療法として、加速投与BEPが標準投与のBEPより優れているかどうかを判定することである。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Ries LA, Smith MA, Gurney JG, et al., eds.: Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. Bethesda, Md: National Cancer Institute, SEER Program, 1999. NIH Pub.No. 99-4649. Also available online. Last accessed January 31, 2020.[PUBMED Abstract]
- Walsh TJ, Grady RW, Porter MP, et al.: Incidence of testicular germ cell cancers in U.S. children: SEER program experience 1973 to 2000. Urology 68 (2): 402-5; discussion 405, 2006.[PUBMED Abstract]
- Schlatter M, Rescorla F, Giller R, et al.: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group. J Pediatr Surg 38 (3): 319-24; discussion 319-24, 2003.[PUBMED Abstract]
- Canning DA: Excellent outcome in patients with stage I germ cell tumors of the testes: a study of the Children's Cancer Group/Pediatric Oncology Group [Editorial Comment on Schlatter]. J Urol 174 (1): 310, 2005.[PUBMED Abstract]
- Rescorla FJ: Pediatric germ cell tumors. Semin Surg Oncol 16 (2): 144-58, 1999.[PUBMED Abstract]
- Haas RJ, Schmidt P, Göbel U, et al.: Treatment of malignant testicular tumors in childhood: results of the German National Study 1982-1992. Med Pediatr Oncol 23 (5): 400-5, 1994.[PUBMED Abstract]
- Pinkerton CR: Malignant germ cell tumours in childhood. Eur J Cancer 33 (6): 895-901; discussion 901-2, 1997.[PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000.[PUBMED Abstract]
- Rescorla FJ, Ross JH, Billmire DF, et al.: Surveillance after initial surgery for Stage I pediatric and adolescent boys with malignant testicular germ cell tumors: Report from the Children's Oncology Group. J Pediatr Surg 50 (6): 1000-3, 2015.[PUBMED Abstract]
- Göbel U, Haas R, Calaminus G, et al.: Testicular germ cell tumors in boys <10 years: results of the protocol MAHO 98 in respect to surgery and watch & wait strategy. Klin Padiatr 225 (6): 296-302, 2013.[PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004.[PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004.[PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015.[PUBMED Abstract]
- Shaikh F, Cullen JW, Olson TA, et al.: Reduced and Compressed Cisplatin-Based Chemotherapy in Children and Adolescents With Intermediate-Risk Extracranial Malignant Germ Cell Tumors: A Report From the Children's Oncology Group. J Clin Oncol 35 (11): 1203-1210, 2017.[PUBMED Abstract]
- de Wit R, Fizazi K: Controversies in the management of clinical stage I testis cancer. J Clin Oncol 24 (35): 5482-92, 2006.[PUBMED Abstract]
- Carver BS, Shayegan B, Serio A, et al.: Long-term clinical outcome after postchemotherapy retroperitoneal lymph node dissection in men with residual teratoma. J Clin Oncol 25 (9): 1033-7, 2007.[PUBMED Abstract]
- Carver BS, Shayegan B, Eggener S, et al.: Incidence of metastatic nonseminomatous germ cell tumor outside the boundaries of a modified postchemotherapy retroperitoneal lymph node dissection. J Clin Oncol 25 (28): 4365-9, 2007.[PUBMED Abstract]
- Baranzelli MC, Bouffet E, Quintana E, et al.: Non-seminomatous ovarian germ cell tumours in children. Eur J Cancer 36 (3): 376-83, 2000.[PUBMED Abstract]
- Dark GG, Bower M, Newlands ES, et al.: Surveillance policy for stage I ovarian germ cell tumors. J Clin Oncol 15 (2): 620-4, 1997.[PUBMED Abstract]
- Marina NM, Cushing B, Giller R, et al.: Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology Group/Children's Cancer Group Intergroup Study. J Clin Oncol 17 (7): 2137-43, 1999.[PUBMED Abstract]
- Gershenson DM: Chemotherapy of ovarian germ cell tumors and sex cord stromal tumors. Semin Surg Oncol 10 (4): 290-8, 1994 Jul-Aug.[PUBMED Abstract]
- Duhil de Bénazé G, Pacquement H, Faure-Conter C, et al.: Paediatric dysgerminoma: Results of three consecutive French germ cell tumours clinical studies (TGM-85/90/95) with late effects study. Eur J Cancer 91: 30-37, 2018.[PUBMED Abstract]
- Teinturier C, Gelez J, Flamant F, et al.: Pure dysgerminoma of the ovary in childhood: treatment results and sequelae. Med Pediatr Oncol 23 (1): 1-7, 1994.[PUBMED Abstract]
- Mitchell MF, Gershenson DM, Soeters RP, et al.: The long-term effects of radiation therapy on patients with ovarian dysgerminoma. Cancer 67 (4): 1084-90, 1991.[PUBMED Abstract]
- Brewer M, Gershenson DM, Herzog CE, et al.: Outcome and reproductive function after chemotherapy for ovarian dysgerminoma. J Clin Oncol 17 (9): 2670-75, 1999.[PUBMED Abstract]
- Williams SD, Blessing JA, Hatch KD, et al.: Chemotherapy of advanced dysgerminoma: trials of the Gynecologic Oncology Group. J Clin Oncol 9 (11): 1950-5, 1991.[PUBMED Abstract]
- Gershenson DM: Menstrual and reproductive function after treatment with combination chemotherapy for malignant ovarian germ cell tumors. J Clin Oncol 6 (2): 270-5, 1988.[PUBMED Abstract]
- Shah R, Xia C, Krailo M, et al.: Is carboplatin-based chemotherapy as effective as cisplatin-based chemotherapy in the treatment of advanced-stage dysgerminoma in children, adolescents and young adults? Gynecol Oncol 150 (2): 253-260, 2018.[PUBMED Abstract]
- Gershenson DM, Morris M, Cangir A, et al.: Treatment of malignant germ cell tumors of the ovary with bleomycin, etoposide, and cisplatin. J Clin Oncol 8 (4): 715-20, 1990.[PUBMED Abstract]
- Mitchell PL, Al-Nasiri N, A'Hern R, et al.: Treatment of nondysgerminomatous ovarian germ cell tumors: an analysis of 69 cases. Cancer 85 (10): 2232-44, 1999.[PUBMED Abstract]
- Billmire DF, Cullen JW, Rescorla FJ, et al.: Surveillance after initial surgery for pediatric and adolescent girls with stage I ovarian germ cell tumors: report from the Children's Oncology Group. J Clin Oncol 32 (5): 465-70, 2014.[PUBMED Abstract]
- Palenzuela G, Martin E, Meunier A, et al.: Comprehensive staging allows for excellent outcome in patients with localized malignant germ cell tumor of the ovary. Ann Surg 248 (5): 836-41, 2008.[PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Outcome and staging evaluation in malignant germ cell tumors of the ovary in children and adolescents: an intergroup study. J Pediatr Surg 39 (3): 424-9; discussion 424-9, 2004.[PUBMED Abstract]
- Williams SD: Ovarian germ cell tumors: an update. Semin Oncol 25 (3): 407-13, 1998.[PUBMED Abstract]
- Williams S, Blessing JA, Liao SY, et al.: Adjuvant therapy of ovarian germ cell tumors with cisplatin, etoposide, and bleomycin: a trial of the Gynecologic Oncology Group. J Clin Oncol 12 (4): 701-6, 1994.[PUBMED Abstract]
- Children's Cancer Group(CCG)/Pediatric Oncology Group(POG)の臨床試験では、10歳以下のI期の精巣腫瘍の男児を対象に手術後の観察を評価した。[
3
][
4
]
- 小児の悪性性腺外頭蓋外GCTの治療
-
性腺外頭蓋外胚細胞腫瘍(GCT)(すなわち、仙尾骨、縦隔、および後腹膜部の腫瘍)は、成人より小児に多くみられる。[ 1 ]初期の報告では、性腺外頭蓋外悪性GCTの小児、特に進行期(III期またはIV期)疾患では、どのようなGCTの症状に対しても治療失敗のリスクが最も高かった。[ 2 ][ 3 ]その後、米国および英国における25年間の小児GCTに関する研究からのデータが解析され、性腺外III期およびIV期GCTの11歳未満の小児のイベントフリー生存(EFS)率が85%であったこと、および性腺外III期およびIV期疾患の青年ではより転帰不良であった(推定EFS率、70%未満)ことが報告された。[ 4 ]
思春期前小児における悪性性腺外頭蓋外GCTに対する標準治療法の選択肢
思春期前小児における悪性性腺外頭蓋外GCTに対する標準治療法の選択肢には以下のものがある:
- 手術と化学療法(I~II期)。
- 手術と化学療法(III~IV期)。
- 生検後に化学療法と可能であれば手術(III~IV期)。
悪性性腺外頭蓋外GCTの治療はまた、疾患の部位にも左右される。(詳しい情報については、本要約の悪性性腺外頭蓋外GCTに対する部位特異的な考慮事項のセクションを参照のこと。)
プラチナ製剤をベースにした化学療法の登場および集学的治療アプローチの使用以来、転帰は著しく改善している。[ 2 ][ 5 ]一部の患者では、重大な合併症なしに化学療法前の完全切除が可能な場合がある。仙尾骨腫瘍、縦隔腫瘍、または骨盤広部腫瘍が局所的に進行した患者では、腫瘍生検とその後の術前化学療法により、その後の腫瘍の完全切除が容易になり、最終的な患者の転帰が改善する可能性がある。化学療法を受けた後に遅延切除を受けた性腺外GCT患者における全生存(OS)の低下は認められない。[ 5 ][ 6 ][ 7 ][ 8 ]
性腺外腫瘍では、診断時における手術の役割は年齢および部位により異なるため、個別に判断しなければならない。臨床状況によっては、一次切除、化学療法前の生検、または手術なしが適切な外科的アプローチとなる場合がある(例、気道の障害および腫瘍マーカーの上昇を認める患者における縦隔原発性腫瘍)。化学療法後に腫瘤が残存している選択された患者では、診断時の生検とその後化学療法およびその後の手術が適切な戦略となる場合がある。
I~II期
手術に加えて、標準のシスプラチン、エトポシド、およびブレオマイシン(PEb)による4サイクルの化学療法が治療法選択肢の1つである。このレジメンで治療を受けた患者では、OS率が90%を超えており、治療の縮小を検討できる可能性が示唆される。[ 2 ][ 9 ]代替治療選択肢は、手術に加えて、カルボプラチン、エトポシド、およびブレオマイシン(JEb)による化学療法である。[ 5 ]
III~IV期
III期およびIV期疾患に対する治療法選択肢は、手術に加え、標準のPEbによる4サイクルの化学療法である。このレジメンによる患者のOS率は80%を超えている。[ 2 ]他の治療法選択肢は、手術に加え、JEbによる化学療法で、PEbレジメンと同程度のOS率が得られる。[ 5 ]
小児に関する2件のグループ間共同研究試験で、ランダム化研究における大量シスプラチン(200mg/m2)の使用と、その後の研究で大量シスプラチンにアミフォスチンを追加した場合が調査された。[ 2 ]OSにおける有益性は観察されず、75%の患者では補聴器が必要となった。小児腫瘍学グループ(COG)の試験では、標準用量のPEbに対するシクロホスファミドの追加が検討された。シクロホスファミドの追加は実施可能で、すべての用量群で忍容性が良好であったが、シクロホスファミドの追加による効力の改善を示す証拠は得られなかった。[ 10 ]
悪性性腺外頭蓋外GCTに対する部位特異的な考慮事項
悪性性腺外頭蓋外GCTの治療は一部には、疾患の部位に左右される。
仙尾骨部位
仙尾骨GCTは、きわめて低年齢の小児で、主に低年齢女児にみられる一般的な性腺外腫瘍である。[ 11 ]この腫瘍は、通常、出生時に大きな外部病変(通常は成熟または未熟奇形腫)が主に認められる場合、または生後数年経過してから悪性度がより高い仙骨前面部病変が主に認められる場合に診断される。[ 11 ]
悪性仙尾骨腫瘍は、通常、診断時にかなり進行している;患者の3分の2は、腫瘍が局所領域性で、患者の50%に転移が認められる。[ 7 ][ 12 ][ 13 ]初発時に病気が進行しているため、仙尾骨腫瘍の管理では、プラチナ製剤をベースとした化学療法を実施し、その後に腫瘍切除を遅らせて施行する集学的アプローチが必要である。
シスプラチンまたはカルボプラチンを用いたプラチナ製剤をベースにした療法は、治療の基礎である。PEbレジメンまたはJEbレジメンにより、85%のEFS率が得られる。[ 7 ][ 8 ]術前化学療法により、手術が容易になる可能性がある。仙尾骨GCTの患者にはいずれも、尾骨の切除が必須である。[ 7 ][ 8 ]
外科的切除の完全性は、以下の状況で示されているように重要な予後因子である:[ 7 ][ 8 ][ 14 ]
- 切除腫瘍で顕微鏡的に切除断端が陰性の場合—EFS率は90%を超える。
- 切除腫瘍で顕微鏡的に切除断端が陽性の場合—EFS率は75~85%である。
- 切除腫瘍で肉眼的に腫瘍が残存している場合—EFS率は40%未満である。
縦隔部位
縦隔GCTは、小児における悪性性腺外頭蓋外GCTの15~20%を占める。[ 5 ]縦隔GCTの組織像は年齢により異なり、乳児では奇形腫が主にみられ、1~4歳の小児では卵黄嚢腫瘍の組織像が主にみられる。[ 6 ]
縦隔悪性奇形腫の思春期前小児は腫瘍が切除され、この切除によってほぼすべての患者で治癒が得られる。[ 6 ]I~III期の転移を認めない縦隔GCTの小児がシスプラチンをベースにした化学療法を受けた場合、5年EFS率およびOS率は90%である;しかしながら、IV期縦隔腫瘍の患者では、EFS率が80%に近い。[ 4 ][ 5 ][ 6 ];[ 15 ][証拠レベル:3iiA]
後腹膜部位
後腹膜または腹部に位置する悪性GCTは通常、5歳未満の小児に認められる;ほとんどの腫瘍は進行病期であり、診断時に局所切除が不可能である。[ 16 ]限局的な生検に続いて、腫瘍容積を縮小させるためのプラチナ製剤をベースにした化学療法により、ほとんどの患者において腫瘍の完全切除が可能になる。ほとんどの患者で腫瘍が進行期にあるにもかかわらず、Pediatric Oncology Group/Children's Cancer Groupのグループ間共同研究では、PEbを用いた6年EFS率が83%であった。[ 16 ]
頭頸部
まれではあるが、頭頸部領域に良性および悪性GCTが特に乳児で発生することがある。気道が脅かされる場合が多い。非悪性腫瘍に対しては手術、悪性腫瘍に対しては手術と化学療法により治癒可能である。[ 17 ][証拠レベル:3iiiDii]
思春期後小児における悪性性腺外頭蓋外GCTに対する標準治療法の選択肢
小児性腺外悪性GCTの予後因子についての1件の研究では、12歳以上の年齢が最も重要な予後因子であった。多変量解析では、胸部腫瘍を有する12歳以上の小児の死亡リスクは、胸部以外の原発腫瘍を有する12歳未満の小児に比べ、6倍であった。[ 18 ]その後のメタアナリシスで、III~IV期性腺外疾患を有する青年は転帰不良であった(推定EFS率、70%未満)。[ 4 ]青年および若年成人ではいずれの病期の性腺外疾患も予後不良な危険因子と考えられる。[ 19 ]
思春期後小児における悪性性腺外頭蓋外GCTに対する標準治療法の選択肢には以下のものがある:
- 手術。
- 化学療法(4サイクルのブレオマイシン、エトポシド、およびシスプラチン[BEP])。
- 化学療法とその後の残存腫瘍を切除するための手術。
- 臨床試験への登録。
青年および若年成人における縦隔GCTのほとんどは男性に発生し、22~50%にクラインフェルター症候群と一致する細胞遺伝学的変化がみられる。[ 20 ][ 21 ]クラインフェルター症候群患者における発症時年齢は比較的低く、若年の男性はすべてクラインフェルター症候群が認められないかの検査を検討すべきである。[ 20 ][ 21 ](詳しい情報については、GCTの生物学を参照のこと。)仙尾骨腫瘍と同様に、通常、縦隔GCTの外科的切除を容易にするために初期化学療法が必要であり、切除の完全性は非常に重要な予後指標である。[ 6 ][ 22 ]縦隔腫瘍の高年齢の青年および若年成人集団の生存率は、おおむね60%未満である。[ 4 ][ 18 ][ 23 ][ 24 ][ 25 ];[ 26 ][証拠レベル:3iiA]
クラインフェルター症候群の患者は、縦隔GCTを発症するリスクが高い。[ 20 ][ 27 ][ 28 ]GCT患者は、COGのChildhood Cancer Research Networkから同定された。この研究の29人の患者は縦隔原発腫瘍を有し、9人の患者(31%)はクラインフェルター症候群を有した。疾病予防管理センターの大規模な2013 WONDERデータベースにおいて、GCTを有する患者の3%にクラインフェルター症候群が認められたのに対し(70%が縦隔)、一般集団の男性におけるクラインフェルター症候群の報告は0.2%であった。[ 29 ]
悪性縦隔原発腫瘍で頭蓋外転移を認める患者では、脳に転移するリスクが最も高く、中枢神経系への浸潤による徴候および症状について綿密にモニターする。[ 30 ][証拠レベル:3iiB](成人患者の治療に関する詳しい情報については、性腺外胚細胞腫瘍の治療に関するPDQ要約を参照のこと。)
悪性性腺外頭蓋外GCTに対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
- AGCT1531(NCT03067181)(GCTの小児および成人患者の治療における積極的なサーベイランス、ブレオマイシン、カルボプラチン、エトポシド、またはシスプラチン):この試験の目的は、標準リスクのGCTを有する患者に対する治療の効力を維持しながら毒性を低下させることである。I期の悪性GCTを有する患者(低リスク、年齢0~50歳)は手術と観察で治療される。中リスクのGCTを有する患者は、シスプラチンまたはカルボプラチンとブレオマイシンおよびエトポシドを受ける群にランダムに割り付けられる。11歳未満の小児は各サイクルにブレオマイシンを投与され、11歳以上の小児は週1回ブレオマイシンを投与される。純型セミノーマまたは未分化胚細胞腫を有する患者はこの試験では除外される。
- AGCT1532(NCT02582697)(中リスクおよび予後不良な転移性GCTを有する患者に対する加速投与 vs 標準投与のBEP化学療法のランダム化第3相試験):ブレオマイシン、エトポシド、およびシスプラチン(BEP)の3週間ごとに4サイクルの投与は、依然として中リスクおよび予後不良な転移性GCTに対する標準の第一選択化学療法となっている。BEPは、シスプラチンとエトポシドのサイクルを3週間ごとの代わりに2週間ごとにすることで加速投与が可能である。Australian and New Zealand Urogenital and Prostate Cancer Trials Groupは、加速投与BEPと標準投与BEPを比較する試験を実施している。この研究の目的は、中リスクおよび予後不良な転移性GCTに対する第一選択化学療法として、加速投与BEPが標準投与のBEPより優れているかどうかを判定することである。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Pantoja E, Llobet R, Gonzalez-Flores B: Retroperitoneal teratoma: historical review. J Urol 115 (5): 520-3, 1976.[PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004.[PUBMED Abstract]
- Baranzelli MC, Kramar A, Bouffet E, et al.: Prognostic factors in children with localized malignant nonseminomatous germ cell tumors. J Clin Oncol 17 (4): 1212, 1999.[PUBMED Abstract]
- Frazier AL, Hale JP, Rodriguez-Galindo C, et al.: Revised risk classification for pediatric extracranial germ cell tumors based on 25 years of clinical trial data from the United Kingdom and United States. J Clin Oncol 33 (2): 195-201, 2015.[PUBMED Abstract]
- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000.[PUBMED Abstract]
- Schneider DT, Calaminus G, Reinhard H, et al.: Primary mediastinal germ cell tumors in children and adolescents: results of the German cooperative protocols MAKEI 83/86, 89, and 96. J Clin Oncol 18 (4): 832-9, 2000.[PUBMED Abstract]
- Göbel U, Schneider DT, Calaminus G, et al.: Multimodal treatment of malignant sacrococcygeal germ cell tumors: a prospective analysis of 66 patients of the German cooperative protocols MAKEI 83/86 and 89. J Clin Oncol 19 (7): 1943-50, 2001.[PUBMED Abstract]
- Rescorla F, Billmire D, Stolar C, et al.: The effect of cisplatin dose and surgical resection in children with malignant germ cell tumors at the sacrococcygeal region: a pediatric intergroup trial (POG 9049/CCG 8882). J Pediatr Surg 36 (1): 12-7, 2001.[PUBMED Abstract]
- Rogers PC, Olson TA, Cullen JW, et al.: Treatment of children and adolescents with stage II testicular and stages I and II ovarian malignant germ cell tumors: A Pediatric Intergroup Study--Pediatric Oncology Group 9048 and Children's Cancer Group 8891. J Clin Oncol 22 (17): 3563-9, 2004.[PUBMED Abstract]
- Malogolowkin MH, Krailo M, Marina N, et al.: Pilot study of cisplatin, etoposide, bleomycin, and escalating dose cyclophosphamide therapy for children with high risk germ cell tumors: a report of the children's oncology group (COG). Pediatr Blood Cancer 60 (10): 1602-5, 2013.[PUBMED Abstract]
- Altman RP, Randolph JG, Lilly JR: Sacrococcygeal teratoma: American Academy of Pediatrics Surgical Section Survey-1973. J Pediatr Surg 9 (3): 389-98, 1974.[PUBMED Abstract]
- Rescorla FJ, Sawin RS, Coran AG, et al.: Long-term outcome for infants and children with sacrococcygeal teratoma: a report from the Childrens Cancer Group. J Pediatr Surg 33 (2): 171-6, 1998.[PUBMED Abstract]
- Calaminus G, Schneider DT, Bökkerink JP, et al.: Prognostic value of tumor size, metastases, extension into bone, and increased tumor marker in children with malignant sacrococcygeal germ cell tumors: a prospective evaluation of 71 patients treated in the German cooperative protocols Maligne Keimzelltumoren (MAKEI) 83/86 and MAKEI 89. J Clin Oncol 21 (5): 781-6, 2003.[PUBMED Abstract]
- Egler RA, Gosiengfiao Y, Russell H, et al.: Is surgical resection and observation sufficient for stage I and II sacrococcygeal germ cell tumors? A case series and review. Pediatr Blood Cancer 64 (5): , 2017.[PUBMED Abstract]
- De Pasquale MD, Crocoli A, Conte M, et al.: Mediastinal Germ Cell Tumors in Pediatric Patients: A Report From the Italian Association of Pediatric Hematology and Oncology. Pediatr Blood Cancer 63 (5): 808-12, 2016.[PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Malignant retroperitoneal and abdominal germ cell tumors: an intergroup study. J Pediatr Surg 38 (3): 315-8; discussion 315-8, 2003.[PUBMED Abstract]
- Bernbeck B, Schneider DT, Bernbeck B, et al.: Germ cell tumors of the head and neck: report from the MAKEI Study Group. Pediatr Blood Cancer 52 (2): 223-6, 2009.[PUBMED Abstract]
- Marina N, London WB, Frazier AL, et al.: Prognostic factors in children with extragonadal malignant germ cell tumors: a pediatric intergroup study. J Clin Oncol 24 (16): 2544-8, 2006.[PUBMED Abstract]
- International Germ Cell Consensus Classification: a prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 15 (2): 594-603, 1997.[PUBMED Abstract]
- Nichols CR, Heerema NA, Palmer C, et al.: Klinefelter's syndrome associated with mediastinal germ cell neoplasms. J Clin Oncol 5 (8): 1290-4, 1987.[PUBMED Abstract]
- Schneider DT, Schuster AE, Fritsch MK, et al.: Genetic analysis of mediastinal nonseminomatous germ cell tumors in children and adolescents. Genes Chromosomes Cancer 34 (1): 115-25, 2002.[PUBMED Abstract]
- Billmire D, Vinocur C, Rescorla F, et al.: Malignant mediastinal germ cell tumors: an intergroup study. J Pediatr Surg 36 (1): 18-24, 2001.[PUBMED Abstract]
- Vuky J, Bains M, Bacik J, et al.: Role of postchemotherapy adjunctive surgery in the management of patients with nonseminoma arising from the mediastinum. J Clin Oncol 19 (3): 682-8, 2001.[PUBMED Abstract]
- Ganjoo KN, Rieger KM, Kesler KA, et al.: Results of modern therapy for patients with mediastinal nonseminomatous germ cell tumors. Cancer 88 (5): 1051-6, 2000.[PUBMED Abstract]
- Bokemeyer C, Nichols CR, Droz JP, et al.: Extragonadal germ cell tumors of the mediastinum and retroperitoneum: results from an international analysis. J Clin Oncol 20 (7): 1864-73, 2002.[PUBMED Abstract]
- Kang CH, Kim YT, Jheon SH, et al.: Surgical treatment of malignant mediastinal nonseminomatous germ cell tumor. Ann Thorac Surg 85 (2): 379-84, 2008.[PUBMED Abstract]
- Dexeus FH, Logothetis CJ, Chong C, et al.: Genetic abnormalities in men with germ cell tumors. J Urol 140 (1): 80-4, 1988.[PUBMED Abstract]
- Lachman MF, Kim K, Koo BC: Mediastinal teratoma associated with Klinefelter's syndrome. Arch Pathol Lab Med 110 (11): 1067-71, 1986.[PUBMED Abstract]
- Williams LA, Pankratz N, Lane J, et al.: Klinefelter syndrome in males with germ cell tumors: A report from the Children's Oncology Group. Cancer 124 (19): 3900-3908, 2018.[PUBMED Abstract]
- Göbel U, von Kries R, Teske C, et al.: Brain metastases during follow-up of children and adolescents with extracranial malignant germ cell tumors: risk adapted management decision tree analysis based on data of the MAHO/MAKEI-registry. Pediatr Blood Cancer 60 (2): 217-23, 2013.[PUBMED Abstract]
- 小児の再発悪性GCTの治療
-
頭蓋外胚細胞腫瘍(GCT)の小児および青年で再発する患者はごく少数である。[ 1 ][ 2 ]このような小児の治療および転帰に関する報告は、小規模な研究を基にしたものである。[ 3 ]
再発小児GCTに対する治療法の選択肢は、成人の臨床試験における治療法の選択肢に倣う。現在実施中の米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトから入手することができる。
小児の再発悪性GCTに対する標準治療法の選択肢
小児の再発悪性GCTに対する標準治療法の選択肢には以下のものがある:
- 手術単独。
- 術前補助または補助化学療法を併用する手術。
I期疾患を有する患者に対する観察後の救助療法に関する情報については、以下のセクションを参照のこと:
- 小児の頭蓋外GCTに対する治療法選択肢の概要セクションの手術と観察サブセクション。
- 思春期前男性の悪性精巣GCTセクションのI期サブセクション。
- 胚細胞腫以外の悪性卵巣GCTセクションの手術と観察サブセクション。
術前補助または補助化学療法を併用する手術
成人の再発GCTに使用された救助治療戦略の報告には多数の患者が含まれるが、原発GCTの位置、再燃パターン、および小児GCTの生物学に関して小児と成人では異なるために、成人の救助アプローチを小児に適用するには限界がある。再発GCTの成人において、いくつかの化学療法の併用(ほとんどで、プラチナ製剤にパクリタキセルおよびイホスファミドが追加されている)で比較的良好な無病状態が達成されている。[ 4 ][ 5 ][ 6 ][ 7 ][ 8 ][ 9 ]パクリタキセルとゲムシタビンの併用では、大量化学療法と造血幹細胞移植(HSCT)後に再燃した精巣GCTの成人において活性が実証されている。[ 10 ]
再発する良性の仙尾骨腫瘍の小児では、原発腫瘍部位に悪性腫瘍が存在している可能性がある。このような小児では、再発腫瘍および尾骨の外科的完全切除(最初に実施していない場合)が救助治療の基礎となる;外科的切除の補助としてシスプラチン、エトポシド、およびブレオマイシン(PEb)による術前化学療法を実施してもよい。PEbによる治療後に再発した悪性仙尾骨腫瘍の患者では、手術と追加の化学療法が必要となる可能性がある。[ 3 ]
小児腫瘍学グループ(COG)の第II相試験(AGCT0521[NCT00467051])では、PEb療法後に再燃した21歳未満の患者20人が、2サイクルのパクリタキセル、イホスファミド、およびカルボプラチン(TIC)による治療を受けた。その後、Response Evaluation Criteria In Solid Tumors(RECIST)基準およびマーカーの低下を併用して反応が評価された。8人の患者で部分奏効が得られ、10人の患者で病勢が安定し、2人の患者で疾患が進行した。この化学療法レジメンにより、44%の併合奏効率が得られた。[ 11 ]
小児の再発悪性GCTに対する標準以外の治療法選択肢
高用量(HD)化学療法と造血幹細胞救助
再発小児GCTに対するHD化学療法および造血幹細胞救助の役割は、逸話的報告にもかかわらず確立されていない。(移植に関する詳しい情報については、小児の造血細胞移植に関するPDQ要約の自家造血細胞移植のセクションを参照のこと。)ヨーロッパのシリーズが1件あり、性腺外GCTが再燃し、幹細胞支援によるHD化学療法を受けた小児23人中10人が長期の無病生存(追跡期間中央値66ヵ月)を達成した。[ 12 ]小児および青年を対象とした追加の研究が必要である。
再発精巣GCTの成人に対する治療として、自家幹細胞救助によるHD化学療法が検討されている。HD化学療法 + 造血幹細胞救助は、第三選択療法としてでも、またシスプラチン抵抗性の患者においてでも、再燃した精巣GCTの成人患者を治癒することが報告されている。[ 10 ][ 13 ][ 14 ][ 15 ]1件の小規模研究でもまた、卵巣GCTを有する青年および女性における効力が実証された。[ 16 ][証拠レベル:3iiiA]一部の研究がこのアプローチを支持している一方で[ 10 ][ 14 ][ 15 ][ 17 ][ 18 ]、その他の研究は支持していない。[ 19 ][ 20 ]HSCTの時点で臨床的に無病状態ではない患者の場合は、HD化学療法レジメンを用いた救助の試みは、ほとんど有益ではない可能性がある。[ 13 ][ 21 ]
小児および青年の再発悪性GCTに対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再発または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的なvariant(多様体ないしバリアント)が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
- Alliance A031102(NCT02375204)(再燃したまたは難治性GCT患者の治療における標準用量の多剤併用化学療法または大量多剤併用化学療法および幹細胞移植):この研究の目的は、再燃したGCT患者において大量化学療法がより有効であるかどうかを調査するため、従来の化学療法レジメンと大量レジメンとを比較することである。これらの治療は、化学療法の最初のレジメン後に再発したか、増殖し続けたGCTの男性患者(14歳以上)において評価されている。 従来の化学療法レジメンでは、パクリタキセル、イホスファミド、シスプラチンなどの薬物が4サイクルにわたって使用される。大量レジメンの治療では、2サイクルのパクリタキセルおよびイホスファミドとその後、3サイクルのかなり大量の薬物(カルボプラチンおよびエトポシド)と幹細胞移植が実施される。患者の幹細胞はカルボプラチン/エトポシドによる治療開始前に採取され、その後、カルボプラチン/エトポシドの各サイクル後に患者に戻される。 この研究の患者は、従来の化学療法または大量化学療法レジメンのいずれかを受けるようにランダムに割り付けられるが、両方を受けることはない。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Mann JR, Raafat F, Robinson K, et al.: The United Kingdom Children's Cancer Study Group's second germ cell tumor study: carboplatin, etoposide, and bleomycin are effective treatment for children with malignant extracranial germ cell tumors, with acceptable toxicity. J Clin Oncol 18 (22): 3809-18, 2000.[PUBMED Abstract]
- Cushing B, Giller R, Cullen JW, et al.: Randomized comparison of combination chemotherapy with etoposide, bleomycin, and either high-dose or standard-dose cisplatin in children and adolescents with high-risk malignant germ cell tumors: a pediatric intergroup study--Pediatric Oncology Group 9049 and Children's Cancer Group 8882. J Clin Oncol 22 (13): 2691-700, 2004.[PUBMED Abstract]
- Schneider DT, Wessalowski R, Calaminus G, et al.: Treatment of recurrent malignant sacrococcygeal germ cell tumors: analysis of 22 patients registered in the German protocols MAKEI 83/86, 89, and 96. J Clin Oncol 19 (7): 1951-60, 2001.[PUBMED Abstract]
- Loehrer PJ, Gonin R, Nichols CR, et al.: Vinblastine plus ifosfamide plus cisplatin as initial salvage therapy in recurrent germ cell tumor. J Clin Oncol 16 (7): 2500-4, 1998.[PUBMED Abstract]
- Motzer RJ, Sheinfeld J, Mazumdar M, et al.: Paclitaxel, ifosfamide, and cisplatin second-line therapy for patients with relapsed testicular germ cell cancer. J Clin Oncol 18 (12): 2413-8, 2000.[PUBMED Abstract]
- Hartmann JT, Einhorn L, Nichols CR, et al.: Second-line chemotherapy in patients with relapsed extragonadal nonseminomatous germ cell tumors: results of an international multicenter analysis. J Clin Oncol 19 (6): 1641-8, 2001.[PUBMED Abstract]
- Kondagunta GV, Bacik J, Sheinfeld J, et al.: Paclitaxel plus Ifosfamide followed by high-dose carboplatin plus etoposide in previously treated germ cell tumors. J Clin Oncol 25 (1): 85-90, 2007.[PUBMED Abstract]
- Schmoll HJ, Kollmannsberger C, Metzner B, et al.: Long-term results of first-line sequential high-dose etoposide, ifosfamide, and cisplatin chemotherapy plus autologous stem cell support for patients with advanced metastatic germ cell cancer: an extended phase I/II study of the German Testicular Cancer Study Group. J Clin Oncol 21 (22): 4083-91, 2003.[PUBMED Abstract]
- Kondagunta GV, Bacik J, Bajorin D, et al.: Etoposide and cisplatin chemotherapy for metastatic good-risk germ cell tumors. J Clin Oncol 23 (36): 9290-4, 2005.[PUBMED Abstract]
- Einhorn LH, Brames MJ, Juliar B, et al.: Phase II study of paclitaxel plus gemcitabine salvage chemotherapy for germ cell tumors after progression following high-dose chemotherapy with tandem transplant. J Clin Oncol 25 (5): 513-6, 2007.[PUBMED Abstract]
- Pashankar F, Frazier AL, Krailo M, et al.: Treatment of refractory germ cell tumors in children with paclitaxel, ifosfamide, and carboplatin: A report from the Children's Oncology Group AGCT0521 study. Pediatr Blood Cancer 65 (8): e27111, 2018.[PUBMED Abstract]
- De Giorgi U, Rosti G, Slavin S, et al.: Salvage high-dose chemotherapy for children with extragonadal germ-cell tumours. Br J Cancer 93 (4): 412-7, 2005.[PUBMED Abstract]
- Einhorn LH, Williams SD, Chamness A, et al.: High-dose chemotherapy and stem-cell rescue for metastatic germ-cell tumors. N Engl J Med 357 (4): 340-8, 2007.[PUBMED Abstract]
- Motzer RJ, Mazumdar M, Sheinfeld J, et al.: Sequential dose-intensive paclitaxel, ifosfamide, carboplatin, and etoposide salvage therapy for germ cell tumor patients. J Clin Oncol 18 (6): 1173-80, 2000.[PUBMED Abstract]
- Rick O, Bokemeyer C, Beyer J, et al.: Salvage treatment with paclitaxel, ifosfamide, and cisplatin plus high-dose carboplatin, etoposide, and thiotepa followed by autologous stem-cell rescue in patients with relapsed or refractory germ cell cancer. J Clin Oncol 19 (1): 81-8, 2001.[PUBMED Abstract]
- Meisel JL, Woo KM, Sudarsan N, et al.: Development of a risk stratification system to guide treatment for female germ cell tumors. Gynecol Oncol 138 (3): 566-72, 2015.[PUBMED Abstract]
- Bhatia S, Abonour R, Porcu P, et al.: High-dose chemotherapy as initial salvage chemotherapy in patients with relapsed testicular cancer. J Clin Oncol 18 (19): 3346-51, 2000.[PUBMED Abstract]
- Feldman DR, Sheinfeld J, Bajorin DF, et al.: TI-CE high-dose chemotherapy for patients with previously treated germ cell tumors: results and prognostic factor analysis. J Clin Oncol 28 (10): 1706-13, 2010.[PUBMED Abstract]
- Beyer J, Rick O, Siegert W, et al.: Salvage chemotherapy in relapsed germ cell tumors. World J Urol 19 (2): 90-3, 2001.[PUBMED Abstract]
- Beyer J, Kramar A, Mandanas R, et al.: High-dose chemotherapy as salvage treatment in germ cell tumors: a multivariate analysis of prognostic variables. J Clin Oncol 14 (10): 2638-45, 1996.[PUBMED Abstract]
- Rick O, Bokemeyer C, Weinknecht S, et al.: Residual tumor resection after high-dose chemotherapy in patients with relapsed or refractory germ cell cancer. J Clin Oncol 22 (18): 3713-9, 2004.[PUBMED Abstract]
- Göbel U, von Kries R, Teske C, et al.: Brain metastases during follow-up of children and adolescents with extracranial malignant germ cell tumors: risk adapted management decision tree analysis based on data of the MAHO/MAKEI-registry. Pediatr Blood Cancer 60 (2): 217-23, 2013.[PUBMED Abstract]
- Göbel U, Schneider DT, Teske C, et al.: Brain metastases in children and adolescents with extracranial germ cell tumor - data of the MAHO/MAKEI-registry. Klin Padiatr 222 (3): 140-4, 2010.[PUBMED Abstract]
- Feldman DR, Lorch A, Kramar A, et al.: Brain Metastases in Patients With Germ Cell Tumors: Prognostic Factors and Treatment Options--An Analysis From the Global Germ Cell Cancer Group. J Clin Oncol 34 (4): 345-51, 2016.[PUBMED Abstract]
- 本要約の変更点(05/28/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
小児頭蓋外胚細胞腫瘍(GCT)に関する一般情報
原始胚細胞からの頭蓋外胚細胞の発生を示す図1が追加された。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、小児頭蓋外胚細胞腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Julie Blatt, MD (University of North Carolina)
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- Stephen J. Shochat, MD (St. Jude Children's Research Hospital)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Childhood Extracranial Germ Cell Tumors Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/extracranial-germ-cell/hp/germ-cell-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389316]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する