ご利用について
医療専門家向けの本PDQがん情報要約では、前立腺がんのスクリーニングについて、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Screening and Prevention Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 概要
-
注:前立腺がんの予防、前立腺がんの治療、およびがんのスクリーニング(検診)と予防の研究に関する証拠レベルについては、別のPDQ要約を参照できるようにしてある。
前立腺特異抗原(PSA)または直腸指診法(DRE)を用いた前立腺がんスクリーニングに関連した有益性の不十分な証拠
前立腺特異抗原(PSA)または直腸指診法(DRE)による前立腺がんスクリーニングによって前立腺がんによる死亡が減少するかどうかを判断するには、現在ある証拠では不十分である。スクリーニング検査により前立腺がんを早期に発見することはできるが、この早期発見とその結果行われる早期治療が本疾患の自然史および転帰に変化を与えるかどうかは明らかになっていない。観察研究による証拠は、一部の国々において前立腺がんの死亡率が低いという傾向を示しているが、こうした傾向とスクリーニングの強度との関係ははっきりしておらず、またスクリーニング様式との関連に一貫性はみられない。観察された傾向は、スクリーニングによる場合もあれば、治療法の向上などの他の要因による場合もある。[ 1 ]ランダム化試験の結果には一貫性がない。
影響の大きさ:不明。
有害性
固い証拠によると、PSAおよび/またはDREによるスクリーニングでは、前立腺がんの過剰診断をもたらし、重要な臨床的問題を決して引き起こさないであろう前立腺がんも発見されてしまう。このように、スクリーニングはある程度の過剰治療につながる。固い証拠に基づくと、根治的前立腺摘除術および放射線療法を含む現在の前立腺がん治療は、結果的に多くの男性に永続的な副作用を引き起こしている。これらの副作用のうち最も一般的なものは勃起不全と尿失禁である。[ 1 ][ 2 ][ 3 ][ 4 ]スクリーニングではまた、偽陽性の判定に至り、その結果、不必要な診断検査が行われる。さらに、前立腺生検を受けても前立腺がんが同定されない男性においては、スクリーニング過程そのものが有害な心理的影響をもたらす可能性がある。[ 5 ]前立腺生検では、発熱、疼痛、血精液症/血尿、尿培養、まれに敗血症などの合併症が起こりうる。[ 6 ]
影響の大きさ:根治的前立腺摘除術または外照射療法以前に問題がなかった男性のうち20~70%が、性機能の減退および/または尿の問題をもつと予想される。[ 1 ]
参考文献- Moyer VA; U.S. Preventive Services Task Force: Screening for prostate cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 157 (2): 120-34, 2012.[PUBMED Abstract]
- Chou R, Croswell JM, Dana T, et al.: Screening for prostate cancer: a review of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 155 (11): 762-71, 2011.[PUBMED Abstract]
- Resnick MJ, Koyama T, Fan KH, et al.: Long-term functional outcomes after treatment for localized prostate cancer. N Engl J Med 368 (5): 436-45, 2013.[PUBMED Abstract]
- Johansson E, Steineck G, Holmberg L, et al.: Long-term quality-of-life outcomes after radical prostatectomy or watchful waiting: the Scandinavian Prostate Cancer Group-4 randomised trial. Lancet Oncol 12 (9): 891-9, 2011.[PUBMED Abstract]
- Fowler FJ, Barry MJ, Walker-Corkery B, et al.: The impact of a suspicious prostate biopsy on patients' psychological, socio-behavioral, and medical care outcomes. J Gen Intern Med 21 (7): 715-21, 2006.[PUBMED Abstract]
- Loeb S, Vellekoop A, Ahmed HU, et al.: Systematic review of complications of prostate biopsy. Eur Urol 64 (6): 876-92, 2013.[PUBMED Abstract]
- 証拠の記述
-
発生率および死亡率
皮膚がんを除くと、前立腺がんは北米地域の男性において最も多く診断されるがんである。米国における2020年の新規症例数は約191,930例、前立腺がんに関連する死亡者数は33,330人と推定されている。前立腺がんは現在、肺がんに続いて男性におけるがん死亡原因の第2位の位置を占めている。さらに、男性におけるがん全体の21%、男性のがん関連死亡例の10%を占めている。[ 1 ]2017年では、前立腺がんの年齢調整死亡率が10万人当たり全体で18.9人、白人男性で17.8人、アフリカ系米国人男性で36.4人であった。[ 2 ]年齢調整発生率は1975年から1992年まで着実に上昇を続けており、特に1980年代後半から1990年代初頭にかけては前立腺特異抗原(PSA)でのスクリーニングが普及した関係で発生率の劇的な上昇がみられ、その後は減少している。50歳以上の男性における2011年から2012年の早期前立腺がん発生率の低下(19%)は、2012年に発表されたすべての男性に対してルーチンのPSA検査を行うべきではないとした米国予防サービス作業部会(U.S. Preventive Services Task Force)の勧告後、Surveillance, Epidemiology, and End Results(SEER)登録において2013年(6%)まで持続した。このパターンが遠隔転移を伴った前立腺がんの診断および前立腺がん死亡率の増加につながるかどうかはまだ不明であり、長期の追跡が必要である。[ 3 ]1993年から2017年には、死亡率は52%減少しましたが、安定しているようである。[ 1 ]特定の管轄地域で死亡率が低下しているのは、PSAスクリーニングの有益性を反映すると示唆されているが[ 4 ]、これらの観察は、治療の改善などの独立した現象により説明されるとする他の報告もある。[ 5 ]前立腺がんと診断される生涯リスクは約11.6%と推定されており[ 1 ]、本疾患で死亡する生涯リスクは2.4%である。[ 2 ]
米国がん協会および米国国立がん研究所(NCI)の2010年から2016年のがん統計によれば、局所浸潤および所属リンパ節転移のみの病期(locoregional stage)で診断される割合は89%で、遠隔転移段階で診断される割合は6%であった。[ 6 ]前立腺がんの病期分布は早期発見プログラムの強度による影響を大きく受ける。
前立腺がんの生物学と自然史
前立腺がんの生物学と自然史については完全には分かっていない。前立腺がんの自然史は多様であり、適切な治療法が明確にされていないことから、いずれの前立腺がんスクリーニング法にも厳しい評価を行うのが望ましいとされている。病理解剖で検出される前立腺がんおよび前がん病変の有病率は、年齢が10歳上がるごとに着実に増大しているが、こうした病変のほとんどは、臨床的検出されずに残る。[ 7 ]白人男性とアジア系男性を対象とした病理解剖研究においても、年齢とともに潜在性前立腺がんの発見率が増加しており、80歳を超える年齢では60%近くに達した。アジア系の男性で発見されたがんの50%以上、そして白人男性で発見されたがんの25%以上がグリソンスコア7以上であり、グリソンスコアが臨床的に重要ではない前立腺がんの指標として不正確である可能性を示唆している。[ 8 ][ 9 ]
前立腺がんの原発巣の腫瘍体積と局所進展度、進行、生存率との間には関連がある。[ 10 ]根治的前立腺摘除術、膀胱切除術、剖検における多数の前立腺がん標本の検討から、被膜外浸潤、精嚢浸潤、およびリンパ節転移は通常1.4mLを超える腫瘍にのみ認められることが示された。[ 11 ]また、Gleasonが提唱した半定量的な病理組織学的悪性度の判定法は、病理医間での再現性がかなり高く、数多くの研究においてリンパ節転移の発生率および患者生存率との相関性が確認されている。[ 12 ]
病理学的病期は臨床病期を反映するとは限らず、病理学的病期の方が臨床病期より進んでいると判定されること(被膜外浸潤、切除断端陽性、精嚢浸潤、またはリンパ節転移による)も頻繁にある。PSAスクリーニング検査が普及する以前は、直腸指診(DRE)により検出された前立腺がんのうちの67~88%が臨床的には限局期(T1~2、NX、M0[T = 腫瘍の大きさ、N = リンパ節転移、M = 遠隔転移])とされた。[ 13 ][ 14 ]しかしながら、年1回のスクリーニングとしてDREを受けた患者2,002人の1件のシリーズでは、病理学的に限局期と判定された患者は全体の3分の1のみであった。[ 14 ]
危険因子
50歳未満の男性における前立腺がんの発生はまれである;発生率はこれ以降10歳年齢が上がるごとに急激に増加していく。発生率は、米国の白人男性よりもアフリカ系男性の方が高い。2012年から2016年では、全年齢調節発生率は、白人男性(10万人当たり101.9人)よりもアフリカ系米国人男性(10万人当たり176.7人)で高くなっている。[ 2 ]前立腺がんによる死亡率も、たとえ医療へのアクセスに関する要素について調整を試みた場合でも、アフリカ系米国人男性の方が高くなっている。[ 15 ]前立腺がんの家族歴のある男性では、そうでない男性と比べて本疾患のリスクが高くなっている。[ 16 ][ 17 ]年齢、人種、前立腺がんの家族歴以外の潜在的危険因子としては、飲酒、ビタミンまたはミネラルの相互作用、その他の食習慣などが挙げられる。[ 18 ][ 19 ][ 20 ][ 21 ][ 22 ]高脂肪食、特に飽和脂肪および動物性油脂が前立腺がんリスクの上昇と関連することを示唆した証拠は数多く存在する。[ 23 ][ 24 ]この他に前立腺がんリスクに影響を及ぼす可能性があるものとして、セレン、ビタミンE、ビタミンD、リコピン、イソフラボンが挙げられる。(詳しい情報については、前立腺がんの予防に関するPDQ要約を参照のこと。)1件のケースコントロール研究[ 26 ]とスクリーニングを受けた前立腺がん患者のレトロスペクティブ・レビュー[ 27 ]に加えてPhysicians' Health Studyのネステッドケースコントロール研究[ 25 ]からは、血漿インスリン様増殖因子Iの高値が前立腺がんリスクと関連している可能性が示唆されている。[ 28 ]しかしながら、すべての研究でこのような関連性が確認されているわけではない。[ 29 ]
血清PSAによるスクリーニング
PSA検査法は、初回診断ならびに初回治療後の再発モニタリングの手段として、また治療後の成績予測の方法としても、いくつかの観察研究で検討されてきた。また多数の研究で、前立腺がんを早期に発見するためのスクリーニング介入としての価値も評価されている。この検査法の潜在的価値は、その簡易性、客観性、再現性、比較的非侵襲性で比較的低価格なことにあると考えられる。PSA検査によって早期がんの発見率は増加し、そのうちの一部は局所的な治療により治癒する可能性があるものであり、他は治療の必要がないものである。[ 30 ][ 31 ][ 32 ][ 33 ]良性前立腺病変という偽陽性があまりにも多く同定される可能性があり、検査を慎重に評価する必要がある。さらに、過剰診断や過剰治療のリスクもある(すなわち、組織学的には悪性だが、無治療でも良性または緩慢な自然史を辿り、臨床的な意義をもたない腫瘍の検出)。そのため、複数のランダム化試験が実施されている。
PSAスクリーニングのランダム化試験
Prostate, Lung, Colorectal, and Ovarian (PLCO) Cancer Screening Trial
PLCO Cancer Screening Trialは、前立腺がん、肺がん、大腸がん、卵巣がんのスクリーニングが疾患特異的死亡率に与える影響を評価するようデザインされた多施設ランダム化2群試験である。1993年から2001年にかけて、76,693人の男性が米国の研究実施施設において年1回のスクリーニング群(38,343人)と通常ケアを受ける対照群(38,350人)とにランダムに割り付けられた。スクリーニング群の被験者には、年1回のPSA検査が6年間とDREが4年間実施された。その結果は被験者と医療提供者に伝えられ、その後に行うフォローアップ評価の種類をこの両者に決定させた。通常ケアとしては、一部の団体が推奨していたことから、ときにスクリーニングも実施されていた。[ 34 ]
スクリーニング群で検査へのコンプライアンスが得られた被験者の割合は、PSA検査で85%、DREで86%であった。対照群における自己報告によるスクリーニングの実施率は、PSA検査で1年目の40%から6年目の52%に上昇し、DREで41~46%の範囲であった。[ 35 ]
7年間の追跡後に生死が判明していた98%の男性被験者における10,000人年当たりの前立腺がん発生数は、スクリーニング群で116(がん発見数は2,820)、対照群で95(がん発見数は2,322)であった(発生率比、1.22;95%信頼区間[CI]、1.16-1.29)。10,000人年当たりの死亡率は、スクリーニング群で2.0(死亡者数は50)、対照群で1.7(死亡者数は44)であった(率比、1.13;95%CI、0.75-1.70)。また、67%の完全性を維持していた10年後時点のデータでも、これらの知見と全体的には一貫した結果が確認された(発生率比、1.17;95%CI、1.11-1.22および死亡率比、1.11;95%CI、0.83-1.50)。したがって、7~10年間の追跡後の時点では、前立腺がんによる死亡率は非常に低く、両群間に有意差は認められなかった。[ 35 ]
13年間の追跡後、前立腺がん死亡率のデータは引き続き、PSAおよびDREを使用した前立腺がんスクリーニングによる死亡率の低下を示さなかった。[ 34 ]試験介入群の対策型(organized)スクリーニングは、通常ケア群の任意型(opportunistic)スクリーニングと比較して死亡率低下をもたらさなかった。介入群では4,250人の男性が前立腺がんを診断され、通常ケア群では3,815人の男性が診断された。累積発生率は、介入群で10,000人年当たりの108.4で、通常ケア群では10,000人年当たりの97.1(相対リスク[RR]、1.12;95%CI、1.07-1.17)であった。前立腺がん累積死亡率は、介入群で10,000人年当たりの3.7(死亡者数は158)で、通常ケア群では10,000人年当たりの3.4(死亡者数は145)(RR、1.09;95%CI、0.87-1.36)であった。
サブグループの介入分析で仮説が立てられた年齢、ベースラインの共存症、または試験前のPSA検査との明確な関連はみられなかった。これらの結果は、上述の以前の報告における7~10年の追跡時の結果と一致していた。[ 35 ]試験の更新では、10ヵ所のスクリーニングセンターに1993年11月から2001年7月の間に登録された55~74歳の男性76,685人が計上され、毎年のPSAスクリーニングを6年間とDREを4年間実施(38,340人)または通常ケア(38,345人、ときに地域コミュニティの任意型スクリーニングが含められた)にランダムに割り付けられた。13年間にわたる追跡または2009年12月31日までの前立腺がんのすべての発生と死亡が確認された。[ 34 ]
13年間の追跡を分析したところ、PLCO試験の男性の45%がランダム化前の3年間に少なくとも1回のPSA検査を受けていたことが報告された。通常ケア群のPSAスクリーニングは、スクリーニング期間の終了までに実に52%であると推定された。通常ケア群のPSAスクリーニングの強度は、介入群の強度の半分と推定された。2群間での病期特異的治療はほぼ同じであった。[ 34 ]
死亡率について延長した追跡解析では、追跡期間中央値ほぼ15年(介入群、14.8年;通常ケア群、14.7年)で、前立腺がん死亡率は介入群で10万人年当たり47.8(255例の死亡)、通常ケア群で10万人年当たり46.0(244例の死亡)が示され、率比は1.04(95%CI、0.87-1.24)となった。この試験のスクリーニング後の段階におけるプロトコル以外のスクリーニングの解析により、通常ケア群の男性の78.7%および介入群の男性の80.3%が過去3年以内にPSA検査を受けており、通常ケア群の男性の85.9%および介入群の男性の98.9%がこれまでにPSA検査を受けたことがあると示された。[ 36 ]
本試験において死亡率の減少が認められないことの説明としては、以下のようないくつかの可能性が考えられる:[ 35 ][ 37 ]
European Randomized Study of Screening for Prostate Cancer(ERSPC)
PSA検査によるスクリーニングの前立腺がん死亡率に対する効果を評価すべく、1990年代の初頭からERSPCが開始された。本研究の被験者として欧州7ヵ国の登録から50~74歳の男性182,000人が同定された。プロトコルは各国間でかなり異なっていたが、一般的に男性は、PSAスクリーニングを平均4年に1回受ける群と、スクリーニングを受けない対照群のいずれかにランダムに割り付けられた。本研究では55~69歳の被験者をコア年齢群と設定しており、そうした被験者として162,243人が含まれていた。主要アウトカムは前立腺がんによる死亡率とされた。死亡率の追跡で両群間に差はみられず、2010年まで報告されている。[ 38 ]
本研究では、募集およびランダム化の手順や、治療の定義およびスケジュールなどのプロトコル記載内容が各国間で異なり、各国の規制および標準に従って策定されていた。フィンランド、スウェーデン、およびイタリアでは、被験男性は人口登録から選定され、書面でのインフォームドコンセントが得られる前に試験にランダムに割り付けられていた。これに対してオランダ、ベルギー、スイス、およびスペインでは、対象集団の制定は同様に人口登録から行われたものの、ランダム割り付けは試験への参加に同意が得られた者だけを対象として実施された。ランダム化の比率はフィンランド(1:1.5であった)以外のすべての国で1:1であった。検査陽性の定義および検査スケジュールも国ごとに異なる。
スクリーニング群において、スクリーニングを少なくとも1回受けた者の割合は82%であった。追跡期間中央値9年時点で、診断された前立腺がんの件数は、スクリーニング群で5,990件(累積発生率8.2%)、対照群で4,307件(累積発生率4.8%)であった。コア年齢群における前立腺がん死亡件数は、スクリーニング群で214件、対照群で326件であった(RR、0.80;95%CI、0.67-0.95)。両群の死亡率は、7~8年後から乖離がみられるようになり、その後もさらに乖離が続いた。[ 39 ]13年間の追跡で、前立腺がんは、介入群で775,527人年の追跡中に7,408例、対照群で980,474人年の追跡中に6,107例(RR、1.57;95%CI、1.51-1.62)発生した。また、前立腺がんによる死亡は、介入群で825,018人年の追跡で355例、対照群で1,011,192人年の追跡で545例(RR、0.79;95%CI、0.69-0.91)発生した。その結果、前立腺がんによる1人の死亡を回避するためにスクリーニングへの案内が必要となる男性の数は781人で、生検が必要な男性の数は48人であった。[ 38 ]16年の追跡期間で、前立腺がん死亡率比は0.80(95%CI、0.72-0.89)であり、前立腺がん発生率比は1.41(95%CI、1.36-1.45)であった。したがって、前立腺がんによる1人の死亡を回避するために予防の案内が必要となる男性の数は570人で、診断される必要があるのは18人であった。[ 40 ]
以上より、PSA値に基づくスクリーニングは前立腺がん死亡率を約20%減少させると報告されたが、過剰診断となるリスクも高かった。[ 38 ]
図1は、現在データが利用可能なERSPCにおける各研究施設について最長13年にわたり追跡したPSAに基づくスクリーニングに伴う前立腺がん死亡リスクを対照と比較して示している。[ 38 ][ 39 ]本研究に含まれている7ヵ国のうち、前立腺がんスクリーニングに伴う死亡率の有益性を報告したのは2ヵ国(オランダとスウェーデン)のみであり、これらの2つの施設で観察された違いを説明できそうな因子(例、使用したPSAの閾値または検査間隔、患者の平均年齢)を明らかにするのは容易でない。
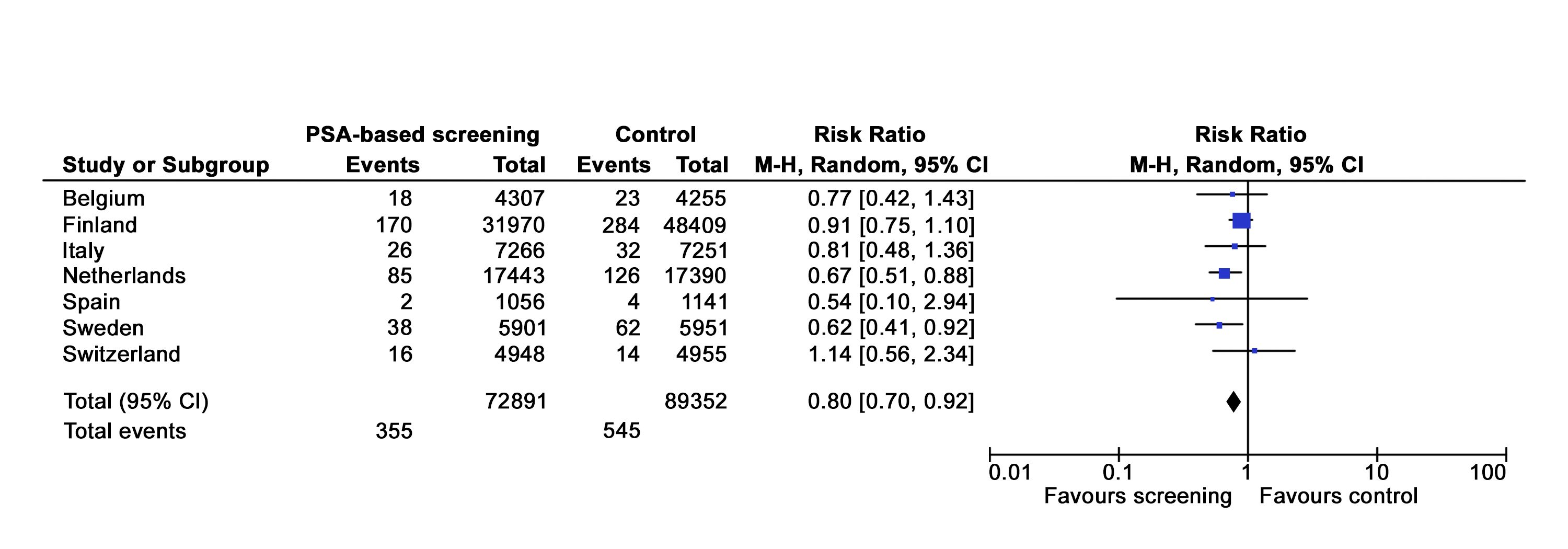
図1.前立腺がん死亡に対するスクリーニングの効果。European Randomized Study of Screening for Prostate Cancer(ERSPC)のスクリーニング群 vs 対照群において最長13年にわたる追跡で研究施設ごとの前立腺がん死亡リスク。 報告されなかった重要な情報として、対照群全体における混入率が挙げられる。さらに、前立腺がん患者に対して施行された治療は病期別およびランダムに割り付けられた群別に異なっており、スクリーニング群(40.3%)の方が対照群(30.3%)よりも根治的前立腺摘除術を多く受けていたというある程度の証拠があった。このような治療の違いは、試験群間にみられるある程度の死亡率の差に関与している可能性がある。この問題に取り組むために、各治療について各試験群で個別に解析が実施され、治療割付および前立腺がんによる死亡リスクにロジスティック回帰モデルが適合していたことから、前立腺がんによる死亡の推定に組み込まれた。スクリーニング群のモデルを対照群に適用した場合およびその逆の場合の前立腺がんによる死亡の差は非常に小さかったことから、治療の違いでは主な試験結果のごくわずかな部分しか説明できないと著者らは結論した。[ 41 ]
しかしながら、この解析では以下の懸念がある:
- 試験実施国のうち4つの国からのデータのみが用いられた。
- 臨床M病期および臨床N病期には、相当な量の欠測データがあった。
- 両比較でスクリーニング群からの前立腺がん死亡リスクモデルが使用されたため、スクリーニング群で治療の質がより良好な可能性があることによって引き起こされる生存バイアスのある程度の増加は考慮されなかった。
- 本解析にはすべての前立腺がん症例が含まれ、結果がすべての症例にわたり平均化された。
これらの症例の大多数は、過剰診断症例を含む早期の病期で、それに対する治療に違いがあれば、わずかな差を生じる可能性があるが、それから生じる前立腺がん死亡の割合は限られている。したがって、治療の違いによる進行例への影響および死亡があったとしても、このアプローチを使用することによって薄められる可能性がある。
可能性のある有害性には過剰診断が含まれ、フィンランドのセンターでは、前立腺がんの累積リスクが対照群と同じであった場合のスクリーニング群における過剰症例数を基に、30%が過剰診断と推定された。[ 42 ]
イェーテボリ(スウェーデン)試験
1994年12月に、1930年から1944年に誕生し、イェーテボリに住む男性20,000人(50~64歳)が対照群またはスクリーニング群のいずれかに1:1の割付比でランダムに割り付けられ、2年にわたりPSA検査が提供された。生検を要するPSA閾値は2.5ng/mLであった。スクリーニング群の男性の77%がスクリーニングを少なくとも1回受けた。追跡期間18年で、スクリーニング群の男性1,396人および対照群の男性962人が前立腺がんと診断されている(ハザード比、1.51;95%CI、1.39–1.64)。前立腺がん死亡率が0.52%(95%CI、0.17%–0.87%)で、RRが0.65(95%CI、0.49–0.87)という絶対的減少が認められた。[ 43 ]
この試験での懸念は情報の二重報告であり、この試験の参加者の一部は、ERSPC試験に含まれているが、各試験で個別に結果が報告されている。最初の発表によると、この試験は1996年にERSPC試験に組み込まれるようになり、1930年から1939年に誕生した男性の結果は以前のERSPC報告で公表されたことが示された。[ 44 ]その後の発表によると、1996年以降、イェーテボリ試験はERSPCのスウェーデン群を構成しているとされている[ 43 ];しかしながら、ERSPCの発表にはスウェーデンから約12,000人の参加者、つまりイェーテボリ試験集団の約60%が含まれていた。[ 40 ]
他のERSPC施設と異なり、イェーテボリの施設からのすべての参加者がERSPC研究に含まれたわけではなかった。ERSPC試験はメタアナリシスとして扱うべきであると主張している者もいる。[ 45 ]
前立腺がんに対するPSA検査のクラスターランダム化試験(CAP)
三番目に規模の大きいPSAスクリーニングのランダム化試験は、英国で実施されたCAP試験である。[ 46 ]この試験は、単回のPSA検査に勧誘し、PSA値が3ng/mL以上の男性にはその後に標準の前立腺生検を実施するプライマリケアベースのクラスターランダム化試験であった。この試験は前立腺がん死亡率に対する介入の効果を明らかにするようにデザインされていた。主要エンドポイントは、追跡期間中央値10年時の明確な、推定される、または介入に関連した前立腺がん死亡率であった。参加者は登録時に50~69歳で2001年から2009年に登録され、2016年3月31日に英国内のデータベース連携を介した受動的フォローアップが完了した。ランダム化はコンピュータ化された乱数発生装置を用いて地域グループおよび隣接した10~12の開業医のブロック内で層別化された。PSA検査が陽性で、臨床的限局性の前立腺がんを診断された男性は、治療のためにProstate Testing for Cancer and Treatment(ProtecT)研究に募集された。他のがんはすべてNational Health Serviceの標準の管理を受けた。試験デザインでは、PSA検査の受診率を35~50%と想定し、十分なイベントを提供して有意水準0.05で80%の検出力を保持して前立腺がん死亡率のRR、0.87を検出できるようにするために、各群には209,000人の男性が必要とされた。
英国の911のプライマリケア開業施設が99の地域内で次のようにランダムに割り付けられた:466施設が介入群に割り付けられ、445施設が対照群に割り付けられた。両方の施設および潜在的な参加者においてさまざまな除外が行われた後に、介入群の271施設で189,386人の男性および対照群の302施設で219,439人の男性のデータを用いて解析が実施された。介入群では、75,707人(40%)の男性がPSA検査クリニックに来院し、67,313人(36%)の男性でPSA用の血液サンプルが採取された。これらの男性のうち、11%でPSA値が(ProtecT試験に適格とされる)3ng/mL~19.9ng/mLとなった;このうち、85%の男性が前立腺生検を受けた。対照群における累積混入率は10年間で10~15%と推定された。
追跡期間中央値10年後、前立腺がん死亡率における有意差は認められなかった。前立腺がん死亡率は、介入群で1,000人年当たり0.30(死亡者数549人)で、対照群では1,000人年当たり0.31(死亡者数647人)(率差、1,000人年当たり-0.013[95%CI、-0.047~0.022];RR、0.96[95%CI、0.85-1.08])であった。2回目の解析で全原因死亡率に対する効果は示されなかった(RR、0.99;95%CI、0.94-1.03)が、前立腺がん発生率は介入群(1,000人年当たり4.45)の方が対照群(1,000人年当たり3.80)と比較して高かった。進行性前立腺がん(グリソンスコア8~10またはT4、N1、あるいはM1)の減少は認められなかった。がん発見の増加は、グリソンスコアが低いか、病期が低いがんに限定され、スクリーニング開始時にみられ、追跡期間中持続したことから、過剰診断が示唆された。
CAP試験の制限としては、以下が含まれる:[ 46 ]
- 介入が1回のPSA検査のみであった。
- ランダム化後の除外が多く、バイアスが生じた可能性がある;ただし、集団の特徴を比較したところ、バイアスの証拠はほとんど認められなかった。
- 追跡期間中央値10年時の前立腺がん死亡数は試験デザインで規定されたものより少なかった。
- スクリーニングに対するコンプライアンスが低かった。
- ProtecT試験は組込み試験であるため、集団ごとに治療に差がある可能性がある;しかしながら、治療に差が存在する場合でも、ProtecT試験の結果が否定的であったため、差は小さい可能性が高い。
ノルチェピング(スウェーデン)研究
ノルチェピング研究は、前立腺がんスクリーニングの集団ベース非ランダム化試験である。1987年にスウェーデンのノルチェピングに住む50~69歳の全男性を対象に、スクリーニング勧誘群(6人ごとに勧誘群に割り付け)または非勧誘群のいずれかに割り付けた。勧誘群男性1,494人には、1987年から1996年までの3年ごとのスクリーニングが勧められた。最初の2回は、DREによるものであった;その後の2回は、DREとPSAによるものであった。勧誘群男性の約85%が少なくとも1回のスクリーニングを受けた;非勧誘群(n = 7,532)がスクリーニングを受けることによる混入は低いと考えられた。追跡20年後、前立腺がん診断における46%の相対的増加が勧誘群に認められた。研究の全期間で、勧誘群男性30人(2%)が前立腺がんで死亡したのに対し、非勧誘群男性では130人(1.7%)が死亡した。前立腺がん死亡率のRRは、1.16(95%CI、0.78-1.73)であった。このように統計的に有意ではないという所見から、スクリーニングの実施は、追跡期間が20年後でも前立腺がん死亡率の減少につながらないという証拠が得られる。[ 47 ]
ケベック(カナダ)試験
プロスペクティブ・ランダム化ケベック研究では、ケベック市とその都市圏の選挙人名簿に記載された男性46,486人が、PSA検査とDREによるスクリーニングを勧める群とそうでない群のいずれかにランダムに割り付けられた。その結果、計31,133人がスクリーニング群に、計15,353人が観察群に割り付けられた。元々の割り付けによる各群について全例解析(intention-to-treat analysis)が実施されると、両群間に死亡率に差はみられなかった;観察群にランダムに割り付けられた15,353人のうち死亡したのが75人(0.49%)であったのに対して、スクリーニング群にランダムに割り付けられた31,133人のうち死亡したのは153人(0.49%)であった(RR、1.085)。[ 48 ]
ストックホルム(スウェーデン)試験
1988年に、ストックホルム南部における27,464人の男性集団から、55~70歳の男性2,400人がDRE、経直腸的超音波(TRUS)、およびPSA(カットオフ値 > 10 ng/mL)によるスクリーニングを受けるようにランダムに選択された。74%の男性がスクリーニング依頼を受け入れた。追跡期間20年後、前立腺がん死亡率(RR、1.05;95%CI、0.83–1.27)または全死亡率(RR、1.01;95%CI、0.95–1.06)の減少は示されなかったが、スクリーニングは1回の実施に限られていた。依頼された集団で過剰な前立腺がん発生率(RR、1.12;95%CI、0.99–1.25)が示されたことから、過剰診断が示唆される。[ 49 ]
ランダム化スクリーニング試験の事後解析
複数の観察研究から妥当な推論を導く場合に伴う問題はまた、複数のランダム化試験の事後解析にも当てはまる。例えば、ランダム化試験の結果をさまざまな方法で解析する場合には、多重性によって引き起こされる関連した問題を生じやすい。統計的結論は、試験のプロトコルまたは統計的な解析計画に従って試験の主要エンドポイントを解析する場合にのみ標準的な解釈が維持される。一部の設定では、多重性を説明するための統計的調整が可能である。しかし、多重性の問題をはるかに超えて、一部の解析は、その価値が限られているとバイアスをかける傾向が高い。
ランダム化は多くの系統的バイアスを排除、または少なくとも最低限に抑える。しかしながら、ランダム化によって解析がバイアスから守られるのは、ある介入にランダム化された集団を別の介入にランダム化された別の集団と比較して検討する場合のみである。解析に2つの集団を混合すると、ランダム化の価値が失われる。
患者は、割り付けられた介入から逸脱することがある。これはときに混入と呼ばれる。しかし、ランダム化の保護を維持するために、患者は割り付けられた集団内でカウントされる:intention-to-treatまたはintention-to-screen解析と呼ばれる。ときに用いられる代替法はas-treatedまたはas-screened解析であり、これは重大なバイアスの影響を受けやすい。このような解析では、割り付けられた群に関係なく、実際にスクリーニングを受けた参加者がスクリーニングを受けなかった参加者と比較される。これは、問題を正しく扱っているように思われるため、一部の研究者には魅力的である。さらに、両方の方向からの混入を修正しているように思われ、これにより統計的検出力が増強される;しかし、このようなアプローチには欠点がある。
as-screened解析には強力なバイアスが付随する;容易に認識できるものもあれば、そうでないものもある。対照群にランダム化されたにもかかわらず、スクリーニングを受診する選択をする参加者は、スクリーニングへの割り付けを受け入れた参加者とは異なる。例えば、このような人はおおむねより良い健康状態にあり、または以前にスクリーニングを受けている可能性があるため、がんと診断される可能性は低い。同様にスクリーニング受ける介入を避ける参加者も対照群への割り付けを受け入れた個人とは差がある。
ランダム化の維持に加えて、intention-to-screen解析は、スクリーニングプログラムの実施に関する決定または一部の集団における推奨を通知する際にも非常に関連がある。以下のセクションでは、as-screened解析の欠点の影響を受けやすい2つの解析を検討する。
ケベック研究
上に示したように、この試験のintention-to-screen解析では、2群間で前立腺がん死亡率における検出可能な差は示されなかった。しかしながら、研究者らは、as-screened解析に注目した。スクリーニングを受けた男性7,155人における前立腺がんによる死亡は4例(0.056%)であり、スクリーニングを受けなかった男性14,255人における前立腺がんによる死亡は44例(0.31%)であり、RRは5.5であった。曝露時間に基づいて、研究者らは前立腺がん死亡率における67.1%の低下がスクリーニングによるものであるとした。[ 48 ]他の研究者から指摘されているように、この結論には欠点がある。[ 50 ](上記を参照のこと)
PLCOがんスクリーニング試験とERSPCを組み合わせたモデリング
PLCOがんスクリーニング試験では、特に対照群においてERSPC試験よりも混入が大きかったことが示された。3つのモデリンググループにより、この不一致に対する説明が試みられた一方、intention-to-screen解析を用いるよりもむしろ以前に用いられなかったas-screened解析が同時に用いられた。平均リードタイム(MLT)と呼ばれる抽出された測定値を用いて、研究者らはスクリーニングによってもたらされる前立腺がん死亡率におけるかなりの(おそらく膨張した)低下を明らかにした。さらに、研究者らは、PLCOおよびERSPCにおいてMLTに従って非常に類似した低下を明らかにした。[ 51 ]手法および結論の両方が結論にバイアスをかけやすく、いくつかの科学者グループから批判されている。[ 52 ][ 53 ]この解析ではまた、上で確認されている他の潜在的な短所を無視していた(上記を参照のこと)。
前立腺がんの治療
スクリーニングの効力はスクリーニングで発見された病変の管理の有効性に左右されるため、早期病変の治療効果の研究はスクリーニングの問題に関連する。早期がんに対する治療選択肢としては、根治的前立腺摘除術、根治的放射線療法、注意深い経過観察(進行の徴候がみられるまでは直ちに治療を開始しないが、治療は根治を目的として計画されない)がある。治療はせずにサーベイランスのみ実施した限局期の前立腺がん患者の転帰については、さまざまな年代のさまざまな施設で実施された複数の症例研究から報告されている。積極的治療の成績についても報告されているが、既報の多様な研究における報告要素および選択要素の違いにより、手術、放射線療法および注意深い経過観察の効果を有効に比較することはめったにできない。
2002年に公表されたランダム化試験では、臨床病期がT1b期、T1c期またはT2期の高分化型、または中分化型の前立腺がんと新たに診断されたスカンジナビア諸国の男性において、注意深い経過観察に対する根治的前立腺摘除術の有益性を調査した。[ 54 ]この試験では、75歳未満の698人の男性が、(ほとんどが新たに診断される北米の患者とは違って)その大多数がスクリーニングによらずに臨床的にがんが発見された患者であるが、2つの治療群の試験にランダムに割り付けられた。5年間の追跡で、根治的前立腺摘除術群と注意深い経過観察群間での前立腺がん特異的死亡率における差は2%であった;10年間の追跡でその差は5.3%であった(RR、0.56;95%CI、0.36-0.88)。全原因死亡率では10年追跡してやっと明らかとなる約5%の差もあった(RR、0.74;95%CI、0.56-0.99)。したがって、1人の寿命を延ばすためには、触知可能な臨床的限局性前立腺がん患者20人について、注意深い経過観察よりむしろ根治的前立腺摘除術を受ける必要がある。今日PSAスクリーニングで発見される前立腺がんのほとんどが触知可能ではないため、この研究は米国において新たに診断された平均的な患者に直接一般化することはできない。[ 55 ]
70歳以下の限局性前立腺がん患者の全国規模のコホートを対象にしたスウェーデンの1件のレトロスペクティブ研究では、低リスク症例とされる臨床的な局所的病期がT1a期、T1b期、またはT1c期で、血清PSA値が10ng/mL未満、グリソンスコアが2~6の疾患を診断された男性2,686人における10年前立腺がん特異的死亡率は2.4%であったと報告された。[ 56 ]このサブグループの解析は、1997年1月1日から2002年12月31日の間に診断され、70歳以下、リンパ節転移または骨転移の徴候を伴わない局所的病期がT1~T2期で、血清PSA値が20ng/mL未満であった男性6,849人を対象としたコホート研究から導き出されており、この研究は75歳以下の男性における固形腫瘍の98%を把握しているSwedish Cancer Registryから抽出された。コホートの治療法選択肢は、サーベイランス(n = 2,021)または治癒目的の根治的前立腺摘除術(n = 3,399)または放射線療法(n = 1,429)で、これは主治医の裁量で決定された。サーベイランスまたは予期治療(expectancy treatment)は、増悪した場合に治癒的治療を行う積極的なサーベイランスまたは警戒しながら待機-症状の進行時には直ちにホルモン治療を実施する戦略である。ベンチマークとして全原因死亡率を用いたこの研究では、コホート全体および低リスクサブグループの3つの治療群に対する累積死亡率が算出された。サーベイランスは共存症のリスクが高い男性および低リスク腫瘍の男性でより一般的であった。6,849人のコホート全体について前立腺がんによる死亡の10年累積リスクは、サーベイランス群で3.6%および治癒目的群で2.7%であったのに対し、低リスクサーベイランス群で2.4%および低リスク治癒目的群で0.7%であった。治療割り付けに付き物のバイアスはこの解析では十分に説明できず、代替治療の相対的有効性に関する結論は下されなかった。しかしながら、サーベイランス群の低リスク前立腺がん患者における2.4%の10年前立腺がん特異的死亡率を、サーベイランス群において観察された競合する原因による19.2%の10年死亡リスクおよび計6,849人のコホートの治癒目的群における10.2%の10年死亡リスクと比較すると、サーベイランスは低リスク疾患を有する多くの患者に適切な治療であることが示唆された。[ 56 ][ 57 ]
Prostate Intervention Versus Observation Trial(PIVOT)は、PSAスクリーニング時代に根治的前立腺全摘除術と注意深い経過観察を直接比較するように実施された最初の試験であった。[ 58 ]1994年11月から2002年1月までに、限局性前立腺がんの75歳以下の男性731人が、2つの管理戦略のいずれかにランダムに割り付けられた。約半数の男性に、触知不可能でスクリーニングにより検出される病変が認められた。中央値10年の追跡後(範囲は最長で約15年)、全死亡率または前立腺がん特異的死亡率の間に統計的有意差はみられなかった。(この研究と結果についての詳しい情報については、前立腺がんの治療に関するPDQ要約の治療法選択肢の概要セクションを参照のこと。)
PSAスクリーニング時代に実施された第2の試験、ProtecT研究[ 59 ]では、限局性前立腺がん男性1,643人が積極的なモニタリング、手術、または放射線療法に均等かつランダムに割り付けられた。主要エンドポイントは前立腺がんによる死亡で、副次的アウトカムは臨床的(局所)増悪、転移、すべての原因による死亡であった。この研究における積極的なモニタリングでは、PIVOTおよびScandinavian Prostate Cancer Group Trial 4 (SPCG-4)試験とは異なり、より積極的な治療を実施する時期を決定する目的でPSA値が用いられた。ランダム化から9ヵ月以内の3群のコンプライアンス率は、モニタリング群で88%、手術群で71%、および放射線療法群で74%であった。10年以内に、積極的なモニタリング群の男性の55%が根治的前立腺全摘除術を受けた。中央値10年の追跡期間中に17人が死亡したが、前立腺がん特異的死亡率または全原因死亡率についてグループ間で有意差はみられなかった。モニタリング群では、転移(P = 0.004)および疾患増悪(P < 0.001)がより多くみられた。転移を来したのは62例、疾患増悪を来したのは204例であった。
結果から、根治的治療は死亡率には影響を及ぼさないことが示唆されているが、原因特異的死亡率の影響を明らかにするための検出力は低かった。転移または増悪の回避はより積極的な治療の理論的根拠となりうるが、別の研究[ 60 ]により、積極的なモニタリングでは積極的な治療により引き起こされる疼痛および苦痛の大部分が発生しないことが示された。
患者が報告したアウトカムについて調査したProtecTのサブスタディでは、QOLを調査するために用いられた質問票のほとんどについて、回答率が85%を超えていた。この研究では、尿、腸、および性機能のほか、治療がQOL、不安およびうつ病、全身健康状態に及ぼす特異的な影響が扱われた。無回答または抜けている回答に対処するための方法は用いられなかった。生活の質の研究では、無回答は有益な情報とされる傾向があるため、このようなことはまれである。[ 60 ]
結果から、前立腺摘除術を受けた男性は勃起不全および失禁をより多く報告したこと;放射線療法を受けた男性は腸機能不全をより多く報告したこと;および積極的なモニタリングを受けた男性はこうした有害作用の程度を最も低く報告したことが示された。一般に、データが収集された6年間で差は小さくなった。全体として、精神衛生および身体的健康は治療によって異なることはなかった。[ 60 ]
前立腺がんの早期発見のために血清PSA測定の性能を向上させる方法
早期のがん発見におけるPSA検査を向上させるさまざまな方法が開発されている(以下を参照)。PSA検査が異常となるも1年後には正常に戻る男性も数多く存在する(65~83%、方法によって異なる)。[ 61 ]これは、個々の男性におけるPSA値の相当な生物学的または他の変動性によるとみられる。複数の要因がPSA値に影響を及ぼしうる。予想される正常な生物学的変動に加えて、[ 61 ][ 62 ]フィナステリド(PSA値を約50%低下させる)など特定の薬物、およびPC-SPES(エストロゲン作用を有するとみられている植物性生薬)などの大衆薬(OTC)もPSA値に影響を及ぼす可能性がある。[ 63 ][ 64 ]射精および直腸指診もPSA値に影響を及ぼしうると示唆する諸家もいるが、これらの変数に関する検討から、これらはPSA値に臨床的に有意な影響を及ぼさないということが示されている。[ 65 ]
複合型PSAおよび遊離型PSAの割合(F/T比)
血清中のPSAには、遊離型として存在するものと、多くのプロテアーゼ阻害物質(特にα-1-アンチキモトリプシン)と複合体を形成したものがある。総PSAの測定では遊離型と複合型の両方が測定される。遊離型PSAのみの測定が可能である。複合型PSA値は総PSA値から遊離型PSA値を減算することで求められる。数件の研究において、複合型PSA値もしくは遊離型PSAの割合(F/T比)(総PSA値に対する遊離型PSA値の比)が総PSA値よりも感度および特異度で優れているかの検討が行われている。あるレトロスペクティブ研究において、前立腺がん患者75人を含む300人の男性を対象として総PSA値、F/T比、複合型PSA値に関する評価が行われている。総PSAの高値、PSA F/T比の低値、複合型PSAの高値はがんの存在と関連していた;感度が95%となるように各項目のカットオフ値を著者らが設定した場合、特異度は総PSAで21.8%、PSA F/T比で15.6%、複合型PSAで26.7%と推定された。[ 66 ]複合PSAおよび遊離PSAの割合(F/T比)の実用性に関する証拠の優位性は明らかにされていない;ただし、依然として総PSAが標準である。
総PSA値に複合型PSA値またはF/T比を組み合わせることによって総PSA値の感度が向上するかどうかを検討した報告も数多く存在する。特に、2.5~4.0ng/mLに相当する総PSA値のグレーゾーン症例について大きな関心が寄せられている。18件の研究のメタアナリシスにおいて、F/T比による診断的有益性の検討が行われた。対象とされた諸研究のカットオフ値は一様ではなかった。カットオフレベルは8~25%(遊離型/総PSA)の幅で、感度/特異度の結果はおよそ45%/95%から95%/15%であった。[ 67 ]
F/T比には腫瘍の生物活性と関係性のある可能性がある。1件の研究において、臨床的限局性がんで最終的に根治的前立腺摘除術を受けた108例を対象として、F/T比と前立腺がんの病理学的特徴の比較検討が行われた。低い遊離PSAの割合(F/T比)値は、被膜外浸潤の高いリスク、および大きい被膜の体積と関連した。[ 68 ]別の大規模シリーズでも、複数の同様の知見が報告された。[ 69 ]
第三世代PSA
第三世代(ultrasensitive)PSA検査は、前立腺がんの患者管理の支援を唯一の目的として開発された酵素免疫測定法である。診断検査またはスクリーニング検査としての本測定法の臨床的有用性は証明されていない。[ 70 ][ 71 ]
年齢調整PSA
PSA値は年齢とともに増加し、前立腺がんのない男性でも年齢を重ねるにつれてPSA値は高くなることが多くの症例研究から証明されている。ある研究では、スクリーニングに年齢調整PSA値を用いる戦略の効果が検討され、これにより早期診断によって得られる生存率を基にした優位性の95%を確保しつつ、偽陽性を27%、過剰診断を33%以上減少させうると推定された。[ 72 ]年齢で調節することにより、若年者であれば感度、高齢者であれは特異度が向上する傾向にあるが、若年者での生検施行数の増加と高齢者でのがん看過の可能性との兼ね合いから、一様な是認は得られていない。
PSA増加速度
いくつかの研究で、さまざまな検査結果が得られた場合の前立腺がんの検出に、PSA増加速度(経時的な変化)がもたらす付加価値の可能性が調査されている。Prostate Cancer Prevention Trial(PCPT)の最終的な解析では、PSA値にかかわりなく十分な確認が試みられたが、家族歴、年齢、人種/民族、PSA、および過去の前立腺生検施行の有無について調整した後のPSA増加速度に、前立腺がんの予測に対する独立した価値の上乗せは認められなかった。このため、PCPTのリスク算定では、PSA増加速度は評価項目に加えられていない。[ 73 ][ 74 ]
PSAカットオフ値の変化
スクリーニング検査における正常値の上限として4.0ng/mLよりも低い値を用いることが可能かどうかについて、多くの研究が行われてきた。ある研究では、白人14,209人とアフリカ系米国人1,004人が対象となり、PSA値の正常上限を2.5ng/mLとした前立腺がんスクリーニングが実施された。この研究では、前立腺生検を勧められた被験者のうち実際に生検を受けたのがわずか40%であったことが大きな交絡因子1つとなった。それにもかかわらず、生検を受けた全男性の27%に前立腺がんが見つかった。[ 75 ]ロッテルダム(オランダ)とフィンランドなど、ヨーロッパのいくつかの協同管轄区において、前立腺がんスクリーニングの臨床試験が実施されている。ロッテルダムでは、55~74歳の男性7,943人を対象としたスクリーニングのデータが報告されている。PSA値3.0~3.9ng/mLの男性534人のうち、446人(83.5%)が生検を受け、このうち96人(18%)が前立腺がんと診断された。全体でみれば、スクリーニングしたうちの4.7%が前立腺がんであった。[ 76 ]フィンランドでは、15,685人の男性がスクリーニングを受け、このうちPSA値が3.0ng/mL以上であった被験者は14%であった。PSAが4.0ng/mLを超える被験者全員に直腸指診、超音波検査、および生検による診断検査が勧められた;92%がこれに同意し、スクリーニングを受けた男性15,685人の2.6%が前立腺がんと診断された。スクリーニングでのPSA値が3.0~3.9ng/mLであった男性801人(すべて生検例)のうちでは、22人(3%)ががんと診断された。スクリーニングでのPSA値が4.0~9.9ng/mLであった男性1,116人では247人(22%)が、スクリーニングでのPSA値が10ng/mL以上であった226人では139人(62%)ががんと診断された。[ 77 ]このような差に寄与している因子としては、前立腺がんの背景有病率、背景的なスクリーニング水準、診断検査の詳細な内容など、いくつかのものが考えられるが、これを判断するための比較データは存在しない。
別の研究では、PSAのカットオフ値を3.0ng/mLが変更され、PSA値3.0~4.0ng/mLの男性243人を対象として、この変化による影響が検討された。被験者のうち32人(13.2%)が最終的に前立腺がんと判明した。このシリーズの根治的前立腺摘除術での切除標本の分析が行われ、その平均腫瘍体積は1.8mL(範囲、0.6~4.4)であった。腫瘍の存在範囲は多くの症例において大きく、切除断端陽性が5例、病理学的病期pT3の症例が6例あった。[ 78 ]
早期発見、発生率、および前立腺がん死亡率に関する集団ベースの観察研究
DREは何十年も前から医療行為の要という位置を維持しているが、PSA検査が前立腺がんの早期診断によく用いられるようになったのは1980年代後半からである。PSA検査が広く普及した結果、前立腺がんの発生率は急激に上昇した。メディケア加入者を対象にしたある研究では、初回のPSA検査から3ヵ月以内に前立腺がんと診断される可能性は4.7%であった。一方、その後の検査後の前立腺がん診断率は統計的に有意に低かった。[ 79 ]
前立腺がんの発見数と診断数の推移を検討したある調査研究では、NCIのSEERのデータベースを基に、1973年から1994年までに前立腺がんと診断されたアフリカ系米国人男性15,662人と白人男性140,936人の調査が行われ、PSA検査が米国中で普及した1980年代後半から大きな変化が起き始めたことが判明した;すなわち、診断時年齢の低下と診断時病期の早期化がみられ、発見される腫瘍の大半が中分化型となった。しかしながら、アフリカ系米国人男性については、低分化型腫瘍の割合が高かった。[ 80 ]
1988年頃にPSA検査によるスクリーニングが開始されて以来、前立腺がんの発生率は最初に劇的に増加した後に減少に転じたが、これはおそらく、母集団中で初めてPSA検査によるスクリーニングを受ける者の割合が最初に増加し、その後減少したためと考えられる。死亡率の低下も観察されている。ミネソタ州オルムステッド郡では、1980年から1984年には男性10万人当たり25.8人であった前立腺がんの年齢調整死亡率が、ピーク時の1989年から1992年には34人まで上昇し、その後1993年から1997年には19.4人まで低下した。[ 81 ]同様の観察が、国外でもなされており、[ 4 ][ 82 ] 死亡率の低下はPSA検査と関係するという仮説につながった。しかしながら、カナダのケベック州の出生コホートおよび居住地別集団の比較によって発生率の増大幅(1989年~1993年)と死亡率の低下幅(1995年~1999年)との関連性が検討されたが、これら2つの変数の間に相関性は認められなかった。[ 82 ]この研究では、少なくともこの期間に限った場合では、死亡率の低下とPSA検査の普及の間に因果関係はないという可能性が示唆された。
前立腺がん死亡率の変化を説明しうる要因の1つとして、死因判定の誤りについても検討がなされている。前立腺がんと診断された個人の死因が誤って前立腺がんであると判定された事例は比較的一定した割合で存在していた。したがって、1980年代後期から1990年代初頭にみられた前立腺がん診断数の大幅な増加がこの時期の前立腺がん死亡率の上昇の要因となったと考えることもできる。1990年代初頭に前立腺がんの診断率が低下した際には、前立腺がんによる死亡率が低下したのに従って、誤って前立腺がんを死因とする誤判定率も低下したものと考えられる。[ 83 ]この点に関しては一貫した証拠が得られていないため、これらの死亡率の推移が偶然、誤判定、早期発見、治療法の改善のいずれか、あるいはこれらの影響が複合的に組み合わさった結果なのかは依然として不明である。
遠隔転移を伴った前立腺がんの発生率は、1991年までは比較的横ばいに推移していたが、その後急激な下降に転じた。この下降はおそらく、PSA検査によるスクリーニングの急速な普及に伴った発見時病期の早期化が原因と考えられる。この発見時病期の早期化は集団の死亡率に急激でかなり大きな影響を与えうるが、一方でホルモン療法などの他の要因が死亡率減少の原因の大部分を占めている可能性もある。米国とヨーロッパで現在実施されているランダム化臨床試験は、PSA検査によるスクリーニングに死亡率でみた有益性があるかどうかを判定できるように設計されている。[ 84 ]
グリソンスコアは、前立腺生検標本の構造的な増殖パターンの病理学的評価に基づく尺度であり、重要な予後予測因子とされている。グリソンの悪性度分類法では、組織標本中の最も大きな前立腺がん領域2つについて、それぞれ悪性度を判定する。コア数8以上の生検を行うと、病理学的悪性度分類の精度が向上する。[ 85 ]悪性度は1~5まであり、1が最も高分化の状態で、5が最も低分化の状態である。悪性度3の腫瘍では転移はめったにみられないが、悪性度4または5の腫瘍では転移がよくみられる。グリソンスコアは2ヵ所の悪性度を合計することで算出される。スコアが2~4の場合はまれで、5~6は低悪性度、7は中悪性度、8~10は高悪性度とされる。針生検標本についての初回の解釈と再評価との全体的な一致率は60%であり、腫瘍悪性度と生検標本中の腫瘍の存在割合が大きい場合ほど正確度は向上すると報告されている。[ 86 ]
2005年現在で、発見される前立腺がんの約90%は臨床的に限局性で、腫瘍の特徴または悪性度はPSAスクリーニング時代以前よりも良好である。[ 87 ]Connecticut Tumor Registryを利用したあるレトロスペクティブな集団-コホート研究において、診断時年齢と悪性度から前立腺がんによる死亡確率を求める試みがなされた。[ 88 ]患者には経過観察か即時または遅延アンドロゲン除去療法が行われ、中央値で24年間の観察が行われた。この研究はPSA検査によるスクリーニングが普及する前に開始されたものである。腫瘍の71%は前立腺肥大症に対する経尿道的前立腺摘除術または開腹手術によって偶発的に同定されたものであった。前立腺がん死亡率は、追跡の最初の15年間は1,000人年当たり33(95%CI、28-38)、15年間の追跡後は1,000人年当たり18(95%CI、10-29)であった。低悪性度前立腺がんの患者では、20年間の追跡期間中に前立腺がんで死亡するリスクが最小であった(グリソンスコア、2~4;1,000人年当たりの死亡数、6;95%CI、2-11)。高悪性度前立腺がんの男性は診断から10年以内に前立腺がんで死亡する確率が高かった(グリソンスコア、8~10;1,000人年当たりの死亡、121;95%CI、90-156)。グリソンスコアが5または6の患者では、前立腺がんによる死亡のリスクが中等度であった。前立腺がんによる年間死亡率は、診断から15年後も安定したままのようである。[ 88 ]
直腸指診
直腸指診(DRE)は長年用いられてきた検査法であるが、この検査法についての入念な評価は行われていない。この検査は安価で、比較的侵襲性が低く、合併症の可能性も少なく、医療専門家以外でも習得することができる;しかしながら、その有効性は検査者の技術および経験に左右される。直腸指診によるルーチンのスクリーニングを年1回実施することで、前立腺がんの死亡率が減少するかどうかは、未だ明らかではない。
数件の観察研究において感度や症例-生存率データなどの項目が検討されているが、これらの研究では、適切な対照が設定されておらず、リードタイム・バイアスやレングス・バイアスへの調整が行われていない。[ 89 ][ 90 ]
1984年に、直腸指診および追跡調査を受けたというほかは選択基準を設けずに研究対象とした50~80歳の患者811人に関する研究が報告された。[ 91 ]前立腺に触知可能な異常が認められた43人の患者のうち、38人が生検の実施を承諾した。触知可能な結節の陽性適中率(PPV)、すなわち生検で前立腺がんであることが判明した症例の割合は29%(11/38)であった。精査を実施したところ、B期が45%、C期が36%、D期が18%であった。さらに、同研究者らのさらなる結果から、陽性適中率が25%であることが明らかにされ、検出された腫瘍の68%は臨床的に限局性であったが、根治的前立腺摘除術後に病理学的に限局性であったのは約30%に過ぎなかった。[ 13 ]研究者の中には、ルーチンの直腸指診において臨床的限局性前立腺がんの割合が高いと報告する者もいれば[ 92 ]、年1回の直腸指診でも診断時に限局性であったのは症例のわずか20%と報告している研究者もいる。[ 93 ]転移のある前立腺がん患者の25%が直腸指診において前立腺は正常であったと報告されている。[ 94 ]DREおよびPSAの両方によるスクリーニングを調べた別のケースコントロール研究では、統計的に有意ではない前立腺がんの死亡率の低下を明らかにした(オッズ比[OR]、0.7;95%CI、0.46-1.1)。この研究の参加男性のほとんどが、PSAよりむしろDREでふるい分けられた。[ 95 ]これら4件のケースコントロール研究はすべて、20~30%の前立腺がん死亡率の低下という点で一致していた。しかしながら、この研究デザインにはバイアスが内在する可能性があるため、この証拠だけで結論を引き出すことはできない。
PSA定量が1980年代後半に広く利用できるようになったので、スクリーニング方法としてDRE単独はあまり議論されていない。多くの研究が、PSA値が非常に低ければ、DREの前立腺がんの適中率が低いことを明らかにしている。前立腺がんスクリーニングに関するヨーロッパの研究では、PSA値が1.5ng/mLを超えるときにのみDREを用いた場合(つまり、PSA値が1.5ng/mL未満であればDREを実施しない)、生検全体の29%が回避され、前立腺がん検出感度は95%で保たれることを明らかにした。PSA値が2.0ng/mLを超える患者にのみDREを実施すれば、生検実施率は36%低下し、感度はわずか92%に低下するだけである。[ 96 ]同施設の以前の報告から、DREの検出能力は不良であることが分かる。ランダムにスクリーニングに割り付けられた男性10,523人について、PSA、DREおよびTRUSによる総前立腺がん検出率は4.5%であり、DREのみを用いた場合はわずか2.5%であったとの報告がある。PSA値が3.0ng/mL未満の男性では、DREの陽性適中率は4~11%に過ぎない。[ 97 ]DREの精度は低いが、ミネソタ州Olmsted Countyで、前立腺がんにより死亡した男性のレトロスペクティブなケースコントロール研究からは、症例は前立腺がんと診断されるまでの10年間のDRE受診率が低いことが分かっている(OR、0.51;95%CI、0.31-0.84)。これらのデータは、スクリーニングでDREを実施することにより、前立腺がんによる死亡の50~70%は予防できると示唆した。[ 98 ]こうした知見に対して、最終的に前立腺がんにより死亡した150例と、前立腺がんではない対照299例とを比較したケースコントロール研究がある。この異なる母集団において、前立腺がんと診断されるまでの10年間にDRE を受けた数は症例も対照もほぼ同じであった。[ 99 ]1件のケースコントロール研究が、DREによるルーチンのスクリーニングと転移性前立腺がんの検出率との間に、統計的に有意な関連はないと報告した。[ 100 ]PCPTでは、確認バイアスに対処するために、すべての男性に対して研究終了時点で前立腺生検を受けるよう求めた;前立腺がんに対するDREの感度は16.7%であった。この感度は、フィナステリドを投与した男性で21.3%に増加した。[ 101 ]
PCA3
PCA3遺伝子アッセイは、米国食品医薬品局により2012年初めに承認された検査で、PSAの増加に対して過去に実施した生検が陰性であり、PSAの持続的増加に対して生検の反復が考慮される男性において、生検の反復の決定を支援する用途を意図している。この検査は、注意深いDRE(前立腺に対して左右の前立腺葉にしっかり届くように触診を数回繰り返す)を実施した後に採取した尿サンプルを対象に実施される。この検査では、60の閾値を用いることで前立腺がんの検出率を高めると同時に、生検を行っても結局は陰性になると予想される男性では生検の数が減少する。[ 102 ]
スクリーニングの頻度
PSA(およびDRE)検査に最適な実施頻度と年齢範囲は分かっていない。[ 72 ][ 103 ][ 104 ]実施間隔が1~4年の範囲では、がんの発見率は同程度であると報告されている。[ 105 ]PLCOがんスクリーニング試験における年1回の定期的スクリーニングでは、ベースラインPSA値が1ng/mL未満の男性のうち、8%が2年以内に前立腺がんの診断を受けていた。[ 106 ]同じ試験でスクリーニング実施間隔を2年にした場合は、平均で5.4~6.5ヵ月の診断の遅れが生じ、4年にした場合の遅れは平均15.6ヵ月(PSAベースライン値、1ng/mL未満)~20.9ヵ月(PSAベースライン値、3~4ng/mL)であった。[ 106 ]この研究の著者らは、これらのデータから前立腺がんスクリーニングの最適な実施頻度は決定できないと注意を促す一方で、スクリーニングを受けることを選択する人々にとっては、これらのデータがPSA検査によるスクリーニングの実施スケジュールを決定する際の判断材料になりうると結論している。
ERSPC試験の報告では、スクリーニング実施間隔の短縮はがんの診断数の増加につながる一方で、侵攻性の中間期がんの発見率はスクリーニング間隔の異なる2ヵ国の地域間で非常に似通った数値であった(4年間隔のロッテルダムでの0.11に対して、2年間隔のイェーテボリでは0.12)。この報告から、ERSPC(2年および4年間隔)試験およびPLCO(任意型スクリーニングと比較して1年間隔)試験の死亡というアウトカムの方が、異なるスクリーニング間隔の有益性およびコストを評価するにはより信頼性が高いことが示唆されている。[ 107 ]
前立腺がんスクリーニングで発見される腫瘍の種類
前立腺がんスクリーニングに関する重大な問題の1つに、組織学的にみた場合のがんの有病率の高さがある。30代および40代の男性のかなりの割合(約3分の1)で組織学的には明らかな前立腺がんが存在することが実証されている。[ 7 ]これらの腫瘍の大半は高分化型で顕微鏡的な大きさのものである。逆に、臨床的に重要となりうる腫瘍はより大きく、悪性度もより高いことが示唆されている。[ 108 ]PSA検査によるスクリーニングが行われるようになって以来、以下のような変化が起きている:(1)前立腺肥大症に対する有効な治療法(α遮断薬やフィナステリドなど)の開発により経尿道的前立腺摘除術の施行数が減少した結果として、無関係な移行域の腫瘍の偶発的発見数が減少した;(2)経直腸的超音波ガイド下前立腺生検の導入により辺縁域の腫瘍の発見数が増大した。移行域の腫瘍は主として体積が小さく悪性度も低い一方、辺縁域の腫瘍は中悪性度ないし高悪性度のものが優勢なことから、現行のスクリーニングで検出される腫瘍のうちでは悪性度の高いものの占める割合がかなり高くなっている。デトロイトの研究では1989年から1996年の各腫瘍の頻度が調査され、低分化型腫瘍の頻度は変化なく、高分化型腫瘍は減少したものの、中分化型腫瘍は増加したという結果が示された。発生率の最大の上昇は、臨床的限局性疾患であった。[ 109 ]PSAスクリーニング時代(すなわち1985年以降)になって以降、米国の解剖病理医による生検標本の組織学的解釈が系統的に変化していることが知られている。[ 110 ]これは、実際には生物学的、臨床的な変化はみられないにもかかわらず時間の経過とともに集団中の高悪性度腫瘍の分布が見かけ上増加する現象であり、ときにgrade inflationとも呼ばれる。これはおそらく、病理医が腫瘍の悪性度をより侵攻性であると判定する傾向が強くなっている結果であると考えられる。[ 111 ]
ごく一部の男性では、前立腺生検において前立腺上皮内腫瘍(PIN)が検出されることもある。高悪性度のPINは、がんではないものの、前立腺がんのリスク増大を予測しうる。PSAはPINに伴い上昇するわけではないらしい。[ 112 ][ 113 ]
スクリーニングに関する医師の行動
種々の変数が、医師が前立腺がんスクリーニングを勧める可能性に影響を与える。ワシントン州では、PSA検査によるスクリーニングでの推奨事項のパターンを明らかにするため、1,369人のプライマリケア医が調査された。714人の回答者のうち、68%はルーチンにPSA検査によるスクリーニングを勧めていた。この調査集団においては性別(男性)、年齢(1974年以前に医学校卒業)、医療費償還様式(出来高払い)がPSA検査によるスクリーニングが施行される可能性を高くするという可能性が示唆された。[ 114 ]
シミュレーションモデル
前立腺がん発見における傾向を分析するため、多くのコンピュータシミュレーションモデルが開発されている。こうした傾向と1990年代初頭以降に米国で観察されている前立腺がん死亡における減少の報告を比較し、さまざまなスクリーニング戦略の費用対効果を調査し、スクリーニングの結果として起こる過剰診断の推定を試みるためのモデルも開発されている。
最初のモデルの1つでは、1992年から1994年までの前立腺がんによる死亡と比較した前立腺がんの発見における傾向に注目された。前立腺がん死亡率の変化をPSAスクリーニングだけで完全に説明することはできなかった。[ 115 ]NCIのCancer Intervention and Surveillance Modeling Network(CISNET)プログラムによるシミュレーションモデリングにより、前立腺がん治療の変化、一次治療後の疾患管理の改善、およびスクリーニングが組み合わさって、前立腺がん死亡率の低下に貢献したことが示唆された。[ 116 ]またSEER発生率データ向けに調整されたCISNETモデルも、米国のPSAスクリーニングを原因とする過剰診断の推定に用いられており、スクリーニングで発見されたすべての前立腺がんの23~42%が過剰診断されたものであると示唆されている。[ 117 ]Microsimulation Screening Analysis(MISCAN)モデルおよびERSPC試験のデータを用いた分析で、68のスクリーニング戦略において診断される前立腺がん数、回避される前立腺がん死亡数、得られる質調整生存年(QALY)、および費用対効果が予測された。[ 118 ]
基礎にある仮定およびモデルについての懸念の例が、35のスクリーニング戦略(スクリーニングの開始および中止年齢、スクリーニング間隔、生検に紹介するための閾値が異なる)の比較に基づく有効性を調査したマイクロシミュレーションモデリングによる取り組みで提供されている。[ 119 ]CISNETモデルでは、PSA値で示されるイベントのリスクとともにスクリーニングが実施されない状況での前立腺がん発生から転移、臨床診断までの前立腺がんの進行を仮定している。進行状態を通してのイベントの割合は、モデルの発生率を観察された発生率に対応させることで確認されるが、そのようにして確認された割合が固有のものであるかは不明である。生存は診断時の病期に依存しており、スクリーニングはスクリーニングを実施しない場合よりも早期の段階でがんを確認し、それにより死亡率の低下につながることが仮定されている。この病期の移行モデルでは、実質的にスクリーニングで有益性が得られることが確約されている。
一般人、患者、患者家族への情報提供
現在実施中の研究の結果が待たれる中、医師や一般男性(とその配偶者)はスクリーニング検査を推奨あるいは依頼すべきかどうかという問題に現在も直面している。男性、専門医、スクリーニングを受けた男性と受けていない男性の夫婦からなるグループにフォーカスを当てて行われた定性研究では、PSAのスクリーニングについて決心すべきかを考えている男性に役立つ可能性のある情報の種類が探索されている。[ 120 ]少なくとも、偽陽性あるいは偽陰性という可能性がありうること、定期的なスクリーニングによって前立腺がんによる死亡数を減少することができるかは不明であること、そして専門家の間でスクリーニングの推奨について見解が分かれていることは知らせておくべきである。[ 121 ][ 122 ]
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Howlader N, Noone AM, Krapcho M, et al.: SEER Cancer Statistics Review (CSR) 1975-2016. Bethesda, Md: National Cancer Institute, 2019. Available online. Last accessed February 27, 2020.[PUBMED Abstract]
- Jemal A, Ma J, Siegel R, et al.: Prostate Cancer Incidence Rates 2 Years After the US Preventive Services Task Force Recommendations Against Screening. JAMA Oncol 2 (12): 1657-1660, 2016.[PUBMED Abstract]
- Bartsch G, Horninger W, Klocker H, et al.: Prostate cancer mortality after introduction of prostate-specific antigen mass screening in the Federal State of Tyrol, Austria. Urology 58 (3): 417-24, 2001.[PUBMED Abstract]
- Etzioni R, Gulati R, Cooperberg MR, et al.: Limitations of basing screening policies on screening trials: The US Preventive Services Task Force and Prostate Cancer Screening. Med Care 51 (4): 295-300, 2013.[PUBMED Abstract]
- National Cancer Institute: SEER Stat Fact Sheets: Prostate. Bethesda, Md: National Cancer Institute. Available online. Last accessed April 22, 2020.[PUBMED Abstract]
- Sakr WA, Haas GP, Cassin BF, et al.: The frequency of carcinoma and intraepithelial neoplasia of the prostate in young male patients. J Urol 150 (2 Pt 1): 379-85, 1993.[PUBMED Abstract]
- Zlotta AR, Egawa S, Pushkar D, et al.: Prevalence of prostate cancer on autopsy: cross-sectional study on unscreened Caucasian and Asian men. J Natl Cancer Inst 105 (14): 1050-8, 2013.[PUBMED Abstract]
- Bell KJ, Del Mar C, Wright G, et al.: Prevalence of incidental prostate cancer: A systematic review of autopsy studies. Int J Cancer 137 (7): 1749-57, 2015.[PUBMED Abstract]
- Freedland SJ, Humphreys EB, Mangold LA, et al.: Risk of prostate cancer-specific mortality following biochemical recurrence after radical prostatectomy. JAMA 294 (4): 433-9, 2005.[PUBMED Abstract]
- McNeal JE, Bostwick DG, Kindrachuk RA, et al.: Patterns of progression in prostate cancer. Lancet 1 (8472): 60-3, 1986.[PUBMED Abstract]
- Resnick MI: Background for screening--epidemiology and cost effectiveness. Prog Clin Biol Res 269: 111-22, 1988.[PUBMED Abstract]
- Chodak GW, Keller P, Schoenberg HW: Assessment of screening for prostate cancer using the digital rectal examination. J Urol 141 (5): 1136-8, 1989.[PUBMED Abstract]
- Thompson IM, Ernst JJ, Gangai MP, et al.: Adenocarcinoma of the prostate: results of routine urological screening. J Urol 132 (4): 690-2, 1984.[PUBMED Abstract]
- Robbins AS, Whittemore AS, Van Den Eeden SK: Race, prostate cancer survival, and membership in a large health maintenance organization. J Natl Cancer Inst 90 (13): 986-90, 1998.[PUBMED Abstract]
- Steinberg GD, Carter BS, Beaty TH, et al.: Family history and the risk of prostate cancer. Prostate 17 (4): 337-47, 1990.[PUBMED Abstract]
- Matikainen MP, Schleutker J, Mörsky P, et al.: Detection of subclinical cancers by prostate-specific antigen screening in asymptomatic men from high-risk prostate cancer families. Clin Cancer Res 5 (6): 1275-9, 1999.[PUBMED Abstract]
- Hayes RB, Brown LM, Schoenberg JB, et al.: Alcohol use and prostate cancer risk in US blacks and whites. Am J Epidemiol 143 (7): 692-7, 1996.[PUBMED Abstract]
- Platz EA, Leitzmann MF, Rimm EB, et al.: Alcohol intake, drinking patterns, and risk of prostate cancer in a large prospective cohort study. Am J Epidemiol 159 (5): 444-53, 2004.[PUBMED Abstract]
- Eichholzer M, Stähelin HB, Gey KF, et al.: Prediction of male cancer mortality by plasma levels of interacting vitamins: 17-year follow-up of the prospective Basel study. Int J Cancer 66 (2): 145-50, 1996.[PUBMED Abstract]
- Gann PH, Hennekens CH, Sacks FM, et al.: Prospective study of plasma fatty acids and risk of prostate cancer. J Natl Cancer Inst 86 (4): 281-6, 1994.[PUBMED Abstract]
- Morton MS, Griffiths K, Blacklock N: The preventive role of diet in prostatic disease. Br J Urol 77 (4): 481-93, 1996.[PUBMED Abstract]
- Fleshner NE, Klotz LH: Diet, androgens, oxidative stress and prostate cancer susceptibility. Cancer Metastasis Rev 17 (4): 325-30, 1998-99.[PUBMED Abstract]
- Clinton SK, Giovannucci E: Diet, nutrition, and prostate cancer. Annu Rev Nutr 18: 413-40, 1998.[PUBMED Abstract]
- Chan JM, Stampfer MJ, Giovannucci E, et al.: Plasma insulin-like growth factor-I and prostate cancer risk: a prospective study. Science 279 (5350): 563-6, 1998.[PUBMED Abstract]
- Oliver SE, Barrass B, Gunnell DJ, et al.: Serum insulin-like growth factor-I is positively associated with serum prostate-specific antigen in middle-aged men without evidence of prostate cancer. Cancer Epidemiol Biomarkers Prev 13 (1): 163-5, 2004.[PUBMED Abstract]
- Turkes A, Peeling WB, Griffiths K: Serum IGF-1 determination in relation to prostate cancer screening: possible differential diagnosis in relation to PSA assays. Prostate Cancer Prostatic Dis 3 (3): 173-175, 2000.[PUBMED Abstract]
- Stattin P, Rinaldi S, Biessy C, et al.: High levels of circulating insulin-like growth factor-I increase prostate cancer risk: a prospective study in a population-based nonscreened cohort. J Clin Oncol 22 (15): 3104-12, 2004.[PUBMED Abstract]
- Chen C, Lewis SK, Voigt L, et al.: Prostate carcinoma incidence in relation to prediagnostic circulating levels of insulin-like growth factor I, insulin-like growth factor binding protein 3, and insulin. Cancer 103 (1): 76-84, 2005.[PUBMED Abstract]
- Catalona WJ, Smith DS, Ratliff TL, et al.: Detection of organ-confined prostate cancer is increased through prostate-specific antigen-based screening. JAMA 270 (8): 948-54, 1993.[PUBMED Abstract]
- Babaian RJ, Mettlin C, Kane R, et al.: The relationship of prostate-specific antigen to digital rectal examination and transrectal ultrasonography. Findings of the American Cancer Society National Prostate Cancer Detection Project. Cancer 69 (5): 1195-200, 1992.[PUBMED Abstract]
- Brawer MK, Chetner MP, Beatie J, et al.: Screening for prostatic carcinoma with prostate specific antigen. J Urol 147 (3 Pt 2): 841-5, 1992.[PUBMED Abstract]
- Mettlin C, Murphy GP, Lee F, et al.: Characteristics of prostate cancers detected in a multimodality early detection program. The Investigators of the American Cancer Society-National Prostate Cancer Detection Project. Cancer 72 (5): 1701-8, 1993.[PUBMED Abstract]
- Andriole GL, Crawford ED, Grubb RL, et al.: Prostate cancer screening in the randomized Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial: mortality results after 13 years of follow-up. J Natl Cancer Inst 104 (2): 125-32, 2012.[PUBMED Abstract]
- Andriole GL, Grubb RL, Buys SS, et al.: Mortality results from a randomized prostate-cancer screening trial. N Engl J Med 360 (13): 1310-9, 2009.[PUBMED Abstract]
- Pinsky PF, Prorok PC, Yu K, et al.: Extended mortality results for prostate cancer screening in the PLCO trial with median follow-up of 15 years. Cancer 123 (4): 592-599, 2017.[PUBMED Abstract]
- Pinsky PF, Andriole GL, Kramer BS, et al.: Prostate biopsy following a positive screen in the prostate, lung, colorectal and ovarian cancer screening trial. J Urol 173 (3): 746-50; discussion 750-1, 2005.[PUBMED Abstract]
- Schröder FH, Hugosson J, Roobol MJ, et al.: Screening and prostate cancer mortality: results of the European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13 years of follow-up. Lancet 384 (9959): 2027-35, 2014.[PUBMED Abstract]
- Schröder FH, Hugosson J, Roobol MJ, et al.: Screening and prostate-cancer mortality in a randomized European study. N Engl J Med 360 (13): 1320-8, 2009.[PUBMED Abstract]
- Hugosson J, Roobol MJ, Månsson M, et al.: A 16-yr Follow-up of the European Randomized study of Screening for Prostate Cancer. Eur Urol 76 (1): 43-51, 2019.[PUBMED Abstract]
- Carlsson SV, Månsson M, Moss S, et al.: Could Differences in Treatment Between Trial Arms Explain the Reduction in Prostate Cancer Mortality in the European Randomized Study of Screening for Prostate Cancer? Eur Urol 75 (6): 1015-1022, 2019.[PUBMED Abstract]
- Kilpeläinen TP, Tammela TL, Malila N, et al.: Prostate cancer mortality in the Finnish randomized screening trial. J Natl Cancer Inst 105 (10): 719-25, 2013.[PUBMED Abstract]
- Hugosson J, Godtman RA, Carlsson SV, et al.: Eighteen-year follow-up of the Göteborg Randomized Population-based Prostate Cancer Screening Trial: effect of sociodemographic variables on participation, prostate cancer incidence and mortality. Scand J Urol 52 (1): 27-37, 2018.[PUBMED Abstract]
- Hugosson J, Carlsson S, Aus G, et al.: Mortality results from the Göteborg randomised population-based prostate-cancer screening trial. Lancet Oncol 11 (8): 725-32, 2010.[PUBMED Abstract]
- Auvinen A, Moss SM, Tammela TL, et al.: Absolute Effect of Prostate Cancer Screening: Balance of Benefits and Harms by Center within the European Randomized Study of Prostate Cancer Screening. Clin Cancer Res 22 (1): 243-9, 2016.[PUBMED Abstract]
- Martin RM, Donovan JL, Turner EL, et al.: Effect of a Low-Intensity PSA-Based Screening Intervention on Prostate Cancer Mortality: The CAP Randomized Clinical Trial. JAMA 319 (9): 883-895, 2018.[PUBMED Abstract]
- Sandblom G, Varenhorst E, Rosell J, et al.: Randomised prostate cancer screening trial: 20 year follow-up. BMJ 342: d1539, 2011.[PUBMED Abstract]
- Labrie F, Candas B, Cusan L, et al.: Screening decreases prostate cancer mortality: 11-year follow-up of the 1988 Quebec prospective randomized controlled trial. Prostate 59 (3): 311-8, 2004.[PUBMED Abstract]
- Lundgren PO, Kjellman A, Norming U, et al.: Long-Term Outcome of a Single Intervention Population Based Prostate Cancer Screening Study. J Urol 200 (1): 82-88, 2018.[PUBMED Abstract]
- Pinsky PF: Results of a randomized controlled trail of prostate cancer screening. Prostate 61 (4): 371, 2004.[PUBMED Abstract]
- Tsodikov A, Gulati R, Heijnsdijk EAM, et al.: Reconciling the Effects of Screening on Prostate Cancer Mortality in the ERSPC and PLCO Trials. Ann Intern Med 167 (7): 449-455, 2017.[PUBMED Abstract]
- Prorok PC, Andriole GL, Bresalier RS, et al.: Design of the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial. Control Clin Trials 21 (6 Suppl): 273S-309S, 2000.[PUBMED Abstract]
- Boniol M, Autier P, Perrin P, et al.: Variation of Prostate-specific Antigen Value in Men and Risk of High-grade Prostate Cancer: Analysis of the Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial Study. Urology 85 (5): 1117-22, 2015.[PUBMED Abstract]
- Holmberg L, Bill-Axelson A, Helgesen F, et al.: A randomized trial comparing radical prostatectomy with watchful waiting in early prostate cancer. N Engl J Med 347 (11): 781-9, 2002.[PUBMED Abstract]
- Bill-Axelson A, Holmberg L, Ruutu M, et al.: Radical prostatectomy versus watchful waiting in early prostate cancer. N Engl J Med 352 (19): 1977-84, 2005.[PUBMED Abstract]
- Stattin P, Holmberg E, Johansson JE, et al.: Outcomes in localized prostate cancer: National Prostate Cancer Register of Sweden follow-up study. J Natl Cancer Inst 102 (13): 950-8, 2010.[PUBMED Abstract]
- Bokhorst LP, Kranse R, Venderbos LD, et al.: Differences in Treatment and Outcome After Treatment with Curative Intent in the Screening and Control Arms of the ERSPC Rotterdam. Eur Urol 68 (2): 179-82, 2015.[PUBMED Abstract]
- Wilt TJ, Brawer MK, Jones KM, et al.: Radical prostatectomy versus observation for localized prostate cancer. N Engl J Med 367 (3): 203-13, 2012.[PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016.[PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016.[PUBMED Abstract]
- Eastham JA, Riedel E, Scardino PT, et al.: Variation of serum prostate-specific antigen levels: an evaluation of year-to-year fluctuations. JAMA 289 (20): 2695-700, 2003.[PUBMED Abstract]
- Carter HB, Pearson JD, Waclawiw Z, et al.: Prostate-specific antigen variability in men without prostate cancer: effect of sampling interval on prostate-specific antigen velocity. Urology 45 (4): 591-6, 1995.[PUBMED Abstract]
- Andriole GL, Guess HA, Epstein JI, et al.: Treatment with finasteride preserves usefulness of prostate-specific antigen in the detection of prostate cancer: results of a randomized, double-blind, placebo-controlled clinical trial. PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Urology 52 (2): 195-201; discussion 201-2, 1998.[PUBMED Abstract]
- DiPaola RS, Zhang H, Lambert GH, et al.: Clinical and biologic activity of an estrogenic herbal combination (PC-SPES) in prostate cancer. N Engl J Med 339 (12): 785-91, 1998.[PUBMED Abstract]
- Stenner J, Holthaus K, Mackenzie SH, et al.: The effect of ejaculation on prostate-specific antigen in a prostate cancer-screening population. Urology 51 (3): 455-9, 1998.[PUBMED Abstract]
- Brawer MK, Meyer GE, Letran JL, et al.: Measurement of complexed PSA improves specificity for early detection of prostate cancer. Urology 52 (3): 372-8, 1998.[PUBMED Abstract]
- Hoffman RM, Clanon DL, Littenberg B, et al.: Using the free-to-total prostate-specific antigen ratio to detect prostate cancer in men with nonspecific elevations of prostate-specific antigen levels. J Gen Intern Med 15 (10): 739-48, 2000.[PUBMED Abstract]
- Arcangeli CG, Humphrey PA, Smith DS, et al.: Percentage of free serum prostate-specific antigen as a predictor of pathologic features of prostate cancer in a screening population. Urology 51 (4): 558-64; discussion 564-5, 1998.[PUBMED Abstract]
- Pannek J, Rittenhouse HG, Chan DW, et al.: The use of percent free prostate specific antigen for staging clinically localized prostate cancer. J Urol 159 (4): 1238-42, 1998.[PUBMED Abstract]
- Taylor JA, Koff SG, Dauser DA, et al.: The relationship of ultrasensitive measurements of prostate-specific antigen levels to prostate cancer recurrence after radical prostatectomy. BJU Int 98 (3): 540-3, 2006.[PUBMED Abstract]
- Sakai I, Harada K, Kurahashi T, et al.: Usefulness of the nadir value of serum prostate-specific antigen measured by an ultrasensitive assay as a predictor of biochemical recurrence after radical prostatectomy for clinically localized prostate cancer. Urol Int 76 (3): 227-31, 2006.[PUBMED Abstract]
- Etzioni R, Cha R, Cowen ME: Serial prostate specific antigen screening for prostate cancer: a computer model evaluates competing strategies. J Urol 162 (3 Pt 1): 741-8, 1999.[PUBMED Abstract]
- Thompson IM, Ankerst DP, Chi C, et al.: Assessing prostate cancer risk: results from the Prostate Cancer Prevention Trial. J Natl Cancer Inst 98 (8): 529-34, 2006.[PUBMED Abstract]
- Vickers AJ, Savage C, O'Brien MF, et al.: Systematic review of pretreatment prostate-specific antigen velocity and doubling time as predictors for prostate cancer. J Clin Oncol 27 (3): 398-403, 2009.[PUBMED Abstract]
- Smith DS, Carvalhal GF, Mager DE, et al.: Use of lower prostate specific antigen cutoffs for prostate cancer screening in black and white men. J Urol 160 (5): 1734-8, 1998.[PUBMED Abstract]
- Schröder FH, Roobol-Bouts M, Vis AN, et al.: Prostate-specific antigen-based early detection of prostate cancer--validation of screening without rectal examination. Urology 57 (1): 83-90, 2001.[PUBMED Abstract]
- Määttänen L, Auvinen A, Stenman UH, et al.: Three-year results of the Finnish prostate cancer screening trial. J Natl Cancer Inst 93 (7): 552-3, 2001.[PUBMED Abstract]
- Lodding P, Aus G, Bergdahl S, et al.: Characteristics of screening detected prostate cancer in men 50 to 66 years old with 3 to 4 ng./ml. Prostate specific antigen. J Urol 159 (3): 899-903, 1998.[PUBMED Abstract]
- Legler JM, Feuer EJ, Potosky AL, et al.: The role of prostate-specific antigen (PSA) testing patterns in the recent prostate cancer incidence decline in the United States. Cancer Causes Control 9 (5): 519-27, 1998.[PUBMED Abstract]
- Farkas A, Schneider D, Perrotti M, et al.: National trends in the epidemiology of prostate cancer, 1973 to 1994: evidence for the effectiveness of prostate-specific antigen screening. Urology 52 (3): 444-8; discussion 448-9, 1998.[PUBMED Abstract]
- Roberts RO, Bergstralh EJ, Katusic SK, et al.: Decline in prostate cancer mortality from 1980 to 1997, and an update on incidence trends in Olmsted County, Minnesota. J Urol 161 (2): 529-33, 1999.[PUBMED Abstract]
- Perron L, Moore L, Bairati I, et al.: PSA screening and prostate cancer mortality. CMAJ 166 (5): 586-91, 2002.[PUBMED Abstract]
- Feuer EJ, Merrill RM, Hankey BF: Cancer surveillance series: interpreting trends in prostate cancer--part II: Cause of death misclassification and the recent rise and fall in prostate cancer mortality. J Natl Cancer Inst 91 (12): 1025-32, 1999.[PUBMED Abstract]
- Feuer EJ, Mariotto A, Merrill R: Modeling the impact of the decline in distant stage disease on prostate carcinoma mortality rates. Cancer 95 (4): 870-80, 2002.[PUBMED Abstract]
- Makhlouf AA, Krupski TL, Kunkle D, et al.: The effect of sampling more cores on the predictive accuracy of pathological grade and tumour distribution in the prostate biopsy. BJU Int 93 (3): 271-4, 2004.[PUBMED Abstract]
- Coard KC, Freeman VL: Gleason grading of prostate cancer: level of concordance between pathologists at the University Hospital of the West Indies. Am J Clin Pathol 122 (3): 373-6, 2004.[PUBMED Abstract]
- Carroll PR: Early stage prostate cancer--do we have a problem with over-detection, overtreatment or both? J Urol 173 (4): 1061-2, 2005.[PUBMED Abstract]
- Albertsen PC, Hanley JA, Fine J: 20-year outcomes following conservative management of clinically localized prostate cancer. JAMA 293 (17): 2095-101, 2005.[PUBMED Abstract]
- Gilbertsen VA: Cancer of the prostate gland. Results of early diagnosis and therapy undertaken for cure of the disease. JAMA 215 (1): 81-4, 1971.[PUBMED Abstract]
- Jenson CB, Shahon DB, Wangensteen OH: Evaluation of annual examinations in the detection of cancer. Special reference to cancer of the gastrointestinal tract, prostate, breast, and female generative tract. JAMA 174: 1783-8, 1960.[PUBMED Abstract]
- Chodak GW, Schoenberg HW: Early detection of prostate cancer by routine screening. JAMA 252 (23): 3261-4, 1984.[PUBMED Abstract]
- Donohue RE, Fauver HE, Whitesel JA, et al.: Staging prostatic cancer: a different distribution. J Urol 122 (3): 327-9, 1979.[PUBMED Abstract]
- Wajsman Z, Chu TM: Detection and diagnosis of prostatic cancer. In: Murphy GP, ed.: Prostatic cancer. Littleton, Mass: PSG Pub. Co., 1987, pp 94-99.[PUBMED Abstract]
- Thompson IM, Zeidman EJ: Presentation and clinical course of patients ultimately succumbing to carcinoma of the prostate. Scand J Urol Nephrol 25 (2): 111-4, 1991.[PUBMED Abstract]
- Weinmann S, Richert-Boe K, Glass AG, et al.: Prostate cancer screening and mortality: a case-control study (United States). Cancer Causes Control 15 (2): 133-8, 2004.[PUBMED Abstract]
- Beemsterboer PM, Kranse R, de Koning HJ, et al.: Changing role of 3 screening modalities in the European randomized study of screening for prostate cancer (Rotterdam). Int J Cancer 84 (4): 437-41, 1999.[PUBMED Abstract]
- Schröder FH, van der Maas P, Beemsterboer P, et al.: Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 90 (23): 1817-23, 1998.[PUBMED Abstract]
- Jacobsen SJ, Bergstralh EJ, Katusic SK, et al.: Screening digital rectal examination and prostate cancer mortality: a population-based case-control study. Urology 52 (2): 173-9, 1998.[PUBMED Abstract]
- Richert-Boe KE, Humphrey LL, Glass AG, et al.: Screening digital rectal examination and prostate cancer mortality: a case-control study. J Med Screen 5 (2): 99-103, 1998.[PUBMED Abstract]
- Friedman GD, Hiatt RA, Quesenberry CP, et al.: Case-control study of screening for prostatic cancer by digital rectal examinations. Lancet 337 (8756): 1526-9, 1991.[PUBMED Abstract]
- Thompson IM, Tangen CM, Goodman PJ, et al.: Finasteride improves the sensitivity of digital rectal examination for prostate cancer detection. J Urol 177 (5): 1749-52, 2007.[PUBMED Abstract]
- PROGENSA® PCA3 Assay - P100033. Silver Spring, Md: U.S. Food and Drug Administration, 2012. Available online. Last accessed April 22, 2020.[PUBMED Abstract]
- Ross KS, Carter HB, Pearson JD, et al.: Comparative efficiency of prostate-specific antigen screening strategies for prostate cancer detection. JAMA 284 (11): 1399-405, 2000.[PUBMED Abstract]
- Carter HB, Landis PK, Metter EJ, et al.: Prostate-specific antigen testing of older men. J Natl Cancer Inst 91 (20): 1733-7, 1999.[PUBMED Abstract]
- van der Cruijsen-Koeter IW, Roobol MJ, Wildhagen MF, et al.: Tumor characteristics and prognostic factors in two subsequent screening rounds with four-year interval within prostate cancer screening trial, ERSPC Rotterdam. Urology 68 (3): 615-20, 2006.[PUBMED Abstract]
- Crawford ED, Pinsky PF, Chia D, et al.: Prostate specific antigen changes as related to the initial prostate specific antigen: data from the prostate, lung, colorectal and ovarian cancer screening trial. J Urol 175 (4): 1286-90; discussion 1290, 2006.[PUBMED Abstract]
- Roobol MJ, Grenabo A, Schröder FH, et al.: Interval cancers in prostate cancer screening: comparing 2- and 4-year screening intervals in the European Randomized Study of Screening for Prostate Cancer, Gothenburg and Rotterdam. J Natl Cancer Inst 99 (17): 1296-303, 2007.[PUBMED Abstract]
- Stamey TA, McNeal JE, Yemoto CM, et al.: Biological determinants of cancer progression in men with prostate cancer. JAMA 281 (15): 1395-400, 1999.[PUBMED Abstract]
- Schwartz KL, Grignon DJ, Sakr WA, et al.: Prostate cancer histologic trends in the metropolitan Detroit area, 1982 to 1996. Urology 53 (4): 769-74, 1999.[PUBMED Abstract]
- Albertsen PC, Hanley JA, Barrows GH, et al.: Prostate cancer and the Will Rogers phenomenon. J Natl Cancer Inst 97 (17): 1248-53, 2005.[PUBMED Abstract]
- Thompson IM, Canby-Hagino E, Lucia MS: Stage migration and grade inflation in prostate cancer: Will Rogers meets Garrison Keillor. J Natl Cancer Inst 97 (17): 1236-7, 2005.[PUBMED Abstract]
- Lefkowitz GK, Sidhu GS, Torre P, et al.: Is repeat prostate biopsy for high-grade prostatic intraepithelial neoplasia necessary after routine 12-core sampling? Urology 58 (6): 999-1003, 2001.[PUBMED Abstract]
- O'Shaughnessy JA, Kelloff GJ, Gordon GB, et al.: Treatment and prevention of intraepithelial neoplasia: an important target for accelerated new agent development. Clin Cancer Res 8 (2): 314-46, 2002.[PUBMED Abstract]
- Edlefsen KL, Mandelson MT, McIntosh MW, et al.: Prostate-specific antigen for prostate cancer screening. Do physician characteristics affect its use? Am J Prev Med 17 (1): 87-90, 1999.[PUBMED Abstract]
- Etzioni R, Legler JM, Feuer EJ, et al.: Cancer surveillance series: interpreting trends in prostate cancer--part III: Quantifying the link between population prostate-specific antigen testing and recent declines in prostate cancer mortality. J Natl Cancer Inst 91 (12): 1033-9, 1999.[PUBMED Abstract]
- Etzioni R, Gulati R, Tsodikov A, et al.: The prostate cancer conundrum revisited: treatment changes and prostate cancer mortality declines. Cancer 118 (23): 5955-63, 2012.[PUBMED Abstract]
- Draisma G, Etzioni R, Tsodikov A, et al.: Lead time and overdiagnosis in prostate-specific antigen screening: importance of methods and context. J Natl Cancer Inst 101 (6): 374-83, 2009.[PUBMED Abstract]
- Heijnsdijk EA, de Carvalho TM, Auvinen A, et al.: Cost-effectiveness of prostate cancer screening: a simulation study based on ERSPC data. J Natl Cancer Inst 107 (1): 366, 2015.[PUBMED Abstract]
- Gulati R, Gore JL, Etzioni R: Comparative effectiveness of alternative prostate-specific antigen--based prostate cancer screening strategies: model estimates of potential benefits and harms. Ann Intern Med 158 (3): 145-53, 2013.[PUBMED Abstract]
- Chan EC, Sulmasy DP: What should men know about prostate-specific antigen screening before giving informed consent? Am J Med 105 (4): 266-74, 1998.[PUBMED Abstract]
- O'Connor AM, Stacey D, Rovner D, et al.: Decision aids for people facing health treatment or screening decisions. Cochrane Database Syst Rev (3): CD001431, 2001.[PUBMED Abstract]
- Volk RJ, Hawley ST, Kneuper S, et al.: Trials of decision aids for prostate cancer screening: a systematic review. Am J Prev Med 33 (5): 428-434, 2007.[PUBMED Abstract]
- スクリーニングの有害性
-
スクリーニングは緩慢な、予想外の、そして無症状の前立腺がんの発見を増加させる。症状のない男性にスクリーニングを実施して得られる何らかの潜在的有益性については、スクリーニングや診断手技、前立腺がんの治療によってもたらされる有害性との比較検討を行う必要がある。これらの有害性は、スクリーニングの結果が偽陽性の男性および過剰診断のために不必要に治療される男性にとって、特に負担が大きくなる。
スクリーニングおよび生検の意図しない結果は、スクリーニング受診集団は重大な疾患を発症するリスクが高いという間違った前提による。Selenium and Vitamin E Cancer Prevention Trial(SELECT)およびProstate Cancer Prevention Trialのコホートにおいて特定の因子に関連した前立腺がんリスクの大きさを調査した研究において、著者らは、スクリーニングおよび生検を受ける可能性は特定の既知のまたは疑われる危険因子に依存することを実証した。言い換えれば、鑑別的なスクリーニングおよび生検は前立腺がんに対する危険因子について偽りの結論を招く可能性がある。[ 1 ]例えば、著者らの説明によると、青色の目といった任意の特徴を危険因子として分類した場合、青色の目をした男性における生検率が増加し、緩慢な前立腺がんが発見され、青色の目は前立腺がんに対する危険因子であるという不正確な結論に達することになる。
スクリーニングでの発見がリスクの測定に及ぼすマイナスの影響としては以下のものがある:
スクリーニングを受ける男性におけるリスクの測定は、スクリーニングを受けない男性におけるリスクの測定と異なる。過去および現在のスクリーニングおよび生検の実践は前立腺がんの危険因子を誤って伝えている可能性がある。不必要な生検を回避するために、重要な前立腺がんを同定するためのより良い方法が必要である。[ 1 ]
スウェーデンおよび米国における3件のコホート研究では、データベースに接続し、新たな前立腺がんの診断と、心血管イベント/死亡または自殺との関連性が検討された。あるスウェーデンの研究によると、前立腺がんと診断された男性では、診断から最初の1年間における心血管疾患(CVD)による死亡リスクが、前立腺がんと診断されなかった男性と比較して高いことが認められた(相対リスク[RR]、1.9;95%信頼区間[CI]、1.9-2.0;年齢、暦時間、および診断からの時間で調整)。CVDによる死亡リスクは、診断から最初の1週間で最も高く(RR、11.2;95%CI、10.4-12.1)、さらに若い男性(54歳未満)の方が高かった。これらのリスクは、診断時期が最近の男性では低かった。同様に、診断から最初の1年間で自殺を犯すリスクは、前立腺がんと診断されている男性で高かった(RR、2.6;95%CI、2.1-3.0;年齢、歴時間、婚姻状況、教育レベル、および精神科入院歴で調整)。ここでも、このリスクは、診断から最初の1週間で最も高かった(RR、8.4;95%CI、1.9-22.7)。[ 2 ]スウェーデンの2番目の研究で、これらの知見はおおむね確認された。[ 3 ]
米国のコホート研究では、前立腺がんと診断された患者を対象に、前立腺がん診断とCVDによる死亡率または自殺率との関連性を検討し、異なった3つの期間(前立腺特異抗原[PSA]普及以前、PSA普及前後、PSA普及以降)について集団レベルで予測される率と比較した。CVDによる死亡率について、前立腺がんと診断された男性の標準化死亡比(SMR)は、全期間とも診断から最初の1ヵ月間で高かった(全SMR、2.05;95%CI、1.89-2.22)が、最初の1年間の2ヵ月目以降では低下した(各PSA普及期間で1.0未満に低下)。年齢、人種、または腫瘍悪性度によって、この関連性に有意な変化は認められなかった。未婚男性、教育レベルが低い地域または貧困率が高い地域に住む男性、および診断時に転移病変を認める男性でSMRが高かった。同様に、診断から最初の3ヵ月間では、前立腺がんの男性で自殺のSMRが高かった(SMR、1.9;95%CI、1.4-2.6)。4~12ヵ月では、自殺のSMRは低下したが、依然として1.0を超えていた。しかしながら、自殺のSMRは、PSA普及以前およびPSA普及前後の期間のみ1.0より高く、PSA普及以降の期間では1.0以下であった。未婚男性でSMRが高いが、教育または貧困による違いはなかった。[ 4 ]
これらのデータは、スクリーニングに起因する前立腺がんの過剰診断が、CVDによる死亡または自殺のリスク増加につながるのではないかという懸念に信憑性を与えている。
直腸指診(DRE)または経直腸的超音波検査については重篤な合併症を示唆した文献は存在せず、PSA検査での静脈穿刺に付随する有害性は取るに足らないものと考えられるが、前立腺生検は重大な合併症に関連している。一時的な発熱、疼痛、血精液症、および血尿が一般的にみられるほか、尿培養が陽性となることも多い。[ 5 ][ 6 ][ 7 ]敗血症は男性の約0.4%に発生する。[ 6 ][ 8 ]
根治的前立腺摘除術の長期的合併症としては、尿失禁、尿道狭窄、勃起不全、ならびに全身麻酔および大手術に起因する合併症が挙げられる。大便失禁も起こりうる。関連死亡率は0.1~1%と報告されており、年齢によって異なる。集団ベース研究であるProstate Cancer Outcomes Studyでは、根治的前立腺摘除術後18ヵ月または24ヵ月の時点で被験者1,291人の8.4%で失禁が、59.9%で性交不能が認められた。また、性的能力に中等度から重度の問題があると報告した被験者が40%以上に上っていた。性機能と排尿機能はどちらも年齢によって異なり、若年の被験者ほど障害が少なかった。[ 8 ][ 9 ]
根治的外照射療法は急性膀胱炎、直腸炎、ときに腸炎の原因となることがある。こうした合併症は一般に可逆的であるが、慢性化することもある。放射線照射後の勃起能については、短期的にみればほとんどの症例で温存されるが、時間とともに減退する可能性もある。放射線療法の合併症に関する文献の系統的レビューから、治療前に勃起不全を認めなかった患者の20~40%が治療後12~24ヵ月に勃起不全を発症していたことが示されている。さらに、治療前に尿失禁を認めなかった男性の2~16%が、治療から12~24ヵ月後に機能障害を起こし、治療から1年後では男性の約18%に何らかの腸機能障害が認められた。近接照射療法については、その影響の大きさまでは確定されていないものの、合併症のスペクトラムは同様である。[ 10 ]前立腺に対する放射線療法は、特に顕著なものとして直腸および膀胱の二次悪性腫瘍のリスクを高めることが報告されている。大規模なSurveillance, Epidemiology and End Results(SEER)をベースとした研究では相対リスクが1.26(95%CI、1.21-1.30)であったが、絶対的なリスク増加は低かった。上記と同一の系統的レビューにおいて、黄体形成ホルモン放出ホルモン(LHRH)アゴニストを用いたホルモン療法は性機能を40~70%低下させ、5~25%の患者で乳房の腫脹がみられることが示されている。また、LHRHアゴニストの投与を受ける男性患者の50~60%でほてりがみられる。[ 8 ](詳しい情報については、前立腺がんの治療に関するPDQ要約を参照のこと。)
スクリーニングを受けた前立腺がん生存者にみられる症状が、前立腺がん治療によるものかどうかという問題は、Prostate, Lung, Colorectal and Ovarian(PLCO)Cancer Screening Trialからの解析の中で検討されている。ランダム化比較PLCO解析では、前立腺がんに特有な総体的症状に関して、診断後5~10年の前立腺がん生存者529人と非がん対照514人が比較された。前立腺がん生存者では、性機能および排尿機能が非がん対照と比べて劣っていたことから、これらの症状は前立腺がん治療に関連したもので、加齢または共存症とは無関係であることが示唆される。[ 11 ]
スクリーニングの導入は前立腺がん発生率の上昇をもたらした。最近の早期前立腺がん治療の傾向では、大半の症例が腫瘍の根絶を目的とした根治的な手術または放射線療法によって治療されている。しかし、スクリーニングの結果として前立腺がんと診断された患者では、必ずしも治癒的治療が直ちに必要となるとは限らないというエビデンスが存在する。スクリーニングで限局期の高分化悪性腫瘍が発見された場合、そうした腫瘍がその患者の生存に影響を及ぼす前に他の原因によって死亡する例も多い。そこで過剰治療とその結果として起こる望ましくない事象を回避するため、このような場合に病態の進行を示す客観的な医学的証拠を認めるまで治癒的治療の開始を遅らせるという、積極的サーベイランス(AS)と呼ばれる新たな戦略が適用可能である。[ 12 ]
European Randomized Study of Screening for Prostate Cancer(ERSPC)試験において、ASの有効性がレトロスペクティブに研究された。1994年から2007年までの間にオランダ、スウェーデン、フィンランドの計4ヵ所の参加施設において定期的なスクリーニングの結果として前立腺がんと診断された577人の男性(平均年齢66.3歳)を対象として、データの評価が行われた。この解析における組み入れ基準は以下の通りである:
診断時点でリンパ節または遠隔転移が陽性であった患者は解析から除外された。以上は、ERSPCから派生したASに関する前向き研究であるProstate Cancer Research International: Active Surveillance Study(未発表)とカナダにおけるASに関するプロトコルベースのプロスペクティブ研究(これも未発表)で採用された基準と同じものである。
この後向き評価における577人の対象者の平均追跡期間は4.35年(0~11.63年)であった。算出された10年後の前立腺がん特異的生存率は100%であった。全体での10年生存率は77%であった。また10年後の延期無治療生存率は43%であった。
治療を受けた対象者の割合は、7.75年後の時点で50%に達した。無治療生存期間の中央値は2.5年であった。追跡期間中に治療を受けた男性は、依然として未治療の男性より診断時年齢がわずかに若かった(64.7歳 vs 67.0歳;P < 0.001)。PSA値およびPSA倍加時間ともに良好であったにもかかわらず積極的治療に移行した110例をみると、DREが実施された53例のうち9例においてその結果が治療判断に影響を及ぼしたのに対し、再生検が実施された27例では、その結果が治療判断に影響した例は1例もなかった。PSA検査の性質を考えれば、無治療のままであった対象者の1.9%は積極的治療の良い候補であった可能性がある一方、積極的治療を受けた対象者の55.8%は根治的治療の明らかな候補ではなく、DREでも再生検でもこの矛盾した判断を説明することができなかった。不安や泌尿器系愁訴などの因子を考慮することでより説明が付く可能性もあるが、これを裏付けるデータは得られていない。
著者らは、これらのデータから、スクリーニングで発見される前立腺がんの多くが積極的な観察(ASなど)を行って治癒的治療の実施を遅らせることが可能で、これにより生存の可能性を低下させることなく根治的治療による望ましくない結果の延期ないし回避が可能となる、という先行研究の知見が確認されたと結論付けている。一方でこの著者らはさらに、見たところ心理的な理由によりASのレジメンを遵守できない患者の割合がかなり高くなるため、ASの実施は根治的治療の延期にはつながっても回避にはつながらない場合が多いという点にも言及している。
Prostate Testing for Cancer and Treatment (ProtecT)研究では、限局性前立腺がん男性1,643人が積極的なモニタリング、手術、または放射線療法に均等かつランダムに割り付けられた。主要エンドポイントは前立腺がんによる死亡で、副次的アウトカムは臨床的(局所)増悪、転移、すべての原因による死亡であった。[ 13 ]
患者が報告したアウトカムについて調査したProtecTのサブスタディでは、QOLを調査するために用いられた質問票のほとんどについて、回答率が85%を超えていた。この研究では、尿、腸、および性機能のほか、治療がQOL、不安およびうつ病、全身健康状態に及ぼす特異的な影響が扱われた。無回答または抜けている回答に対処するための方法は用いられなかった。生活の質の研究では、無回答は有益な情報とされる傾向があるため、このようなことはまれである。[ 14 ]
結果から、前立腺摘除術を受けた男性は勃起不全および失禁をより多く報告したこと;放射線を受けた男性は腸機能不全をより多く報告したこと;および積極的なモニタリングを受けた男性はこうした有害作用の程度を最も低く報告したことが示された。一般に、データが収集された6年間で差は小さくなった。全体として、精神衛生および身体的健康は治療によって異なることはなかった。[ 14 ]
スクリーニングの方法が何であれ、前立腺生検を受けても前立腺がんが認められない男性にとっては、スクリーニングの過程そのものが心理的負担となる可能性がある。スクリーニングを受けた男性のがんに対する不安について調べたある研究では、生検を受けて陰性となった男性では、PSA検査で正常とされた男性と比較して、12ヵ月後の時点で前立腺がんに対する不安を訴えた者の割合が大幅に高かった(26% vs 6%;P < 0.001)。[ 15 ]さらに同一の研究において、生検を受けた男性ではPSA値正常の男性と比較して、PSA検査によるフォローアップを最初の1年間に少なくとも1回受ける(73%対42%;P < 0.001)、もう1回生検を受ける(15%対1%;P < 0.001)、ならびに泌尿器科医を受診する(71%対13%;P < 0.001)可能性が高かった。
参考文献- Tangen CM, Goodman PJ, Till C, et al.: Biases in Recommendations for and Acceptance of Prostate Biopsy Significantly Affect Assessment of Prostate Cancer Risk Factors: Results From Two Large Randomized Clinical Trials. J Clin Oncol 34 (36): 4338-4344, 2016.[PUBMED Abstract]
- Fall K, Fang F, Mucci LA, et al.: Immediate risk for cardiovascular events and suicide following a prostate cancer diagnosis: prospective cohort study. PLoS Med 6 (12): e1000197, 2009.[PUBMED Abstract]
- Carlsson S, Sandin F, Fall K, et al.: Risk of suicide in men with low-risk prostate cancer. Eur J Cancer 49 (7): 1588-99, 2013.[PUBMED Abstract]
- Fang F, Keating NL, Mucci LA, et al.: Immediate risk of suicide and cardiovascular death after a prostate cancer diagnosis: cohort study in the United States. J Natl Cancer Inst 102 (5): 307-14, 2010.[PUBMED Abstract]
- Aus G, Ahlgren G, Bergdahl S, et al.: Infection after transrectal core biopsies of the prostate--risk factors and antibiotic prophylaxis. Br J Urol 77 (6): 851-5, 1996.[PUBMED Abstract]
- Rietbergen JB, Kruger AE, Kranse R, et al.: Complications of transrectal ultrasound-guided systematic sextant biopsies of the prostate: evaluation of complication rates and risk factors within a population-based screening program. Urology 49 (6): 875-80, 1997.[PUBMED Abstract]
- Sharpe JR, Sadlowski RW, Finney RP, et al.: Urinary tract infection after transrectal needle biopsy of the prostate. J Urol 127 (2): 255-6, 1982.[PUBMED Abstract]
- Walter LC, Fung KZ, Kirby KA, et al.: Five-year downstream outcomes following prostate-specific antigen screening in older men. JAMA Intern Med 173 (10): 866-73, 2013.[PUBMED Abstract]
- Stanford JL, Feng Z, Hamilton AS, et al.: Urinary and sexual function after radical prostatectomy for clinically localized prostate cancer: the Prostate Cancer Outcomes Study. JAMA 283 (3): 354-60, 2000.[PUBMED Abstract]
- Screening for Prostate Cancer. Rockville, Md: U.S. Preventive Services Task Force, 2011. Available online. Last accessed April 22, 2020.[PUBMED Abstract]
- Taylor KL, Luta G, Miller AB, et al.: Long-term disease-specific functioning among prostate cancer survivors and noncancer controls in the prostate, lung, colorectal, and ovarian cancer screening trial. J Clin Oncol 30 (22): 2768-75, 2012.[PUBMED Abstract]
- Mahal BA, Butler S, Franco I, et al.: Use of Active Surveillance or Watchful Waiting for Low-Risk Prostate Cancer and Management Trends Across Risk Groups in the United States, 2010-2015. JAMA 321 (7): 704-706, 2019.[PUBMED Abstract]
- Hamdy FC, Donovan JL, Lane JA, et al.: 10-Year Outcomes after Monitoring, Surgery, or Radiotherapy for Localized Prostate Cancer. N Engl J Med 375 (15): 1415-1424, 2016.[PUBMED Abstract]
- Donovan JL, Hamdy FC, Lane JA, et al.: Patient-Reported Outcomes after Monitoring, Surgery, or Radiotherapy for Prostate Cancer. N Engl J Med 375 (15): 1425-1437, 2016.[PUBMED Abstract]
- Fowler FJ, Barry MJ, Walker-Corkery B, et al.: The impact of a suspicious prostate biopsy on patients' psychological, socio-behavioral, and medical care outcomes. J Gen Intern Med 21 (7): 715-21, 2006.[PUBMED Abstract]
- 本要約の変更点(04/22/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
証拠の記述
本文で以下の記述が改訂された;2017年では、前立腺がんの年齢調整死亡率が10万人当たり全体で18.9人、白人男性で17.8人、アフリカ系米国人男性で36.4人であった(引用、参考文献2としてHowlader et al.)。また本文に以下の記述が改訂された;前立腺がんと診断される生涯リスクは約11.6%と推定されており、本疾患で死亡する生涯リスクは2.4%である。
本文で以下の記述が改訂された;米国がん協会および米国国立がん研究所(NCI)の2010年から2016年のがん統計によれば、局所浸潤および所属リンパ節転移のみの病期(locoregional stage)で診断される割合は89%で、遠隔転移段階で診断される割合は6%であった(引用、参考文献6として National Cancer Institute)。
本文で以下の記述が改訂された;2012年から2016年では、全年齢調節発生率は、白人男性(10万人当たり101.9人)よりもアフリカ系米国人男性(10万人当たり176.7人)で高くなっている。
本要約はPDQ Screening and Prevention Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、前立腺がんのスクリーニングについて、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Screening and Prevention Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Screening and Prevention Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Screening and Prevention Editorial Board.PDQ Prostate Cancer Screening.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/prostate/hp/prostate-screening-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389383]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
これらの要約内の情報は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する