ご利用について
医療専門家向けの本PDQがん情報要約では、がん遺伝学について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Cancer Genetics Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 序
-
[注: 本要約で用いられている医学および科学用語については、NCI Dictionary of Genetics Termsに解説が用意されている。リンクが張られた用語をクリックすれば、別のウインドウにその定義が表示される。]
[注: 現在、遺伝学的多様性を記載するための用語体系を変化させるべく、遺伝学のコミュニティにおいて協調的な取り組みが進められている。その変化とは、研究対象の個人または集団と参照配列との間に存在する遺伝学的な差異を記載する際に、特に生殖細胞系に存在する違いについて、従来の「mutation(突然変異ないし変異)」ではなく、「variant(多様体ないしバリアント)」という用語を使用するというものである。多様体はさらに、良性(無害)(benign [harmless])、おそらく良性(likely benign)、意義不明(of uncertain significance)、おそらく病原性(likely pathogenic)、病原性(疾患を引き起こす)(pathogenic [disease causing])のいずれかに分類することができる。本要約では、全体を通じて、疾患を引き起こす突然変異に対して病原性多様体(pathogenic variant)という用語を使用する。詳しい情報については、表1、病原性についての多様体分類を参照のこと。]
がんの病因は複数の因子で構成されるものであり、遺伝要因、環境要因、医学的要因、生活様式の因子などが相互に関与し合いながら悪性腫瘍が発生する。がん遺伝学の知識は、がんの生物学的理解の急速な前進、ハイリスク者同定手法の改善、がんの特徴に関する診断能の向上、病変の分子指紋に合わせたテイラーメード治療の確立、新たな治療法の開発などに貢献している。その結果、拡大を続けるこの知識基盤は、予防、スクリーニング、治療を含むがん管理のあらゆる面で重要性をもつようになった。
遺伝学的情報はがんのハイリスク者の同定を可能にする。遺伝学的情報の入手源としては、DNAの生体試料、疾患に関する家族歴から得られる情報、身体診察所見、医療記録などが挙げられる。DNAに基づく情報は、受胎前から死亡後に至るまでの個人の生涯のあらゆる時点において収集、保管、分析が可能である。家族歴は、それにより低水準から中等度のがんリスクを有する個人が同定されることもあれば、がんの生涯リスクを大幅に高める遺伝的がん素因同定の第一歩となることもある。 DNA検査により、特定の病原性多様体の遺伝リスクの原因としての同定や家系員が疾患に関連する多様体を受け継いでいるかどうかの決定が、ますます多くの疾患で可能になってきている。
病原性多様体を有する人にその疾患が発症する割合を浸透度と呼ぶ。通常、がん感受性に関連する遺伝子多様体で高頻度のものは、まれな遺伝子多様体より浸透度が低い。図1は、このことを示している。成人発症型疾患では、浸透度は通常、個々のキャリアの年齢および性別に依存する。例えば、女性のBRCA1/BRCA2病原性多様体キャリアにおける乳がんの浸透度は、50歳までおよび70歳までの値が引用されることが多い。浸透度を推定する方法は多くあるが、バイアスの可能性のないものはなく、個々のキャリアのがんリスクの測定にはある程度の不確かさが伴う。
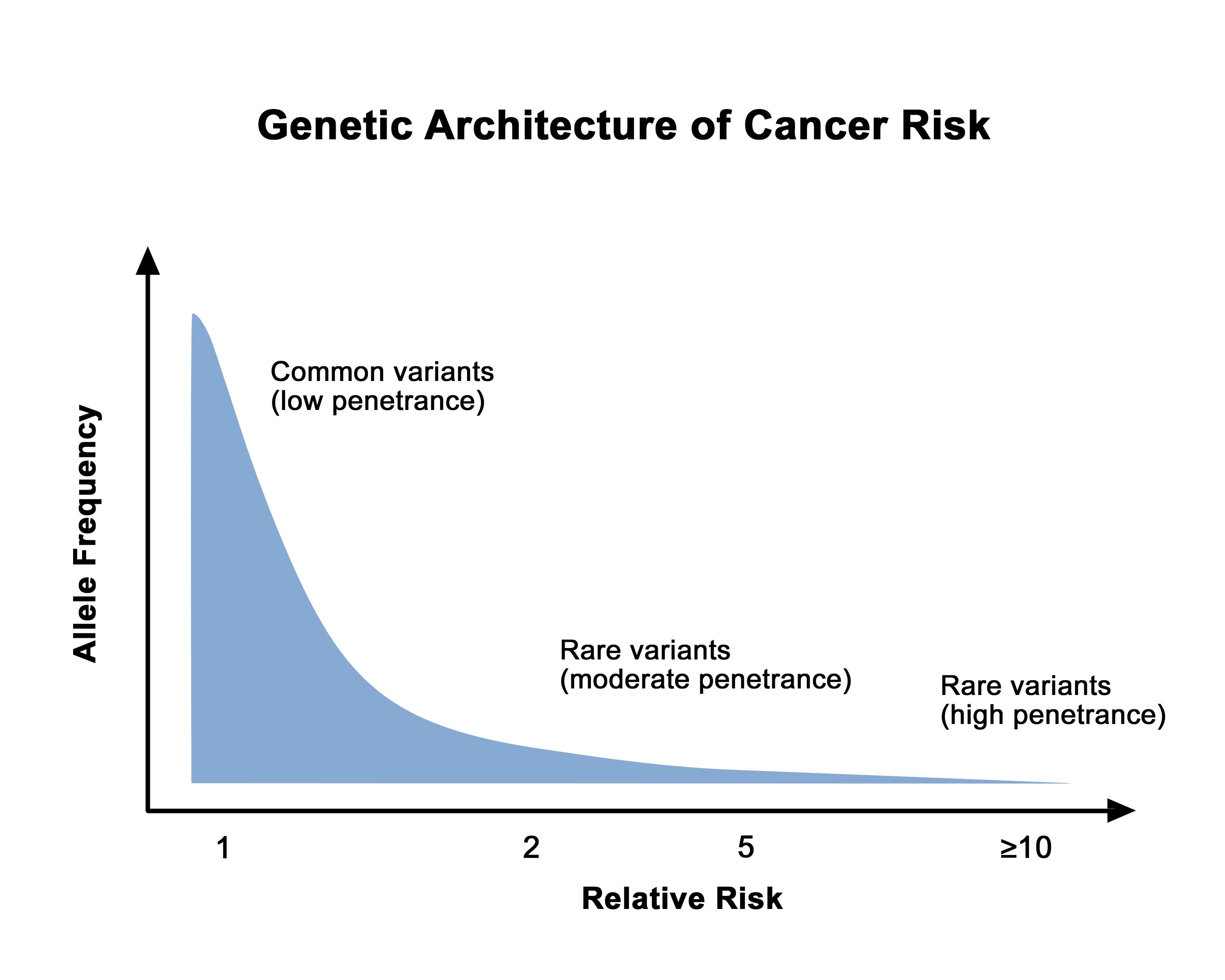
図1.がんリスクの遺伝子構成。このグラフでは、低い相対リスクはゲノムワイド関連解析で同定された一塩基多型などの高頻度で低浸透度の遺伝子多様体に関連し、高い相対リスクは遺伝性乳がんや卵巣がんに関連するBRCA1/BRCA2遺伝子の病原性多様体やリンチ症候群に関連するミスマッチ修復遺伝子などのまれな高浸透度の遺伝子多様体に関連しているという全体的な知見が示されている。 遺伝子多様体、つまり特定の遺伝子の通常のDNA配列の変化が健康に及ぼす影響としては有害、有益、中立、または不明のいずれもが存在し、多様体は常染色体優性、常染色体劣性、またはX連鎖性の形質として遺伝する。生涯の早期から深刻な障害を引き起こす病原性多様体は、平均余命や生殖に有害作用を及ぼすため、通常はまれである。しかしながら、病原性多様体が常染色体劣性(その変異遺伝子のコピーを2つ[母親と父親から1つずつ]受け継いで初めてその多様体の健康への影響が現れる)の場合は、一般集団においても病原性多様体のキャリア(変異遺伝子のコピー1つをもつ健常者)の頻度が比較的高くなるものもある。ここでいう頻度が高いとは、慣例により、保有率が1%以上であることとする。がんの素因となることが判明しているいくつかのものを含め、中高年において健康に影響を及ぼす病原性多様体にも比較的頻度の高いものがある。がんの素因となる形質の多くは、常染色体優性(受け継がれる変異遺伝子のコピーが1つのみでもがん感受性が生じる)の形式で遺伝する。常染色体優性遺伝の場合、その病原性多様体による遺伝的素因を受け継いでいる個体を意味するにあたり、やや砕けた用法で「キャリア」という用語がしばしば用いられる。(既知のがん感受性症候群に関する詳しい情報については、各種がんの遺伝学を中心に扱った各PDQ要約を参照のこと。)
がんに対する家族性および遺伝性の感受性ならびに遺伝学的なリスク評価および検査の両方に関し、一般の人々がインターネットに情報を求める傾向がますます強くなってきている。遺伝性乳がんおよび結腸がんでは、地域によっては遺伝子検査の消費者向け市場も展開されている。このように遺伝性のがんリスクに関して広く情報が普及してきたことにより、以前は家族歴の重要性を認識していなかった人々の間にも注意が喚起され、一部では対応への助言や忠告を求めてプライマリケア医を受診するに至る場合もある。この評価や助言は、多くの場合、家族性がんの基礎知識を有する医師にとっては比較的簡単なものとなる。しかし一部の患者では評価が複雑になり、さらなる評価とカウンセリングのために遺伝学の専門家への紹介が必要になることもある。
がん発症リスクの高い個人および家系を正しく発見、同定することは、プライマリケア医をはじめとする医療提供者にとって無数に存在する重要な役割のうちの1つである。いったん同定されてしまえば、その個人には遺伝カウンセリングやリスク評価、遺伝子検査の検討、管理計画の作成など、適切な紹介が可能となる。病歴および家族歴から家族性または遺伝性のがん感受性疾患(下記参照)が発見された場合は[ 1 ]、さらなる評価が必要となることがある。(がんの遺伝学的リスク評価の内容に関するより詳しい情報については、がんの遺伝学的リスク評価とカウンセリングに関するPDQ要約を参照のこと。)
遺伝性のがんの特徴としては、以下のものがある:
ある個人のがん発症リスクが高いと結論付けることは、その対応において生命を救う可能性を秘める重要な意味をもち、そのリスク軽減を目的とした特異的介入(例、乳がんに対するタモキシフェン、結腸がんに対する大腸内視鏡検査、卵巣がんに対するリスク軽減のための卵管卵巣摘出術)の実施につながることもある。家族性のがんリスクに関する情報からは、個人に将来設計(生活様式や医療に関する決定、家族計画、その他の意思決定)がどの程度可能であるかについても知ることができる。また遺伝学的情報は、遺伝性のがん感受性がないことを証明することにより、直接的な健康面への利益をもたらすこともある。例えば、ある家系が特定遺伝子にがんの素因となる多様体を保有していることが判明している場合、遺伝子検査によって1人の家系員が疾患に関連するその多様体のキャリアではないということが判明すれば、その個人の不安は軽減され、医療費を低く抑えることも可能となる。これとは逆に、家族性のがんリスクに関する情報が心理的影響や社会的コストをもたらす場合もある(例、不安、罪悪感、医療費の増大)。家族動態が障害される場合もある。例えば、遺伝子検査を有益なものとするためには1人または複数の家族成員の参加が必要となる場合があり、また、子供に遺伝性のリスクを与えてしまったことに両親が罪の意識を感じることもある。
がんの素因となる多様体に関する知識は、検査を受けた個人だけでなく、他の家系員にとっても有益な情報となりうる。それまで自身の健康に対する家族歴の意味を考えたことのなかった家族成員が、それを顧みるようになることもあり、人によっては遺伝子検査を受けて自身の遺伝学的リスクが高いか否かについて、より決定的な情報を得る場合もある。また、一部の近親者において自身で検査を受けることなしにキャリアの状況が判明する場合があり、例えば、病原性多様体のキャリアであることが判明している子供の生物学上の親が絶対キャリアと同定される場合などがそれにあたる。創始者効果により特定の民族集団においてある病原性多様体の保有率が高いという認識が生じることがあるが、これは臨床的に有用(遺伝子検査の戦略をより合理的なものにする)である一方、その集団に汚名を着せる結果にもつながりうる。検査によって父権が否定されることもある。遺伝学的情報の乱用の危険性も理論的には存在し、保険や雇用における差別の可能性に関する懸念も生じてくる。遺伝学的情報はまた、医療や生活様式に関する意思決定にも影響を及ぼす。
付属的な問題を扱った科学的証拠については、各PDQ要約を参照のこと。
参考文献- Lindor NM, McMaster ML, Lindor CJ, et al.: Concise handbook of familial cancer susceptibility syndromes - second edition. J Natl Cancer Inst Monogr (38): 1-93, 2008.[PUBMED Abstract]
- 遺伝カウンセリング
-
遺伝カウンセリングとは、遺伝学の専門家と患者の間のコミュニケーションのプロセスで、関係する遺伝学的な健康状態、実施可能な検査、および管理法の選択肢に関する情報、ならびにその情報を理解し日常生活に組み込む際の支援を、個人およびその家族に提供することを目的としたものである。遺伝カウンセリングは一般に以下の6つの段階を踏んで行われる:
- 家族歴および病歴の評価。
- 遺伝学的情報の分析。
- 遺伝学的情報に関するコミュニケーション。
- 遺伝、遺伝子検査、管理、リスク低減、資源および研究機会に関する教育。
- インフォームドチョイスおよびリスクまたは条件への適応を容易にするための支持的カウンセリング。
- フォローアップ。[ 1 ]
遺伝学的評価には、遺伝医をはじめとする遺伝学の専門家との対話も含まれ、遺伝カウンセリングに加えて身体診察や診断検査が実施される場合もある。遺伝カウンセリングの理念においては、情報を与えられた上での任意の意思決定、非指示的かつ非強制的なカウンセリング、およびクライアントの機密とプライバシーの保護が中心原則となる。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ](遺伝カウンセリングの性質や歴史に関するより詳しい情報については、がんの遺伝学的リスク評価とカウンセリングに関するPDQ要約を参照のこと。)
1990年代半ばから2000年代半ばにかけて、遺伝性のがんリスクに関連する遺伝子が数多く発見されたのに伴い遺伝カウンセリングの範囲も拡大し、がんリスクに対する遺伝子検査の検討もその範疇に含まれるようになった。がんの遺伝カウンセリングはしばしば医療従事者の集学的チームによって実施されるが、これには遺伝カウンセラー、上級実践遺伝看護師、遺伝医;精神衛生の専門家;ならびに腫瘍専門医、外科医、内科医を始めとする多くの専門医が参加する。カウンセリングには、医学的な遺伝子検査や心理社会的問題に焦点を当てるために何回もの訪問が必要となることがある。がんリスクのカウンセリングを受け始めたのは1人の個人であっても、遺伝性のがんリスクは家族全体に関わる問題である。遺伝的リスクは未知数の生物学的近親者に影響が及ぶので、正確な家族歴と病歴を収集するため、しばしばこうした近親者との接触が必須となる。がんの遺伝カウンセリングでは家族成員数人の参加が必要となる場合があり、その中にはがん患者もそうでない者も含まれる。
リスク評価や素因に関する遺伝子検査の与える影響は、健康上のアウトカムを改善する。リスク評価および/または遺伝子検査から得られた情報により、医療提供者は健康増進のアプローチを個人ごとに設計するとともに、がん発症前にハイリスク者を同定することで長期的な健康上のアウトカムを至適化することが可能になる。このようにして早期に介入を行うことにより、医療提供者はリスク軽減またはがんの早期診断が可能となり、その場合には効果的治療法に向けて最も大きな変更が可能となる。この情報は、初発がんの管理方針の修正、他のがんのリスクの明確化、特定の治療法に対する既存のがんの反応性予測などにも用いることができ、これらはすべて、推奨される治療法や長期的なフォローアップに変更を与えうる。
参考文献- Resta R, Biesecker BB, Bennett RL, et al.: A new definition of Genetic Counseling: National Society of Genetic Counselors' Task Force report. J Genet Couns 15 (2): 77-83, 2006.[PUBMED Abstract]
- Baker DL, Schuette JL, Uhlmann WR, eds.: A Guide to Genetic Counseling. New York, NY: Wiley-Liss, 1998.[PUBMED Abstract]
- Bartels DM, LeRoy BS, Caplan AL, eds.: Prescribing Our Future: Ethical Challenges in Genetic Counseling. New York, NY: Aldine de Gruyter, 1993.[PUBMED Abstract]
- Kenen RH: Genetic counseling: the development of a new interdisciplinary occupational field. Soc Sci Med 18 (7): 541-9, 1984.[PUBMED Abstract]
- Kenen RH, Smith AC: Genetic counseling for the next 25 years: models for the future. J Genet Couns 4 (2): 115-24, 1995.[PUBMED Abstract]
- 家族性がん感受性症候群
-
各種がんの遺伝学を中心に扱った各PDQ要約では、多くの既知のがん感受性症候群に関する詳細な情報が扱われている。完全な一覧ではないが、PDQがん遺伝学要約で以下のがん感受性症候群が考察されている(症候群名の後の括弧内に各論名を示した):
- 基底細胞母斑症候群、ゴーリン症候群、ゴーリン-ゴルツ症候群、または母斑性基底細胞がん症候群(皮膚がんの遺伝学)。
- バート・ホッグ・デュベ症候群(腎がん[腎細胞がん]の遺伝学)。
- ブルーム症候群(皮膚がんの遺伝学)。
- 乳がん/婦人科がん、遺伝性(乳がんおよび婦人科がんの遺伝学)。
- Brooke-Spiegler症候群(皮膚がんの遺伝学)。
- カーニー-ストラタキス症候群(内分泌および神経内分泌腫瘍の遺伝学)。
- 結腸がん、遺伝性非ポリポーシスまたはリンチ症候群(大腸がんの遺伝学)。
- コーデン症候群およびPTEN過誤腫腫瘍症候群(乳がんおよび婦人科がんの遺伝学;大腸がんの遺伝学;皮膚がんの遺伝学)。
- 先天性角化異常症(Zinsser-Cole-Engman症候群)(皮膚がんの遺伝学)。
- 疣贅状表皮発育異常症(皮膚がんの遺伝学)。
- 表皮水疱症(皮膚がんの遺伝学)。
- 家族性円柱腫症(皮膚がんの遺伝学)。
- ファンコニー貧血(皮膚がんの遺伝学;乳がんおよび婦人科がんの遺伝学)。
- びまん性胃がんおよび小葉がん(乳がんおよび婦人科がんの遺伝学)。
- 副甲状腺機能亢進症、家族性(内分泌および神経内分泌腫瘍の遺伝学)。
- リー-フラウメニ様症候群(乳がんおよび婦人科がんの遺伝学)。
- 甲状腺髄様がん、家族性(内分泌および神経内分泌腫瘍の遺伝学)。
- 黒色腫、遺伝性(皮膚がんの遺伝学)。
- ムア-トレ症候群(皮膚がんの遺伝学)。
- 多発性内分泌腺腫症 1型(内分泌および神経内分泌腫瘍の遺伝学)。
- 多発性内分泌腫瘍2A型、2B型(シップル症候群)(内分泌および神経内分泌腫瘍の遺伝学)。
- 多発性家族性毛包上皮腫(皮膚がんの遺伝学)。
- 眼皮膚白皮症(皮膚がんの遺伝学)。
- オリゴポリポーシス(大腸がんの遺伝学)。
- 傍神経節腫、遺伝性(内分泌および神経内分泌腫瘍の遺伝学)。
- 遺伝性褐色細胞腫(内分泌および神経内分泌腫瘍の遺伝学)。
- ポイツ・ジェガース症候群(大腸がんの遺伝学;乳がんおよび婦人科がんの遺伝学)。
- ポリポーシス、家族性大腸腺腫症および弱化家族性大腸腺腫症(大腸がんの遺伝学)。
- ポリポーシス、家族性若年性(大腸がんの遺伝学)。
- 遺伝性混合ポリポーシス(大腸がんの遺伝学)。
- ポリポーシス、MUTYH関連(大腸がんの遺伝学)。
- 鋸歯状ポリポーシス(大腸がんの遺伝学)。
- 前立腺がん、遺伝性(前立腺がんの遺伝学)。
- 腎細胞がん、遺伝性子宮平滑筋腫(腎がん[細胞がん]の遺伝学;皮膚がんの遺伝学)。
- 腎細胞がん、遺伝性乳頭状(腎がん[腎細胞がん]の遺伝学)。
- Rothmund-Thomson症候群(皮膚がんの遺伝学)。
- フォン・ヒッペル-リンダウ症候群(腎がん(腎細胞がん)の遺伝学)。
- ウェルナー症候群(皮膚がんの遺伝学)。
- 色素性乾皮症(皮膚がんの遺伝学)。
- 遺伝子解析および遺伝子発見の手法
-
本セクションで記述される方法は、過去10~15年間に疾患感受性遺伝子の同定のために使用されてきた遺伝子解析および発見のアプローチに関する背景を簡潔に示すことを目的とするものである。これらの方法はBRCA1および乳がんリスクなどの重要ながん遺伝子の発見につながっている。それ以後、遺伝子解析手法は本要約の臨床シークエンシングのセクションに記述しているような次世代の塩基配列決定法へと移行している。
連鎖解析
がんが家系内で多発することが認識されるようなったため、連鎖研究を通してがん感受性遺伝子の位置を特定する目的で、多くの研究者が複数症例を有する家系のデータを収集するようになった。
連鎖研究は、疾患感受性遺伝子の同定を目的として、典型的には、ある特定疾患の症例が複数認められている高リスクの家系を対象に実施される。連鎖解析では、罹患者と非罹患者の間で統計的に遺伝子型を比較し、既知の遺伝子マーカーが疾患の特徴とともに受け継がれている証拠を探す。そうした証拠(連鎖)が認められた場合には、そのマーカーの近くの染色体領域にも疾患感受性遺伝子が潜んでいるという統計学的データが得られる。焦点となっているゲノム領域が連鎖解析によって同定されると、感受性遺伝子が本当にその位置に存在することを証明するため追加の研究が必要となる。連鎖解析は以下の因子によって影響を受ける:
連鎖研究におけるさらなる問題は、家族研究における散発性がんの背景割合である。例えば、男性の前立腺がんの生涯リスクは9人中1人であり、[ 1 ]研究対象の家系が遺伝性および散発性前立腺がんの両方の症例を有することも起こりうる。したがって、その家系において分離している前立腺がん感受性遺伝子を受け継いでいない男性にも前立腺がんが発生しうる。
連鎖研究間の不一致に対処する1つの方法として、臨床的に意義のある病態を定義する選択基準が必要である。[ 2 ][ 3 ][ 4 ][ 5 ][ 6 ]このアプローチでは、連鎖シグナルを同定する確率を上げるため、一組の均一な症例/家系を定義する試みがなされる。このアプローチではまた、家系のスクリーニングによって同定された臨床的に明らかではないと考えられる症例の選択が避けられる。
ゲノムワイド関連解析(GWAS)
GWASは、がんを含む多くの複合疾患[ 7 ]に対する一般的な低浸透度の感受性アレルを同定している。このアプローチは、有病率が高い家系内で遺伝的リスクを伴う多様体を同時分離して検索する連鎖解析と対比することが可能である。連鎖解析は、予測できる遺伝パターン(例えば、常染色体優性、常染色体劣性、X連鎖性、およびミトコンドリア性)で分離されるまれで浸透度の高い多様体を発見することを目的としているが、多数の一般的な浸透度の低い遺伝的多型を特定するにはGWASが最も適している。前立腺がんのように複合表現型の遺伝的基礎は、それぞれが軽度のリスクを与える多くのアレルによって支配されているという仮定の下で、GWASは実施される。GWASにおいて遺伝子型解析された遺伝的多型のほとんどが一般的なものであり、対象集団(例えば、ヨーロッパ系の男性)内におけるマイナーアレル頻度は1%超~5%である。GWASにより、ゲノム全体にわたって一般的な多様性の大半が捕捉される。[ 8 ][ 9 ]検査対象の染色体上で、お互いに近い位置にある多くのアレル間に強い相関(連鎖不均衡と呼ぶ)が認められると、1,000万にも及ぶ既知の一塩基多型(SNP)をすべて調べなくてもゲノム全体を「スキャン」することが可能となる。GWASにより、研究者は1回の検査で約100万~500万のSNPが検査可能で、ゲノム全体で一般的な遺伝的多様体のほぼすべてを確認できる。
GWASでは、症例と対照間で各SNPのアレル頻度が比較される。アレル頻度が対照集団と比較した症例で有意に偏向しているという有望なシグナルは、複製コホートで検証される。表現型に関連する多様体を識別する統計的な検出力を満たすために、一般的にはそれぞれ数千人という多数の症例と対照を調査する。GWASで評価されるSNPが最大で100万個であることから、標準的な統計閾値を用いた場合は、偽陽性の判定が高頻度で発生すると予想される。そのため、厳しい統計的法則を採用して陽性と判定し、通常はP < 1 × 10-7の閾値を用いる。[ 10 ][ 11 ][ 12 ]
検出力に優れたGWASにより、現時点で数百ものがんリスク多様体が特定され、独立したコホートで検証されている。[ 13 ]これらの研究により、特定の遺伝的多様体とがんリスクとの間の一貫した関連性が明らかにされている。しかしながら、この知見は以下のわずかだが重要な検討を加えて検証すべきである:
- これまでに報告されたGWASは、比較的一般的な遺伝的多型を特定するようにデザインされている。集団内に高頻度にみられるアレルが単独でがんリスクに実質的に寄与する可能性はきわめて低い。腫瘍形成の多遺伝子性を考え合わせると、このことは、今日までにGWASにより特定された1つの多様体による寄与はいずれもきわめて小さく、一般に疾患リスクのオッズ比は1.3未満であることを意味している。さらに、何万もの症例と対照を対象とした一般的多型についての広範なゲノムワイド検索にもかかわらず、今日までのGWASの結果では、がんリスクにおける遺伝的要素を説明できるものは半数にも満たない。[ 14 ]
- GWASによって明らかになった多様体が疾患リスクの直接的な要因となる可能性は低い。前述したように、SNPは連鎖不均衡ブロック内に存在し、単に検査対象ブロック内にある1組の多様体(既知および未発見のいずれでも)の代理指標となるだけである。原因となるアレルは連鎖不均衡ブロック内のどこかに位置している。
- 異なった先祖グループが混合しているためにGWASの結果が混乱することがある(すなわち、統計的に有意な結果が、疾患との真の関連性というより、症例 vs 対照における被験者数の不釣り合いを反映している可能性がある)。そのため、GWASは一般的に単一の支配的な先祖グループを解析するよう検出力をもたせられている。その結果、ゲノムワイド関連解析では、一部の集団が依然として過小評価される。
- GWASにより特定された多様体の臨床的関連性は依然として不明である。[ 15 ][ 16 ][ 17 ]
これらの点についての意味合いは、乳がんおよび婦人科がんの遺伝学、大腸がんの遺伝学、および前立腺がんの遺伝学のPDQ要約でより詳細に考察する。追加の詳しい情報が別の場所で見つかることがある。[ 18 ]
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Stanford JL, McDonnell SK, Friedrichsen DM, et al.: Prostate cancer and genetic susceptibility: a genome scan incorporating disease aggressiveness. Prostate 66 (3): 317-25, 2006.[PUBMED Abstract]
- Chang BL, Isaacs SD, Wiley KE, et al.: Genome-wide screen for prostate cancer susceptibility genes in men with clinically significant disease. Prostate 64 (4): 356-61, 2005.[PUBMED Abstract]
- Lange EM, Ho LA, Beebe-Dimmer JL, et al.: Genome-wide linkage scan for prostate cancer susceptibility genes in men with aggressive disease: significant evidence for linkage at chromosome 15q12. Hum Genet 119 (4): 400-7, 2006.[PUBMED Abstract]
- Cancer risks in BRCA2 mutation carriers. The Breast Cancer Linkage Consortium. J Natl Cancer Inst 91 (15): 1310-6, 1999.[PUBMED Abstract]
- Easton DF, Bishop DT, Ford D, et al.: Genetic linkage analysis in familial breast and ovarian cancer: results from 214 families. The Breast Cancer Linkage Consortium. Am J Hum Genet 52 (4): 678-701, 1993.[PUBMED Abstract]
- Wellcome Trust Case Control Consortium: Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature 447 (7145): 661-78, 2007.[PUBMED Abstract]
- The International HapMap Consortium: The International HapMap Project. Nature 426 (6968): 789-96, 2003.[PUBMED Abstract]
- Thorisson GA, Smith AV, Krishnan L, et al.: The International HapMap Project Web site. Genome Res 15 (11): 1592-3, 2005.[PUBMED Abstract]
- Evans DM, Cardon LR: Genome-wide association: a promising start to a long race. Trends Genet 22 (7): 350-4, 2006.[PUBMED Abstract]
- Cardon LR: Genetics. Delivering new disease genes. Science 314 (5804): 1403-5, 2006.[PUBMED Abstract]
- Chanock SJ, Manolio T, Boehnke M, et al.: Replicating genotype-phenotype associations. Nature 447 (7145): 655-60, 2007.[PUBMED Abstract]
- Chang CQ, Yesupriya A, Rowell JL, et al.: A systematic review of cancer GWAS and candidate gene meta-analyses reveals limited overlap but similar effect sizes. Eur J Hum Genet 22 (3): 402-8, 2014.[PUBMED Abstract]
- Ioannidis JP, Castaldi P, Evangelou E: A compendium of genome-wide associations for cancer: critical synopsis and reappraisal. J Natl Cancer Inst 102 (12): 846-58, 2010.[PUBMED Abstract]
- Park JH, Gail MH, Greene MH, et al.: Potential usefulness of single nucleotide polymorphisms to identify persons at high cancer risk: an evaluation of seven common cancers. J Clin Oncol 30 (17): 2157-62, 2012.[PUBMED Abstract]
- Lindström S, Schumacher FR, Cox D, et al.: Common genetic variants in prostate cancer risk prediction--results from the NCI Breast and Prostate Cancer Cohort Consortium (BPC3). Cancer Epidemiol Biomarkers Prev 21 (3): 437-44, 2012.[PUBMED Abstract]
- Wacholder S, Hartge P, Prentice R, et al.: Performance of common genetic variants in breast-cancer risk models. N Engl J Med 362 (11): 986-93, 2010.[PUBMED Abstract]
- Jorgenson E, Witte JS: Genome-wide association studies of cancer. Future Oncol 3 (4): 419-27, 2007.[PUBMED Abstract]
- 臨床シークエンシング
-
序
多重遺伝子(パネル)検査、全エキソーム配列決定法(WES)、および全ゲノム配列決定法(WGS)といった広範な遺伝子シークエンシングのアプローチが急速に進化しており、がん治療法およびがんリスク評価などの臨床腫瘍学の分野に組み込まれている。いくつかの施設および会社が腫瘍のシークエンシングを提供しており、腫瘍ゲノムの配列決定を行って原因となる遺伝子変化を特定し、患者に有益な治療法に標的を定めることが可能な正確な医薬(precision medicine)プログラムを開発している施設もある。[ 1 ][ 2 ][ 3 ]このような腫瘍ベースのアプローチの多くが、腫瘍内のみのDNA変化と遺伝する可能性のあるDNA変化とを鑑別する基準として、生殖細胞系DNA塩基配列を用いている。遺伝カウンセリングおよびがんリスク評価の面では、多重遺伝子検査を使用してがん遺伝リスクを評価することがさらに多くなってきており、またがんリスクに関係する多数の遺伝子を対象に変異を検出する多重遺伝子検査をさまざまな施設および会社が提供しているため、近い将来にはルーチンで使用されるようになる可能性もある。
遺伝子シークエンシング技術におけるこのような進展により、遺伝子の塩基配列検査が依頼された本来の適応症に関連する遺伝子における多様体が特定される上に、検査対象の疾患に関連のない所見も得られる。後者の遺伝学的所見は、偶発的または二次的な所見と呼ばれるが、今や臨床面、倫理面、法律面、およびカウンセリング面において論争の種となっている。American College of Medical Genetics and Genomics(ACMG)およびPresidential Commission for the Study of Bioethical Issuesは、これらの問題の一部に取り組み、これらの使用に対するガイダンスおよび推奨を提供する文献を公表している。[ 4 ][ 5 ][ 6 ][ 7 ]しかしながら、患者およびその医療提供者に結果についていつ、なにを伝えるかについては、依然として異論がある。臨床シークエンシングとの関連で遺伝子シークエンシング技術に関する情報を提供するとともに、臨床的に不明確で、さらに調査およびアプローチが必要な追加分野に光を当てるために、このセクションを設けた。
背景
特に2005年に超並列塩基配列決定法、つまり次世代塩基配列決定法(NGS)が導入されて以降、DNAシークエンシング技術は急速な進化を遂げている。[ 8 ]
自動化されたSanger塩基配列決定法は、シークエンシング技術の第一世代とみなされている。[ 9 ]Sangerのがん遺伝子塩基配列決定法では、関心のある遺伝子領域のポリメラーゼ連鎖反応(PCR)増幅を行い、その後に蛍光標識されたターミネーター、キャピラリー電気泳動によるPCR産物の分離、およびヌクレオチド配列のレーザー信号検出を用いてPCR産物の塩基配列決定を行う。[ 10 ][ 11 ]Sanger塩基配列決定法は正確なシークエンシング技術であるが、主な限界として、処理量が少ないこと、同時に数個の遺伝子より多くの塩基配列決定を行う能力が限られていること、および構造的再構成を検出できないことが挙げられる。[ 10 ]
NGSはハイスループットDNAシークエンシング技術と呼ばれており、複数のDNA塩基配列を並行して処理できる。[ 11 ]テンプレート生成および塩基配列検索においてプラットフォームは異なるが、NGS技術に対する全体的アプローチには、DNAテンプレート分子をせん断し、固体表面に固定することも含まれ、分子の分離と同時にシークエンシング反応(100万から10億)を並行して実施することができる。[ 10 ][ 12 ]そのため、NGS技術の大きな利点は、数千もの遺伝子の配列決定を同時に実施できること、低コストであることのほか、挿入、欠失、コピー数変異、および再構成といったさまざまな種類のゲノム変異を検出できることである。[ 10 ]限界としては、特定の遺伝子領域が見逃される恐れがあること、結果を得るまでの時間が非常に長いこと(ただし、短縮されてきている)、および莫大な量の遺伝子データを取り扱う情報技術的支援がシークエンシング能力に追いついていないことが挙げられる。NGSデータを利用する上でよく認識されている障害は、莫大な量の遺伝子データを記憶・処理・解析する高度な計算基盤が不足していることである。NGSにより得られる多様体の数は指数関数的に増加している;バイオインフォマティクスのアプローチでは、疾患の生物学で推定される機能的結果と対比して遺伝子多様体を評価する必要がある。科学および医学コミュニティに影響を与える遺伝子データを解析し、統合化するためには、使用者が取り扱いやすいバイオインフォマティクスのパイプラインも必要である。[ 11 ][ 13 ]
NGS検査の臨床応用および報告された結果の意味をより良く理解するために、以下の用語が定義されている。
- 遺伝子多様体:最も頻度の高いDNAヌクレオチド配列の変異。多様体という用語は、良性、病原性、または意義不明の多様体を記述するのに使われることがある。多様体という用語は、特に生殖細胞変異で、突然変異という用語の代わりに使われることが増えてきている。表1は疾患の原因に対する塩基配列多様体を分類したものである。[ 6 ]
- 生殖細胞多様体:子孫の身体内のすべての細胞のDNAに組み込まれるようになる生殖細胞(卵子および精子)における遺伝子変化。生殖細胞に含まれる多様体は、親から子孫に受け継がれることがあり、このため遺伝性である。
- 体細胞変異:受胎後に現れ、生殖細胞内には存在しないDNA変異。体細胞変異は、胚細胞(精子および卵子)を除く体細胞のいずれかに発生する可能性があり、したがって子供に受け継がれることはない。体細胞変異は、がんまたは他の疾患を引き起こすことがある(ただし、常にそうだとは限らない)。
- 二次的所見:エキソームおよびゲノムシークエンシングが依頼された適応症とは関係ないが、依頼した医師、患者、またはその家族にとっては、医学的な価値または有用性が認められる可能性のある遺伝子検査の結果。(出典:ACMG[ 4 ]。)ACMGは、標準的な命名法として偶発的所見ではなく、むしろ二次的所見を現在採用している。
- アクション可能な(actionable)遺伝情報:臨床管理に情報を与えるために使用可能な腫瘍または生殖細胞における遺伝子多様体の有無。(出典:Dancey et al.[ 1 ])
表1.病原性についての多様体分類 多様体の種類 説明 出典:Richards et al.[ 6 ] 病原性 疾患発症に直接寄与する。この多様体の分類を変更するような追加の証拠は予期されない。[注: すべての病原性多様体が十分な浸透度を有するわけではない。] 病原性を有する可能性が高い 疾患発症に寄与する可能性が非常に高いが、これを決定的に証明するには現在証拠が不十分である。 意義不明 現時点でこの多様体のより確定的な分類を裏付けるだけの情報が存在しない。 良性の可能性が高い 疾患に対する大きな影響はないと予期されるが、これを決定的に証明するには現在証拠が不十分である。 良性 疾患の原因とならない。この多様体の分類を変更するような追加の証拠は予期されない。 新興の臨床応用
NGSにはさまざまな可能性を秘めた臨床応用がある。腫瘍学では、主に以下の2つの応用がある:1)予後および/または標的療法の情報を得るための腫瘍における体細胞変異の評価;および2)リスクアレルを特定するための生殖細胞の評価。
体細胞検査
腫瘍の体細胞変異の検査には多くのアプローチがある。標的多重遺伝子検査では、多くの異なった遺伝子を同時に評価できる。このような標的多重遺伝子検査では、検査に含める遺伝子を大幅に変えることが可能で、個々の腫瘍型に応じて作成することができる。標的多重遺伝子検査では、解析するデータを制限し、既知の遺伝子のみを含めることで、全エキソームまたは全ゲノム技術よりも解釈が容易になる。その上、標的多重遺伝子検査では、WESまたはWGSよりカバレッジの深さを大きくすることが可能である。カバレッジの深さは、1つのヌクレオチドの塩基配列決定を行った回数のことをいう;カバレッジの深さが大きいほど、塩基配列決定エラーが少なくなる。深いカバレッジは、塩基配列決定エラーを一塩基多型と区別するためにも役立つ。
WESおよびWGSは、はるかに広い範囲を対象とした技術で、既知の遺伝子および先経験に疑わしくない遺伝子における多様体を明らかにすることを目的としている。特定の腫瘍型で予想されていない多様体が発見されることで、方針を定めた治療法が使用できるようになり、患者の転帰を改善できる可能性がある。WESは、ゲノム全体(WGS)ではなく、ゲノムのコード領域(ヒトゲノムの約1%を占める)における塩基配列データを生成する。そのため、WESはWGSより安価である。
WGSを使用すれば非コード領域の多様体が特定できるが、WESを使用した場合は特定できない。WGSの使用は、コストのほか、解釈に必要な膨大なバイオインフォマティクスにより制限される。シークエンシングのコストは急激に低下しているが、その解析には依然として手間がかかっている。[ 14 ]
WESおよびWGSの目標は、アクション可能な遺伝子多様体(治療で標的とすることが可能な突然変異)を検出することによる患者ケアの向上であるが、多くの問題を考慮に入れる必要がある。このような検査では、病原性多様体、意義不明の多様体(VUS)、またはこれまで検出不能であった異常が検出されることがある。その上、腫瘍形成に明らかに関係していると考えられる遺伝子に病原性多様体が発見されること以外に、関連性が明らかでない遺伝子に検出されることもある(特にWESおよびWGSアプローチで)。VUSは、その蛋白が機能を喪失することも、喪失しないこともあるため、意義が不明確である。アクション可能性(actionable)の定義は異なることもあるが、この用語は、臨床試験が利用可能な特定の治療(rasの多様体など)または既知の標的薬が存在する特定の治療に対する推奨につながると考えられる異常が発見された場合に使用されることが多い。このアプローチで成功した症例報告があるが、すんなり成功する可能性は低い。いくつかの研究が進められている。
市販または単一施設の解析法で腫瘍のみを検査するものがある。腫瘍で重要な遺伝子にみられる明らかに病原性の多様体は、体細胞変異の可能性があるが、生殖細胞由来と考えられる場合もある。体細胞解析を生殖細胞解析とペアで行っている状況では、同定された変異が遺伝性であるかどうかを判定できる。正常DNAシークエンシングと対応させて、腫瘍のシークエンシングを受けた患者から生殖細胞多様体の保有率を推定した研究では、がん感受性遺伝子が1,566人中198人(12.6%)で同定されたことが報告された。これらの198人のうち、自身の腫瘍型と一致したがん感受性遺伝子に病原性多様体が認められたのはわずか81人(40.9%)であった。既知の非がん関連メンデル疾患遺伝子を含めるように拡張した場合、1,566人中246人(15.7%)で、病原性および推定病原性の生殖細胞多様体が同定された。[ 15 ]
腫瘍シークエンシングでは、遺伝性(生殖細胞系)の病原性多様体の同定に至ることがある。[ 16 ]十分に特徴が明らかにされているがん感受性遺伝子における創始者病原性多様体は、生殖細胞病原性多様体であることが強く示唆される。超変異腫瘍の表現型は、基礎をなすDNA修復の体質的欠陥を示唆していることがある。家族歴、診断時年齢が若い、または具体的な腫瘍型といった特定の遺伝的素因と合致する臨床的特徴によっても、腫瘍多様体と関連する生殖細胞多様体の疑いが生じることがある。多様体アレルの割合が高い場合も生殖細胞多様体を示すことがある。これらの因子はすべて、患者が遺伝カウンセリングを受け、確定的な生殖細胞遺伝子検査を考慮する必要がある可能性を知らせている。
体細胞検査の一環として評価されたある遺伝子に多様体が認められないからといって遺伝的感受性の存在が除外されるわけではない。個人歴および家族歴が遺伝性がんを示唆するすべての患者について、その体細胞検査の結果に関わらず、生殖細胞検査を考慮すべきである。
NCI Molecular Analysis for Therapy Choice (NCI-MATCH) Trialなどの現在実施中の臨床試験では、アクション可能な標的を発見するための体細胞配列決定の価値が検討されている。この研究の一構成要素として生殖細胞系配列決定が実施中である。
生殖細胞検査
生殖細胞検査の目標は、がんの遺伝リスクと関係する病原性多様体を特定すること、およびがんのリスク管理上の意思決定の指針とすることである。また、生殖細胞検査は、診断時点におけるいくつかの管理上の意思決定に役立つことがある(例えば、リンチ症候群関連結腸がんにおける結腸切除術およびBRCA1/BRCA2病原性多様体のキャリアにおける対側乳房切除術に関する意思決定)。さらに、生殖細胞の状態は全身治療の意思決定に役立つ可能性があることを示すデータが新たに出てきている(例えば、BRCA1/BRCA2関連がんにおけるシスプラチンまたはポリ[ADP]リボース-ポリメラーゼ[PARP]阻害薬の使用)。
現在までに、ほとんどの生殖細胞遺伝子検査が、臨床像と関連する遺伝子の多様体を探す標的方式で実施されている(例えば、遺伝性乳がんおよび卵巣がんでは、BRCA1およびBRCA2;またはリンチ症候群ではミスマッチ修復[MMR]遺伝子)。しかし、現在では、さまざまな遺伝子セットを含む標的多重遺伝子検査が市販または施設内で利用できる。すべてのがんを標的としたものもあるし、特定のがんを標的としたものもある(例えば、乳がん、結腸がん、または前立腺がん)。マルチ遺伝子検査の遺伝子には、特定の腫瘍に関連した浸透度の高い遺伝子(乳がんパネル上のBRCA1/BRCA2など);さまざまな種類のがんに関係するが、基準の腫瘍に対してより中等度のリスクを有する浸透度の高い遺伝子(乳がんパネル上のCDH1またはMSH6など);および臨床的有用性が不明確な浸透度が中等度の遺伝子(乳がんパネル上のNBNなど)がある。これらのパネル上には多数の遺伝子が含まれているため、これらのパネルを用いて検査を受ける多くの人、おそらくほとんどの人に、VUSが1つ以上発見されると予想される。20の遺伝子を含むパネルに対して標準の検査前カウンセリングのモデルを採用することはできないため、新たなカウンセリングモデルが必要である。患者が特定の結果(乳がんにおけるTP53またはCDH1など)を知らないでおくことができるか、またこれを臨床診療でどのように実現するかという倫理的問題は未解決のままである。
(標的多重遺伝子検査の利用に関するより詳しい情報については、がんの遺伝学的リスク評価とカウンセリングに関するPDQ要約の多重遺伝子(パネル)検査のセクションを参照のこと。)
遺伝性のがん感受性を調べるWESも市販されている。二次的所見の可能性は高いため、このような所見に対する管理が進展している。
次世代塩基配列決定法(NGS)のガバナンス、解釈、および監視制度
ACCEモデルでは新たな遺伝子検査を評価するために以下の4つの主要な要素を用いている:分析的妥当性;臨床的妥当性;臨床的有用性;および倫理的、法的、社会的問題。[ 17 ]
- 分析的妥当性は遺伝子型の測定の正確度と信頼性を反映する。
- 臨床的妥当性は、所見(遺伝的多様性など)が関心のあるアウトカム(がんリスクなど)をどの程度正確に予測するかを示す。
- 臨床的有用性は、検査結果が明らかになったことにより患者の転帰が改善されるかどうかを考慮している。2015年に、ACMGは臨床的有用性の定義を拡大し、個々の患者、家族、および社会のための遺伝子およびゲノムサービスの有用性を考慮する必要性について方針声明を発表した。[ 5 ]
- 倫理的、法的、社会的問題はインフォームド・コンセントの問題を含めて新たな遺伝子検査それぞれで発生しうる。
ACCEモデルの枠組みは遺伝子検査を評価するため世界的に採用されている。
臨床の設定では、NGSの管理に複雑な階層がいくつか存在する。純粋に技術的なレベルでは、シークエンシング技術の向上により、エキソームのみならず、全ゲノムにわたる塩基配列決定が可能となっている。コストの低下とともに、腫瘍および正常組織のエキソームおよびゲノムの塩基配列決定がより通常的に実施されるようになると予想される。
WGSのルーチンでの使用により、解釈に大きな課題が出現している。第一に、既知のがん素因遺伝子における塩基配列の多様性で、病因性のもの、無害なもの、およびその意義についてさらに評価が必要なものを判断するという課題がある。これは新たな課題ではない。増加を続けている多様体のデータベースとその意義に関する解釈およびキュレーション(人手による精選と修正)のプロセスをさまざまなグループが開発している。例えば、International Society for Gastrointestinal Hereditary Tumorsは、Human Variome Project and International Mismatch Repair Consortiumと協力して、MMR遺伝子に対するそのようなプロセスを開発している。
これらのプロセスは、腫瘍の進行またはその他の疾患の調節機能が不明確または未知の遺伝子における塩基配列多様性の意義を解釈するという新たに現れてきた課題に対する枠組みとして役立つ可能性がある。大規模ながん素因の多重遺伝子検査が民間の研究所で開発されており、解釈に独自のプロセスを用いている。意義不明の遺伝子が含まれる多重遺伝子検査の規模がますます大きくなってきている限り、解釈プロセスのガバナンスでは、学術機関が独自の多重遺伝子検査を提供したり、外部で独自に開発されたパネルを用いたりして、検査性能の品質保証(適切な施設であれば、Clinical Laboratory Improvement Amendments [CLIA]など)および解釈を管理する審議プロセスを開発することが求められる。
米国臨床遺伝学会(ACMG)は、二次的変異の解釈および報告で説明責任を果たすため、以下のような更新されたガイドラインを発行している:[ 4 ][ 18 ]
- 臨床シークエンシングが依頼された適応症および患者の年齢にかかわらず、解析施設は依頼した臨床家に対して56の遺伝子リスト内の構成的多様体を報告すべきである。この中には、塩基配列決定済みの腫瘍と正常の2個一組からなる通常のサンプルが含まれる。患者は、臨床シークエンシング前に悪影響および十分なインフォームド・コンセントを明確に理解した後にそのような解析を受けないように選択できる。
- 過去に報告された多様体および疾患で確認された原因、または過去に報告されていないが、疾患を引き起こすことが予想される種類の多様体のみを報告すべきである。
- 臨床的ゲノムスケールシークエンシングを実施する場合、資格を有する遺伝学の医療専門家が検査の性質について記述し、解釈の不確実性、プライバシー、家族への影響、二次的な所見の発生といった問題を扱った文書によるインフォームド・コンセントを入手すべきである。
- 医師は、臨床シークエンシングの基本属性と限界を熟知しておくべきである。
- ACMGは、コンテンツエキスパートおよび他の専門医組織と合同で、このようなガイドラインを改良し更新することを毎年継続すべきである。
腫瘍のシークエンシングの状況において生殖細胞多様体をルーチンに報告する場合、検査室に対して生殖細胞系と腫瘍ゲノムの専門知識を用いた結果のレビューの実施を要求することになり、これには費用、検査室の努力、結果報告のための所要時間の増加が予想されるという懸念が依然として存在する。腫瘍医と患者間の話し合いの性質は、生殖細胞多様体検査と潜在的な結果にかかわる複数の側面を含むように変化することになる。検査前後の話し合いでもまた、場合によっては遺伝カウンセラーおよび遺伝医(腫瘍学の実践における能力は限られている)が関与する必要があるであろう。最近の専門家のコメントによると、腫瘍のシークエンシングを受けているがん患者に対して二次的な生殖細胞所見を報告することの有益性についてはさらなるデータが必要であり、腫瘍学および遺伝学界の専門家による推奨が必要であると述べられている。[ 19 ]
制度レベルでの監視については、開発プロセスのまだ非常に早い段階にある。一例として、がん患者を多く扱うある施設では、以下のプロセスが用いられている:
- 研究目的で腫瘍組織の評価を検討している場合は、体細胞組織の非常に大きなパネルを全身組織に対応するパネルとペアにして検査を実施することに患者の同意を求める。重要な研究の取り組みには、腫瘍の多様体パターンに従って予後および治療効果の違いを評価することが含まれる。
- 同意取得プロセスでは、基礎にある腫瘍の感受性を示唆する多様体が特定される可能性があることについて要点を説明する。アクション可能な遺伝子多様体が特定された場合に、この情報を受け取ることを希望するかどうかを患者に尋ねる。また、緊急の遺伝カウンセリングも実施する(研究プロトコルに関与しているカウンセラーが担当)。このようなアクション可能な遺伝子多様体情報を受け取らないことを患者が選択した場合でも、患者の制度上のプライマリケア医(PCP)に結果が報告される。このような情報を受け取ることを過去に辞退したにもかかわらず、関連結果に関わっているPCPにより、患者がその情報に再び接近するようになる可能性のある環境については、今日まで未解決のままである。
- 重大な結果となる可能性が認められる場合は、特定の検査をCLIAラボで再び実施することがある。
- 委員会を組織して多様体を調べ、多様体が病原性とみなせるか、さもなければアクション可能とみなせるかどうかを判断する。
- 別の委員会を組織してこのようなプロトコルの実施について監視し、がん患者で予想されるこのようなパネルのルーチンのパフォーマンスに一致する形で上記のプロセスを意図的に進展させるために、患者の自主性に必要なものと釣り合いを保って、インフォームド・コンセントに適切に詳述する。
NGSの応用から生じたインフォームド・コンセントの課題
選択した家系内で遺伝性疾患が既知または疑われる状況で、浸透度の高い疾患遺伝子のシークエンシングを行う場合のインフォームド・コンセントが1990年代中期から実施されている。しかし、十分な情報を得た上での意思決定を推進するために、遺伝子検査で可能性のある有益性、限界、有害性について教育およびカウンセリングを実施する最善の方法およびアプローチについては、十分に解明されているとは言えず、適切に検証されているとも言えない。NGS技術が臨床および研究の設定で適用されるようになるにつれて、新たなインフォームド・コンセントの課題が現れてきている。インフォームド・コンセントの課題としては、以下のものがある:
- ゲノム配列決定を介して特定される可能性のある医学的リスクの幅および多様性に対して個人中心の認識を提供。インフォームド・コンセントの確立は、十分な医療サービスを受けられず、疾患リスクの概念を良く知らない集団およびリスクが高いことが特定された疾患の知識、経験、または背景がない人において特に問題となることがある。
- 明確な管理アルゴリズムまたは特定されたベストプラクティスがない状況での疾患のシークエンシング。
- 病原性を有する可能性があるものの不明確な多様体の解釈。
- 他の家族員に重要となる可能性のある遺伝情報の連絡。
- 医療提供者が遺伝子/ゲノム医薬のオーダーに慣れておらず、担当患者の代わりに結果を受け取り、医学的にアクション可能な結果を得て管理することが予想される場合には、さらに別の課題が予想される。
NGS技術の利用可能性が増し、費用が低下することで、がん治療の潜在的な標的として体細胞多様体の同定を目標にした腫瘍のゲノムワイドな検査の利用が拡大している。生殖細胞病原性多様体の同定は腫瘍の検査という主目的に対する二次的なものとして考えられるが、がん素因遺伝子における病原性多様体のアクション可能な二次的所見を同定できる可能性はこの状況において遺伝カウンセリングが必要であることを裏付けている。腫瘍のシークエンシングの状況において遺伝カウンセリングおよびインフォームド・コンセントに対するアプローチが提案されている。[ 20 ][ 21 ]
結論
遺伝子シークエンシングの進展により、個人の全ゲノムまたは全エキソームの塩基配列決定のコストが劇的に低下している。体細胞変異および生殖細胞多様体のいずれの検査でも、臨床状況でWGSおよびWESが採用されることが増えてきている。さらに現在では、多重遺伝子検査が市販または施設内で利用可能である。NGSおよび遺伝子パネルに関連する臨床面、倫理面、法律面、およびカウンセリング面にまつわる多くの議論がある。これら課題に対処するには、さらなる研究が必要である。
参考文献- Dancey JE, Bedard PL, Onetto N, et al.: The genetic basis for cancer treatment decisions. Cell 148 (3): 409-20, 2012.[PUBMED Abstract]
- Meric-Bernstam F, Farhangfar C, Mendelsohn J, et al.: Building a personalized medicine infrastructure at a major cancer center. J Clin Oncol 31 (15): 1849-57, 2013.[PUBMED Abstract]
- Sleijfer S, Bogaerts J, Siu LL: Designing transformative clinical trials in the cancer genome era. J Clin Oncol 31 (15): 1834-41, 2013.[PUBMED Abstract]
- Green RC, Berg JS, Grody WW, et al.: ACMG recommendations for reporting of incidental findings in clinical exome and genome sequencing. Genet Med 15 (7): 565-74, 2013.[PUBMED Abstract]
- ACMG Board of Directors: Clinical utility of genetic and genomic services: a position statement of the American College of Medical Genetics and Genomics. Genet Med 17 (6): 505-7, 2015.[PUBMED Abstract]
- Richards S, Aziz N, Bale S, et al.: Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med 17 (5): 405-24, 2015.[PUBMED Abstract]
- Presidential Commission for the Study of Bioethical Issues: Anticipate and Communicate: Ethical Management of Incidental and Secondary Findings in the Clinical, Research, and Direct-to-Consumer Contexts. Washington, DC: U.S. Government Printing Office, 2013. Available online. Last accessed July 24, 2020.[PUBMED Abstract]
- National Human Genome Research Institute: DNA Sequencing Costs: Data from the NHGRI Genome Sequencing Program (GSP). 2014. Available online. Last accessed July 24, 2020.[PUBMED Abstract]
- Sanger F, Nicklen S, Coulson AR: DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci U S A 74 (12): 5463-7, 1977.[PUBMED Abstract]
- MacConaill LE: Existing and emerging technologies for tumor genomic profiling. J Clin Oncol 31 (15): 1815-24, 2013.[PUBMED Abstract]
- Rizzo JM, Buck MJ: Key principles and clinical applications of "next-generation" DNA sequencing. Cancer Prev Res (Phila) 5 (7): 887-900, 2012.[PUBMED Abstract]
- Linnarsson S: Recent advances in DNA sequencing methods - general principles of sample preparation. Exp Cell Res 316 (8): 1339-43, 2010.[PUBMED Abstract]
- Fernald GH, Capriotti E, Daneshjou R, et al.: Bioinformatics challenges for personalized medicine. Bioinformatics 27 (13): 1741-8, 2011.[PUBMED Abstract]
- Mardis ER: The $1,000 genome, the $100,000 analysis? Genome Med 2 (11): 84, 2010.[PUBMED Abstract]
- Schrader KA, Cheng DT, Joseph V, et al.: Germline Variants in Targeted Tumor Sequencing Using Matched Normal DNA. JAMA Oncol 2 (1): 104-11, 2016.[PUBMED Abstract]
- Raymond VM, Gray SW, Roychowdhury S, et al.: Germline Findings in Tumor-Only Sequencing: Points to Consider for Clinicians and Laboratories. J Natl Cancer Inst 108 (4): , 2016.[PUBMED Abstract]
- Haddow J, Palomaki G: A model process for evaluating data on emerging genetic tests. In: Khoury M, Little J, Burke W, eds.: Human Genome Epidemiology: A Scientific Foundation for Using Genetic Information to Improve Health and Prevent Disease. New York, NY: Oxford University Press, 2004, pp 217-33.[PUBMED Abstract]
- ACMG Board of Directors: ACMG policy statement: updated recommendations regarding analysis and reporting of secondary findings in clinical genome-scale sequencing. Genet Med 17 (1): 68-9, 2015.[PUBMED Abstract]
- Parsons DW, Roy A, Plon SE, et al.: Clinical tumor sequencing: an incidental casualty of the American College of Medical Genetics and Genomics recommendations for reporting of incidental findings. J Clin Oncol 32 (21): 2203-5, 2014.[PUBMED Abstract]
- Everett JN, Gustafson SL, Raymond VM: Traditional roles in a non-traditional setting: genetic counseling in precision oncology. J Genet Couns 23 (4): 655-60, 2014.[PUBMED Abstract]
- Catenacci DV, Amico AL, Nielsen SM, et al.: Tumor genome analysis includes germline genome: are we ready for surprises? Int J Cancer 136 (7): 1559-67, 2015.[PUBMED Abstract]
- PDQ要約の構造と内容
-
がん遺伝学に関するPDQ要約では、特定のがんの遺伝学、遺伝性がん症候群、およびがんの遺伝学的情報の倫理的、社会的、心理的問題に焦点が当てられている。特定のがんの遺伝学に関するセクションでは、がんの家族歴のリスク上の意味合い、がんの素因となる多様体の保有率と特徴、遺伝学的リスクに対する既知の修飾因子、遺伝子検査の機会、遺伝カウンセリングおよび遺伝子検査の結果、遺伝的素因によるがんのハイリスク者に実施可能な介入法などに関して、症候群ごとの情報が扱われている。
がん遺伝学に関するPDQ要約で引用される医学文献は査読された科学出版物からのものであり、その質と信頼性は証拠レベルという観点から評価されている。関連する部分では、証拠レベルが引用されるか、もしくは研究個々の強さまたはその証拠の限界が記述されている。
がん遺伝学に関するPDQ要約に用いられる証拠レベルに関する詳しい情報については、がん遺伝学研究に関する証拠レベルの要約を参照のこと。
- Genetics Resources
-
遺伝カウンセリングを含む遺伝サービスを行っている医療提供者は、米国遺伝カウンセラー学会(National Society of Genetic Counselors)などの地方、地域、全国の遺伝学専門家組織を通じて探すことができる。がんの遺伝サービスの場合、その提供者はある1つの専門職に限定されているわけではなく、遺伝医、遺伝カウンセラー、上級実践遺伝看護師、腫瘍専門医(内科、放射線科、外科)、その他の外科医、内科医、小児科医、家族医、精神衛生の専門家などが含まれる。がん遺伝学の医療提供者は、家系図の作成および評価、個人および家系の病歴の聴取および評価、ならびにその家系におけるがんに関連するがんリスクおよび/または病原性多様体の確率に関する情報の算定および提供を支援する。さらに、遺伝子検査が利用可能であれば、これらの提供者は、検査前カウンセリング、検査機関の選択、インフォームド・コンセント、検査結果の解釈、検査後カウンセリング、およびフォローアップにおいても支援可能となる。
表2.臨床遺伝学情報 資源 説明 ClinGen 正確な医薬(precision medicine)および研究での使用のための遺伝子多様体の臨床的関連性を評価するプログラム。 ClinVar ゲノム変化および人間の健康に対するその関係に関する情報を集約する公共保存データベース。 Human Genome Epidemiology Network(HuGENet) ヒトゲノムに関する母集団ベースの疫学情報を共有するためのネットワーク。 National Institutes of Health Genetic Testing Registry(GTR) 医療提供者が遺伝子検査情報を自発的に提出するための中心施設。検査情報には検査の目的、方法論、妥当性、検査の有用性の証拠、および検査所の連絡先や証明書が含まれている。 Online Mendelian Inheritance in Man(OMIM) ヒトの遺伝子および遺伝学的障害のカタログ。 表3.臨床管理情報 資源 説明 米国臨床遺伝学会(ACMG)の臨床診療ガイドライン この臨床診療ガイドラインは、一部のがんを含むさまざまな遺伝性疾患を有する人、またはこれらの疾患の発症リスクが高い人のリスク評価、検査およびカウンセリングに関する専門委員により開発された。 米国臨床腫瘍学会(ASCO)の臨床診療ガイドライン この臨床診療ガイドラインは、特定の臨床的症状(疾患指向)または承認された医薬品、治療法または検査法の使用(モダリティ指向)に関する専門委員により開発された。 全米総合がん情報ネットワーク(NCCN)のガイドライン この臨床診療ガイドラインは、専門委員により開発され、がん患者全体の97%が罹患する悪性がんに対する管理決定および医療介入の手順について詳述している。さらに、個別のガイドラインでは、主要な予防およびスクリーニングの課題を扱っており、もう一組の経路では、主要な支持療法領域に焦点を当てている。 医療研究・品質調査機構(AHRQ)によるナショナル・ガイドライン・クリアリングハウス 科学的根拠に基づいた臨床診療ガイドラインのための公的資源。 表4.利用者/クライアント:一般情報 資源 説明 Dictionary of Genetics Terms(NCI) 遺伝学に関係する200を超える用語の定義。 DNA Learning Center さまざまな教育資源、DNA研究に関するインタラクティブな年表など。 The DNA Files 1時間の公開ラジオドキュメンタリー14回シリーズ、および関連情報。 Facing Our Risk of Cancer Empowered(FORCE) 遺伝性乳がんおよび卵巣がんに罹患した本人および家族に対する無料電話相談、掲示板、チャットルームおよび支援グループを介した支援と情報提供。 Genetic and Rare Diseases Information Center(米国立ヒトゲノム研究所[NHGRI]) 患者および患者家族の他、医療専門家や生物医学研究者を含めた、一般大衆向け情報サービス。 Genetic Science Learning Center(ユタ大学) 基礎遺伝学、遺伝性疾患、社会遺伝学、およびいくつかのテーマ単位に関する情報。 Genetic Testing for Inherited Cancer Susceptibility Syndromes (NCI) 遺伝性がんリスクに対する遺伝子検査について、検査の種類、検査を検討すべき人、検査結果について理解する方法、ある個人の検査結果を利用できる人物などの情報が記載されたファクトシート。自宅用または消費者向けの遺伝子検査に関する情報も掲載されている。 Genetics Education Center 教育者向けの教材。 Genetics Home Reference(米国国立医学図書館) 遺伝学的状態、およびその状態の原因となっている遺伝子または染色体に関する消費者向けの情報。 Talking Glossary of Genetics Terms(NHGRI) 遺伝学に関係する200を超える用語の定義と遺伝学用語の知識を判定するクイズを収録。多くの用語には、画像、アニメおよび遺伝学分野の専門家による解説文も付けられている。 表5.倫理的、法的、および社会的意味合い;政策;および法規の情報 資源 説明 bioethics.net 遺伝学および生命倫理関連記事へのリンク。 DNA Patent Database 米国特許商標局により公表されたDNAに関する特許および特許申請の検索データベース。 Ethical, Legal, and Social Issues(米国エネルギー省) 広範な遺伝学問題に関する情報、記事、リンク。 2008年遺伝情報差別禁止法(GINA)(米国立ヒトゲノム研究所[NHGRI]) 一般向けに遺伝差別およびGINAを記述した情報。 GINA:An Overview(Coalition for Genetic Fairness) 法律制定までの歴史、主な例および定義を含め、GINA(Genetic Information Nondiscrimination Act:遺伝情報差別禁止法)保護制度に関する解説。 Genome Statute and Legislation Database (NHGRI) 遺伝情報のプライバシー/守秘義務;インフォームド・コンセント;保険および雇用差別;遺伝子検査および遺伝カウンセリング;および商業化と特許に関する、州の法律/法令の検索可能なデータベース。 HumGen International ヒト遺伝学の法的、社会的、倫理的側面に関する包括的な国際データベース。 National Information Resource on Ethics and Human Genetics(ジョージタウン大学) 倫理学およびヒト遺伝学に関係する特定の問題に関する文献を対象とした検索エンジン。 National Society of Genetic Counselors Code of Ethics 遺伝カウンセラーの倫理的行為を明らかにし、指導する記述。 Congress.gov(米国議会図書館) 米国法規に関する検索用データベース(現在および過去の米国連邦議会)。 Your Genes, Your Choices:Exploring the Issues Raised by Genetic Research ヒトゲノムプロジェクト、その背景にある科学、および同プロジェクトによって生じる倫理的、法的、社会的問題の解説。 表6.家族歴ツール 資源 説明 Family Health History(Genetic Alliance) 家族歴情報収集のためのヒントとその情報源へのリンク。 Family Health History(疾病予防管理センター) 健康増進を目的とした家族歴使用に特化したウェブサイト。ウェブサイトには、ウェブベースの家族歴ツールであるMy Family Health Portraitへのリンクが含まれている。 Family History Resources (National Society of Genetic Counselors) 家族の病歴収集に関する情報。 Family Medical History(米国医師会) 家族歴情報の収集のためのツールとその提供元へのリンク。 表7.ゲノム研究情報 資源 説明 UCSC = カリフォルニア大学、サンタクルーズ。 Chromosomal Variation in Man 染色体の多様体および異常に関する文献引用の検索データベース。 Ensembl(Joint software project between the European Bioinformatics Institute and the Wellcome Trust Sanger Institute) ゲノム解析およびアノテーションの自動プロセスから得られたデータセット。 International Cancer Genome Consortium Data Portal 13のがんの種類およびサブタイプの3,500超の腫瘍ゲノムで構成された25以上のがんプロジェクトから得られたゲノムデータの収集物。ほとんどのデータがオープンアクセスで利用できる。 Leiden Open Variation Database 遺伝子中心の収集およびDNA変異の表示のためのフレキシブルでフリーなツール。 KMcancerDB がん関連遺伝子の分子情報の画像を伴うヒト病原性多様体に関するデータベース。 National Center for Biotechnology Information:Genomic Biology 染色体、マップ、遺伝子座位に関する視覚的情報;他のNCBI情報資源へのリンク。 Online Mendelian Inheritance in Man(OMIM) ヒトの遺伝子および遺伝学的障害のカタログ。 UCSC Genome Bioinformatics ヒトおよびC. elegansゲノムの参照配列、ならびにマウス、ラット、フグ、ショウジョウバエ、 C. briggsae、酵母、およびSARSゲノムの作業草案。 表8.医療専門家向け医療および遺伝学教育情報 資源 説明 Centre for Genetics Education 患者および専門家向けの教育およびサービス資源。 DNA Learning Center さまざまな教育資源、DNA研究に関するインタラクティブな年表など。 Essentials of Genetic and Genomic Nursing:Competencies, Curricula Guidelines, and Outcome Indicators, 2nd edition 遺伝学およびゲノム学に特化した優れた看護ケアを提供する看護職に必要な最低限の基礎技能の定義。 Genetics Education Center ヒト遺伝学やヒトゲノムプロジェクトに関心がある教育者向けのオンラインセンター。 Genetics Education Program for Nurses(GEPN) 遺伝看護師課程の講義概要のサンプル、その他の看護師向けの遺伝学教育の機会および資源。 Genetics/Genomics Competency Center (G2C2) 遺伝カウンセラー、看護師、薬剤師、医師助手、医師のための遺伝学/ゲノム学教育用リソースリポジトリ。 Genetics in Primary Care 訓練プログラムのカリキュラム教材。 Genetics Toolkit(米国臨床腫瘍学会) 遺伝性がんリスク評価を統合して医療行為に移すことで腫瘍学専門家を支援するまとまったツールおよびリソース。 Genetics Toolkit(Society of Gynecologic Oncology) 婦人科がんにおける遺伝学の役割について、医療従事者と患者が直面する共通の問題と課題を説明する一連の症例研究。このリソースは、Society of Gynecologic Oncology、Society of Gynecologic Oncology、Bright Pink、Facing Our Risk of Cancer Empowered(FORCE)の協力によって展開されました。 Genomic Applications in Practice and Prevention Network(GAPPNet) 遺伝子検査、技術および家族歴などの検証された有用なゲノムの知識および応用に関して、有効な責任ある利用を加速させ効率を上げるために、利害関係者を集めて臨床診療および公衆衛生業務に参加させることを目指す共同イニシアチブである。 Medical School Core Curriculum in Genetics Association of Professors of Human and Medical Geneticsと米国人類遺伝学会により開発された遺伝学カリキュラムにおける、医学学習課程で身に付けるべき能力、技能、知識、行動。 National Genetics and Genomics Education Centre 遺伝学教育の機会および資源の作成、提供、評価。 表9.施設審査委員会(IRB) 資源 説明 Genetic Testing and Screening in the Age of Genomic Medicine.New York State Task Force on Life and the Law. 箇条書き形式の総合的および州ごとの情報が扱われている。 Pharmacogenetics:Ethical Issues.Nuffield Council on Bioethics. 臨床試験における薬理遺伝学の利用を議論したセクションなど。 Human Subjects Research in Genomics (National Human Genome Research Institute [NHGRI]) 今日もIRB研究者や政策決定者を悩ませ続けている数多くの問題が議論されている。 表10.専門家機関:遺伝学 資源 説明 American Board of Genetic Counseling(ABGC) 遺伝カウンセラーの認定に関する情報。 American Board of Medical Genetics and Genomics (ABMGG) 遺伝医学の訓練プログラムおよび遺伝医の認定に関する情報。 米国臨床遺伝学会(ACMG) 遺伝医学に関する資源、政策要綱、診療ガイドライン。 米国人類遺伝学会(ASHG) ヒト遺伝学に関する資源、プロジェクト、政策。 Genetics Society of America(GSA) 遺伝学に関する教育ウェブサイト、一般教育コース、専門誌および出版物へのリンク。 International Society of Nurses in Genetics(ISONG) ヒト遺伝学の知識を医療行為、教育、研究に役立てるための看護師向け資源。 National Society of Genetic Counselors(NSGC) 遺伝カウンセリングに関する情報:診療行為ガイドライン、遺伝カウンセラーへのリンク、遺伝差別に関する資源。 表11.リスク評価情報 資源 説明 Breast Cancer Genetics Referral Screening Tool(B-RST) 家族歴のために遺伝性乳がんおよび卵巣がんのリスクが高い可能性のある人を特定するために役立つスクリーニングツール。[ 1 ][ 2 ] Breast Cancer Risk Assessment Tool (米国国立がん研究所[NCI]) 女性の浸潤性乳がん発症リスクを推定するためのインタラクティブツール。 Colorectal Cancer Risk Assessment Tool(NCI) 50~85歳の非ヒスパニック系男女の大腸がん発症リスクを推定するためのインタラクティブツール。 Family HealthLink(オハイオ州立大学医療センター) 家系内のがん発生パターンからがんのリスクを推定するためのインタラクティブツール。 Melanoma Risk Assessment Tool(NCI) 個人の黒色腫発症の絶対リスクを推定するためのインタラクティブツール。 表12.オンライン病原性多様体予測プログラム 資源 説明 MMR = ミスマッチ修復、MRC = 英国医学研究審議会。 MRC Human Genetics Unit, Edinburgh 結腸がん患者でミスマッチ修復遺伝子1つに病原性多様体がある可能性を予測。 The Penn II Risk Model 個人がBRCA1またはBRCA2病原性多様体を有している確率を推定。 PREMM5 Model:Prediction Model for MLH1, MSH2, MSH6, PMS2, and EPCAM Pathogenic Variants 個人がMLH1、MSH2、MSH6、PMS2、またはEPCAM遺伝子の1つに関し病原性多様体のキャリアである確率を推定。このモデルは、PREMM(1,2,6)モデルの後継となる。 表13.遺伝学およびゲノム学に特化した検索エンジン 資源 説明 GWAS = ゲノムワイド関連解析;HuGE = ヒトゲノム疫学; SNP = 一塩基多型。 Catalog of Published Genome-Wide Association Studies 発表済みのゲノムワイド関連解析から作成されたSNP-形質関連のオンラインカタログであり、形質/疾患関連SNPのゲノム特性の調査に用いられる。 HuGE Navigator 遺伝的関連とヒトゲノム疫学についての統合ナレッジベース(検索可能)。 National Information Resource on Ethics and Human Genetics(ジョージタウン大学) 倫理学およびヒト遺伝学に関係する特定の問題に関する文献を対象とした検索エンジン。 表14.米国政府機関 資源 説明 Centers for Disease Control and Prevention Office of Public Health Genomics ヒトゲノムに関する発見が健康改善や疾病予防にどのように利用可能なのかについての情報、多数の資源へのリンクも含まれる。 National Cancer Institute がん遺伝学関連情報の要約。 National Human Genome Research Institute 遺伝性のまれな疾患に関する、研究、政策、倫理、教育、および訓練の情報と資源。 U.S. Department of Energy Office of Science ゲノム学の教育資源。 参考文献- Bellcross CA, Lemke AA, Pape LS, et al.: Evaluation of a breast/ovarian cancer genetics referral screening tool in a mammography population. Genet Med 11 (11): 783-9, 2009.[PUBMED Abstract]
- Bellcross C: Further development and evaluation of a breast/ovarian cancer genetics referral screening tool. Genet Med 12 (4): 240, 2010.[PUBMED Abstract]
- 本要約の変更点(07/24/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Cancer Genetics Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、がん遺伝学について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Cancer Genetics Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Cancer Genetics Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Cancer Genetics Editorial Board.PDQ Cancer Genetics Overview.Bethesda, MD:National Cancer Institute.Updated <MM/DD/YYYY>.Available at:https://www.cancer.gov/about-cancer/causes-prevention/genetics/overview-pdq.Accessed <MM/DD/YYYY>.[PMID:26389204]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
これらの要約内の情報は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する