CONTENTS
- メルケル細胞がんに関する一般情報
-
メルケル細胞がん(MCC)は1972年にTokerにより、皮膚の索状性がんとして最初に記述された。[ 1 ]他の呼称としては、Toker腫瘍、皮膚の原発性小細胞がん、原発性皮膚神経内分泌腫瘍、悪性毛盤腫などがある。[ 2 ]
MCCは、真皮表皮接合部に発生する侵攻性の神経内分泌がんであり(図1を参照のこと)、MCCは黒色腫に次いで皮膚がんによる死因の第二位となっている。[ 3 ][ 4 ]メルケル細胞の正確な起源および機能は依然として研究段階にあるが、上皮と神経内分泌の両方の起源の特徴をもち、触覚感度機能(機械受容器)を有する細胞に発生すると考えられている。[ 5 ][ 6 ][ 7 ][ 8 ][ 9 ][ 10 ][ 11 ]
進行疾患を有する患者に対する治療法の選択肢は歴史的に限られている;しかしながら、新たな免疫療法アプローチは持続的反応に関連している。[ 12 ]
疫学/病因
1986年から2001年のSurveillance, Epidemiology, and End Results(SEER)Programのデータにおいて、年齢で調整した米国のMCC年間発生率は、10万人当たり0.15から0.44(8.08%/年の増加)へと3倍になった。この増加速度は黒色腫を含む他のどの皮膚がんよりも速いが、米国における年間絶対症例数は少ない。2007年の米国におけるMCCの新規症例数は約1,500例と予想された。[ 13 ][ 14 ][ 15 ][ 16 ][ 17 ][ 18 ]
発生率および死亡率
MCCの発生率は年齢とともに累進的に増加する。50歳未満の患者はほとんどなく、診断時年齢中央値は約65歳である(図2を参照のこと)。[ 14 ]発生率は黒人よりも白人においてかなり高く、女性よりも男性の方がわずかに高い。[ 13 ][ 14 ][ 15 ][ 16 ][ 18 ]
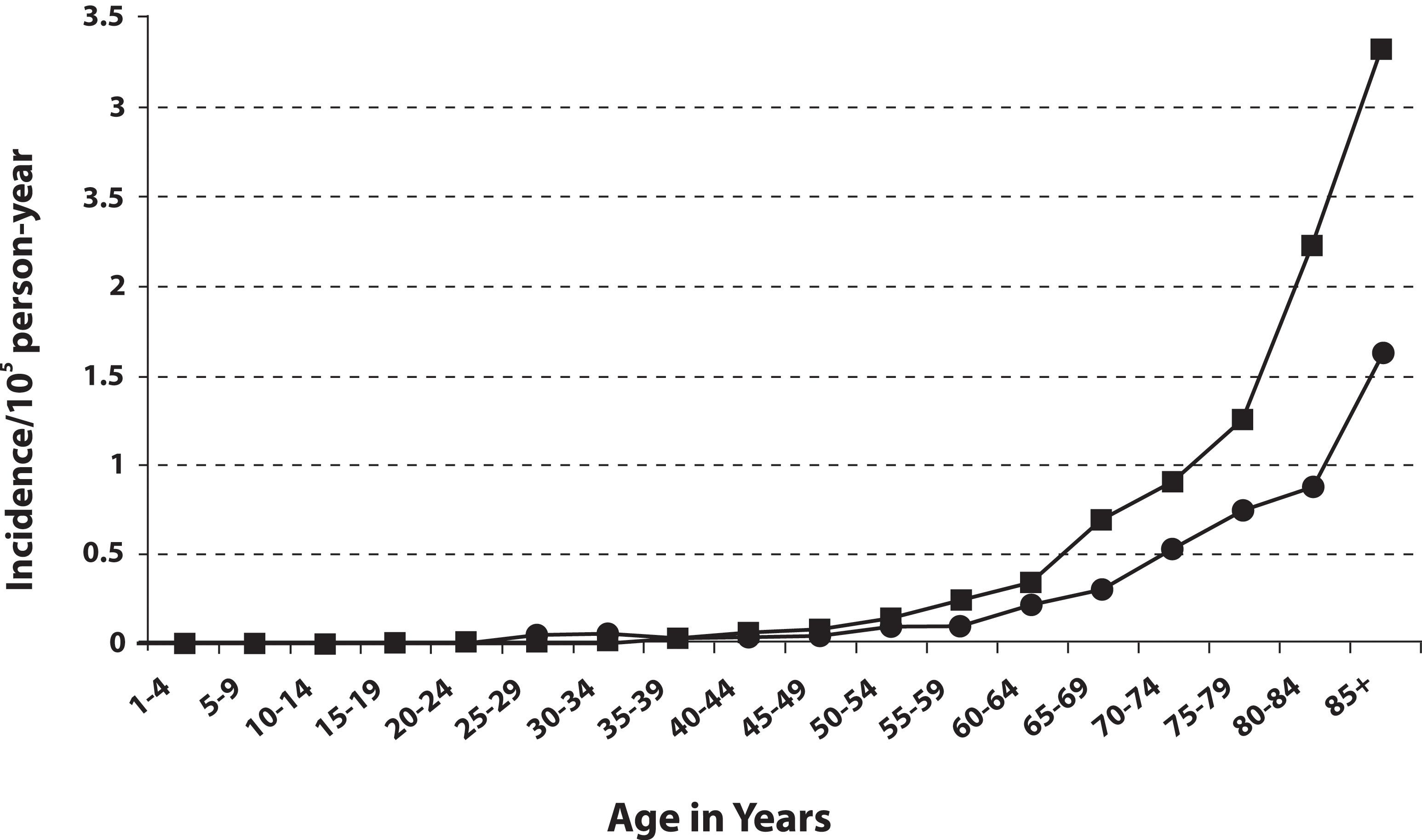
図2.年齢および男性(■)と女性(●)別のMCCの頻度。Reprinted from Journal of the American Academy of Dermatology, 49 (5), Agelli M and Clegg L, Epidemiology of primary Merkel cell carcinoma in the United States, pp.832-41, Copyright (2003), with permission from Elsevier. MCCは皮膚が日光曝露を受ける部位、特に頭頸部に最も頻繁に起こり、続いて四肢、体幹の順に好発する。[ 5 ][ 16 ][ 19 ]発生率は、紫外線B波の強い地域でより高いことが報告されている。[ 16 ]
2013年の時点で、米国におけるMCCの年間発生率は10万人当たり0.7であった。[ 20 ]発生率は過去数十年間にわたって増加しており、米国における発生率は2000年から2013年の間にほぼ倍増した。この増加はより正確な病理学的診断ツール、MCCの臨床認識の向上、老年人口、感受性が高い集団における日光曝露の増加、および登録ツールの改善に関係している可能性がある。発生率はまた、免疫抑制集団(HIV、血液悪性腫瘍、免疫抑制薬など)で比較的高い。[ 21 ]米国では、2000年以降、約25,000例のMCCが記録されており、これには、2014年にNational Program of Cancer Registries/SEERを統合した登録(米国人集団の98%以上をカバーし、MCCの最も一般的な10の部位が記録されている;表1を参照のこと)に報告された2,200例以上の発生症例が含まれる。[ 18 ]
表1.メルケル細胞がんの上位10位までの好発部位、(SEER 1973-2006)a 解剖学的部位 症例数(%) NOS = 他に特定されない;SEER = Surveillance, Epidemiology, and End Results Program。 aAlbores-Saavedra J et al: Merkel cell carcinoma demographics, morphology, and survival based on 3,870 cases: A population-based study.J Cutan Pathol.Reprinted with permission © 2009. Published by Wiley-Blackwell.All rights reserved.[ 18 ] 皮膚、顔 1,041 (26.9) 上肢および肩部の皮膚 853 (22.0) 下肢および殿部の皮膚 578 (14.9) 体幹の皮膚 410 (10.6) 頭皮および頸部の皮膚 348 (9.0) 皮膚、NOS 234 (6.0) 外耳 120 (3.1) 眼瞼 98 (2.5) 口唇の皮膚 91 (2.4) 原発部位不明 31 (0.8) 合計 3,804 (98.3) さまざまなケースシリーズにおいて、MCCの97%までが皮膚に発生する。原発部位不明のMCCと同様に、他の部位の原発腫瘍は非常にまれであった。[ 18 ]
SEER登録データによると、いくつかの原発がんを有する患者で、MCCが初発がんまたは二次がんとして発生するリスクが過度に高いことが示されている。[ 22 ]北欧3ヵ国の全国がん登録では、MCCの後に、さまざまな二次がんが診断されたことが確認されている。[ 23 ]
発生機序
MCC発生率の増加はまた、乾癬に対してメトキサレン(ソラレン)および長波長紫外線(PUVA)による治療が多用された患者(患者1,380人中3人、0.2%)、および特に慢性リンパ性白血病、ヒト免疫不全ウイルス、以前の固形臓器移植による慢性的な免疫抑制患者でもみられる。[ 16 ][ 24 ]
2008年、MCC腫瘍標本から新たなポリオーマウイルス(メルケル細胞ポリオーマウイルス、[MCPyV])が初めて報告され[ 25 ]、この所見は後に他の研究室で確認された。[ 26 ][ 27 ][ 28 ]ある種のウイルス抗原のMCC細胞内発現および抗ウイルス抗体の存在とともに、高レベルのウイルスDNAおよびMCC腫瘍内のウイルスのクローン組み込みも報告されている。[ 29 ]MCCのすべての症例がMCPyV感染に関連しているわけではないと考えられている。[ 30 ]
MCPyVはMCC原発腫瘍から離れた正常な皮膚、MCC以外の皮膚障害を有するかなりの割合の患者、健康な個人の見かけは正常な皮膚、および免疫抑制患者における黒色腫以外の皮膚がんにおいて、非常に低レベルで検出されている。[ 10 ][ 31 ][ 32 ][ 33 ]MCC腫瘍標本の他、非MCC腫瘍、血液、尿、および他の組織でMCPyVの存在を同定し、定量化するために、さまざまな手法が用いられている。[ 34 ][ 35 ]
新たなMCPyV発見の意義は依然として明らかではない。ウイルス量および抗体力価レベルの予後的意義、ならびに宿主の基礎にある(疾患および投薬による)免疫抑制の役割については、調査段階にある。
オーストラリアと対比して、米国および欧州のMCC患者では、MCPyVの有病率が異なると考えられる。MCCの発生には2つの独立した経路がある:1つは、MCPyVの存在により起動する経路で、もう1つは、特にオーストラリアの患者シリーズで認められたように、主に日焼けによる損傷によって起動する経路である。[ 26 ][ 30 ][ 36 ]
MCCに固有のマーカーは同定されていないが、さまざまな分子マーカーおよび細胞遺伝学的マーカーが報告されている。[ 7 ][ 10 ][ 17 ]
臨床像
MCCは、通常は淡紅色から濃紫色の無痛性硬結性孤立真皮内結節で、潰瘍を呈することはめったにない。MCCは皮膚リンパ管から局所に浸潤し、その結果、多発性の衛星病変を引き起こしうる。その非特異的な臨床的外観のために、MCCが生検実施前に疑われることはめったにない。[ 5 ]MCCの皮膚病変の写真は臨床的多様性を写し出す。[ 37 ]
以下のようなMCCの典型的な臨床的特徴をまとめた記憶法[ 19 ]が提唱されている:
すべての患者がこの記憶法のすべての要素を有するわけではない;しかしながら、この研究では89%の患者が3つ以上の基準を満たし、52%が4つ以上の基準を満たし、7%が5つすべての基準を満たした。[ 19 ]
初期臨床評価
局所領域進展が一般的であるため、MCCを新たに診断された患者には、衛星病変および所属リンパ節転移がないか探すなど注意深い臨床診察が必要である。
画像診断による精密検査は、臨床像のほか、関連するあらゆる徴候および症状に合わせるように検討すべきである。新たに診断された患者に対する最適な画像診断による精密検査について検討した系統的研究はなく、新たに診断されたすべての患者、特に原発腫瘍が最も小さい患者で詳細な画像診断による精密検査により便益が得られるかどうかは不明である。
画像診断による精密検査を実施する場合には、原発性小細胞肺がんのほか、遠隔転移および所属リンパ節転移を除外するため胸部および腹部のコンピュータ断層撮影(CT)スキャンが含まれる。疑わしい徴候および症状を評価するためにデザインされた画像検査も推奨される。1件のシリーズにおいて、CTスキャンは所属リンパ節転移に対する偽陰性率が80%であった。[ 38 ]頭頸部の症状には追加の画像検査が必要であろう。MCCの評価には磁気共鳴画像法が用いられているが、系統的に研究されていない。[ 39 ]フッ素18-フルデオキシグルコースポジトロン放射断層撮影の結果が選択された症例においてのみ報告されている。[ 40 ][ 41 ]ベースライン時のルーチンの血液検査が推奨されているが、系統的に研究されていない。MCCに特異的な既知の循環血液中の腫瘍マーカーは存在しない。
初回病期分類の結果
MCCの初回臨床病期分類の結果は、過去数十年で報告されたレトロスペクティブ・ケースシリーズに基づく文献では大きな差がある。浸潤がんについては、48.6%が限局性で、31.1%が領域性で、8.2%が遠隔性であった。[ 18 ]
同定可能な原発巣がみられない所属リンパ節に生じるMCCが少数の患者においてみられ、これらの症例の割合は報告される研究で異なっている。同定可能な原発巣がみられない腫瘍は、臨床的に潜伏性の部位の原発性または転移性神経内分泌がんの自然退縮が原因とされている。[ 8 ][ 18 ][ 19 ][ 42 ][ 43 ]
臨床的進行
18件のケースシリーズの患者をレビューしたところ、遠隔転移疾患を発症した患者を除いて、患者926人中279人(30.1%)が追跡期間中に局所再発を来した。これらのイベントは典型的に外科的切除断端が不十分であったことおよび/または補助放射線療法の不実施が原因とされている。さらに、患者982人中545人(55.5%)には診断時または追跡期間中にリンパ節転移がみられた。[ 8 ]
18件のケースシリーズの同じレビューにおいて、遠隔転移の最も一般的な部位は遠隔リンパ節(60.1%)、離れた皮膚(30.3%)、肺(23.4%)、中枢神経系(18.4%)、および骨(15.2%)であった。[ 8 ]他の部位も多数報告されており、転移部位の分布はケースシリーズによって差がある。
局所または領域病変を呈する患者237人の1件のシリーズにおいて、再発までの期間中央値は9ヵ月であった(範囲、2~70ヵ月)。再発の91%は診断から2年以内に起こった。[ 44 ]
考えられる予後因子
提示時の腫瘍の進展度は、予後を推定するのに最も有用なようである。[ 7 ]
センチネルリンパ節生検などの診断手順は、提示時の局所病変と領域病変を識別するのに役立つと考えられる。臨床的に触知可能なまたは放射線診断的に可視のリンパ節がみられない患者の1/3は、顕微鏡的に明らかな領域病変を有する。[ 38 ]おそらく、腫瘍が小さい患者(例、1.0cm以下)のリンパ節が陽性である可能性はかなり低いであろう。[ 45 ]
多くのレトロスペクティブ研究で、種々多様な生物学的および組織学的因子と生存率および局所領域制御率との関係が評価されている。[ 7 ][ 8 ][ 18 ][ 38 ][ 44 ][ 46 ][ 47 ][ 48 ][ 49 ][ 50 ][ 51 ][ 52 ][ 53 ][ 54 ][ 55 ][ 56 ][ 57 ][証拠レベル:3iiiDiii]これらの報告の多くは、少数の患者、潜在的な選択バイアス、紹介バイアス、短い追跡期間、病期分類および治療の両方に対する統一された臨床プロトコルの欠如により交絡が生じており、わずかな差をみるには検出力不足である。
MCC患者156人を対象とし、追跡期間中央値51ヵ月(範囲、2~224ヵ月)の大規模単一施設レトロスペクティブ研究により、潜在的に予後と関連のある組織学的因子が評価された。[ 55 ][証拠レベル:3iiiB]この報告は潜在的な選択および紹介バイアスによる影響を受けている可能性があるが、単変量および多変量解析はいずれも原因特異的生存率の改善と、浸潤パターンよりも限局性の増殖パターン、深い腫瘍深達度よりも浅い腫瘍深達度、リンパ血管性浸潤の存在よりもリンパ血管性浸潤の欠如との関連を証明した。これらの知見を包括的な予後アルゴリズムに採用するには、十分な検出力をもたせた研究による独立した確認を待たなければならない。
2009年の1件の研究により、MCCのフィンランド人患者114人においてMCC腫瘍標本中に新たに同定されたMCPyVの存在が臨床転帰に影響するかどうかが調査された。この小規模研究において、腫瘍がMCPyV陽性の患者では、MCPyV陰性の患者よりも生存率が良好なようであった。[ 58 ][証拠レベル:3iiiDiii]予後的かつ疫学的な問題の理解を深めるには、MCPyVおよび関連抗体を同定し定量化する手法の標準化が必要である。[ 10 ]
予後
MCCに対する最も重要な予後パラメータには、腫瘍サイズおよび局所領域転移または遠隔転移の存在が挙げられる。これらの因子は、MCCに対する米国がん合同委員会の病期分類システムの基礎を形成している。[ 59 ][ 60 ]原発腫瘍サイズの増大は転移性疾患のリスク増加に相関するが、MCC腫瘍はいかなるサイズでも潜伏性転移のリスクがかなり高いことから、すべての症例に対してセンチネルリンパ節生検の利用が支持される。[ 61 ]リンパ血管性浸潤および腫瘍の増殖パターンなど、原発腫瘍の追加の特徴もまた予後的意義を有する可能性がある。臨床的に検知可能なリンパ節病変は、顕微鏡的転移よりも転帰不良である。[ 55 ][ 59 ]予後不良に関連する他の所見としては、リンパ節転移におけるシート状病変および転移リンパ節の数が多いことが挙げられる。[ 60 ][ 62 ]
MCCの文献の大部分は小規模なケースシリーズからのものであり、こうしたケースシリーズは多くの交絡因子の影響を受ける。(詳しい情報については、本要約の考えられる予後因子のセクションを参照のこと。)このため、病期ごとに報告される再燃率および生存率は文献によって大きな差がある。全般に、病期が低い疾患の全生存率はより良好である。[ 63 ]
1件の報告において、容積の小さい局所病変を呈し、リンパ節転移陰性が病理学的に確認された患者の治療成績は、原因特異的5年生存率が90%を超えることが報告されている。[ 44 ][ 55 ][証拠レベル:3iiiDiii]
12件のシリーズからMCCの治療結果を表にした要約から、シリーズ間の治療成績データの比較の難しさが示されている。[ 7 ]
1973年に採用されたSEER Program登録MCC病期分類システムを用いて、MCCの病期ごとの生存率データ(1973~2006年)を以下にまとめる:[ 18 ]
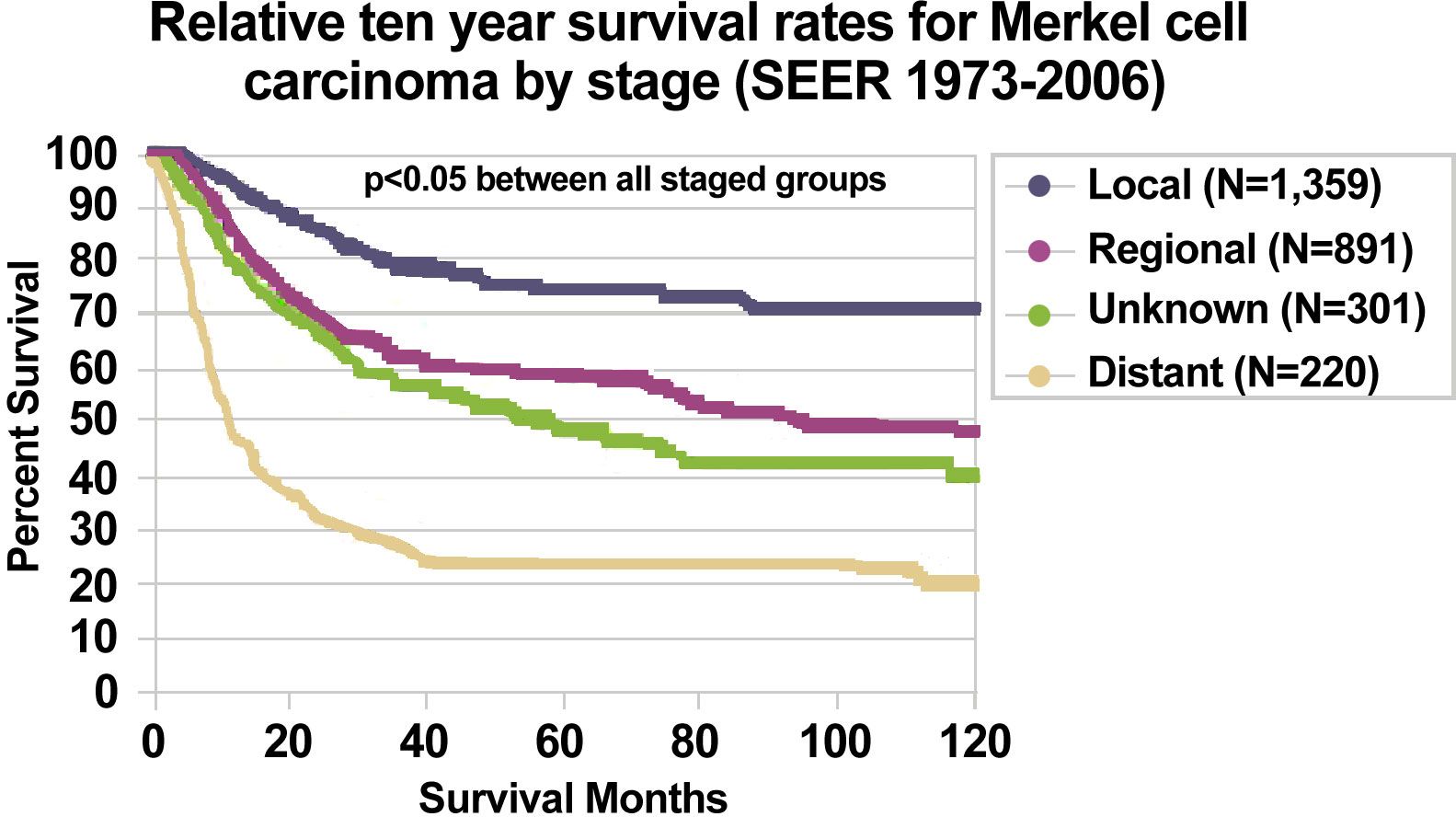
図3.メルケル細胞がんに対する病期ごとの10年相対生存率(SEER 1973-2006)。Albores-Saavedra J et al: Merkel cell carcinoma demographics, morphology, and survival based on 3,870 cases: A population-based study.J Cutan Pathol.Reprinted with permission © 2009. Published by Wiley-Blackwell.All rights reserved. 参考文献- Toker C: Trabecular carcinoma of the skin. Arch Dermatol 105 (1): 107-10, 1972.[PUBMED Abstract]
- Schwartz RA, Lambert WC: The Merkel cell carcinoma: a 50-year retrospect. J Surg Oncol 89 (1): 5, 2005.[PUBMED Abstract]
- Agelli M, Clegg LX, Becker JC, et al.: The etiology and epidemiology of merkel cell carcinoma. Curr Probl Cancer 34 (1): 14-37, 2010 Jan-Feb.[PUBMED Abstract]
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017.[PUBMED Abstract]
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. Hamilton, Ontario: BC Decker Inc., 2001, pp 127-141.[PUBMED Abstract]
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. New York, NY: McGraw-Hill , 2008, pp 1087-94.[PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.[PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.[PUBMED Abstract]
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.[PUBMED Abstract]
- Rockville Merkel Cell Carcinoma Group: Merkel cell carcinoma: recent progress and current priorities on etiology, pathogenesis, and clinical management. J Clin Oncol 27 (24): 4021-6, 2009.[PUBMED Abstract]
- Calder KB, Smoller BR: New insights into merkel cell carcinoma. Adv Anat Pathol 17 (3): 155-61, 2010.[PUBMED Abstract]
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016.[PUBMED Abstract]
- Hodgson NC: Merkel cell carcinoma: changing incidence trends. J Surg Oncol 89 (1): 1-4, 2005.[PUBMED Abstract]
- Agelli M, Clegg LX: Epidemiology of primary Merkel cell carcinoma in the United States. J Am Acad Dermatol 49 (5): 832-41, 2003.[PUBMED Abstract]
- Young JL, Ward KC, Ries LAG: Cancer of rare sites. In: Ries LAG, Young JL, Keel GE, et al., eds.: SEER Survival Monograph: Cancer Survival Among Adults: U. S. SEER Program, 1988-2001, Patient and Tumor Characteristics. Bethesda, MD: National Cancer Institute, 2007. NIH Pub. No. 07-6215, pp 251-61.[PUBMED Abstract]
- Miller RW, Rabkin CS: Merkel cell carcinoma and melanoma: etiological similarities and differences. Cancer Epidemiol Biomarkers Prev 8 (2): 153-8, 1999.[PUBMED Abstract]
- Lemos B, Nghiem P: Merkel cell carcinoma: more deaths but still no pathway to blame. J Invest Dermatol 127 (9): 2100-3, 2007.[PUBMED Abstract]
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010.[PUBMED Abstract]
- Heath M, Jaimes N, Lemos B, et al.: Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. J Am Acad Dermatol 58 (3): 375-81, 2008.[PUBMED Abstract]
- Paulson KG, Park SY, Vandeven NA, et al.: Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. J Am Acad Dermatol 78 (3): 457-463.e2, 2018.[PUBMED Abstract]
- Ma JE, Brewer JD: Merkel cell carcinoma in immunosuppressed patients. Cancers (Basel) 6 (3): 1328-50, 2014.[PUBMED Abstract]
- Howard RA, Dores GM, Curtis RE, et al.: Merkel cell carcinoma and multiple primary cancers. Cancer Epidemiol Biomarkers Prev 15 (8): 1545-9, 2006.[PUBMED Abstract]
- Bzhalava D, Bray F, Storm H, et al.: Risk of second cancers after the diagnosis of Merkel cell carcinoma in Scandinavia. Br J Cancer 104 (1): 178-80, 2011.[PUBMED Abstract]
- Lunder EJ, Stern RS: Merkel-cell carcinomas in patients treated with methoxsalen and ultraviolet A radiation. N Engl J Med 339 (17): 1247-8, 1998.[PUBMED Abstract]
- Feng H, Shuda M, Chang Y, et al.: Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 319 (5866): 1096-100, 2008.[PUBMED Abstract]
- Garneski KM, Warcola AH, Feng Q, et al.: Merkel cell polyomavirus is more frequently present in North American than Australian Merkel cell carcinoma tumors. J Invest Dermatol 129 (1): 246-8, 2009.[PUBMED Abstract]
- Becker JC, Houben R, Ugurel S, et al.: MC polyomavirus is frequently present in Merkel cell carcinoma of European patients. J Invest Dermatol 129 (1): 248-50, 2009.[PUBMED Abstract]
- Kassem A, Schöpflin A, Diaz C, et al.: Frequent detection of Merkel cell polyomavirus in human Merkel cell carcinomas and identification of a unique deletion in the VP1 gene. Cancer Res 68 (13): 5009-13, 2008.[PUBMED Abstract]
- Houben R, Schrama D, Becker JC: Molecular pathogenesis of Merkel cell carcinoma. Exp Dermatol 18 (3): 193-8, 2009.[PUBMED Abstract]
- Paik JY, Hall G, Clarkson A, et al.: Immunohistochemistry for Merkel cell polyomavirus is highly specific but not sensitive for the diagnosis of Merkel cell carcinoma in the Australian population. Hum Pathol 42 (10): 1385-90, 2011.[PUBMED Abstract]
- Andres C, Belloni B, Puchta U, et al.: Prevalence of MCPyV in Merkel cell carcinoma and non-MCC tumors. J Cutan Pathol 37 (1): 28-34, 2010.[PUBMED Abstract]
- Kassem A, Technau K, Kurz AK, et al.: Merkel cell polyomavirus sequences are frequently detected in nonmelanoma skin cancer of immunosuppressed patients. Int J Cancer 125 (2): 356-61, 2009.[PUBMED Abstract]
- Foulongne V, Dereure O, Kluger N, et al.: Merkel cell polyomavirus DNA detection in lesional and nonlesional skin from patients with Merkel cell carcinoma or other skin diseases. Br J Dermatol 162 (1): 59-63, 2010.[PUBMED Abstract]
- DeCaprio JA: Does detection of Merkel cell polyomavirus in Merkel cell carcinoma provide prognostic information? J Natl Cancer Inst 101 (13): 905-7, 2009.[PUBMED Abstract]
- Laude HC, Jonchère B, Maubec E, et al.: Distinct merkel cell polyomavirus molecular features in tumour and non tumour specimens from patients with merkel cell carcinoma. PLoS Pathog 6 (8): , 2010.[PUBMED Abstract]
- Buck CB, Lowy DR: Immune readouts may have prognostic value for the course of merkel cell carcinoma, a virally associated disease. J Clin Oncol 29 (12): 1506-8, 2011.[PUBMED Abstract]
- Seattle Cancer Care Alliance: Merkel Cell Carcinoma Information for Patients and Their Physicians: Clinical Photos/Images. Seattle, Wa: Seattle Cancer Care Alliance Skin Oncology Clinic, 2009. Available online. Last accessed December 8, 2016, 2016.[PUBMED Abstract]
- Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006.[PUBMED Abstract]
- Anderson SE, Beer KT, Banic A, et al.: MRI of merkel cell carcinoma: histologic correlation and review of the literature. AJR Am J Roentgenol 185 (6): 1441-8, 2005.[PUBMED Abstract]
- Iagaru A, Quon A, McDougall IR, et al.: Merkel cell carcinoma: Is there a role for 2-deoxy-2-[f-18]fluoro-D-glucose-positron emission tomography/computed tomography? Mol Imaging Biol 8 (4): 212-7, 2006 Jul-Aug.[PUBMED Abstract]
- Belhocine T, Pierard GE, Frühling J, et al.: Clinical added-value of 18FDG PET in neuroendocrine-merkel cell carcinoma. Oncol Rep 16 (2): 347-52, 2006.[PUBMED Abstract]
- Missotten GS, de Wolff-Rouendaal D, de Keizer RJ: Merkel cell carcinoma of the eyelid review of the literature and report of patients with Merkel cell carcinoma showing spontaneous regression. Ophthalmology 115 (1): 195-201, 2008.[PUBMED Abstract]
- Richetta AG, Mancini M, Torroni A, et al.: Total spontaneous regression of advanced merkel cell carcinoma after biopsy: review and a new case. Dermatol Surg 34 (6): 815-22, 2008.[PUBMED Abstract]
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.[PUBMED Abstract]
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009.[PUBMED Abstract]
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007.[PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.[PUBMED Abstract]
- Skelton HG, Smith KJ, Hitchcock CL, et al.: Merkel cell carcinoma: analysis of clinical, histologic, and immunohistologic features of 132 cases with relation to survival. J Am Acad Dermatol 37 (5 Pt 1): 734-9, 1997.[PUBMED Abstract]
- Sandel HD 4th, Day T, Richardson MS, et al.: Merkel cell carcinoma: does tumor size or depth of invasion correlate with recurrence, metastasis, or patient survival? Laryngoscope 116 (5): 791-5, 2006.[PUBMED Abstract]
- Llombart B, Monteagudo C, López-Guerrero JA, et al.: Clinicopathological and immunohistochemical analysis of 20 cases of Merkel cell carcinoma in search of prognostic markers. Histopathology 46 (6): 622-34, 2005.[PUBMED Abstract]
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007.[PUBMED Abstract]
- Goldberg SR, Neifeld JP, Frable WJ: Prognostic value of tumor thickness in patients with Merkel cell carcinoma. J Surg Oncol 95 (8): 618-22, 2007.[PUBMED Abstract]
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007.[PUBMED Abstract]
- Tai P: Merkel cell cancer: update on biology and treatment. Curr Opin Oncol 20 (2): 196-200, 2008.[PUBMED Abstract]
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.[PUBMED Abstract]
- Paulson KG, Iyer JG, Tegeder AR, et al.: Transcriptome-wide studies of merkel cell carcinoma and validation of intratumoral CD8+ lymphocyte invasion as an independent predictor of survival. J Clin Oncol 29 (12): 1539-46, 2011.[PUBMED Abstract]
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011.[PUBMED Abstract]
- Sihto H, Kukko H, Koljonen V, et al.: Clinical factors associated with Merkel cell polyomavirus infection in Merkel cell carcinoma. J Natl Cancer Inst 101 (13): 938-45, 2009.[PUBMED Abstract]
- Harms KL, Healy MA, Nghiem P, et al.: Analysis of Prognostic Factors from 9387 Merkel Cell Carcinoma Cases Forms the Basis for the New 8th Edition AJCC Staging System. Ann Surg Oncol 23 (11): 3564-3571, 2016.[PUBMED Abstract]
- Iyer JG, Storer BE, Paulson KG, et al.: Relationships among primary tumor size, number of involved nodes, and survival for 8044 cases of Merkel cell carcinoma. J Am Acad Dermatol 70 (4): 637-643, 2014.[PUBMED Abstract]
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011.[PUBMED Abstract]
- Ko JS, Prieto VG, Elson PJ, et al.: Histological pattern of Merkel cell carcinoma sentinel lymph node metastasis improves stratification of Stage III patients. Mod Pathol 29 (2): 122-30, 2016.[PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: Treatment of merkel cell carcinoma. Am J Clin Oncol 27 (5): 510-5, 2004.[PUBMED Abstract]
- メルケル細胞がんの細胞分類
-
メルケル細胞の正確な起源および機能は依然として研究段階にあるが、上皮と神経内分泌の両方の起源の特徴をもち、触覚感度機能(機械受容器)を有する細胞に発生すると考えられている。[ 1 ][ 2 ][ 3 ][ 4 ]
特徴的な病理組織学的特性としては、電子顕微鏡検査での有芯の細胞質神経分泌顆粒(dense core cytoplasmic neurosecretory granules)および免疫組織化学でのサイトケラチン20が挙げられる(図4を参照のこと)。[ 5 ]
免疫試薬の一覧(図4を参照のこと)は、メルケル細胞がん(MCC)と肺神経内分泌がん(すなわち、小細胞がん)、リンパ腫、末梢性原始神経外胚葉性腫瘍、転移性カルチノイド、小細胞黒色腫など他の外見が類似した腫瘍とを区別するのに役立つ。[ 5 ]
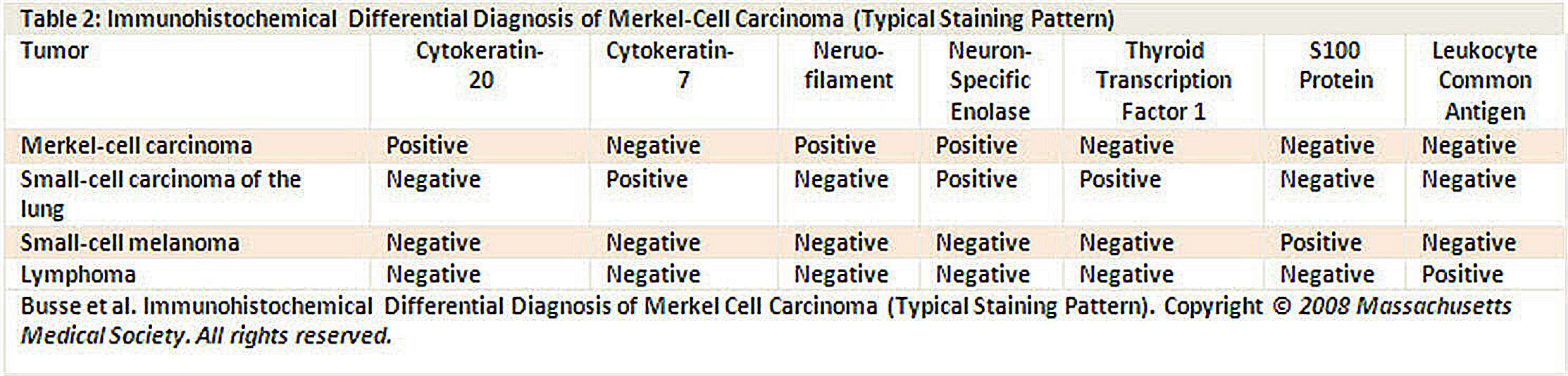
図4.メルケル細胞がんのメルケル-免疫組織化学的鑑別診断(典型的な染色パターン)。 組織学的には、MCCは3つの亜型に分類されている:[ 6 ][ 7 ][ 8 ][ 9 ]
変異体の混合は一般的である。[ 6 ][ 7 ][ 8 ]一部の小規模なレトロスペクティブ・ケースシリーズで特定の組織学的特徴と治療成績との相関が示唆されているが、証拠は不明のままである。[ 10 ][ 11 ][ 12 ]
1つのグループにより、切除された原発巣の病理学の報告書に記述すべき12の要素およびセンチネルリンパ節の病理学の報告書に記述すべき9つの要素の一覧が提案されている。これらの要素の予後的意義はプロスペクティブに妥当性が確認されていない。[ 13 ]
すべてのMCC患者に対して次のデータが記録されれば、どの患者も既存のまたは新たな病期分類システムで病期を決定できる:
皮膚にMCCを有する患者から採取した標本の検査プロトコルをCollege of American Pathologistsが公表している。[ 14 ]
(詳しい情報については、本要約のメルケル細胞がんの病期情報のセクションを参照のこと。)
MCCの組織学的亜型については、図5に示す。[ 15 ]
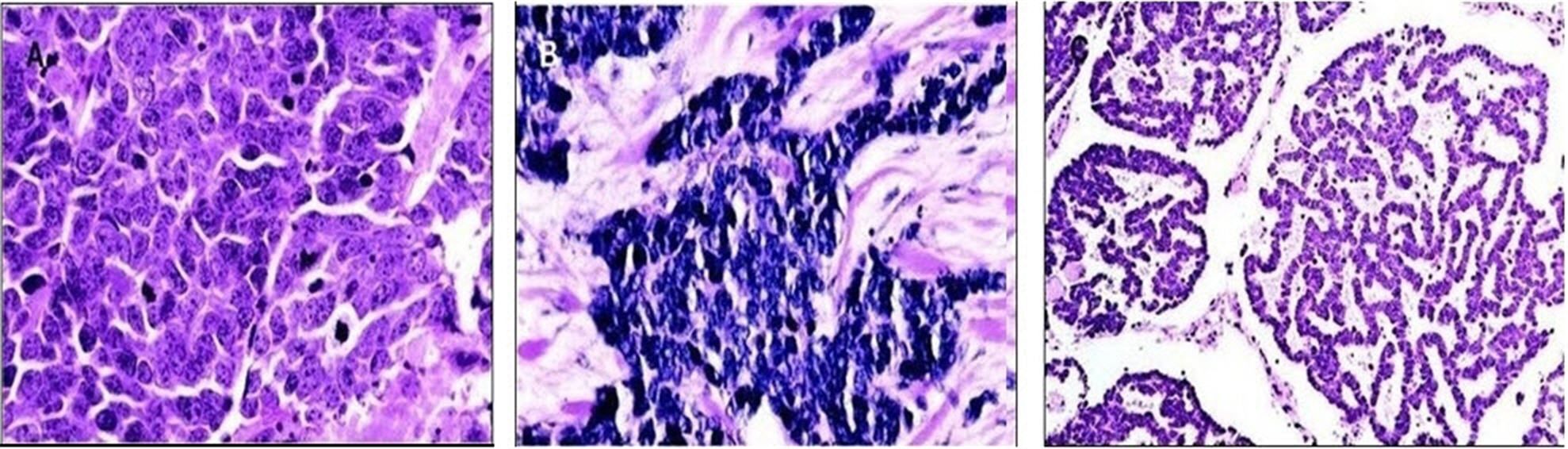
図5.(A)MCCの中間型 顕著な核小体および複数の有糸分裂を伴った小胞性の好塩基性核を示す。(B)小細胞型 気管支小細胞がんと組織学的に区別不能である。(C)索状型 まれで通常は混合型の小さい構成要素としてのみみられる。Goessling W et al: Merkel Cell Carcinoma, J Clin Oncol, 20 (2), pp.588–98. Reprinted with permission.© 2009 American Society of Clinical Oncology.All rights reserved. 参考文献- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. Hamilton, Ontario: BC Decker Inc., 2001, pp 127-141.[PUBMED Abstract]
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 549-62.[PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.[PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.[PUBMED Abstract]
- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.[PUBMED Abstract]
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995.[PUBMED Abstract]
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993.[PUBMED Abstract]
- Gould VE, Moll R, Moll I, et al.: Neuroendocrine (Merkel) cells of the skin: hyperplasias, dysplasias, and neoplasms. Lab Invest 52 (4): 334-53, 1985.[PUBMED Abstract]
- Albores-Saavedra J, Batich K, Chable-Montero F, et al.: Merkel cell carcinoma demographics, morphology, and survival based on 3870 cases: a population based study. J Cutan Pathol 37 (1): 20-7, 2010.[PUBMED Abstract]
- Alam M: Management of Merkel cell carcinoma: What we know. Arch Dermatol 142 (6): 771-4, 2006.[PUBMED Abstract]
- Heath ML, Nghiem P: Merkel cell carcinoma: if no breslow, then what? J Surg Oncol 95 (8): 614-5, 2007.[PUBMED Abstract]
- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.[PUBMED Abstract]
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007.[PUBMED Abstract]
- Rao P, Balzer BL, Lemos BD, et al.: Protocol for the examination of specimens from patients with merkel cell carcinoma of the skin. Arch Pathol Lab Med 134 (3): 341-4, 2010.[PUBMED Abstract]
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.[PUBMED Abstract]
- メルケル細胞がんの病期情報
-
メルケル細胞がん(MCC)の記載については、以前までは5つの競合する病期分類システムを用いた論文が大半を占めていた。
表2.以前用いられていた5つの競合するメルケル細胞がん病期分類システム 最初の著者 発表日 施設 ケースシリーズにおける患者数 症例の日付 MSKCC = Memorial Sloan Kettering Cancer Center;N/A = 該当せず。 aMSKCCシステムは日々進化している。MSKCCの著者らは、256人の患者に関する1件の追加のケースシリーズを発表している。[ 1 ] Yiengpruksawan[ 2 ] 1991 MSKCCa 77 1969–1989 Allen[ 3 ] 1999 MSKCCa 102 1969–1996 Allen[ 4 ] 2005 MSKCCa 250 1970–2002 米国がん合同委員会(American Joint Committee on Cancer)[ 5 ] 2017 N/A N/A Clark[ 6 ] 2007 Westmead Hospital、シドニー、オーストラリア 110 Princess Margaret Hospital/University Health Network、トロント、カナダ Sydney Head and Neck Cancer Institute/Royal Prince Alfred Hospital、シドニー、オーストラリア これらの病期分類システムは互いにほとんど一致していない。実際、III期疾患は進行性局所病変からリンパ節病変、遠隔転移病変に至るあらゆるものを意味する。さらに、使用されているすべてのMCC病期分類システムが300人未満の患者にしか基づいていない。
米国がん合同委員会(AJCC)の病期分類とTNMの定義
これらの問題に対処するため、新たなMCC専用のコンセンサスが得られた病期分類システムがMCCを定義するためAJCCにより開発された。[ 7 ]この新しいシステムの発表以前は、AJCCは非黒色腫病期分類システムの使用を提唱していた。
この病期分類システムを用いて病期分類されるがんには、原発性皮膚神経内分泌がん(MCC)が含まれる。
臨床的病期グループ(cTNM)
表3.0期の臨床的病期グループ(cTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. 0 Tis、N0、M0 Tis = 上皮内(in situ)原発腫瘍。 N0 = 臨床検査および/または放射線検査で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表4.I期の臨床的病期グループ(cTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. I T1、N0、M0 T1 = 臨床的な腫瘍の最大径が2cm以下。 N0 = 臨床検査および/または放射線検査で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表5.IIA期およびIIB期の臨床的病期グループ(cTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. IIA T2-3、N0、M0 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 N0 = 臨床検査および/または放射線検査で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 IIB T4、N0、M0 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 N0 = 臨床検査および/または放射線検査で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表6.III期の臨床的病期グループ(cTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. III T0-4、N1-3、M0 T0 = 原発腫瘍を認めない。 Tis = 上皮内(in situ)原発腫瘍。 T1 = 臨床的な腫瘍の最大径が2cm以下。 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 N1 = 所属リンパ節転移あり。 N2 = リンパ節転移を伴わないin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 N3 = リンパ節転移を伴うin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表7.IV期の臨床的病期グループ(cTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. IV T0-4、すべてのN、M1 T0 = 原発腫瘍を認めない。 Tis = 上皮内(in situ)原発腫瘍。 T1 = 臨床的な腫瘍の最大径が2cm以下。 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 NX = 所属リンパ節の臨床的評価が不可能(例、以前に別の理由で切除されているか、または体型のため)。 N0 = 臨床検査および/または放射線検査で所属リンパ節転移が発見されていない。 N1 = 所属リンパ節転移あり。 N2 = リンパ節転移を伴わないin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 N3 = リンパ節転移を伴うin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 M1 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 病理学的病期グループ(pTNM)
表8.0期の病理学的病期グループ(pTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;p = 病理学的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. 0 Tis、pN0、M0 Tis = 上皮内(in situ)原発腫瘍。 pN0 = 病理学的評価で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表9.I期の病理学的病期グループ(pTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;p = 病理学的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. I T1、pN0、M0 T1 = 臨床的な腫瘍の最大径が2cm以下。 pN0 = 病理学的評価で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表10.IIA期およびIIB期の病理学的病期グループ(pTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;p = 病理学的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. IIA T2-3、pN0、M0 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 pN0 = 病理学的評価で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 IIB T4、pN0、M0 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 pN0 = 病理学的評価で所属リンパ節転移が発見されていない。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表11.IIIA期およびIIIB期の病理学的病期グループ(pTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;p = 病理学的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. IIIA T1-4、pN1a(sn)またはpN1a、M0 T1 = 臨床的な腫瘍の最大径が2cm以下。 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 pN1a(sn) = センチネルリンパ節生検でのみ同定され、臨床的には潜伏性の所属リンパ節転移。 pN1a = リンパ節郭清後に臨床的に潜伏性の所属リンパ節転移。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 T0、pN1b、M0 T0 = 原発腫瘍を認めない。 pN1b = 臨床的および/または放射線学的に発見される所属リンパ節転移で、顕微鏡的に確認される。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 IIIB T1-4、pN1b-3、M0 T1 = 臨床的な腫瘍の最大径が2cm以下。 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 pN1b = 臨床的および/または放射線学的に発見される所属リンパ節転移で、顕微鏡的に確認される。 pN2 = リンパ節転移を伴わないin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 pN3 = リンパ節転移を伴うin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 M0 = 臨床検査および/または放射線検査で遠隔転移が発見されていない。 表12.IV期の病理学的病期グループ(pTNM)の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;p = 病理学的。 aAJCCから許諾を得て転載:Merkel Cell Carcinoma.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.549–62. IV T0-4、すべてのpN、pM1 T0 = 原発腫瘍を認めない。 T1 = 臨床的な腫瘍の最大径が2cm以下。 T2 = 臨床的な腫瘍の最大径が2cmを超えるが5cm以下。 T3 = 臨床的な腫瘍の最大径が5cmを超える。 T4 = 原発腫瘍が筋膜、筋肉、軟骨、または骨に浸潤している。 pNX = 所属リンパ節の評価が不可能(例、以前に別の理由で切除されているか、または病理学的評価目的で切除されていない)。 pN0 = 病理学的評価で所属リンパ節転移が発見されていない。 pN1 = 所属リンパ節転移あり。 -pN1a(sn) = センチネルリンパ節生検でのみ同定され、臨床的には潜伏性の所属リンパ節転移。 -pN1a = リンパ節郭清後に臨床的に潜伏性の所属リンパ節転移。 -pN1b = 臨床的および/または放射線学的に発見される所属リンパ節転移で、顕微鏡的に確認される。 pN2 = リンパ節転移を伴わないin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 pN3 = リンパ節転移を伴うin-transit転移巣(原発巣から連続していない;原発腫瘍と流入領域の所属リンパ節の間、または原発腫瘍より遠位部に位置する)。 pM1 = 顕微鏡的に確認された遠隔転移。 -pM1a = 顕微鏡的に確認された離れた皮膚、離れた皮下組織、または遠隔リンパ節への転移。 -pM1b = 顕微鏡的に確認された肺転移。 pM1c = 顕微鏡的に確認された他のあらゆる遠隔部位への転移。 新たなAJCCのコンセンサスが得られた病期分類システムが発表される以前は、最大規模の患者数に基づき妥当性の確認が最も優れていたため、Memorial Sloan Kettering Cancer Center(MSKCC)による最新の4病期のシステムが支持されていた。[ 1 ]MSKCCシステムにおける病期には以下が含まれていた:
1つのグループにより、切除された原発巣の病理学の報告書に記述すべき12の要素およびセンチネルリンパ節の病理学の報告書に記述すべき9つの要素の一覧が提案されている。これらの要素の予後的意義はプロスペクティブに妥当性が確認されていない。[ 8 ]2009 AJCC病期分類マニュアルでもまた、病理学の報告書でプロスペクティブに収集すべきさまざまな因子が明記されている。
参考文献- Andea AA, Coit DG, Amin B, et al.: Merkel cell carcinoma: histologic features and prognosis. Cancer 113 (9): 2549-58, 2008.[PUBMED Abstract]
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991.[PUBMED Abstract]
- Allen PJ, Zhang ZF, Coit DG: Surgical management of Merkel cell carcinoma. Ann Surg 229 (1): 97-105, 1999.[PUBMED Abstract]
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.[PUBMED Abstract]
- Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017.[PUBMED Abstract]
- Clark JR, Veness MJ, Gilbert R, et al.: Merkel cell carcinoma of the head and neck: is adjuvant radiotherapy necessary? Head Neck 29 (3): 249-57, 2007.[PUBMED Abstract]
- Bichakjian CK, Nghiem P, Johnson T, et al.: Merkel Cell Carcinoma. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 549-62.[PUBMED Abstract]
- Bichakjian CK, Lowe L, Lao CD, et al.: Merkel cell carcinoma: critical review with guidelines for multidisciplinary management. Cancer 110 (1): 1-12, 2007.[PUBMED Abstract]
- 治療法選択肢の概要
-
メルケル細胞がん(MCC)はまれな腫瘍である。文献における臨床管理の推奨事項のほとんどは比較的少数の患者について記述しているケースシリーズに基づいており、こうした患者は正式な臨床試験に登録されておらず、一定の臨床病期分類の手順で評価されておらず、一定の治療プロトコルで治療されておらず、定期的な所定の経過観察が行われていない。これらの報告にはまた、潜在的な選択バイアス、紹介バイアス、短い追跡期間により交絡が生じており、治療成績におけるわずかな差をみるには検出力不足である。
さらに、米国がん合同委員会のI期およびII期疾患の患者の治療成績はしばしば合わせて報告される。所定の精密検査、治療、および経過観察を行った臨床試験からの結果がないため、ほとんどのMCC患者は、それぞれの症例の特質のほか、患者の希望を考慮した施設または開業医の好みで治療されている。
最も適切なMCCの治療方法に関する多くの議論には、2つの競合する考え方が根底にある。第一の考え方では、MCCは他の非黒色腫皮膚がんと同様に治療され、手術および必要に応じた放射線療法により局所領域疾患を治療するように重点が置かれている。2番目の考え方では、MCCはその生物学的特性に応じて治療される。このアプローチにより、MCCは全身性疾患とみなされる小細胞肺がんと類似していることになり、系統的な補助化学療法がよりルーチンに推奨されている。[ 1 ]
原発巣に対する手術
18件のケースシリーズのレビューにおいて、診察時に遠隔転移疾患を発症していた患者を除いて、患者926人中279人(30.1%)が追跡期間中に局所再発を来した。これらの再発は典型的に外科的切除断端が不十分であったことまたはおそらく補助放射線療法の不実施が原因とされている。[ 2 ][ 3 ]
MCCの局所再発傾向(ときに衛星病変および/またはin-transit転移を伴う)を考慮すると、局所再発リスクを低下させるための広範囲局所切除が臨床病期I期またはII期疾患の患者に推奨されている。
原発腫瘍周囲の切除すべき正常組織縁の最適な最小幅および深さに関する推奨はさまざまなレトロスペクティブ・ケースシリーズ間で異なるが、この問題は系統的に研究されていない。[ 3 ][ 4 ][ 5 ][ 6 ][ 7 ][証拠レベル:3iiiDiii]非常に広範な切除縁により全生存(OS)が改善することを示唆する決定的なデータはないが、より広範な切除縁により局所制御は改善するらしいとした報告が数件ある。[ 3 ][証拠レベル:3iiiDiii]特に広範な切除縁を確保する余地のない解剖学的部位に腫瘍がある場合には、凍結切片による切除縁の評価が有用であろう。
諸家の中には、組織を温存する技術としてモース氏顕微鏡組織手術の使用を提唱する者もいる。報告されている再燃率は広範囲切除のそれと勝るとも劣らなかったが、この方法により治療された症例はほとんどなく、ランダム化比較試験は実施されていない。[ 7 ][ 8 ][ 9 ][ 10 ][証拠レベル:3iiiDiii]
所属リンパ節の手術
一部のケースシリーズによると、リンパ節の病理学的病期分類が省略される場合は局所領域再発率が高い。臨床的には陰性の患者におけるリンパ節の外科的病期分類により、少なくとも25~35%の患者で陽性のリンパ節が同定されている。[ 4 ][ 11 ][ 12 ][証拠レベル:3iiiDiii]原発腫瘍の外科的治療および流入領域リンパ節の評価を受けた患者213人を対象としたレトロスペクティブ・シリーズが1件あり、リンパ節陽性が認められた患者は、腫瘍が小さい(例、1.0cm以下)患者54人中2人、1.0cmを超える患者159人中51人であった。[ 13 ][証拠レベル:3iiiDiii]
臨床的にリンパ節転移陽性を認めない場合の選択的リンパ節郭清(ELND)の役割は正式な臨床試験で研究されていない。複数の小規模ケースシリーズにおいて、比較的大きな原発腫瘍、分裂像が高倍率視野当たり11以上みられる腫瘍、リンパ管または血管内浸潤、組織学的に小細胞亜型の場合に、ELNDが推奨されている。[ 14 ][ 15 ][ 16 ][証拠レベル:3iiiDiii]
MCCの適正な病期分類のための完全ELNDに代わる望ましい最初の代替手法として、センチネルリンパ節(SLN)生検が提唱されている。SLN生検は、完全リンパ節郭清より罹病率が低い。さらに、例えば背中の部位のように左右どちらにリンパ流があるか分からない場合のMCC部位には、SLN生検技術が所属リンパ節を同定するのに使用できる。SLN生検を実施する場合は、局所リンパ管が未だ無傷である広範囲切除時に行われる。
数件の報告により、MCCにおけるSLN生検技術の使用は信頼性と再現性が高いことが明らかになった。[ 17 ][ 18 ][ 19 ][ 20 ]しかしながら、SLN陽性の意義は依然として明らかではない。
十分な検出力をもたせられたプロスペクティブ・ランダム化臨床試験は実施されていないので、以下の問題が残っている:[ 4 ][ 12 ][ 21 ][ 24 ][証拠レベル:3iiiDiii]
- すべての陽性のSLN生検後にルーチンに完全なリンパ節の手術および/または放射線療法を実施すべきか。
- リンパ節の手術で複数のリンパ節における腫瘍および/または被膜外浸潤および/またはリンパ血管性浸潤が明らかにされた場合、ルーチンに放射線を追加することで治療成績が確実に改善されるか。
- MCCが1cm未満の患者はルーチンにセンチネルリンパ節郭清(SLND)を受けるべきか。
- リンパ節の精密検査が陰性か、精密検査を受けていない患者はルーチンに局所または局所領域放射線療法を受けるべきか。
- リンパ節の微小転移を同定するために免疫組織化学的染色法を使用すべきか、リンパ節の微小転移病変は臨床的に重要か。
現時点では、リンパ節手術の主な役割は、病期を判定すること、および治療追加の指針を得ることである。
少数のレトロスペクティブ研究によれば、陽性のSLND後の所属リンパ節の治療的郭清はその後の所属リンパ節再発およびin-transit転移のリスクを完全に排除できるわけではないが、最小限に抑えるようである。[ 4 ][ 21 ][ 24 ][証拠レベル:3iiiDiii]手術による所属リンパ節の決定的な治療により生存率が改善することを実証しているプロスペクティブ・ランダム化試験のデータはない。
放射線療法
MCCの侵攻的な本質、明らかな放射線感受性、および高い局所領域再発率(原発腫瘍床への手術単独後のin-transit転移を含む)のために、一部の臨床家は原発部位およびリンパ節流域への補助放射線療法を推奨している。特により大きな腫瘍、局所切除が不可能な腫瘍を有するか、切除断端が腫瘍に近いか陽性で追加の手術で改善できない患者、および特にSLND後に所属リンパ節陽性の患者(II期)に対しては、原発部位に対する放射線に隣接したリンパ節流域への放射線が検討されている。[ 10 ][ 11 ][ 14 ][ 15 ][ 25 ][証拠レベル:3iiiDiii]数件の小規模レトロスペクティブ・シリーズでは、放射線 + 適切な手術により手術単独と比較して局所領域制御率が改善することが示されているが[ 2 ][ 5 ][ 26 ][ 27 ][ 28 ][ 29 ]、別のシリーズでは同じ結果は示されなかった。[ 4 ][ 8 ][証拠レベル:3iiiDiii]
十分な検出力をもたせられたプロスペクティブ・ランダム化臨床試験は実施されていないので、以下の問題が残っている:[ 4 ][ 8 ][ 9 ][ 12 ][ 21 ][ 24 ][ 26 ][ 30 ][ 31 ][ 32 ][ 33 ][ 34 ][証拠レベル:3iiiDiii]
- すべての陽性のSLN生検後にルーチンに完全なリンパ節の手術および/または放射線療法を実施すべきか。
- リンパ節の手術で複数のリンパ節における腫瘍および/または被膜外浸潤および/またはリンパ血管性浸潤が明らかにされた場合にのみ、ルーチンに放射線を追加することで治療成績が確実に改善されるか。
- リンパ節の精密検査が陰性か、精密検査を受けていないすべての患者がルーチンに局所または局所領域放射線療法を受けるべきか、それとも特定の患者のみで良いか。
これらの非ランダム化レトロスペクティブ・シリーズは小規模であるため、放射線療法の正確な便益は依然として判明していない。
放射線療法が推奨される場合、照射線量は、マージンを加えた手術部、および流入領域の所属リンパ管に対して50Gy以上で、2Gy分割で照射することになっている。非切除腫瘍や顕微鏡下で断端を越えて拡がりを認める腫瘍を有する患者には、原発部位へのより高線量の56Gy~65Gyが推奨されている。[ 5 ][ 10 ][ 11 ][ 14 ][ 15 ][ 27 ][ 31 ][ 35 ][証拠レベル:3iiiDiii]これらの線量はプロスペクティブ臨床試験では検討されていない。
さまざまな臨床特性を有する患者を対象とした小規模な厳選された非ランダム化ケースシリーズで、放射線療法単独によるMCCの局所および/または領域的なコントロールが報告されている。[ 29 ][ 36 ]これらの患者は、典型的に、原発腫瘍および/またはリンパ節が手術不能であった患者、あるいは医学的に手術が適切でないとみなされた患者であった。[ 29 ][ 36 ][証拠レベル:3iiiDiii]
Surveillance, Epidemiology, and End Results (SEER) Programのレトロスペクティブ・データは手術に放射線を追加した場合の生存価値を示唆しているが、不完全な患者データ、評価および治療のためのプロトコルの欠如、および潜在的な標本抽出バイアスにより結論を下すことは困難である。[ 32 ]手術に放射線療法を併用することで生存率を変えられるかどうかを評価するには、プロスペクティブ・ランダム化臨床試験が必要である。[ 33 ][ 34 ][証拠レベル:3iiiDiii]
免疫療法
米国におけるMCC症例の約70~80%がメルケル細胞ポリオーマウイルス(MCPyV)を原因としており、ウイルス陽性のMCCでは、ウイルスがん蛋白(T抗原)が構成的に発現し、増殖を促進している。さらに、MCPyVに対する免疫反応が刺激された患者では、疾患の転帰が比較的良好であり、免疫療法を使用する根拠となっている。
1件の第II相試験では、化学療法で治療された転移性MCCの患者88人が、ヒト抗プログラム死リガンド-1(PD-L1)モノクローナル抗体のアベルマブを投与された(2週間ごとに10mg/kg、静注[IV])。客観的奏効率は33%で、11%の患者で完全奏効が得られた。奏効期間中央値は6.1週間で、MCPyVまたはPD-L1の状態に関係しなかった。さらに重要なことに、奏効は持続性で、74%で少なくとも1年以上持続した。結果として、OS期間中央値は歴史的な中央値、すなわち、第二選択化学療法を受けた場合の4~6ヵ月のOS期間より2倍以上長かった。その後、この研究結果に基づいて、アベルマブは2017年に米国食品医薬品局により、以前の化学療法の投与に関係なく、転移性MCCの治療として承認された。[ 37 ][ 38 ][ 39 ]
ヒト化IgG4抗プログラム細胞死-1(PD-1)モノクローナル抗体のペムブロリズマブが、切除不能なIIIB期またはIV期MCC患者に対する第一選択全身治療法について検討した第II相試験(NCT02267603)において研究されている。初期報告には26人の患者が含められた;16%が完全奏効および40%が部分奏効を示し、その結果、56%の客観的奏効率が得られた。奏効率は第一選択化学療法で得られた歴史的奏効率とほぼ同じであったが、ペムブロリズマブの奏効の方が長期に及び、86%が最終の追跡時に持続していた。[ 40 ]
別の抗PD-1抗体のニボルマブが、MCCを含むウイルス関連がん患者において現在研究されている(NCT02488759)。MCPyV状態または以前の化学療法に関係なく、転移性MCCの患者が適格とされた。予備的結果で、87%という持続的な奏効率が報告され、最終の追跡時に患者15人中13人で反応が示された(追跡期間中央値、6ヵ月)。この試験では、転移性MCCにおけるニボルマブ + イピリムマブ(1mg/kg)について研究する2番目のコホートが追加されている。[ 41 ]
化学療法
MCC患者にはさまざまな化学療法レジメンが補助療法のほか、進行疾患および再発疾患に対する治療の設定で用いられている。[ 5 ][ 34 ][ 42 ][ 43 ][証拠レベル:3iiiDiii]補助化学療法によりOSの改善がもたらされることを証明するための第III相臨床試験は実施されていないが、一部の臨床家は以下の理由でほとんどの症例においてその使用を推奨している:
- MCCおよび全身性疾患とみなされている組織学的に類似した小細胞肺がん間で生物学的類似性が成立している。
- MCCでは転移および進行のリスクが高い。
- 一部の化学療法レジメンで臨床的初回奏効率が良好であったことが示されている。
可能な場合は、患者には臨床試験への参加を奨励するように検討すべきである。
1997年から2001年にTrans-Tasman Radiation Oncology Groupにより、高リスク局所領域病変を有するMCC患者53人を対象とした第II相評価が実施された。高リスクは、一次治療後の再発、リンパ節転移、1cmを超える原発腫瘍、手術後の肉眼的残存腫瘍、またはリンパ節転移陽性原発不明がんとして定義された。治療法として、局所領域放射線(25分割で50Gy)、カルボプラチン同時投与(薬物血中濃度時間曲線下面積[AUC]4.5)、およびエトポシド静注(1、4、7、10周目の1~3日目に89mg/m2)が含まれた。手術は原発腫瘍またはリンパ節のどちらに対しても標準化されず、12人の患者では不十分な切除断端、陽性の切除断端、または肉眼的残存腫瘍を認めた。24人の患者ではリンパ節床の郭清は実施されず、残りはさまざまなリンパ節の手術を受けた。追跡期間中央値48ヵ月の時点で、3年OS率は76%、局所領域制御率は75%、および遠隔制御率は76%であった。皮膚の放射反作用および発熱性好中球減少は重大な臨床的急性毒性であった。集団が不均一で手術が標準化されていないため、化学療法から明確な治療の便益を推測することは困難である。[ 44 ][証拠レベル:3iiiA]
その後の報告において、同じ研究者らによりこれらのプロトコルの患者のサブセット(N = 40、原発不明がん患者を除外後)が評価され、これらの患者と、化学療法を受けず、1997年以前に診断され同じ施設で治療され、ルーチンの画像診断による病期分類検査を受けなかった歴史的対照61例とが比較された。50人の患者に対して放射線が実施された。化学療法を受けた患者に対する有意な生存便益は示されなかった。[ 45 ]
2004年から2006年に18人の患者を調査したその後のパイロット臨床試験では、同じ研究者らにより、Study 96-07でみられた皮膚および血液学的毒性を低下させる試みがなされた。薬物投与スケジュールは、放射線療法の1日目に開始し、最大5回投与する毎週実施のカルボプラチン(AUC = 2)に続いて、3サイクルのカルボプラチン(AUC 4.5、および放射線終了後3週間の時点で開始する1~3日目のエトポシド静注80mg/m2を3週間ごとに3サイクル繰り返す)に変更された。放射線は初期の試験とほぼ同じであった。[ 44 ]初期の結果はより低い毒性を示唆しているが、他の臨床試験の治療成績は未だ報告されていない。[ 46 ]
局所進行および転移性疾患を有する選択された患者における化学療法の使用についても報告されている。107人の患者を対象とした1件のレトロスペクティブ研究では、転移性疾患を有する患者の57%および局所進行疾患を有する患者の69%が初回化学療法に反応した。OS期間中央値は転移性疾患を有する患者で9ヵ月および局所進行疾患を有する患者で24ヵ月であった。3年OS率は転移性疾患を有する患者で17%および局所進行疾患を有する患者で35%と予測された。しかしながら、毒性が有意に認められ、特により年齢の高い患者では明確な便益は認められなかった。[ 47 ][証拠レベル:3iiiDiii]
経過観察
MCCの治療を受けた患者に対する最も適切な経過観察の手法および頻度はプロスペクティブに研究されていない。局所および領域の再発傾向があるため、臨床家は少なくとも初発病変および所属リンパ節部位の徹底的な身体診察を実施すべきである。画像検査は、懸念されている徴候および症状を評価するためにオーダーされるか、早期の遠隔転移を同定するために実施されることがあるが、新たな遠隔転移の早期発見と治療によって生存率が改善されることを示唆しているデータはない。
局所または領域病変を呈する患者237人の1件のシリーズにおいて、再発までの期間中央値は9ヵ月であった(範囲、2~70ヵ月)。再発の91%は診断から2年以内に起こった。[ 4 ]経過観察の強度は2~3年を過ぎれば、再発の大多数は既に発生している可能性が高いため、次第に弱められることが示唆されている。[ 4 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Busse PM, Clark JR, Muse VV, et al.: Case records of the Massachusetts General Hospital. Case 19-2008. A 63-year-old HIV-positive man with cutaneous Merkel-cell carcinoma. N Engl J Med 358 (25): 2717-23, 2008.[PUBMED Abstract]
- Medina-Franco H, Urist MM, Fiveash J, et al.: Multimodality treatment of Merkel cell carcinoma: case series and literature review of 1024 cases. Ann Surg Oncol 8 (3): 204-8, 2001.[PUBMED Abstract]
- Nghiem P, James N: Merkel cell carcinoma. In: Wolff K, Goldsmith LA, Katz SI, et al., eds.: Fitzpatrick's Dermatology in General Medicine. 7th ed. New York, NY: McGraw-Hill , 2008, pp 1087-94.[PUBMED Abstract]
- Allen PJ, Bowne WB, Jaques DP, et al.: Merkel cell carcinoma: prognosis and treatment of patients from a single institution. J Clin Oncol 23 (10): 2300-9, 2005.[PUBMED Abstract]
- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.[PUBMED Abstract]
- Senchenkov A, Barnes SA, Moran SL: Predictors of survival and recurrence in the surgical treatment of merkel cell carcinoma of the extremities. J Surg Oncol 95 (3): 229-34, 2007.[PUBMED Abstract]
- Nghiem P, McKee PH, Haynes HA: Merkel cell (cutaneous neuroendocrine) carcinoma. In: Sober AJ, Haluska FG, eds.: Skin Cancer. Hamilton, Ontario: BC Decker Inc., 2001, pp 127-141.[PUBMED Abstract]
- Boyer JD, Zitelli JA, Brodland DG, et al.: Local control of primary Merkel cell carcinoma: review of 45 cases treated with Mohs micrographic surgery with and without adjuvant radiation. J Am Acad Dermatol 47 (6): 885-92, 2002.[PUBMED Abstract]
- Wilson LD, Gruber SB: Merkel cell carcinoma and the controversial role of adjuvant radiation therapy: clinical choices in the absence of statistical evidence. J Am Acad Dermatol 50 (3): 435-7; discussion 437-8, 2004.[PUBMED Abstract]
- Gollard R, Weber R, Kosty MP, et al.: Merkel cell carcinoma: review of 22 cases with surgical, pathologic, and therapeutic considerations. Cancer 88 (8): 1842-51, 2000.[PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.[PUBMED Abstract]
- Gupta SG, Wang LC, Peñas PF, et al.: Sentinel lymph node biopsy for evaluation and treatment of patients with Merkel cell carcinoma: The Dana-Farber experience and meta-analysis of the literature. Arch Dermatol 142 (6): 685-90, 2006.[PUBMED Abstract]
- Stokes JB, Graw KS, Dengel LT, et al.: Patients with Merkel cell carcinoma tumors < or = 1.0 cm in diameter are unlikely to harbor regional lymph node metastasis. J Clin Oncol 27 (23): 3772-7, 2009.[PUBMED Abstract]
- Haag ML, Glass LF, Fenske NA: Merkel cell carcinoma. Diagnosis and treatment. Dermatol Surg 21 (8): 669-83, 1995.[PUBMED Abstract]
- Ratner D, Nelson BR, Brown MD, et al.: Merkel cell carcinoma. J Am Acad Dermatol 29 (2 Pt 1): 143-56, 1993.[PUBMED Abstract]
- Yiengpruksawan A, Coit DG, Thaler HT, et al.: Merkel cell carcinoma. Prognosis and management. Arch Surg 126 (12): 1514-9, 1991.[PUBMED Abstract]
- Messina JL, Reintgen DS, Cruse CW, et al.: Selective lymphadenectomy in patients with Merkel cell (cutaneous neuroendocrine) carcinoma. Ann Surg Oncol 4 (5): 389-95, 1997 Jul-Aug.[PUBMED Abstract]
- Hill AD, Brady MS, Coit DG: Intraoperative lymphatic mapping and sentinel lymph node biopsy for Merkel cell carcinoma. Br J Surg 86 (4): 518-21, 1999.[PUBMED Abstract]
- Wasserberg N, Schachter J, Fenig E, et al.: Applicability of the sentinel node technique to Merkel cell carcinoma. Dermatol Surg 26 (2): 138-41, 2000.[PUBMED Abstract]
- Rodrigues LK, Leong SP, Kashani-Sabet M, et al.: Early experience with sentinel lymph node mapping for Merkel cell carcinoma. J Am Acad Dermatol 45 (2): 303-8, 2001.[PUBMED Abstract]
- Mehrany K, Otley CC, Weenig RH, et al.: A meta-analysis of the prognostic significance of sentinel lymph node status in Merkel cell carcinoma. Dermatol Surg 28 (2): 113-7; discussion 117, 2002.[PUBMED Abstract]
- Schwartz JL, Griffith KA, Lowe L, et al.: Features predicting sentinel lymph node positivity in Merkel cell carcinoma. J Clin Oncol 29 (8): 1036-41, 2011.[PUBMED Abstract]
- Fields RC, Busam KJ, Chou JF, et al.: Recurrence and survival in patients undergoing sentinel lymph node biopsy for merkel cell carcinoma: analysis of 153 patients from a single institution. Ann Surg Oncol 18 (9): 2529-37, 2011.[PUBMED Abstract]
- Maza S, Trefzer U, Hofmann M, et al.: Impact of sentinel lymph node biopsy in patients with Merkel cell carcinoma: results of a prospective study and review of the literature. Eur J Nucl Med Mol Imaging 33 (4): 433-40, 2006.[PUBMED Abstract]
- Goepfert H, Remmler D, Silva E, et al.: Merkel cell carcinoma (endocrine carcinoma of the skin) of the head and neck. Arch Otolaryngol 110 (11): 707-12, 1984.[PUBMED Abstract]
- Lewis KG, Weinstock MA, Weaver AL, et al.: Adjuvant local irradiation for Merkel cell carcinoma. Arch Dermatol 142 (6): 693-700, 2006.[PUBMED Abstract]
- Veness MJ, Perera L, McCourt J, et al.: Merkel cell carcinoma: improved outcome with adjuvant radiotherapy. ANZ J Surg 75 (5): 275-81, 2005.[PUBMED Abstract]
- Jabbour J, Cumming R, Scolyer RA, et al.: Merkel cell carcinoma: assessing the effect of wide local excision, lymph node dissection, and radiotherapy on recurrence and survival in early-stage disease--results from a review of 82 consecutive cases diagnosed between 1992 and 2004. Ann Surg Oncol 14 (6): 1943-52, 2007.[PUBMED Abstract]
- Veness M, Foote M, Gebski V, et al.: The role of radiotherapy alone in patients with merkel cell carcinoma: reporting the Australian experience of 43 patients. Int J Radiat Oncol Biol Phys 78 (3): 703-9, 2010.[PUBMED Abstract]
- Meeuwissen JA, Bourne RG, Kearsley JH: The importance of postoperative radiation therapy in the treatment of Merkel cell carcinoma. Int J Radiat Oncol Biol Phys 31 (2): 325-31, 1995.[PUBMED Abstract]
- Marks ME, Kim RY, Salter MM: Radiotherapy as an adjunct in the management of Merkel cell carcinoma. Cancer 65 (1): 60-4, 1990.[PUBMED Abstract]
- Mojica P, Smith D, Ellenhorn JD: Adjuvant radiation therapy is associated with improved survival in Merkel cell carcinoma of the skin. J Clin Oncol 25 (9): 1043-7, 2007.[PUBMED Abstract]
- Housman DM, Decker RH, Wilson LD: Regarding adjuvant radiation therapy in merkel cell carcinoma: selection bias and its affect on overall survival. J Clin Oncol 25 (28): 4503-4; author reply 4504-5, 2007.[PUBMED Abstract]
- Garneski KM, Nghiem P: Merkel cell carcinoma adjuvant therapy: current data support radiation but not chemotherapy. J Am Acad Dermatol 57 (1): 166-9, 2007.[PUBMED Abstract]
- Foote M, Harvey J, Porceddu S, et al.: Effect of radiotherapy dose and volume on relapse in Merkel cell cancer of the skin. Int J Radiat Oncol Biol Phys 77 (3): 677-84, 2010.[PUBMED Abstract]
- Fang LC, Lemos B, Douglas J, et al.: Radiation monotherapy as regional treatment for lymph node-positive Merkel cell carcinoma. Cancer 116 (7): 1783-90, 2010.[PUBMED Abstract]
- Becker JC, Lorenz E, Ugurel S, et al.: Evaluation of real-world treatment outcomes in patients with distant metastatic Merkel cell carcinoma following second-line chemotherapy in Europe. Oncotarget 8 (45): 79731-79741, 2017.[PUBMED Abstract]
- Kaufman HL, Russell JS, Hamid O, et al.: Updated efficacy of avelumab in patients with previously treated metastatic Merkel cell carcinoma after ≥1 year of follow-up: JAVELIN Merkel 200, a phase 2 clinical trial. J Immunother Cancer 6 (1): 7, 2018.[PUBMED Abstract]
- Cowey CL, Mahnke L, Espirito J, et al.: Real-world treatment outcomes in patients with metastatic Merkel cell carcinoma treated with chemotherapy in the USA. Future Oncol 13 (19): 1699-1710, 2017.[PUBMED Abstract]
- Nghiem PT, Bhatia S, Lipson EJ, et al.: PD-1 Blockade with Pembrolizumab in Advanced Merkel-Cell Carcinoma. N Engl J Med 374 (26): 2542-52, 2016.[PUBMED Abstract]
- Topalian SL, Bhatia S, Hollebecque A, et al.: Abstract CT074: Non-comparative, open-label, multiple cohort, phase 1/2 study to evaluate nivolumab (NIVO) in patients with virus-associated tumors (CheckMate 358): efficacy and safety in Merkel cell carcinoma (MCC). [Abstract] Cancer Res 77 (13 Suppl): A-CT074, 2017.[PUBMED Abstract]
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000.[PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.[PUBMED Abstract]
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003.[PUBMED Abstract]
- Poulsen MG, Rischin D, Porter I, et al.: Does chemotherapy improve survival in high-risk stage I and II Merkel cell carcinoma of the skin? Int J Radiat Oncol Biol Phys 64 (1): 114-9, 2006.[PUBMED Abstract]
- Poulsen M, Walpole E, Harvey J, et al.: Weekly carboplatin reduces toxicity during synchronous chemoradiotherapy for Merkel cell carcinoma of skin. Int J Radiat Oncol Biol Phys 72 (4): 1070-4, 2008.[PUBMED Abstract]
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999.[PUBMED Abstract]
- I期およびII期のメルケル細胞がんの治療
-
I期およびII期のメルケル細胞がん(MCC)には局所病変のみを有する患者が含まれる。
切除縁を1~2cmとする切除および放射線療法が原発性MCC腫瘍に対する管理の中心である。原発腫瘍部位への補助放射線療法がしばしば推奨される;しかしながら、小さい低リスク病変(すなわち、他の予後不良因子が認められない2cm未満の腫瘍)を有する患者のサブセットにおいて示されているように、放射線による罹病を回避し、低い局所再発率を維持することが可能である。[ 1 ]
潜伏性のリンパ節病変のリスクが高いため、臨床的に検知可能な転移性病変が認められない患者には、センチネルリンパ節(SLN)生検が推奨される。[ 2 ]現在、転移巣はいずれのサイズでも所属リンパ節(N)の病期分類に関して陽性と考えられている;そのため、SLNにおける微小転移の発見を向上させるために、免疫組織化学検査がルーチンに用いられる。[ 3 ][ 4 ]
I期およびII期のMCCに対する標準治療法の選択肢
I期およびII期のMCCに対する標準治療法の選択肢には以下のものがある:
- 切除断端陰性での局所切除で、機能維持を試みる。
- 典型的には最初にSLN手技を行う外科的リンパ節評価が、リンパ節病変のリスクが高いと考えられる患者に検討される。陽性のリンパ節が発見された場合は患者の病期がIII期に格上げされ、完全リンパ節郭清が検討される。
- 原発腫瘍の切除断端が十分でないという懸念がある場合には、局所放射線療法が検討される。リンパ節の病期分類手技が不完全であるか省略されている場合には、領域放射線療法が検討される。原発腫瘍の所属リンパ節の位置が不明である場合(例、中背部)は、所属リンパ節照射野の選択が問題となる。
I期およびII期のMCCに対して臨床評価段階にある治療法の選択肢
I期およびII期のMCCに対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 臨床試験への登録が奨められる。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Frohm ML, Griffith KA, Harms KL, et al.: Recurrence and Survival in Patients With Merkel Cell Carcinoma Undergoing Surgery Without Adjuvant Radiation Therapy to the Primary Site. JAMA Dermatol 152 (9): 1001-7, 2016.[PUBMED Abstract]
- Cassler NM, Merrill D, Bichakjian CK, et al.: Merkel Cell Carcinoma Therapeutic Update. Curr Treat Options Oncol 17 (7): 36, 2016.[PUBMED Abstract]
- Harms PW: Update on Merkel Cell Carcinoma. Clin Lab Med 37 (3): 485-501, 2017.[PUBMED Abstract]
- Su LD, Lowe L, Bradford CR, et al.: Immunostaining for cytokeratin 20 improves detection of micrometastatic Merkel cell carcinoma in sentinel lymph nodes. J Am Acad Dermatol 46 (5): 661-6, 2002.[PUBMED Abstract]
- III期のメルケル細胞がんの治療
-
III期のメルケル細胞がん(MCC)にはリンパ節病変を有する患者が含まれる。
III期のMCCに対する標準治療法の選択肢
III期のMCCに対する標準治療法の選択肢には以下のものがある:
- 切除断端陰性での局所切除で、機能維持を試みる。
- センチネルリンパ節手技、陽性のリンパ節が発見された場合には、より根治的な所属リンパ節の手術をその後に実施。
- 特に原発腫瘍の切除断端が十分でないという懸念またはリンパ節の手術後に局所領域再発のリスク(例、複数の原発性リンパ節、被膜外浸潤、リンパ血管性浸潤、およびin-transit転移の証拠)がある場合には、局所および所属リンパ節への放射線。
III期のMCCに対して臨床評価段階にある治療法の選択肢
III期のMCCに対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 再発リスクが最も高いと考えられる患者には、既存のデータは臨床での生存便益を証明していないことを理解した上で、全身化学療法が実施されることがある。臨床試験への登録が奨められる。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- IV期のメルケル細胞がんの治療
-
IV期のメルケル細胞がん(MCC)には遠隔転移を有する患者が含まれる。
パフォーマンスステータスが良好なIV期疾患の患者には化学療法が検討される。さまざまなレジメンで反応が得られているが、化学療法により持続性の疾患制御または長期の生存がもたらされるという証拠は十分ではない。
化学療法が適切な選択肢と考えられないIV期の患者では、局所または領域の緩和のために手術および/または放射線療法が検討される。
抗プログラム死リガンド-1抗体のアベルマブは、米国食品医薬品局により、転移性MCCの治療法として承認されている。MCCに対する他の免疫療法が現在臨床評価段階にある。免疫療法の成功は、進行期MCCの管理において重大な出来事である。ただし、すべての患者が免疫療法に反応するわけではない。さらに、固形臓器移植または自己免疫疾患の状況で免疫抑制が必要な患者は、免疫療法の最適な候補にならない可能性がある。
IV期のMCCに対する標準治療法の選択肢
IV期のMCCに対する標準治療法の選択肢には以下のものがある:
- 臨床的に適切な場合に化学療法および/または手術および/または放射線療法による緩和。
IV期のMCCに対して臨床評価段階にある治療法の選択肢
IV期のMCCに対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 臨床試験への登録が強く奨められる。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- 再発メルケル細胞がんの治療
-
メルケル細胞がんはまれな腫瘍である。再発メルケル細胞がん患者に限定して報告された臨床試験はない。これらの患者に対する推奨事項およびさまざまな治療の転帰は、多くの大規模ケースシリーズ[ 1 ][ 2 ][ 3 ][証拠レベル:3iiiDiii]および1件の第II相臨床試験に含まれている。[ 4 ][証拠レベル:3iiiA]治療は通常、患者の希望およびそれぞれの症例の特質に基づいて個別に決定され、標準の選択肢は存在しない。臨床試験への登録が検討されるべきである。
局所再発
局所再発を来した患者に対する治療法の選択肢として、可能な場合はより広範囲の局所手術、およびその後に以前に行われていない場合は放射線を実施する。
所属リンパ節郭清(RLND)もまた、以前に流入領域の所属リンパ節が切除されていない場合に検討できる。
再発後の予後は不良なため、全身化学療法の実施も検討できるが、それにより生存率が改善するという証拠はない。
リンパ節再発
所属リンパ節にのみ再発を来した患者に対する治療法の選択肢としては、以前に流入領域の所属リンパ節が治療されていない場合、RLNDおよび補助放射線療法が挙げられる。再発後の予後は不良なため、全身化学療法の実施も検討できるが、それにより生存率が改善するという証拠はない。
遠隔再発
遠隔再発しかみられない患者には、患者のPSが良好であれば化学療法が選択肢となる。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ][ 6 ][証拠レベル:3iiiDiii]化学療法による反応は局所進行および転移性疾患を有する選択された患者において報告されているが、毒性が有意に認められ、特により年齢の高い患者で明確な便益は認められていない。適切な場合には、特に化学療法が選択肢として検討されない場合に、再発部位の緩和として放射線療法および/または手術が提供される。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Goessling W, McKee PH, Mayer RJ: Merkel cell carcinoma. J Clin Oncol 20 (2): 588-98, 2002.[PUBMED Abstract]
- Henness S, Vereecken P: Management of Merkel tumours: an evidence-based review. Curr Opin Oncol 20 (3): 280-6, 2008.[PUBMED Abstract]
- Voog E, Biron P, Martin JP, et al.: Chemotherapy for patients with locally advanced or metastatic Merkel cell carcinoma. Cancer 85 (12): 2589-95, 1999.[PUBMED Abstract]
- Poulsen M, Rischin D, Walpole E, et al.: High-risk Merkel cell carcinoma of the skin treated with synchronous carboplatin/etoposide and radiation: a Trans-Tasman Radiation Oncology Group Study--TROG 96:07. J Clin Oncol 21 (23): 4371-6, 2003.[PUBMED Abstract]
- Eng TY, Boersma MG, Fuller CD, et al.: A comprehensive review of the treatment of Merkel cell carcinoma. Am J Clin Oncol 30 (6): 624-36, 2007.[PUBMED Abstract]
- Tai PT, Yu E, Winquist E, et al.: Chemotherapy in neuroendocrine/Merkel cell carcinoma of the skin: case series and review of 204 cases. J Clin Oncol 18 (12): 2493-9, 2000.[PUBMED Abstract]
- 本要約の変更点(03/23/2019)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
メルケル細胞がんの病期情報
本セクションには編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、メルケル細胞がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Russell S. Berman, MD (New York University School of Medicine)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Merkel Cell Carcinoma Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/skin/hp/merkel-cell-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 20943647]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。


 画像を拡大する
画像を拡大する