ご利用について
医療専門家向けの本PDQがん情報要約では、成人食道がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 食道がんに関する一般情報
-
食道悪性新生物の大多数を占める組織型は、腺がんと扁平上皮がんの2つである。腺がんは通常、食道下部から発生し、扁平上皮がんは食道の全域で発生しうる。これらの組織型の疫学は著しく異なる。
発生率および死亡率
米国において、2020年に推定される食道がんの新規症例数および死亡数:[ 1 ]
食道がんの発生率はこの数十年間で上昇してきており、それと同時に組織型および原発巣部位にも変化がみられる。米国では歴史的に扁平上皮がんが多くみられるが、過去数十年に、米国と西ヨーロッパで腺がんの発生率が劇的に上昇している。[ 2 ][ 3 ]世界規模では今でも扁平上皮がんが優勢な組織型であるが、米国および西ヨーロッパでは現在、食道腺がんの方が扁平上皮がんよりも多くみられる。[ 4 ]腺がんの発生率は、白人男性における増加が特に顕著である。[ 5 ]米国では、食道がんを発症した患者の年齢の中央値は67歳である。[ 6 ]ほとんどの腺がんが下部食道に発生する。発生率の上昇および人口統計学的変化の原因は分かっていない。
解剖学
食道は食物を消化管へと運ぶ導管としての役割を担っている。食道は喉頭から胃まで伸びており胸郭では後縦隔に位置し、肺胸膜、腹膜、心膜、横隔膜に近接している。腹腔に入ると、食道は急に向きを変えて胃に接続する。食道は消化器系の中でも筋肉の割合が高い部分であり、内側の輪筋層と外側の縦筋層で構成される。上部食道と下部食道はそれぞれ、輪状咽頭筋と胃食道括約筋の括約筋機能で制御される。食道の粘膜固有層および粘膜下組織には豊かなリンパ管ネットワークが集中しており、粘膜下に縦方向のリンパ流がある。
食道の腫瘍は、慣習的に腫瘍の上部境界から切歯までの距離で区別される。内視鏡検査で切歯からの距離を測ると、食道の長さは約30~40cmである。食道は主に4つの部分に分けられる:
- 頸部食道(切歯から15~20cmまで)。
- 胸部上部食道(切歯から20~25cm)。
- 胸部中部食道(切歯から25~30cm)。
- 胸部下部食道および胃食道接合部(切歯から30~40cm)。
危険因子
食道扁平上皮がんの危険因子には以下のものがある:
食道腺がんに関連する危険因子はあまり明らかになっていない。[ 3 ]ただし、Barrett食道は例外で、その存在は食道腺がんの発生リスク増大に関連する。慢性的逆流はBarrett化生の有力な原因であると考えられる。スウェーデンの集団ベースのケースコントロール研究の成績は、症候性胃食道逆流が食道腺がんの危険因子であることを強く示唆している。逆流症状の頻度、重症度ならびに持続時間と食道腺がんのリスクの増大との間には、正の相関が認められる。[ 7 ]
(詳しい情報については、食道がんの予防に関するPDQ要約を参照のこと。)
予後因子
予後良好因子には次のものがある:
下部食道のBarrett粘膜に重度の異形成を来している患者では、しばしば異形成領域内に上皮内がんまたは浸潤がんが存在する。こうした患者の切除後の予後は、通常きわめて良好である。[ 8 ]
ほとんどの場合、食道がんは治療可能な疾患であるが、治癒することはまれである。決定的な治療を受けた患者の5年全生存率は5~30%である。きわめて早期のがんが見つかる患者がたまにおり、生存の可能性が高くなる。
関連する要約
食道がんに関する情報を含む他のPDQ要約には以下のものがある:
食道に発生することがあり通常は良性である消化管間質腫瘍の情報については、以下の要約を参照のこと:
食道がん患者に対する支持療法の情報については、以下の要約を参照のこと:
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Brown LM, Devesa SS, Chow WH: Incidence of adenocarcinoma of the esophagus among white Americans by sex, stage, and age. J Natl Cancer Inst 100 (16): 1184-7, 2008.[PUBMED Abstract]
- Blot WJ, McLaughlin JK: The changing epidemiology of esophageal cancer. Semin Oncol 26 (5 Suppl 15): 2-8, 1999.[PUBMED Abstract]
- Schmassmann A, Oldendorf MG, Gebbers JO: Changing incidence of gastric and oesophageal cancer subtypes in central Switzerland between 1982 and 2007. Eur J Epidemiol 24 (10): 603-9, 2009.[PUBMED Abstract]
- Kubo A, Corley DA: Marked multi-ethnic variation of esophageal and gastric cardia carcinomas within the United States. Am J Gastroenterol 99 (4): 582-8, 2004.[PUBMED Abstract]
- Ginsberg RJ: Cancer treatment in the elderly. J Am Coll Surg 187 (4): 427-8, 1998.[PUBMED Abstract]
- Lagergren J, Bergström R, Lindgren A, et al.: Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 340 (11): 825-31, 1999.[PUBMED Abstract]
- Reed MF, Tolis G, Edil BH, et al.: Surgical treatment of esophageal high-grade dysplasia. Ann Thorac Surg 79 (4): 1110-5; discussion 1110-5, 2005.[PUBMED Abstract]
- 食道がんの細胞分類
-
典型的にはBarrett食道に発生する腺がんは悪性病変の少なくとも50%を占めており、この組織構造の発生率は上昇しているように思われる。Barrett食道では、食道胃移行部の口側に腺上皮が存在する。
3つの異なるタイプの腺上皮が見られる:
食道がんの50%未満が扁平上皮がんである。
食道には消化管間質腫瘍が発生することがあり、通常は良性である。(詳しい情報については、消化管間質腫瘍の治療(成人)に関するPDQ要約を参照のこと。)
- 食道がんの病期情報
-
食道がん患者に治療法を割り付け、比較する上での大きな困難の1つは、術前の病期決定が的確さに欠けることである。病期によって、治療アプローチの意図が根治になるのか症状の緩和になるのかが決まる。
病期評価
非侵襲的な標準の病期分類法には以下のものがある:
腫瘍深達度分類の全精度は超音波内視鏡法では85~90%、CTでは50~80%であり、所属リンパ節転移分類の精度は超音波内視鏡法では70~80%、CTでは50~70%である。[ 1 ][ 2 ]
あるレトロスペクティブ研究では、超音波内視鏡下穿刺吸引法(FNA)による所属リンパ節転移分類の感度は93%、特異度は100%と報告された。超音波内視鏡下FNAによるリンパ節転移分類は、プロスペクティブ評価段階にある。[ 3 ]
一部の外科施設では、食道がんの病期決定に胸腔鏡検査法および腹腔鏡検査法が用いられている。[ 4 ][ 5 ][ 6 ]あるグループ間共同研究試験では、胸腔鏡検査法/腹腔鏡検査法を施行した場合の所属リンパ節転移の検出率は評価可能な患者107人で56%であり、CT、磁気共鳴画像法、超音波内視鏡法などの非侵襲的病期決定検査を施行した場合の41%から上昇し、重篤な合併症や死亡を引き起こさなかった。[ 7 ]
放射線標識したブドウ糖アナログフッ素18-フルオロデオキシグルコース(18F-FDG)を用いる非侵襲的なPETによる術前の食道がん病期決定は、遠隔転移の検出においてCTまたは超音波内視鏡よりも感度が高い。切除可能と考えられる食道がん患者262人に対する最近の研究では、標準的評価を受けた患者の少なくとも4.8%に確定的な遠隔転移病変が同定されるという形で18F-FDG PETの有用性が示された。[ 8 ][ 9 ][ 10 ][ 11 ][ 12 ]
AJCC病期分類
AJCCは、食道がんおよび胃食道接合部がんを定義するためにTNM(腫瘍、リンパ節、転移)分類による病期判定を指定している。[ 13 ]腫瘍が胃食道接合部から5cm以内の胃噴門部に位置し、食道または胃食道接合部に進展している場合は、食道がんに分類される。腫瘍の中心が胃食道接合部から5cm以上離れた胃噴門部に位置しているか、または食道に進展していない場合は、胃がんに分類される。[ 13 ](詳しい情報については、胃がんの治療に関するPDQ要約の胃がんの病期情報のセクションを参照のこと。)
腹部リンパ節転移をM1に分類することについては、意見の一致をみていない。腹部リンパ節転移の存在は、遠隔臓器への転移ほど不良な予後をもたらすわけではないようである。[ 14 ]所属リンパ節腫脹および/または腹腔動脈リンパ節腫脹がある患者は、転移によって必ず切除不可能な疾患がもたらされていると考えるべきではない。可能であれば、原発巣の完全切除と適切なリンパ節郭清を試みられる。
表1.原発腫瘍、所属リンパ節、遠隔転移、扁平上皮がんと腺がんの組織学的悪性度、および食道扁平上皮がんの位置の定義a T分類/基準 N分類/基準 M分類/基準 Gの定義 L分類/基準 T = 原発腫瘍の定義;N = 所属リンパ節の定義;M = 遠隔転移の定義;G = 組織学的悪性度の定義;L = 位置の定義。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. b位置は食道における腫瘍の中心点の位置によって定義される。 TX = 腫瘍の評価が不可能。 NX = 所属リンパ節の評価が不可能。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 T0 = 原発腫瘍を認めない。 N0 = 所属リンパ節に転移を認めない。 M1 = 遠隔転移を認める。 G1 = 高分化型。 Tis = 高度の異形成、基底膜近くの上皮に限局する悪性細胞と定義される。 N1 = 1~2個の所属リンパ節転移。 G2 = 中分化型。 G3 = 低分化型、未分化型。 T1 = 腫瘍が粘膜固有層、粘膜筋板、または粘膜下層に浸潤。 N2 = 3~6個の所属リンパ節転移。 N3 = 7個以上の所属リンパ節転移。 T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 T1b = 腫瘍が粘膜下層に浸潤。 T2 = 腫瘍が固有筋層に浸潤。 T3 = 腫瘍が食道外膜に浸潤。 T4 = 腫瘍が隣接臓器に浸潤。 T4a = 腫瘍が胸膜、心膜、奇静脈、横隔膜、または腹膜に浸潤。 T4b = 腫瘍が大動脈、椎体、気道などの他の隣接臓器に浸潤。 食道扁平上皮がんの病期分類
表2.pTNM分類における0期食道扁平上皮がんの定義a 病期 TNM 悪性度 腫瘍の位置 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度; L = 腫瘍の位置;N/A = 該当せず;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202 0 Tis、N0、M0 N/A すべて Tis = 高度の異形成、基底膜近くの上皮に限局する悪性細胞と定義される。 
N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G1 = N/A。 すべてのL = 表1を参照のこと。 表3.pTNM分類におけるIA期およびIB期食道扁平上皮がんの定義a 病期 TNM 悪性度 腫瘍の位置 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;L = 腫瘍の位置;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. IA T1a、N0、M0 G1 すべて -T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 
N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G1 = 高分化型。 すべてのL = 表1を参照のこと。 T1a、N0、M0 GX すべて -T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 すべてのL = 表1を参照のこと。 IB T1a、N0、M0 G2-G3 すべて -T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 
N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G2 = 中分化型。 G3 = 低分化型、未分化型。 すべてのL = 表1を参照のこと。 T1b、N0、M0 G1-G3 すべて -T1b = 腫瘍が粘膜下層に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G1 = 高分化型。 G2 = 中分化型。 G3 = 低分化型、未分化型。 すべてのL = 表1を参照のこと。 T1b、N0、M0 GX すべて -T1b = 腫瘍が粘膜下層に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 すべてのL = 表1を参照のこと。 T2、N0、M0 G1 すべて T2 = 腫瘍が固有筋層に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G1 = 高分化型。 すべてのL = 表1を参照のこと。 表4.pTNM分類におけるIIA期およびIIB期食道扁平上皮がんの定義a 病期 TNM 悪性度 腫瘍の位置 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;L = 腫瘍の位置;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp. 185–202. b位置は食道における腫瘍の中心点の位置によって定義される。 IIA T2、N0、M0 GX すべて T2 = 腫瘍が固有筋層に浸潤。 


N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 すべてのL = 表1を参照のこと。 T2、N0、M0 G2-G3 すべて T2 = 腫瘍が固有筋層に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G2 = 中分化型。 G3 = 低分化型、未分化型。 すべてのL = 表1を参照のこと。 T3、N0、M0 すべて 下部 T3 = 腫瘍が食道外膜に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 下部 = 下肺静脈の下縁から胃までで、胃食道接合部を含む。 T3、N0、M0 G1 上部/中部 T3 = 腫瘍が食道外膜に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G1 = 高分化型。 上部 = 頸部食道から奇静脈の下縁まで。 中部 = 奇静脈の下縁から下肺静脈の下縁まで。 IIB T3、N0、M0 G2-G3 上部/中部 T3 = 腫瘍が食道外膜に浸潤。 


N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G2 = 中分化型。 G3 = 低分化型、未分化型。 上部 = 頸部食道から奇静脈の下縁まで。 中部 = 奇静脈の下縁から下肺静脈の下縁まで。 T3、N0、M0 GX すべて T3 = 腫瘍が食道外膜に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 すべてのL = 表1を参照のこと。 T3、N0、M0 すべて 位置 X T3 = 腫瘍が食道外膜に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 位置 X = 位置が不明。 T1、N1、M0 すべて すべて T1 = 腫瘍が粘膜固有層、粘膜筋板、または粘膜下層に浸潤。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 表5.pTNM分類におけるIIIA期およびIIIB期食道扁平上皮がんの定義a 病期 TNM 悪性度 腫瘍の位置 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;L = 腫瘍の位置;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. b位置は食道における腫瘍の中心点の位置によって定義される。 IIIA T1、N2、M0 すべて すべて T1 = 腫瘍が粘膜固有層、粘膜筋板、または粘膜下層に浸潤。 
-T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 -T1b = 腫瘍が粘膜下層に浸潤。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 T2、N1、M0 すべて すべて T2 = 腫瘍が固有筋層に浸潤。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 IIIB T2、N2、M0 すべて すべて T2 = 腫瘍が固有筋層に浸潤。 
N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 T3、N1-N2、M0 すべて すべて T3 = 腫瘍が食道外膜に浸潤。 N1 = 1~2個の所属リンパ節転移。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 T4a、N0-1、M0 すべて すべて -T4a = 腫瘍が胸膜、心膜、奇静脈、横隔膜、または腹膜に浸潤。 
N0 = 所属リンパ節に転移を認めない。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 表6.pTNM分類におけるIVA期およびIVB期食道扁平上皮がんの定義a 病期 TNM 悪性度 腫瘍の位置 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;L = 腫瘍の位置;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. b位置は食道における腫瘍の中心点の位置によって定義される。 IVA T4a、N2、M0 すべて すべて -T4a = 腫瘍が胸膜、心膜、奇静脈、横隔膜、または腹膜に浸潤。 
N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 T4b、N0-2、M0 すべて すべて -T4b = 腫瘍が大動脈、椎体、気道などの他の隣接臓器に浸潤。 
N0 = 所属リンパ節に転移を認めない。 N1 = 1~2個の所属リンパ節転移。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 すべてのT、N3、M0 すべて すべて すべてのT = 表1を参照のこと。 
N3 = 7個以上の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 IVB すべてのT、すべてのN、M1 すべて すべて すべてのT = 表1を参照のこと。 
すべてのN = 表1を参照のこと。 M1 = 遠隔転移を認める。 すべてのG = 表1を参照のこと。 すべてのL = 表1を参照のこと。 最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
食道腺がんの病期分類
表9.pTNM分類におけるIIA期およびIIB期食道腺がんの定義a 病期 TNM 悪性度 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. IIA T2、N0、M0 G3 T2 = 腫瘍が固有筋層に浸潤。 
N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 G3 = 低分化型、未分化型。 T2、N0、M0 GX T2 = 腫瘍が固有筋層に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 GX = 悪性度の評価が不可能。 IIB T1、N1、M0 すべて T1 = 腫瘍が粘膜固有層、粘膜筋板、または粘膜下層に浸潤。 
-T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 -T1b = 腫瘍が粘膜下層に浸潤。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 T3、N0、M0 すべて T3 = 腫瘍が食道外膜に浸潤。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 表10.pTNM分類におけるIIIA期およびIIIB期食道腺がんの定義a 病期 TNM 悪性度 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. IIIA T1、N2、M0 すべて T1 = 腫瘍が粘膜固有層、粘膜筋板、または粘膜下層に浸潤。 
-T1a = 腫瘍が粘膜固有層または粘膜筋板に浸潤。 -T1b = 腫瘍が粘膜下層に浸潤。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 T2、N1、M0 すべて T2 = 腫瘍が固有筋層に浸潤。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 IIIB T2、N2、M0 すべて T2 = 腫瘍が固有筋層に浸潤。 
N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 T3、N1-2、M0 すべて T3 = 腫瘍が食道外膜に浸潤。 N1 = 1~2個の所属リンパ節転移。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 T4a、N0-1、M0 すべて -T4a = 腫瘍が胸膜、心膜、奇静脈、横隔膜、または腹膜に浸潤。 
N0 = 所属リンパ節に転移を認めない。 N1 = 1~2個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 表11.pTNM分類におけるIVA期およびIVB期食道腺がんの定義a 病期 TNM 悪性度 説明 図解 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;G = 悪性度;p = 病理学的。 a AJCCから許諾を得て転載:Esophageal and esophagogastric junction.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.185–202. IVA T4a、N2、M0 すべて -T4a = 腫瘍が胸膜、心膜、奇静脈、横隔膜、または腹膜に浸潤。 
N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 T4b、N0-2、M0 すべて -T4b = 腫瘍が大動脈、椎体、気道などの他の隣接臓器に浸潤。 
N0 = 所属リンパ節に転移を認めない。 N1 = 1~2個の所属リンパ節転移。 N2 = 3~6個の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 すべてのT、N3、M0 すべて すべてのT = 表1を参照のこと。 
N3 = 7個以上の所属リンパ節転移。 M0 = 遠隔転移を認めない。 すべてのG = 表1を参照のこと。 IVB すべてのT、すべてのN、M1 すべて すべてのT = 表1を参照のこと。 
すべてのN = 表1を参照のこと。 M1 = 遠隔転移を認める。 すべてのG = 表1を参照のこと。 参考文献- Ziegler K, Sanft C, Zeitz M, et al.: Evaluation of endosonography in TN staging of oesophageal cancer. Gut 32 (1): 16-20, 1991.[PUBMED Abstract]
- Tio TL, Coene PP, den Hartog Jager FC, et al.: Preoperative TNM classification of esophageal carcinoma by endosonography. Hepatogastroenterology 37 (4): 376-81, 1990.[PUBMED Abstract]
- Vazquez-Sequeiros E, Norton ID, Clain JE, et al.: Impact of EUS-guided fine-needle aspiration on lymph node staging in patients with esophageal carcinoma. Gastrointest Endosc 53 (7): 751-7, 2001.[PUBMED Abstract]
- Bonavina L, Incarbone R, Lattuada E, et al.: Preoperative laparoscopy in management of patients with carcinoma of the esophagus and of the esophagogastric junction. J Surg Oncol 65 (3): 171-4, 1997.[PUBMED Abstract]
- Sugarbaker DJ, Jaklitsch MT, Liptay MJ: Thoracoscopic staging and surgical therapy for esophageal cancer. Chest 107 (6 Suppl): 218S-223S, 1995.[PUBMED Abstract]
- Luketich JD, Schauer P, Landreneau R, et al.: Minimally invasive surgical staging is superior to endoscopic ultrasound in detecting lymph node metastases in esophageal cancer. J Thorac Cardiovasc Surg 114 (5): 817-21; discussion 821-3, 1997.[PUBMED Abstract]
- Krasna MJ, Reed CE, Nedzwiecki D, et al.: CALGB 9380: a prospective trial of the feasibility of thoracoscopy/laparoscopy in staging esophageal cancer. Ann Thorac Surg 71 (4): 1073-9, 2001.[PUBMED Abstract]
- Flamen P, Lerut A, Van Cutsem E, et al.: Utility of positron emission tomography for the staging of patients with potentially operable esophageal carcinoma. J Clin Oncol 18 (18): 3202-10, 2000.[PUBMED Abstract]
- Flamen P, Van Cutsem E, Lerut A, et al.: Positron emission tomography for assessment of the response to induction radiochemotherapy in locally advanced oesophageal cancer. Ann Oncol 13 (3): 361-8, 2002.[PUBMED Abstract]
- Weber WA, Ott K, Becker K, et al.: Prediction of response to preoperative chemotherapy in adenocarcinomas of the esophagogastric junction by metabolic imaging. J Clin Oncol 19 (12): 3058-65, 2001.[PUBMED Abstract]
- van Westreenen HL, Westerterp M, Bossuyt PM, et al.: Systematic review of the staging performance of 18F-fluorodeoxyglucose positron emission tomography in esophageal cancer. J Clin Oncol 22 (18): 3805-12, 2004.[PUBMED Abstract]
- Meyers BF, Downey RJ, Decker PA, et al.: The utility of positron emission tomography in staging of potentially operable carcinoma of the thoracic esophagus: results of the American College of Surgeons Oncology Group Z0060 trial. J Thorac Cardiovasc Surg 133 (3): 738-45, 2007.[PUBMED Abstract]
- Rice TW, Kelsen D, Blackstone EH, et al.: Esophagus and Esophagogastric Junction. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp 185-202.[PUBMED Abstract]
- Korst RJ, Rusch VW, Venkatraman E, et al.: Proposed revision of the staging classification for esophageal cancer. J Thorac Cardiovasc Surg 115 (3): 660-69; discussion 669-70, 1998.[PUBMED Abstract]
- 食道がんに対する治療法選択肢の概要
-
浸潤性のきわめて低い切除可能な食道がんの患者は、外科的切除単独で治癒する可能性がある。対照的に、切除可能な局所進行食道がん患者に対する治療的管理は過去数十年のうちに大きく進歩してきた。遠隔転移および局所再燃のリスクのために、化学療法、放射線療法、外科的切除を併用する集学的治療が標準治療になっている。
集学的治療は臨床評価段階にあり、以下の治療法が含まれる:
以下の治療法のさまざまな併用により、個々の症例で効果的な症状緩和が得られる可能性がある:
表12.食道がんに対する標準治療法の選択肢 病期( 治療法選択肢 0期の食道がん 手術 内視鏡的切除術 I期の食道がん 化学放射線療法とその後の手術 手術単独 II期の食道がん 化学放射線療法とその後の手術 手術単独 化学療法とその後の手術 根治的化学放射線療法 III期の食道がん 化学放射線療法とその後の手術 術前化学療法とその後の手術 根治的化学放射線療法 IV期の食道がん 化学放射線療法とその後の手術(IVA期疾患の患者に対して) 転移を伴う下部食道腺がんの患者に部分奏効が得られている化学療法 Nd:YAG腔内腫瘍破壊術または電気凝固術 嚥下困難を緩和するための内視鏡的ステント留置術 挿管拡張術を伴うまたは伴わない放射線療法 嚥下困難緩和のための管腔内小線源治療 再発食道がん 支持療法を含む標準治療のいずれかによる症状緩和 手術
手術(Barrett食道)
食道腺がんにおけるBarrett上皮化生の有病率は、Barrett食道が前がん病変であることを示唆する。Barrett上皮化生患者への内視鏡サーベイランスは、治癒的切除の可能性が高い早期の腺がんを発見しうる。Barrett上皮化生部位に高度異形成がみられる患者では、切除を強く考慮すべきである。[ 6 ]
手術(食道がん)
食道がん患者の生存率は低い。切除可能な食道がんの外科治療では5~30%の5年生存率が得られ、早期がんの患者の方が生存率が高い。[ 7 ]食道粘膜または粘膜下組織にとどまる無症状で小型の腫瘍が発見されるのは偶然に過ぎない。手術はこれら小型の腫瘍に対して選択される治療である。いったん症状が現れれば(例、ほとんどの症例で、嚥下困難)、食道がんは通常、固有筋層またはさらに下層に浸潤しており、リンパ節または他の臓器に転移しているであろう。
食道に部分閉塞がみられる患者の一部では、播種性病変があるか手術適応がない場合に、拡張型金属ステント留置術[ 8 ]または放射線療法により、嚥下困難が軽減することがある。嚥下困難を軽減する他の方法としては、レーザー療法や腔内腫瘍を破壊する電気凝固術が報告されている。[ 9 ][ 10 ][ 11 ]
完全な食道閉塞が認められ、全身転移の臨床証拠がない場合、食道を置換するため腫瘍の外科切除と胃の授動が、嚥下困難を軽減する伝統的手段である。
食道がんの根治的切除を施行するための最適な外科的アプローチは明らかになっていない。1つのアプローチは、経食道裂孔的食道切除頸部食道胃吻合である。2つ目のアプローチは、胃の腹腔内授動および開胸食道切除と、胸部上部食道胃吻合または頸部食道胃吻合である。1件の研究は、経裂孔的食道切除術が拡大一括リンパ節郭清を伴う経胸的食道切除よりも低い死亡率に関連していることを結論付けた;しかしながら全無病生存と質調整生存の中央値については有意差がみられなかった。[ 12 ]同様に、実証されたQOL測定方法を用いて測定した長期的な生活の質(QOL)においても、差は報告されていない。[ 13 ]最近になって、切開部をより小さくして侵襲性を最小限に抑えることで、術中の失血の減少、術後合併症の減少、入院期間の短縮といった利点を得るためのアプローチが登場した。しかし、このアプローチでは、切除断端陰性の達成可能性、リンパ節郭清の妥当性、長期成績が十分に確立されていない。[ 14 ]
米国では、食道がんを発症した患者の年齢の中央値は67歳である。[ 15 ]17年間にある外科チームによる手術を受けた患者505人をレトロスペクティブに再調査し、70歳以上の患者グループとそれ以下の患者グループとを比較したところ、周術期死亡率、生存期間中央値、嚥下困難に対する食道切除術の症状緩和的な利益のいずれにも差は認められなかった。[ 16 ][証拠レベル:3iiAおよび3iiB]このシリーズにおけるすべての患者は、起こりうる手術危険性に基づいて手術が選択されていた。切除できる可能性がある食道がん患者については、年齢だけで治療法を決定できない。
食道がんの外科的治療は、10%未満の手術死亡率を伴う。[ 7 ]周術期死亡を防ぎ、嚥下困難を軽減させる試みとして、根治的放射線療法と化学療法との併用が検討されている。
術前化学放射線療法
複数のランダム化試験の結果に基づき、化学放射線療法とその後の手術は、IB期、II期、III期、IVA期の食道がん患者に対する標準治療法の選択肢となっている。
複数の第III相試験で、食道がん患者に術前に同時化学放射線療法を施行した群と手術のみを施行した群の比較が行われている。[ 17 ][ 18 ][ 19 ][ 20 ][ 21 ][ 21 ][ 22 ][ 23 ][証拠レベル: 1iiA]ネオアジュバント化学放射線療法の有益性については、早期のランダム化研究間で相反する結果が得られたために議論が続いていた。[ 17 ][ 18 ][ 19 ][ 20 ]しかし、Chemoradiotherapy for Oesophageal Cancer Followed by Surgery Study(CROSS)が最終的に、局所進行食道がんにおける手術単独との比較で術前化学放射線療法の生存利益を実証した。[ 21 ]
早期腫瘍に対しては、現在も術前化学放射線療法の役割について見解が分かれている。CROSS研究にも早期患者は含まれていたが、早期(I期またはII期)患者のみを対象としたFrancophone de Cancérologie Digestive(FFCD)9901研究(NCT00047112)[ 23 ]では、この患者集団における生存の優位性は示されなかった。
証拠(術前化学放射線療法):
- CROSS研究では、切除可能な食道がんまたは食道胃接合部がんの患者366人を、手術単独群またはカルボプラチン(2mg/mL/分のAUC[曲線下面積]を達成するように調整した用量)およびパクリタキセル(BSA [体表面積] 1m2当たり50mg)を週1回投与し、同時に放射線療法(41.4Gyを23分割)を5週間にわたって照射する群にランダムに割り付けた。CROSSに登録された患者の大半(75%)は腺がんであった。[ 21 ][ 24 ][証拠レベル:1iiA]
- 1件の多施設プロスペクティブ・ランダム化試験で、扁平上皮がん患者に対する術前併用化学療法(すなわち、シスプラチン)および放射線療法(37Gyを3.7Gyずつに分割)vs 手術単独の比較が行われた。[ 17 ][証拠レベル:1iiA]
- 食道腺がん患者を対象に、単一施設での第III相試験で5-フルオロウラシル(5-FU)、シスプラチン、および40Gyの放射線(1回2.67Gy)からなる導入化学放射線療法 + 手術による治療と、切除術単独の治療とが比較された。[ 18 ][証拠レベル:1iiA]
- その後の単一施設における試験では、患者(75%が腺がん)を5-FU、シスプラチン、ビンブラスチン、および放射線療法(1.5Gyを1日2回、計45Gy)による治療と切除を施行する群か、または食道切除術単独群にランダムに割り付けた。[ 19 ][証拠レベル:1iiA]
- 1件のグループ間共同研究試験(CALGB-9781 [NCT00003118])では、胸部食道の切除可能な扁平上皮がんまたは腺がんの患者475人を、術前化学放射線療法(5-FU、シスプラチン、および50.4Gy)の後に食道切除術およびリンパ節郭清を行う治療か、または手術単独の治療にランダムに割り付けるよう計画された。この試験は患者の登録が不十分であったため中止された;しかしながら、登録された患者56人に関して追跡期間中央値6年の結果が報告された。[ 20 ][証拠レベル:1iiA]
- 早期食道がんに対するネオアジュバント化学放射線療法の影響をさらに評価するために、FFCD 9901では、I期またはII期食道がん患者195人を手術単独群か、またはネオアジュバント化学放射線療法(45Gyの25分割と2コースの5-FU [800mg/m2]およびシスプラチン[75mg/m2]の併用)とその後の手術を施行する群のいずれかにランダムに割り付けた。[ 23 ][証拠レベル:1iiA]
術前化学療法
術前化学療法の効果は現在、複数のランダム化試験で評価が行われている。これまでに複数の研究で、手術単独と比較した場合の術前化学療法の生存利益が実証されている。[ 25 ][ 26 ][ 27 ]しかし、ある大規模なランダム化研究では、術前化学療法の生存利益が確認されなかった。[ 28 ]術前化学療法単独との比較で、術前化学放射線療法は病理的奏効を改善するほか、治療成績を向上させる可能性がある。[ 29 ]
証拠(術前化学療法):
- 1件のグループ間共同研究試験(NCT00525785)では、限局性かつ手術可能な食道がん患者440人を、細胞型にかかわらず、術前5-FUおよびシスプラチンの3サイクル投与後に手術を施し、さらに2サイクルの化学療法を施行する群、または手術単独群にランダムに割り付けた。[ 28 ][証拠レベル:1iiA]
- Medical Research Council Oesophageal Cancer Working Partyは、あらゆる細胞型の切除可能な食道がん患者802人を、2サイクルの術前5-FUおよびシスプラチンの投与後に手術を実施する群、または手術単独群にランダムに割り付けた。[
25
][証拠レベル:1iiA]
これらのグループ間共同研究試験と術前化学療法に関する試験の結果は、TまたはNの病期分類が報告されなかったこと、および治療に当たった腫瘍医の裁量でprerandomizationと放射線療法が実施された可能性があることから、解釈が困難である。
- 日本のClinical Oncology Groupでは、臨床病期II期またはIII期(T4を除く)扁平上皮がんを有する患者330人が、2サイクルの術前シスプラチンおよび5-FU投与とその後に手術を受ける群 vs 手術とその後に同じレジメンの術後化学療法を受ける群にランダムに割り付けられた。患者の登録後に予定されていた中間解析が実施された;主要エンドポイントであるPFSは満たされなかったものの、術前化学療法で治療された患者ではOSにおける有意な有益性が示された(P = 0.01)。こうした結果を受けて、Data and Safety Monitoring Committeeは早期の研究中止を勧告した。[ 26 ][証拠レベル:1iiC]
- Fédération Nationale des Centres de Lutte contre le CancerおよびFFCDは、食道下部、胃食道接合部、または胃に切除可能な腺がんを認める患者224人を、周術期化学療法および手術群(n = 113)または手術単独群(n = 111)のいずれかにランダムに割り付けた。化学療法は、28日周期で1日目にシスプラチン(100mg/m2)を静脈内(IV)投与し、5日連続(1~5日目)で5-FU(800mg/m2)を持続IV注入するレジメンを術前に2~3サイクル施行するか、同じレジメンを術後に3~4サイクル施行する。[ 27 ][証拠レベル:1iiA]
- Preoperative Chemotherapy or Radiochemotherapy in Esophago-gastric Adenocarcinoma Trial(POET)は、術前化学療法に対する放射線療法のさらなる有益性の評価を試みた。患者は導入化学療法(15週)とその後に手術を受ける群か、または化学療法(12週)に続いて化学放射線療法(3週)を受け、その後に手術を受ける群のいずれかにランダムに割り付けられた。[ 29 ][証拠レベル:1iiA]
根治的化学放射線療法
医学的に手術不能とみなされる、または切除不能な腫瘍を有すると考えられる患者について、多数のランダム化比較試験で根治的化学放射線療法の有効性が確立されている。[ 30 ][ 31 ]食道扁平上皮がん患者では、根治的化学放射線療法により、術前化学放射線療法とその後の外科的切除と比較して同等の治療成績が得られる可能性がある。[ 32 ][ 33 ]
証拠(根治的化学放射線療法):
- Radiation Therapy Oncology Groupの試験(RTOG-8501)では、患者を化学療法および放射線療法の施行群 vs 放射線療法単独群にランダムに割り付けた。患者は、放射線療法単独(64Gyを32分割)を受ける群か、またはシスプラチン(75mg/m2)の同時併用と5-FUの持続注入(1週目と5週目の1~4日目に1,000mg/m2を投与し、その後3週間隔で2サイクルの化学療法を追加)を施行する化学放射線療法(50Gyを25分割)のいずれかにランダムに割り付けられた。[ 30 ][証拠レベル:1iiA]
- RTOG-8501の結果を改善する試みでIntergroup-0123(RTOG-9405[NCT00002631])が実施された。Intergroup-0123では、食道に限局性腫瘍を有する患者236人を、高線量の放射線療法(64.8Gy)と5-FUおよびシスプラチンの4ヵ月間のサイクルを併用する化学放射線療法群 vs 従来の線量の放射線療法(50.4Gy)と同様の化学療法スケジュールを併用する群にランダムに割り付けた。[ 31 ][証拠レベル:1iiA]
- Eastern Cooperative Oncology Group試験(EST-1282)では患者135人を評価した。[ 34 ][証拠レベル: 1iiA]
- PRODIGE5/ACCORD17(NCT00861094)試験では、限局性食道がん患者の根治的化学放射線療法に関する化学療法の治療骨格として、オキサリプラチン、フルオロウラシル、ロイコボリンカルシウム(FOLFOX)vs 5-FUおよびシスプラチンについて、有効性と安全性を評価ならびに比較することを試みた。この多施設ランダム化第II相および第III相試験では、6サイクルのFOLFOX(3サイクルは放射線療法と同時併用)としてオキサリプラチン(85mg/m2)、ロイコボリン(200mg/m2)、5-FUボーラス(400mg/m2)、5-FU注入(46時間かけて1,600mg/m2)を受ける群か、4サイクルの5-FU(1,000mg/m2を4日間)およびシスプラチン(1日目に75mg/m2)の投与を受ける群のいずれかに、患者267人をランダムに割り付けた。いずれの患者にも放射線療法(50Gyを25分割)を施行した。[ 35 ][証拠レベル:1iiDiii]
- ドイツの1件の第III相試験でも、食道のT3またはT4扁平上皮がん患者に対して、導入化学療法(3コースの5-FUボーラス投与、ロイコボリン、エトポシド、シスプラチン)に続いて化学放射線療法(シスプラチン、エトポシド、40Gy)を施行し、その後手術を施行する治療(治療群A)、または同じ導入化学療法に続いて化学放射線療法(少なくとも65Gy)を実施し手術は併用しない治療(治療群B)が比較された。OSが主要なアウトカムであった。[ 32 ][証拠レベル:1iiA]
- FFCD 9102(NCT00416858)では、T3N0-1M0の胸部食道がん患者259人を、2サイクルの5-FUおよびシスプラチン(1~5日目と22~26日目)に加えて、従来の放射線照射(4.5週で46Gy)を受ける群または分割照射(15Gy、1~5日目と22~26日目)を受ける群のいずれかにランダムに割り付けた。続いて、奏効した患者を、外科的切除の施行群(治療群A)または化学放射線療法を継続する群(治療群B:3サイクルの5FU + シスプラチン、および従来の20Gyまたは分割照射で15Gyの放射線療法)のいずれかにランダムに割り付けた。[ 33 ][証拠レベル:1iiA]
術後放射線療法
2件のランダム化試験では、手術単独との比較において、術後放射線療法に有意なOSの有益性は認められなかった。[ 36 ][ 37 ][証拠レベル:1iiA]新たに診断された患者はみな、治療の対象であり、かつ、さまざまな治療法を比較する臨床試験の対象とみなされるべきである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Tietjen TG, Pasricha PJ, Kalloo AN: Management of malignant esophageal stricture with esophageal dilation and esophageal stents. Gastrointest Endosc Clin N Am 4 (4): 851-62, 1994.[PUBMED Abstract]
- Lightdale CJ, Heier SK, Marcon NE, et al.: Photodynamic therapy with porfimer sodium versus thermal ablation therapy with Nd:YAG laser for palliation of esophageal cancer: a multicenter randomized trial. Gastrointest Endosc 42 (6): 507-12, 1995.[PUBMED Abstract]
- Kubba AK: Role of photodynamic therapy in the management of gastrointestinal cancer. Digestion 60 (1): 1-10, 1999 Jan-Feb.[PUBMED Abstract]
- Heier SK, Heier LM: Tissue sensitizers. Gastrointest Endosc Clin N Am 4 (2): 327-52, 1994.[PUBMED Abstract]
- Bourke MJ, Hope RL, Chu G, et al.: Laser palliation of inoperable malignant dysphagia: initial and at death. Gastrointest Endosc 43 (1): 29-32, 1996.[PUBMED Abstract]
- Lerut T, Coosemans W, Van Raemdonck D, et al.: Surgical treatment of Barrett's carcinoma. Correlations between morphologic findings and prognosis. J Thorac Cardiovasc Surg 107 (4): 1059-65; discussion 1065-6, 1994.[PUBMED Abstract]
- Kelsen DP, Bains M, Burt M: Neoadjuvant chemotherapy and surgery of cancer of the esophagus. Semin Surg Oncol 6 (5): 268-73, 1990.[PUBMED Abstract]
- Saxon RR, Morrison KE, Lakin PC, et al.: Malignant esophageal obstruction and esophagorespiratory fistula: palliation with a polyethylene-covered Z-stent. Radiology 202 (2): 349-54, 1997.[PUBMED Abstract]
- Campbell WR, Taylor SA, Pierce GE, et al.: Therapeutic alternatives in patients with esophageal cancer. Am J Surg 150 (6): 665-8, 1985.[PUBMED Abstract]
- Mellow MH, Pinkas H: Endoscopic therapy for esophageal carcinoma with Nd:YAG laser: prospective evaluation of efficacy, complications, and survival. Gastrointest Endosc 30 (6): 334-9, 1984.[PUBMED Abstract]
- Karlin DA, Fisher RS, Krevsky B: Prolonged survival and effective palliation in patients with squamous cell carcinoma of the esophagus following endoscopic laser therapy. Cancer 59 (11): 1969-72, 1987.[PUBMED Abstract]
- Hulscher JB, van Sandick JW, de Boer AG, et al.: Extended transthoracic resection compared with limited transhiatal resection for adenocarcinoma of the esophagus. N Engl J Med 347 (21): 1662-9, 2002.[PUBMED Abstract]
- de Boer AG, van Lanschot JJ, van Sandick JW, et al.: Quality of life after transhiatal compared with extended transthoracic resection for adenocarcinoma of the esophagus. J Clin Oncol 22 (20): 4202-8, 2004.[PUBMED Abstract]
- Santillan AA, Farma JM, Meredith KL, et al.: Minimally invasive surgery for esophageal cancer. J Natl Compr Canc Netw 6 (9): 879-84, 2008.[PUBMED Abstract]
- Ginsberg RJ: Cancer treatment in the elderly. J Am Coll Surg 187 (4): 427-8, 1998.[PUBMED Abstract]
- Ellis FH, Williamson WA, Heatley GJ: Cancer of the esophagus and cardia: does age influence treatment selection and surgical outcomes? J Am Coll Surg 187 (4): 345-51, 1998.[PUBMED Abstract]
- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997.[PUBMED Abstract]
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996.[PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001.[PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008.[PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012.[PUBMED Abstract]
- Oppedijk V, van der Gaast A, van Lanschot JJ, et al.: Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials. J Clin Oncol 32 (5): 385-91, 2014.[PUBMED Abstract]
- Mariette C, Dahan L, Mornex F, et al.: Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol 32 (23): 2416-22, 2014.[PUBMED Abstract]
- Shapiro J, van Lanschot JJ, Hulshof MC, et al.: Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol 16 (9): 1090-8, 2015.[PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002.[PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012.[PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011.[PUBMED Abstract]
- Kelsen DP, Ginsberg R, Pajak TF, et al.: Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med 339 (27): 1979-84, 1998.[PUBMED Abstract]
- Stahl M, Walz MK, Stuschke M, et al.: Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction. J Clin Oncol 27 (6): 851-6, 2009.[PUBMED Abstract]
- Cooper JS, Guo MD, Herskovic A, et al.: Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group. JAMA 281 (17): 1623-7, 1999.[PUBMED Abstract]
- Minsky BD, Pajak TF, Ginsberg RJ, et al.: INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy. J Clin Oncol 20 (5): 1167-74, 2002.[PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005.[PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007.[PUBMED Abstract]
- Smith TJ, Ryan LM, Douglass HO, et al.: Combined chemoradiotherapy vs. radiotherapy alone for early stage squamous cell carcinoma of the esophagus: a study of the Eastern Cooperative Oncology Group. Int J Radiat Oncol Biol Phys 42 (2): 269-76, 1998.[PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014.[PUBMED Abstract]
- Ténière P, Hay JM, Fingerhut A, et al.: Postoperative radiation therapy does not increase survival after curative resection for squamous cell carcinoma of the middle and lower esophagus as shown by a multicenter controlled trial. French University Association for Surgical Research. Surg Gynecol Obstet 173 (2): 123-30, 1991.[PUBMED Abstract]
- Fok M, Sham JS, Choy D, et al.: Postoperative radiotherapy for carcinoma of the esophagus: a prospective, randomized controlled study. Surgery 113 (2): 138-47, 1993.[PUBMED Abstract]
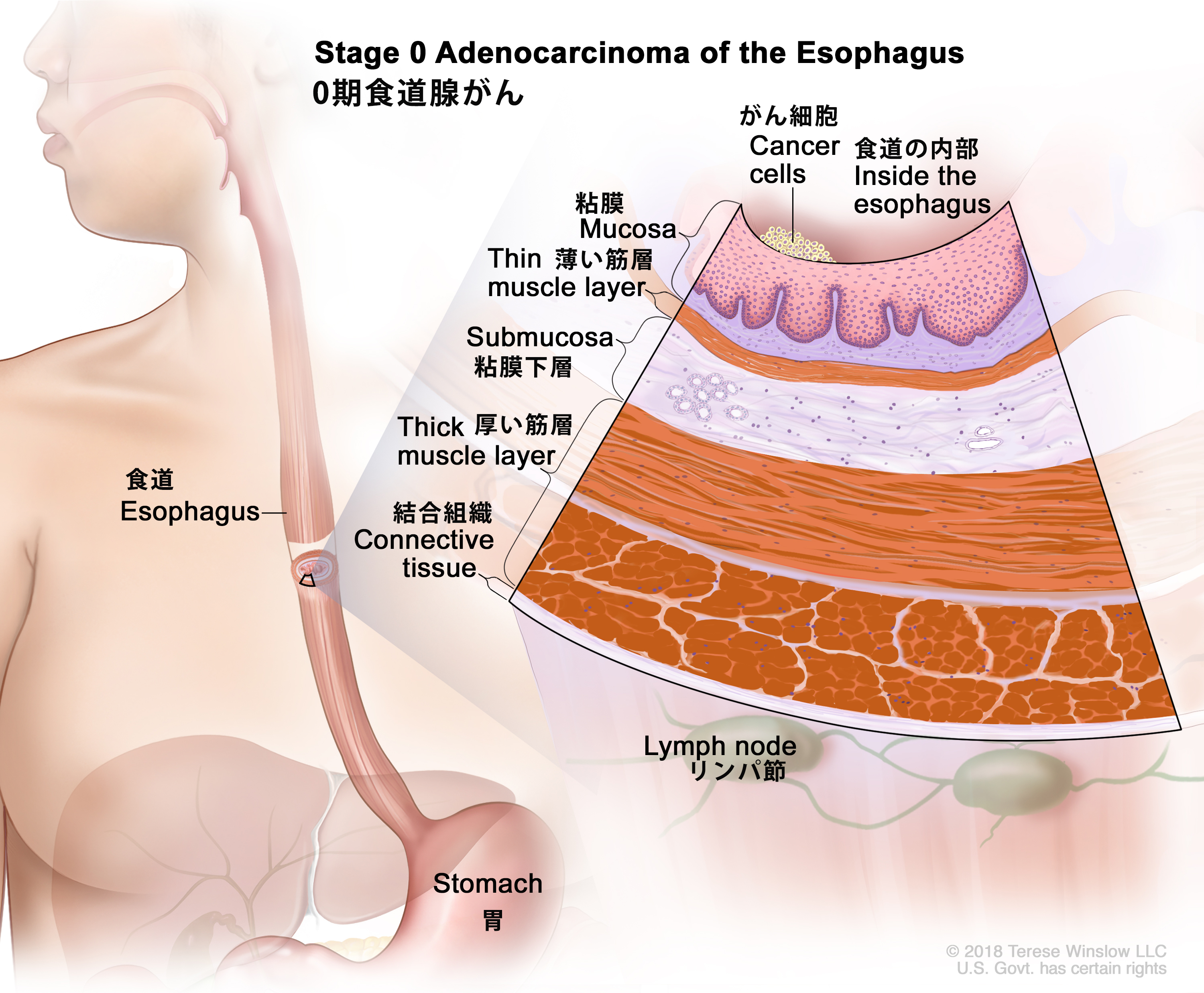
- 0期の食道がんの治療
-
0期の食道がんに対する標準治療法の選択肢
米国では0期の食道扁平上皮がんはまれであるが、治療には手術が用いられている。[ 1 ][ 2 ]浸潤性がきわめて低い早期食道がんの場合は、手術と内視鏡下の手技により、高い確率で治癒が得られる。[ 3 ][ 4 ]
- 手術。
- 内視鏡的切除術。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Rusch VW, Levine DS, Haggitt R, et al.: The management of high grade dysplasia and early cancer in Barrett's esophagus. A multidisciplinary problem. Cancer 74 (4): 1225-9, 1994.[PUBMED Abstract]
- Heitmiller RF, Redmond M, Hamilton SR: Barrett's esophagus with high-grade dysplasia. An indication for prophylactic esophagectomy. Ann Surg 224 (1): 66-71, 1996.[PUBMED Abstract]
- Pech O, Bollschweiler E, Manner H, et al.: Comparison between endoscopic and surgical resection of mucosal esophageal adenocarcinoma in Barrett's esophagus at two high-volume centers. Ann Surg 254 (1): 67-72, 2011.[PUBMED Abstract]
- Prasad GA, Wu TT, Wigle DA, et al.: Endoscopic and surgical treatment of mucosal (T1a) esophageal adenocarcinoma in Barrett's esophagus. Gastroenterology 137 (3): 815-23, 2009.[PUBMED Abstract]
- I期の食道がんの治療
-
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997.[PUBMED Abstract]
- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996.[PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001.[PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008.[PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012.[PUBMED Abstract]
- II期の食道がんの治療
-
II期の食道がんに対する標準治療法の選択肢
II期の食道がんに対する標準治療法の選択肢には以下のものがある:[ 1 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996.[PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008.[PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012.[PUBMED Abstract]
- Urba SG, Orringer MB, Turrisi A, et al.: Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol 19 (2): 305-13, 2001.[PUBMED Abstract]
- Bosset JF, Gignoux M, Triboulet JP, et al.: Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med 337 (3): 161-7, 1997.[PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014.[PUBMED Abstract]
- Mariette C, Dahan L, Mornex F, et al.: Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol 32 (23): 2416-22, 2014.[PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002.[PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012.[PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011.[PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005.[PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007.[PUBMED Abstract]
- III期の食道がんの治療
-
III期の食道がんに対する標準治療法の選択肢
III期の食道がんに対する標準治療法の選択肢には以下のものがある:
- 化学放射線療法とその後の手術。[ 1 ][ 2 ][ 3 ]
- 術前化学療法とその後の手術。[ 4 ][ 5 ][ 6 ]
- 根治的化学放射線療法。[ 7 ][ 8 ][ 9 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Walsh TN, Noonan N, Hollywood D, et al.: A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 335 (7): 462-7, 1996.[PUBMED Abstract]
- Tepper J, Krasna MJ, Niedzwiecki D, et al.: Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol 26 (7): 1086-92, 2008.[PUBMED Abstract]
- van Hagen P, Hulshof MC, van Lanschot JJ, et al.: Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 366 (22): 2074-84, 2012.[PUBMED Abstract]
- Medical Research Council Oesophageal Cancer Working Group: Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial. Lancet 359 (9319): 1727-33, 2002.[PUBMED Abstract]
- Ando N, Kato H, Igaki H, et al.: A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol 19 (1): 68-74, 2012.[PUBMED Abstract]
- Ychou M, Boige V, Pignon JP, et al.: Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 29 (13): 1715-21, 2011.[PUBMED Abstract]
- Conroy T, Galais MP, Raoul JL, et al.: Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial. Lancet Oncol 15 (3): 305-14, 2014.[PUBMED Abstract]
- Stahl M, Stuschke M, Lehmann N, et al.: Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol 23 (10): 2310-7, 2005.[PUBMED Abstract]
- Bedenne L, Michel P, Bouché O, et al.: Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 25 (10): 1160-8, 2007.[PUBMED Abstract]
- IV期の食道がんの治療
-
IV期の食道がんに対する標準治療法の選択肢
診断時、食道がん患者の約50%に転移性病変が認められ、症状緩和目的の治療が適応とされる。[ 1 ]
IV期の食道がんに対する標準治療法の選択肢には以下のものがある:
臨床評価段階にある治療法の選択肢:
食道がんは多くの抗がん剤に反応する。プラチナ製剤をベースに5-フルオロウラシル、タキサン、トポイソメラーゼ阻害薬、ヒドロキシウレア、またはビノレルビンを併用するレジメンでは、客観的奏効率は30~60%、生存期間中央値は1年未満とする報告が多い。[ 1 ][ 4 ][ 9 ]トラスツズマブは、HER2/neuが過剰発現している腫瘍の患者に対して、化学療法との併用で効果が得られることがある。[ 10 ][証拠レベル:1iiA]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Enzinger PC, Ilson DH, Kelsen DP: Chemotherapy in esophageal cancer. Semin Oncol 26 (5 Suppl 15): 12-20, 1999.[PUBMED Abstract]
- Waters JS, Norman A, Cunningham D, et al.: Long-term survival after epirubicin, cisplatin and fluorouracil for gastric cancer: results of a randomized trial. Br J Cancer 80 (1-2): 269-72, 1999.[PUBMED Abstract]
- Ross P, Nicolson M, Cunningham D, et al.: Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU) With epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer. J Clin Oncol 20 (8): 1996-2004, 2002.[PUBMED Abstract]
- Taïeb J, Artru P, Baujat B, et al.: Optimisation of 5-fluorouracil (5-FU)/cisplatin combination chemotherapy with a new schedule of hydroxyurea, leucovorin, 5-FU and cisplatin (HLFP regimen) for metastatic oesophageal cancer. Eur J Cancer 38 (5): 661-6, 2002.[PUBMED Abstract]
- Bourke MJ, Hope RL, Chu G, et al.: Laser palliation of inoperable malignant dysphagia: initial and at death. Gastrointest Endosc 43 (1): 29-32, 1996.[PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001.[PUBMED Abstract]
- Sur RK, Levin CV, Donde B, et al.: Prospective randomized trial of HDR brachytherapy as a sole modality in palliation of advanced esophageal carcinoma--an International Atomic Energy Agency study. Int J Radiat Oncol Biol Phys 53 (1): 127-33, 2002.[PUBMED Abstract]
- Gaspar LE, Nag S, Herskovic A, et al.: American Brachytherapy Society (ABS) consensus guidelines for brachytherapy of esophageal cancer. Clinical Research Committee, American Brachytherapy Society, Philadelphia, PA. Int J Radiat Oncol Biol Phys 38 (1): 127-32, 1997.[PUBMED Abstract]
- Conroy T, Etienne PL, Adenis A, et al.: Vinorelbine and cisplatin in metastatic squamous cell carcinoma of the oesophagus: response, toxicity, quality of life and survival. Ann Oncol 13 (5): 721-9, 2002.[PUBMED Abstract]
- Bang YJ, Van Cutsem E, Feyereislova A, et al.: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 376 (9742): 687-97, 2010.[PUBMED Abstract]
- 再発食道がんの治療
-
すべての再発食道がん患者で、症状緩和は困難な問題を伴う。すべての患者は、本要約の食道がんに対する治療法選択肢の概要のセクションに記載した臨床試験の対象とすることを検討すべきである。
標準治療法の選択肢:
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- 本要約の変更点(05/07/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、成人食道がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Esophageal Cancer Treatment (Adult).Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/esophageal/hp/esophageal-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389338]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。


 画像を拡大する
画像を拡大する