ご利用について
医療専門家向けの本PDQがん情報要約では、小児甲状腺がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 発生率
-
甲状腺がんの年間発生率は0~19歳の100万人当たり4.8~5.9人であり、この年齢層のすべてのがんの約1.5%を占めている。[ 1 ][ 2 ]15~19歳の小児における甲状腺がん発生率はやや高くなり(100万人当たり17.6人)、この年齢層において発生するがんの約8%を占めている。[ 1 ][ 3 ]甲状腺がんは男児よりも女児に多い。[ 4 ]比較的大きな腫瘍の傾向があることから、診断的精密検査だけでは観察された結果の説明とならないことが示唆されている。[ 5 ]
Surveillance, Epidemiology, and End Results(SEER)データベースを用いた2件の時系列研究により、1973年から2011年までおよび1984年から2010年までの米国における小児、青年、および若年成人の分化型甲状腺がんの発生率はそれぞれ、年間2%および3.8%増加したことが示されている。[ 1 ][ 5 ]カナダでも過去20年間にわたって、小児、青年、および若年成人における甲状腺がん発生率の同様の増加傾向が実証されている。[ 6 ]24歳未満の患者における甲状腺がんについてのデンマークの集団ベース研究において、(10万人当たりの)年齢調整発生率は1980年の0.36から2014年の0.97へと有意に増加し、年間変化率は平均2.9%であったことが報告された。[ 7 ]全生存における変化は観察されなかったが、若年成人(18~24歳)では、主に女性と乳頭がん患者における増加のために甲状腺がん発生率の有意な増加が示された。
甲状腺がんの発生率は白人(100万人当たり5.3人 vs 黒人における100万人当たり1.5人)および青年期女性(100万人当たり8.1人 vs 青年期男性における100万人当たり1.7人)において比較的高い。[ 1 ]
乳頭がんサブタイプが最も一般的で症例の約60%を占め、濾胞型乳頭がんサブタイプ(20~25%)、濾胞がんサブタイプ(10%)、髄様がんサブタイプ(10%未満)が続く。乳頭がんサブタイプおよび濾胞型乳頭がんサブタイプの発生率のピークは15~19歳である。甲状腺髄様がんの発生率は0~4歳の年齢層が最も高く、より高い年齢層では低下する(図1を参照のこと)。[ 2 ]
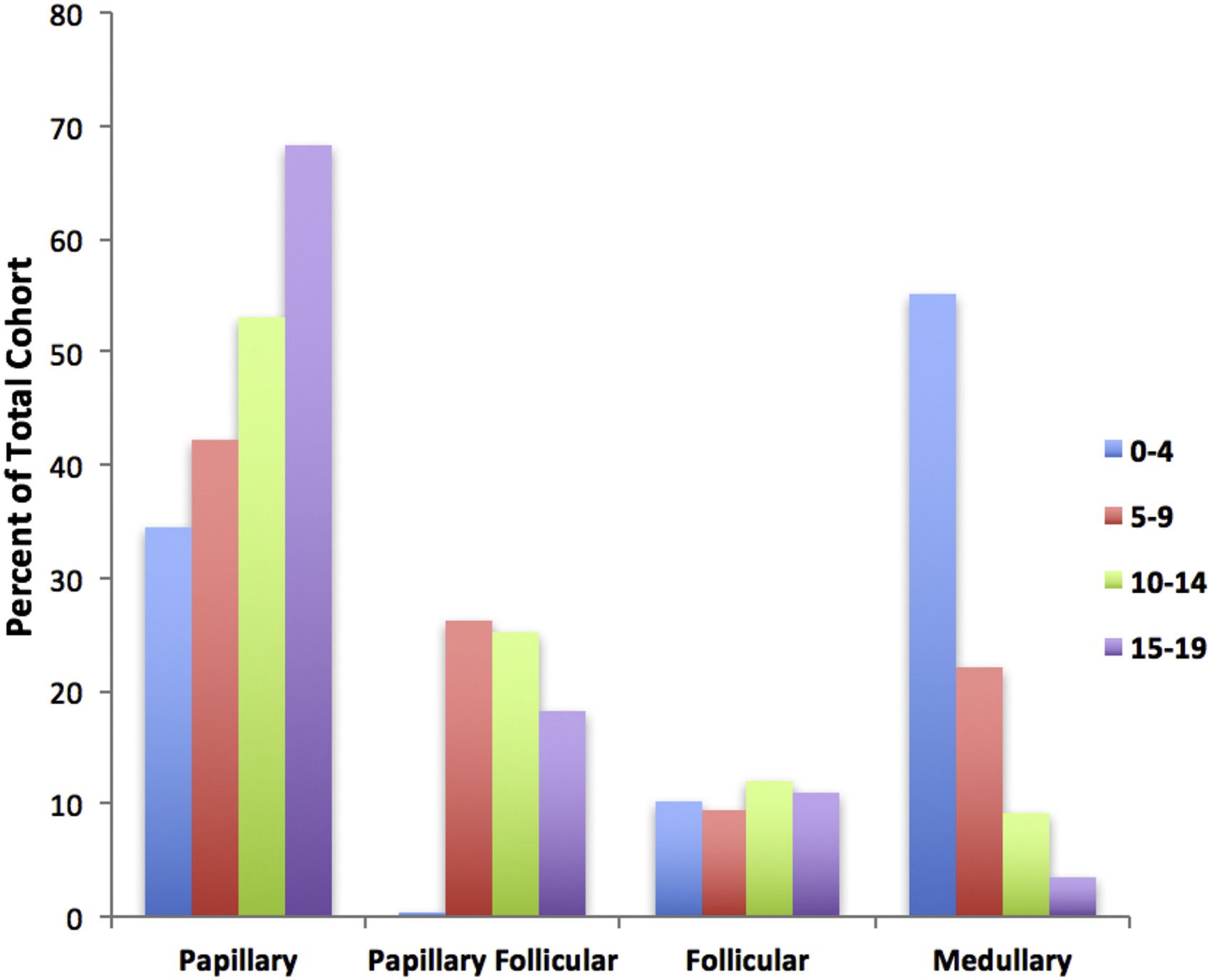
図1.10万人当たりの頻度の高いサブタイプ順にコホート全体のパーセントで表した小児甲状腺がんの発生率。Elsevierから許諾を得て転載:International Journal of Pediatric Otorhinolaryngology, Volume 89, Sarah Dermody, Andrew Walls, Earl H. Harley Jr., Pediatric thyroid cancer: An update from the SEER database 2007-2012, Pages 121-126, Copyright (2016). 参考文献- Golpanian S, Perez EA, Tashiro J, et al.: Pediatric papillary thyroid carcinoma: outcomes and survival predictors in 2504 surgical patients. Pediatr Surg Int 32 (3): 201-8, 2016.[PUBMED Abstract]
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.[PUBMED Abstract]
- Horner MJ, Ries LA, Krapcho M, et al.: SEER Cancer Statistics Review, 1975-2006. Bethesda, Md: National Cancer Institute, 2009. Also available online. Last accessed January 31, 2020.[PUBMED Abstract]
- Shapiro NL, Bhattacharyya N: Population-based outcomes for pediatric thyroid carcinoma. Laryngoscope 115 (2): 337-40, 2005.[PUBMED Abstract]
- Vergamini LB, Frazier AL, Abrantes FL, et al.: Increase in the incidence of differentiated thyroid carcinoma in children, adolescents, and young adults: a population-based study. J Pediatr 164 (6): 1481-5, 2014.[PUBMED Abstract]
- Pole JD, Zuk AM, Wasserman JD: Diagnostic and Treatment Patterns Among Children, Adolescents, and Young Adults with Thyroid Cancer in Ontario: 1992-2010. Thyroid 27 (8): 1025-1033, 2017.[PUBMED Abstract]
- Schmidt Jensen J, Grønhøj C, Mirian C, et al.: Incidence and Survival of Thyroid Cancer in Children, Adolescents, and Young Adults in Denmark: A Nationwide Study from 1980 to 2014. Thyroid 28 (9): 1128-1133, 2018.[PUBMED Abstract]
- 危険因子
-
小児甲状腺がんに対する危険因子には以下のものがある:
参考文献- Cahoon EK, Nadyrov EA, Polyanskaya ON, et al.: Risk of Thyroid Nodules in Residents of Belarus Exposed to Chernobyl Fallout as Children and Adolescents. J Clin Endocrinol Metab 102 (7): 2207-2217, 2017.[PUBMED Abstract]
- Rose J, Wertheim BC, Guerrero MA: Radiation treatment of patients with primary pediatric malignancies: risk of developing thyroid cancer as a secondary malignancy. Am J Surg 204 (6): 881-6; discussion 886-7, 2012.[PUBMED Abstract]
- Lal G, Groff M, Howe JR, et al.: Risk of subsequent primary thyroid cancer after another malignancy: latency trends in a population-based study. Ann Surg Oncol 19 (6): 1887-96, 2012.[PUBMED Abstract]
- Lubin JH, Adams MJ, Shore R, et al.: Thyroid Cancer Following Childhood Low-Dose Radiation Exposure: A Pooled Analysis of Nine Cohorts. J Clin Endocrinol Metab 102 (7): 2575-2583, 2017.[PUBMED Abstract]
- Iglesias ML, Schmidt A, Ghuzlan AA, et al.: Radiation exposure and thyroid cancer: a review. Arch Endocrinol Metab 61 (2): 180-187, 2017 Mar-Apr.[PUBMED Abstract]
- Bauer AJ: Molecular Genetics of Thyroid Cancer in Children and Adolescents. Endocrinol Metab Clin North Am 46 (2): 389-403, 2017.[PUBMED Abstract]
- Acquaviva G, Visani M, Repaci A, et al.: Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathology 72 (1): 6-31, 2018.[PUBMED Abstract]
- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.[PUBMED Abstract]
- 組織学
-
甲状腺の腫瘍は、腺腫またはがん腫のいずれかに分類される。[ 1 ][ 2 ][ 3 ]腺腫とは、腺のすべてまたは一部に腫脹をもたらすことのある良性の境界明瞭かつ被包性の小結節であり、頸部両側面に拡がり、相当大きくなる場合がある;なかにはホルモン分泌能を有する腫瘍もある。一部の細胞で悪性腫瘍への形質転換が起こることもあり、その場合は増殖を続け、頸部リンパ節や肺へと拡大していく。小児における甲状腺結節の約20%が悪性である。[ 1 ][ 4 ]
甲状腺がんの一般的な診断カテゴリーは、以下の組織像によって説明される:
-
分化型甲状腺がん:乳頭がんおよび濾胞がんはしばしば分化型甲状腺がんと呼ばれる。小児における分化型甲状腺がんの病理学的分類は、世界保健機関により指定された標準的な定義に基づいており、この基準は小児と成人で同じである。分化型甲状腺がんの小児および青年に対する長期の治療成績はきわめて優れており、10年生存率は95%を超える。[
4
][
5
][
6
]
- 甲状腺乳頭がん:甲状腺乳頭がんは、小児および青年期の間に発生する分化型甲状腺がんの全症例の90%以上を占める。小児甲状腺乳頭がんは、次のようなさまざまな組織像を呈することがある:通常型、充実型、濾胞型、およびびまん硬化型。甲状腺乳頭がんは多発性および両側性である頻度が高く、ほとんどの小児では所属リンパ節に転移する。肺への血行性転移が25%までの症例で生じる。[ 4 ]
- 甲状腺濾胞がん:甲状腺濾胞がんはまれである。甲状腺濾胞がんは典型的に単発性腫瘍であり、肺および骨に最初に血行性転移を来す傾向がより強い。所属リンパ節への転移はまれである。甲状腺濾胞がんの組織型には、ヒュルトレ細胞(膨大細胞型)がん、明細胞がん、および島状(低分化型)がんがある。[ 4 ]
- 甲状腺髄様がん:甲状腺髄様がんは、カルシトニン分泌傍濾胞C細胞に起始するまれな形態の甲状腺がんであり、小児における甲状腺がんの全症例の10%未満を占める。[ 6 ]小児では、甲状腺髄様がんは通常、多発性内分泌腫瘍2型症候群の状況でのRET生殖細胞変異に関連している。[ 7 ]
- 未分化がん:小児甲状腺がんの1%未満が未分化がんである。
参考文献- Dinauer C, Francis GL: Thyroid cancer in children. Endocrinol Metab Clin North Am 36 (3): 779-806, vii, 2007.[PUBMED Abstract]
- Vasko V, Bauer AJ, Tuttle RM, et al.: Papillary and follicular thyroid cancers in children. Endocr Dev 10: 140-72, 2007.[PUBMED Abstract]
- Halac I, Zimmerman D: Thyroid nodules and cancers in children. Endocrinol Metab Clin North Am 34 (3): 725-44, x, 2005.[PUBMED Abstract]
- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.[PUBMED Abstract]
- Golpanian S, Perez EA, Tashiro J, et al.: Pediatric papillary thyroid carcinoma: outcomes and survival predictors in 2504 surgical patients. Pediatr Surg Int 32 (3): 201-8, 2016.[PUBMED Abstract]
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.[PUBMED Abstract]
- Viola D, Romei C, Elisei R: Medullary thyroid carcinoma in children. Endocr Dev 26: 202-13, 2014.[PUBMED Abstract]
-
分化型甲状腺がん:乳頭がんおよび濾胞がんはしばしば分化型甲状腺がんと呼ばれる。小児における分化型甲状腺がんの病理学的分類は、世界保健機関により指定された標準的な定義に基づいており、この基準は小児と成人で同じである。分化型甲状腺がんの小児および青年に対する長期の治療成績はきわめて優れており、10年生存率は95%を超える。[
4
][
5
][
6
]
- 分子的特徴
-
濾胞細胞の甲状腺がん
濾胞細胞の甲状腺腫瘍発生および甲状腺がん(分化型甲状腺がん、低分化型甲状腺乳頭がん、および未分化甲状腺がん)への進行は、MAPKおよび/またはPI3K/PTEN/AKTシグナル伝達経路の異常な活性化に至る多段階の過程により定義される。過去10年間で実施された包括的なゲノム研究により、これらの腫瘍の状況のほか、これらの腫瘍の遺伝子型-表現型の相関が明らかにされている。以下のようにBRAFおよびRAS遺伝子における変異が最も一般的なドライバーイベントであり、RETまたはNTRKが関与する遺伝子融合がこれに続く:[ 1 ][ 2 ][ 3 ]
-
BRAF:BRAF遺伝子の点変異が甲状腺がんにおいてみられる最も一般的な変化である;最も一般的な変異はV600Eである(BRAF変異症例の95%)。BRAF変異は甲状腺乳頭がんの40~80%で認められ、低分化型甲状腺乳頭がん(5~35%)および未分化甲状腺がん(10~50%)での割合は低い。[
1
][
3
]
BRAF V600Eの存在は甲状腺外への腫瘍進展および再発リスクの増加に関連している;しかしながら、その予後的意義については意見が分かれている。BRAF V600E腫瘍は広範な免疫抑制プロファイルを示すようであり、抗プログラム死リガンド1(PD-L1)の発現量が多い。[ 1 ][ 3 ]
18歳未満で甲状腺乳頭がんを有するブラジル人患者80人を対象にした1件のレトロスペクティブ解析で、AGK-BRAF遺伝子融合およびBRAF V600E点変異が同定された。[ 4 ]甲状腺乳頭がんの小児患者の19%でみつかるAGK-BRAF遺伝子融合は、遠隔転移およびより低い年齢と関連した。甲状腺乳頭がんの小児患者の15%でみつかるBRAF V600E変異は、より高い年齢およびより大きな腫瘍サイズと相関した。
- RAS:発がん性のRAS活性化はすべてのRASファミリーの遺伝子(NRAS、HRAS、およびKRAS)に発生する可能性があるが、最も頻度の高い変化はNRAS点変異である。RAS変異は濾胞性パターンの甲状腺病変のマーカーである;これらの変異は甲状腺濾胞がんの30~50%および濾胞型甲状腺乳頭がんの25~45%で認められる一方で、甲状腺乳頭がんで認められるのは10%未満である。これらはまた、低分化型甲状腺乳頭がん(20~50%)および未分化甲状腺がん(10~50%)でも頻繁に認められ、腫瘍の進行を促進すると考えられている。ヨウ素が欠乏している地域ではこれらの有病率が比較的高い。[ 1 ][ 3 ]
- RET-PTC再構成:複数のRET-PTC再構成が甲状腺乳頭がんの約5~25%で同定されているが、濾胞型乳頭がんでは10%未満である。これらは環境放射線または治療的放射線への曝露に強く関連しており、また若年患者でも一般的であり、若年患者の多くがリンパ節転移を来し、侵攻性の臨床病理学的特徴を呈する。[ 1 ][ 3 ]
- NTRK再構成:NTRK1およびNTRK3の再構成は甲状腺乳頭がんの約5%で記述されている;しかしながら、ETV6-NTRK3は放射線誘発性甲状腺乳頭がんの15%で報告されている。若い患者および小児におけるNTRK再構成を認める甲状腺乳頭がんでは、リンパ節転移および侵攻性の臨床病理学的特徴を呈することがあり、RET再構成を伴う腫瘍の所見と同様である。[ 1 ][ 3 ]
- DICER1変異:甲状腺乳頭がん30例中12例(40%)で通常の変化が発見された(5例でBRAF V600E、3例でRET/PTC1、および4例でRET/PTC3が認められた)。DICER1の病原性変異は甲状腺乳頭がんの約10%に同定されている。[ 5 ]
- ALK再構成は甲状腺乳頭がんの10%未満で記述されており、一般的に脱分化に関連している。
- AKT1の活性化変異は、再発したまたは転移性低分化型甲状腺乳頭がんの19%で記述されている。
- PPARG再構成は甲状腺濾胞がんの20~50%で認められ、濾胞型甲状腺乳頭がんでの割合は低い。
- TERT活性化変異は、低分化型甲状腺乳頭がん(20~50%)および未分化甲状腺がん(30~75%)で一般的に認められ、甲状腺濾胞がんの10~35%および甲状腺乳頭がんの5~15%でも報告されている。TERT変異は、低分化型甲状腺乳頭がんおよび未分化甲状腺がんへの腫瘍の進行を促進する否定的な予後マーカーであると考えられている。
- TP53は未分化甲状腺がんの40~80%および低分化型甲状腺乳頭がんの10~35%で変異している;腫瘍進行の最終段階および予後不良マーカーであると考えられている。
体細胞遺伝子変化の範囲は、以下のように類似した組織像の腫瘍を解析したところ、小児と成人患者間で異なっているようである:[ 2 ]
- RETまたは、より低頻度ではあるがNTRKが関与する遺伝子融合は、小児の分化型甲状腺がんにおける分子的変化の約50%を占めたのに対し、成人では約15%であった。
- BRAFまたはRASが関与する点変異は、成人に診断される甲状腺がんの約70%で定義される遺伝子変化で、小児腫瘍の30~40%に認められる;BRAF変異は、症例の約30%で報告されているが、RAS変異は、小児にみられる頻度がはるかに低い(5~10%)。
甲状腺髄様がん
甲状腺髄様がんは、神経堤に起始する甲状腺傍濾胞C細胞に由来する神経内分泌悪性腫瘍である。小児における甲状腺髄様がんは、優性遺伝またはRETがん遺伝子におけるde novoの機能獲得型変異により引き起こされる単一遺伝子性疾患で、多発性内分泌腫瘍2型(MEN2)(変異の種類に応じてMEN2AまたはMEN2Bのいずれか)と関連している。甲状腺髄様がんはRET M918T変異によって最もリスクが高くなり、この変異はMEN2Bに関連している;MEN2Aに関連するRET変異では甲状腺髄様がんのリスクはより低くなる。[ 2 ]
参考文献- Acquaviva G, Visani M, Repaci A, et al.: Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathology 72 (1): 6-31, 2018.[PUBMED Abstract]
- Bauer AJ: Molecular Genetics of Thyroid Cancer in Children and Adolescents. Endocrinol Metab Clin North Am 46 (2): 389-403, 2017.[PUBMED Abstract]
- Cancer Genome Atlas Research Network: Integrated genomic characterization of papillary thyroid carcinoma. Cell 159 (3): 676-90, 2014.[PUBMED Abstract]
- Sisdelli L, Cordioli MICV, Vaisman F, et al.: AGK-BRAF is associated with distant metastasis and younger age in pediatric papillary thyroid carcinoma. Pediatr Blood Cancer 66 (7): e27707, 2019.[PUBMED Abstract]
- Wasserman JD, Sabbaghian N, Fahiminiya S, et al.: DICER1 Mutations Are Frequent in Adolescent-Onset Papillary Thyroid Carcinoma. J Clin Endocrinol Metab 103 (5): 2009-2015, 2018.[PUBMED Abstract]
-
BRAF:BRAF遺伝子の点変異が甲状腺がんにおいてみられる最も一般的な変化である;最も一般的な変異はV600Eである(BRAF変異症例の95%)。BRAF変異は甲状腺乳頭がんの40~80%で認められ、低分化型甲状腺乳頭がん(5~35%)および未分化甲状腺がん(10~50%)での割合は低い。[
1
][
3
]
- 臨床像および予後因子
-
分化型甲状腺がん
甲状腺がん患者は、通常、無痛の頸部リンパ節腫脹を伴うまたは伴わない甲状腺の腫瘤を呈する。[ 1 ]病歴と家族歴および一連の臨床症状に基づくと、甲状腺がんは多発性内分泌腫瘍(MEN)、APC関連ポリポーシス、PTEN過誤腫腫瘍症候群、カーニー複合、ウェルナー症候群、およびDICER1症候群などの腫瘍素因症候群の一部である可能性がある。[ 2 ][ 3 ]
分化型甲状腺がんでは、年齢が低い方が臨床像は侵攻性となる。以下の観察が報告されている:
- 米国の地域病院の20%を含む1件の横断研究において、小児症例644例の臨床像が43,000例以上の成人症例の臨床像と比較された。成人と比べて、小児ではリンパ節転移(小児では31.5% vs 成人では14.7%)および肺転移(小児では5.7% vs 成人では2.2%)の割合が高かった。[ 1 ]
- 発症時年齢が低いほど再発率が高くなる。[ 4 ]
- 比較的大きな腫瘍サイズ(1cm超)、甲状腺外への進展、および多発性病変がリンパ節転移リスクの増加に関連している。[ 5 ]
- 思春期の青年と比べて、思春期前の小児の方が、より広い甲状腺外への進展、リンパ節転移、および肺転移を伴う侵攻性の症状がみられる。しかしながら、治療成績は思春期前のグループと青年のグループでほぼ同じである。[ 6 ]
高分化甲状腺がんでは、男性、腫瘍サイズ大、および遠隔転移に早期死亡の予後的意義があることが明らかになっている;しかしながら、遠隔転移を有する最高リスク群の患者でも90%の生存率を有した。[ 7 ]1件のフランスの登録に対する解析では、以前に放射線療法を受けた後に甲状腺乳頭がんを発症した小児および若年成人と、自然に甲状腺乳頭がんが発生した小児および若年成人との比較で、同様の転帰がみられた;しかしながら、良性病変に対して甲状腺照射歴のある患者は、より多くの浸潤性腫瘍およびリンパ節転移を呈した。[ 8 ]
National Cancer Databaseのレビューにより、低所得家族の21歳以下の患者および保険金が不足している患者は高分化甲状腺がんの診断から治療までの期間が長くなり、より高い病期の疾患を呈していたことが明らかにされた。[ 9 ]
甲状腺髄様がん
甲状腺髄様がんの小児は比較的侵攻性の臨床経過を辿る;症例の50%では診断時に血行性転移がみられる。[ 10 ]甲状腺髄様がんの小児および若年成人におけるその自然史の研究が米国国立がん研究所により実施されている(NCT01660984)。0~21歳の甲状腺髄様がん患者430人を対象にしたレビューでは、診断時に比較的年長であること(16~21歳)、2cm超の腫瘍径、甲状腺全摘術後の切除断端陽性、およびリンパ節転移は予後不良と関連することが報告された。[ 11 ]
1997年から2019年まで、German Society for Pediatric Oncology and Hematology(GPOH)のMalignant Endocrine Tumors(MET)レジストリーでは、計57人の甲状腺髄様がん患者および17人のC細胞過形成患者が特定された。[ 12 ][証拠レベル:3iA]甲状腺髄様がんの患者では、追跡期間中央値が5年(範囲、0~19年)で、診断時年齢の中央値が10歳(範囲、0~17歳)であった。全生存率は87%、イベントフリー生存(EFS)率は52%であった。合計すると、患者の96.4%がMEN2型(MEN2)症候群であった;患者42人中37人がMEN2A、患者28人中3人がMEN2B(RET M918T変異)であった。10年EFS率は、MEN2Aの患者が78%、MEN2Bの患者が38%であった(P < 0001)。多変量解析で、陽性リンパ節状態および術後カルシトニン値上昇は、EFSに関する有意な予後不良因子であった。
遺伝性MEN2B型の小児では、生後1年以内に甲状腺髄様がんが発見される場合があり、5歳前にリンパ節転移を来すことがある。MEN2Bに関連するRET M918T変異はしばしばde novoであるため、粘膜神経腫、無涙液症の病歴、便秘(腸管神経節神経腫症に続発する)、およびマルファン症候群様の顔面の特徴および細長い体型の認識が早期認識および診断にきわめて重要である。MEN2B患者の約50%が褐色細胞腫を発症する一方、MEN2Aでは特異的なRET変異によって褐色細胞腫および副甲状腺機能亢進症を発症するリスクの程度はさまざまである。[ 13 ][ 14 ](詳しい情報については、小児の多発性内分泌腫瘍[MEN]症候群の治療に関するPDQ要約を参照のこと。)
RETのde novo変異があり、家族歴のない小児では、腸管神経節神経腫症もしくは骨格または眼の徴候などの非内分泌症状により早期の診断が促進され、より良好な転帰が得られる場合がある。[ 14 ]
参考文献- Al-Qurayshi Z, Hauch A, Srivastav S, et al.: A National Perspective of the Risk, Presentation, and Outcomes of Pediatric Thyroid Cancer. JAMA Otolaryngol Head Neck Surg 142 (5): 472-8, 2016.[PUBMED Abstract]
- Acquaviva G, Visani M, Repaci A, et al.: Molecular pathology of thyroid tumours of follicular cells: a review of genetic alterations and their clinicopathological relevance. Histopathology 72 (1): 6-31, 2018.[PUBMED Abstract]
- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.[PUBMED Abstract]
- Ye B, Shi J, Shen C, et al.: Comparison of differentiated thyroid carcinoma recurrence and its clinical features in children of different ages. Oncotarget 8 (29): 48051-48059, 2017.[PUBMED Abstract]
- Kim J, Sun Z, Adam MA, et al.: Predictors of nodal metastasis in pediatric differentiated thyroid cancer. J Pediatr Surg 52 (1): 120-123, 2017.[PUBMED Abstract]
- Lazar L, Lebenthal Y, Steinmetz A, et al.: Differentiated thyroid carcinoma in pediatric patients: comparison of presentation and course between pre-pubertal children and adolescents. J Pediatr 154 (5): 708-14, 2009.[PUBMED Abstract]
- Shayota BJ, Pawar SC, Chamberlain RS: MeSS: A novel prognostic scale specific for pediatric well-differentiated thyroid cancer: a population-based, SEER outcomes study. Surgery 154 (3): 429-35, 2013.[PUBMED Abstract]
- Sassolas G, Hafdi-Nejjari Z, Casagranda L, et al.: Thyroid cancers in children, adolescents, and young adults with and without a history of childhood exposure to therapeutic radiation for other cancers. Thyroid 23 (7): 805-10, 2013.[PUBMED Abstract]
- Garner EF, Maizlin II, Dellinger MB, et al.: Effects of socioeconomic status on children with well-differentiated thyroid cancer. Surgery 162 (3): 662-669, 2017.[PUBMED Abstract]
- Waguespack SG, Rich TA, Perrier ND, et al.: Management of medullary thyroid carcinoma and MEN2 syndromes in childhood. Nat Rev Endocrinol 7 (10): 596-607, 2011.[PUBMED Abstract]
- Raval MV, Sturgeon C, Bentrem DJ, et al.: Influence of lymph node metastases on survival in pediatric medullary thyroid cancer. J Pediatr Surg 45 (10): 1947-54, 2010.[PUBMED Abstract]
- Kuhlen M, Frühwald MC, Dunstheimer DPA, et al.: Revisiting the genotype-phenotype correlation in children with medullary thyroid carcinoma: A report from the GPOH-MET registry. Pediatr Blood Cancer 67 (4): e28171, 2020.[PUBMED Abstract]
- Bauer AJ: Molecular Genetics of Thyroid Cancer in Children and Adolescents. Endocrinol Metab Clin North Am 46 (2): 389-403, 2017.[PUBMED Abstract]
- Wells SA, Asa SL, Dralle H, et al.: Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 25 (6): 567-610, 2015.[PUBMED Abstract]
- 診断的評価
-
甲状腺結節を有する小児または青年の初期評価には、以下を含める:
- 甲状腺の超音波検査。
- 血清甲状腺刺激ホルモン(TSH)値。
- 血清サイログロブリン値。
甲状腺の機能検査は通常は正常であるが、サイログロブリンが高値を示す場合がある。
最初の診断法としての穿刺吸引法は感度が高く有用である。しかしながら、疑わしい症例では切開生検または切除を検討すべきである。[ 1 ]
参考文献- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.[PUBMED Abstract]
- 甲状腺乳頭がんおよび濾胞がんの治療
-
甲状腺乳頭がんおよび濾胞がん(分化型甲状腺がん)に対する治療法の選択肢には以下のものがある:
- 手術。
- 放射性ヨード療法。
- 標的療法。
2015年に、American Thyroid Association (ATA) Task Force on Pediatric Thyroid Cancerは、小児および青年における甲状腺結節および分化型甲状腺がんを管理するためのガイドラインを発表した。これらのガイドライン(以下に要約する)は、証拠レベルの注意深い評価とともに科学的証拠および専門家パネルの意見に基づいている。[ 1 ]
- 術前評価。[
1
]
- 高解像度プローブおよびドプラ法を用いて頸部全域の包括的超音波検査を経験豊富な超音波検査士が実施すべきである。手術前に完全な超音波検査を行うべきである。
- 気道消化管への浸潤の懸念がある場合は、横断的画像検査(造影コンピュータ断層撮影[CT]または磁気共鳴画像法)の追加を検討すべきである。重要なことに、ヨード造影剤を用いる場合、全身のヨード負荷が低下するまで放射性ヨードによる追加の評価および治療は2~3ヵ月間延期する必要がある。
- 胸部画像検査(x線またはCT)は、実質的に頸部リンパ節病変を有する患者に検討される場合がある。
- 甲状腺核シンチグラフィは、患者の甲状腺刺激ホルモン(TSH)が抑制されている場合にのみ実施すべきである。
- 骨スキャンまたはフッ素18-フルデオキシグルコース(18F-FDG)ポジトロン放射断層撮影(PET)のルーチンの使用は推奨されない。
- 手術。[
1
]
小児の甲状腺手術は、理想ではあらゆる範囲の小児専門治療に対応できる病院で小児における内分泌手技の実施経験を有する外科医により行われる。
- 甲状腺摘除術:
乳頭がんまたは濾胞がん患者に対しては、甲状腺全摘術が推奨される選択すべき治療法である。ATA専門家パネルの推奨は、両側(30%)および多発性(65%)病変の発生率が高いことを示すデータに基づいている。
甲状腺に限局する片側の小さい腫瘍を有する患者では、これらの臓器の永続的損傷を軽減するため甲状腺亜全摘術-これにより反回神経の起始部または上副甲状腺において少量の甲状腺組織(1~2%未満)が残される-が検討される場合がある。[ 2 ]
甲状腺全摘術でも、画像検査および治療のために放射性ヨードが最大限に利用される。
- central neck dissection:
- 頸部側方のリンパ節郭清:
- 手術前に頸部側方のリンパ節への転移病変の細胞学的確認が推奨される。
- 頸部側方のリンパ節をルーチンに予防的に郭清することは推奨されない。
- 甲状腺摘除術:
- 分類およびリスク割り付け。[
1
]
小児におけるデータは限られているが、ATA Task Forceは、3つのリスクグループの1つに患者を分類するため腫瘍-リンパ節転移-遠隔転移(TNM)分類を用いるように推奨している。(TNM分類に関する詳しい情報については、甲状腺がんの治療[成人]に関するPDQ要約の甲状腺がんの病期情報のセクションを参照のこと。)この分類戦略は、持続性の頸部病変のリスクを定義し、遠隔転移の存在に対して術後の病期分類を受けるべき患者を明らかにする一助とするように意図されている。
- ATA小児低リスク:腫瘍が甲状腺に限局しており、N0またはNX病変を伴うか、偶発的なN1a(少数の頸部中央区域リンパ節への顕微鏡的転移)を有する患者。これらの患者は遠隔転移のリスクが最も低いが、特に初回手術でcentral neck dissectionが含められない場合に、頸部に病変が残存するリスクが依然としてある。
- ATA小児中リスク:広範なN1aまたは微小なN1b病変。これらの患者は遠隔転移のリスクは低いものの、リンパ節郭清が不完全で頸部に病変が持続するリスクが高い。
- ATA小児高リスク:広範な所属リンパ節転移(N1b)または局所浸潤性腫瘍(T4)で、遠隔転移を伴うものまたは伴わないもの。このグループの患者は不完全な切除、持続性の病変、および遠隔転移のリスクが最も高い。
- 術後の病期分類および長期間のサーベイランス。[
1
]
初回病期分類は術後12週間以内に実施すべきである;目的は持続性の局所領域病変の証拠がないか評価し、ヨウ素131(131I)による追加治療から利益が得られる可能性の高い患者を特定することである。ATAの小児リスクレベル(上で定義)は術後の検査範囲を決定するのに役立つ。
- ATA小児低リスク:
- 術後の初回病期分類にはTSH抑制サイログロブリンが含まれる。診断的ヨウ素123(123I)スキャンは必要ない。
- TSH抑制は、0.5~1.0mIU/Lの血清値を目標にすべきである。
- 疾患の証拠が認められない患者におけるサーベイランスには、術後6ヵ月時とその後の5年間は年1回の超音波検査;および2年間は3~6ヵ月ごととその後は年1回サイログロブリン値の検査(ホルモン補充療法中)を含めるべきである。
- ATA小児中リスク:
- 術後の初回病期分類には、TSH刺激サイログロブリン値の検査と診断的ヨウ素123I全身スキャンが含まれ、追加の層別化および測定にはヨウ素131Iが用いられる。
- TSH抑制は、0.1~0.5mIU/Lの血清値を目標にすべきである。
- 疾患の証拠が認められない患者におけるサーベイランスには、術後6ヵ月時とその後の5年間は6~12ヵ月ごとの超音波検査(さらにその後はより頻度を下げる);および3年間は3~6ヵ月ごととその後は年1回サイログロブリン値の検査(ホルモン補充療法中)を含めるべきである。
- ヨウ素131Iによる治療を受けた患者には、1~2年後のTSH刺激サイログロブリン値の検査および診断的ヨウ素123Iスキャンを検討すべきである。
- ATA小児高リスク:
- 術後の初回病期分類には、TSH刺激サイログロブリン値の検査と診断的ヨウ素123I全身スキャンが含まれ、追加の層別化および測定にはヨウ素131Iが用いられる。
- TSH抑制は、0.1mIU/L未満の血清値を目標にすべきである。
- 疾患の証拠が認められない患者におけるサーベイランスには、術後6ヵ月時とその後の5年間は6~12ヵ月ごとの超音波検査(さらにその後はより頻度を下げる);および3年間は3~6ヵ月ごととその後は年1回サイログロブリン値の検査(ホルモン補充療法中)を含めるべきである。
- ヨウ素131Iによる治療を受けた患者では、1~2年後のTSH刺激サイログロブリン値の検査および場合により、診断的ヨウ素123Iスキャン。
抗サイログロブリン抗体が認められる患者に対しては、T4またはM1疾患の患者を除き、抗体クリアランスの時間を見越して術後の病期分類を延期するように検討してもよい。
- ATA小児低リスク:
- 放射性ヨード療法。[
1
]
ヨウ素131I療法の目標は、ヨウ素集積病変を除去することで再発リスクおよび死亡率を低下させることである。
- ATA Task Forceでは、切除不能な持続性のヨウ素集積局所領域病変またはリンパ節病変および既知のまたは推定のヨウ素集積遠隔転移を治療するため、ヨウ素131Iの使用を推奨している。ヨウ素131I投与後に病変が持続している患者について、追加のヨウ素131I療法を実施する決定は、臨床データと以前の反応に基づいて個別に対応すべきである。
- 残存するヨウ素集積病変によるヨウ素131Iの取り込みを促進するため、TSH値は30mIU/Lを超えるようにすべきである。この値はレボチロキシンを14日間以上中止することで達成できる。十分なTSH反応が得られないか、重度の甲状腺機能低下に耐えられない患者では、組換えヒト型TSHを使用できる。
- 治療目的のヨウ素131I投与は一般的に経験的投薬または全身の線量測定に基づく。経験的治療と線量測定で得た情報に基づく治療とを比較したデータは不足しており、ATA Task Forceでは単一の特異的アプローチを推奨できなかった。しかしながら、成人と比較して小児では身体の大きさとヨウ素クリアランスに差があるため、小児に投与する際には経験を積んだ専門医がヨウ素131Iのすべての使用について計算すべきであると推奨されている。
- ヨウ素131I療法から4~7日後にすべての小児に対して治療後の全身スキャンが推奨される。単一光子放射CTの従来の集積されたCTへの追加(SPECT/CT)は、病変による取り込みの解剖学的部位の識別に有用な場合がある。
ヨウ素131I療法の晩期合併症(晩期障害)はまれではあるが、唾液腺機能不全、骨髄抑制、肺線維症、および二次悪性腫瘍が挙げられる。[ 5 ]
TRK融合陽性甲状腺がんの患者の治療にラロトレクチニブ(標的療法の1つ)が用いられている。ラロトレクチニブ療法で治療されたTRK融合陽性甲状腺がんの患者5人中5人が部分奏効または完全奏効を達成した。[ 6 ]
参考文献- Francis GL, Waguespack SG, Bauer AJ, et al.: Management Guidelines for Children with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 25 (7): 716-59, 2015.[PUBMED Abstract]
- Spinelli C, Strambi S, Rossi L, et al.: Surgical management of papillary thyroid carcinoma in childhood and adolescence: an Italian multicenter study on 250 patients. J Endocrinol Invest 39 (9): 1055-9, 2016.[PUBMED Abstract]
- Kim J, Sun Z, Adam MA, et al.: Predictors of nodal metastasis in pediatric differentiated thyroid cancer. J Pediatr Surg 52 (1): 120-123, 2017.[PUBMED Abstract]
- Machens A, Elwerr M, Thanh PN, et al.: Impact of central node dissection on postoperative morbidity in pediatric patients with suspected or proven thyroid cancer. Surgery 160 (2): 484-92, 2016.[PUBMED Abstract]
- Albano D, Bertagna F, Panarotto MB, et al.: Early and late adverse effects of radioiodine for pediatric differentiated thyroid cancer. Pediatr Blood Cancer 64 (11): , 2017.[PUBMED Abstract]
- Drilon A, Laetsch TW, Kummar S, et al.: Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med 378 (8): 731-739, 2018.[PUBMED Abstract]
- 再発甲状腺乳頭がんおよび濾胞がんの治療
-
分化型甲状腺がんの小児は成人と比較して発症時に疾患が進行しているにもかかわらず、一般に生存はきわめて良好であり、副作用も比較的少ない。[ 1 ][ 2 ][ 3 ]
再発甲状腺乳頭がんおよび濾胞がんに対する治療法の選択肢には以下のものがある:
- ヨウ素131(131I)による放射性ヨード療法。
131Iによる放射性ヨード療法は通常、再発後に有効である。[ 4 ]131I抵抗性疾患の患者には、キナーゼ阻害薬を用いた分子標的療法が代替療法となりうる。
成人の治療について効力が実証されたチロシンキナーゼ阻害薬(TKI)には以下のものがある:
-
ソラフェニブ。ソラフェニブは血管内皮増殖因子受容体(VEGFR)、血小板由来増殖因子受容体(PDGFR)、およびRASキナーゼの阻害薬である。1件の第III相ランダム化試験において、ソラフェニブは、放射性ヨウ素抵抗性局所進行または転移性分化型甲状腺がんの成人患者において、プラセボとの比較で無増悪生存(PFS)を改善した(10.8ヵ月 vs 5.8ヵ月)。[
5
]ソラフェニブは2013年11月に、進行期転移分化型甲状腺がんの成人の治療について米国食品医薬品局(FDA)に承認された。
小児に特化したデータは非常に限られている;しかしながら、ある症例報告で、ソラフェニブは、転移性甲状腺乳頭がんを来した8歳の患児において放射線学的奏効をもたらした。[ 6 ]
-
レンバチニブ。レンバチニブはVEGFR、線維芽細胞増殖因子受容体、PDGFR、RET、およびKITの経口阻害薬である。131I抵抗性分化型甲状腺がんの成人を対象とした1件の第III相ランダム化研究において、レンバチニブは、プラセボとの比較で、PFSおよび奏効率の有意な改善と関連していた。[
7
]レンバチニブは2015年2月に、放射性ヨード抵抗性進行分化型甲状腺がんの成人の治療についてFDAにより承認された。
放射性ヨウ素に不応性であった甲状腺乳頭がんの3人の子供はレンバチニブに対して臨床反応を示した。[ 8 ]
- BRAF阻害薬。131I抵抗性の転移性または切除不能なBRAF-V600E陽性の甲状腺乳頭がんで、以前にTKIによる治療を受けていない成人患者を対象にしたベムラフェニブに関する1件の第II相非ランダム化オープンラベル研究において、38.5%の奏効率が示された。[ 9 ]転移性または進行性のBRAF V600E変異未分化甲状腺がんの患者には、ダブラフェニブとMEK阻害薬のトラメチニブの併用により、69%の奏効率が示されている。[ 10 ]
(詳しい情報については、成人の甲状腺がんの治療[成人]に関するPDQ要約を参照のこと。)
甲状腺乳頭がんおよび濾胞がんの再発に対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再発または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的なvariant(多様体ないしバリアント)が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
参考文献- Golpanian S, Perez EA, Tashiro J, et al.: Pediatric papillary thyroid carcinoma: outcomes and survival predictors in 2504 surgical patients. Pediatr Surg Int 32 (3): 201-8, 2016.[PUBMED Abstract]
- Vergamini LB, Frazier AL, Abrantes FL, et al.: Increase in the incidence of differentiated thyroid carcinoma in children, adolescents, and young adults: a population-based study. J Pediatr 164 (6): 1481-5, 2014.[PUBMED Abstract]
- Dermody S, Walls A, Harley EH: Pediatric thyroid cancer: An update from the SEER database 2007-2012. Int J Pediatr Otorhinolaryngol 89: 121-6, 2016.[PUBMED Abstract]
- Powers PA, Dinauer CA, Tuttle RM, et al.: Treatment of recurrent papillary thyroid carcinoma in children and adolescents. J Pediatr Endocrinol Metab 16 (7): 1033-40, 2003.[PUBMED Abstract]
- Brose MS, Nutting CM, Jarzab B, et al.: Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 384 (9940): 319-28, 2014.[PUBMED Abstract]
- Iyer P, Mayer JL, Ewig JM: Response to sorafenib in a pediatric patient with papillary thyroid carcinoma with diffuse nodular pulmonary disease requiring mechanical ventilation. Thyroid 24 (1): 169-74, 2014.[PUBMED Abstract]
- Schlumberger M, Tahara M, Wirth LJ, et al.: Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 372 (7): 621-30, 2015.[PUBMED Abstract]
- Mahajan P, Dawrant J, Kheradpour A, et al.: Response to Lenvatinib in Children with Papillary Thyroid Carcinoma. Thyroid 28 (11): 1450-1454, 2018.[PUBMED Abstract]
- Brose MS, Cabanillas ME, Cohen EE, et al.: Vemurafenib in patients with BRAF(V600E)-positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine: a non-randomised, multicentre, open-label, phase 2 trial. Lancet Oncol 17 (9): 1272-82, 2016.[PUBMED Abstract]
- Subbiah V, Kreitman RJ, Wainberg ZA, et al.: Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. J Clin Oncol 36 (1): 7-13, 2018.[PUBMED Abstract]
- 甲状腺髄様がんの治療
-
甲状腺髄様がんは一般的に、多発性内分泌腫瘍2型(MEN2)症候群に関連する(詳しい情報については、小児の多発性内分泌腫瘍[MEN]症候群の治療に関するPDQ要約を参照のこと)。
甲状腺髄様がんに対する治療法の選択肢には以下のものがある:
-
手術:甲状腺髄様がんの小児に対する主な治療法は手術である。研究者らにより、基礎のカルシトニン血清値が40pg/mL未満の場合、遺伝性甲状腺髄様がん患者には予防的central node dissectionは実施すべきではないと結論付けられている。[
1
]
小児における甲状腺髄様がん症例のほとんどは、MEN 2AおよびMEN 2B症候群と関連して起こる。こうした家族性症例では、早期の遺伝子検査およびカウンセリングが適応となり、RET遺伝子に生殖細胞変異がみられる小児では予防的手術が推奨される。遺伝子型-表現型の強い相関によって、スクリーニングおよび予防的甲状腺摘出術を実施すべき年齢など、介入のためのガイドラインの策定が推進されている。[ 2 ]
1件のレトロスペクティブ解析により、予防的甲状腺摘出術を受けたRET変異を有する小児167人が確認された;この集団の109人の患者は同時central node dissectionを受けず、58人の患者が同時central node dissectionを受けた。central node dissectionが実施されたかどうかにかかわらず、年齢の高い小児では術後に副甲状腺機能低下症が頻繁に認められた(最も年齢の高いグループで32% vs 最も年齢の低いグループで3%;P = 0.002)。3人の小児が反回神経麻痺を発症したが、全員がcentral node dissectionを受けていた(P = 0.040)。いずれの合併症も6ヵ月以内に回復した。カルシトニン血清値の術後の正常化は、術前に値が上昇していた小児115人中114人(99.1%)で達成された。小児はRET変異の種類別にリスクグループに分類された(表1を参照のこと)。[ 3 ]
- 最高リスクカテゴリーでは、3歳以下の小児6人中5人(83%)で甲状腺髄様がんがみつかった。
- 高リスクカテゴリーでは、3歳以下の小児20人中6人(30%)、4~6歳の小児36人中16人(44%)、および7~12歳の小児16人中11人(69%)で甲状腺髄様がんが存在していた(P = 0.081)。
- 中リスクカテゴリーでは、3歳以下の小児9人中1人(11%)、4~6歳の小児26人中1人(4%)、7~12歳の小児26人中3人(12%)、および13~18歳の小児16人中7人(44%)で甲状腺髄様がんがみつかった(P = 0.006)。
American Thyroid Associationでは、遺伝性甲状腺髄様がんの小児における予防的甲状腺摘除術について以下のようなガイドラインを提案している(表1を参照のこと)。[ 2 ]
表1.遺伝子スクリーニングで発見される一般的なRET変異に基づくリスクレベルとリスク管理a 甲状腺髄様がんのリスクレベル 最高レベル(MEN2B) 高レベル(MEN2A) 中レベル(MEN2A) MEN2A = 多発性内分泌腫瘍2A型;MEN2B = 多発性内分泌腫瘍2B型。 a出典:Wells et al.[ 2 ] RET変異 M918T A883F、C634F/G/R/S/W/Y G533C、C609F/G/R/S/Y、C611F/G/S/Y/W、C618F/R/S、C620F/R/S、C630R/Y、D631Y、K666E、E768D、L790F、V804L、V804M、S891A、R912P 予防的甲状腺摘除術のための年齢 生後1年以内、理想的には生後数ヵ月以内の甲状腺全摘術。 血清カルシトニン値に基づいて5歳時または5歳前の甲状腺全摘術。 血清カルシトニン値が正常範囲を上回るか、両親が長期に及ぶサーベイランスへの従事を望まない場合は都合のよいときに甲状腺全摘術を実施すべきである。 -
チロシンキナーゼ阻害薬(TKI)療法:多くのTKIが進行甲状腺がん患者について評価され、承認されている。
-
バンデタニブ。バンデタニブ(RETキナーゼ、血管内皮成長因子受容体(VEGFR)、および上皮成長因子受容体の信号伝達を阻害する薬)は、切除不能な局所進行性または転移性病変を有する成人患者における症候性または進行性甲状腺髄様がんの治療に対して米国食品医薬品局(FDA)により承認されている。承認はランダム化プラセボ対照第III相試験に基づいたもので、この試験では、バンデタニブ投与にランダムに割り付けられた患者に無増悪生存(PFS)の顕著な改善が示された(ハザード比、0.35);またこの試験では、バンデタニブが投与された患者で客観的奏効率の優位性も示された(44% vs プラセボ群で1%)。[
4
][
5
]
第I/II相試験において、局所進行または転移性甲状腺髄様がんを有する小児がバンデタニブを用いて治療された。16人の患者のうち、奏効が得られなかったのは1人だけで、7人に部分奏効が得られ、客観的奏効率は44%であった。これらの患者の3人ではその後に疾患が再発したが、バンデタニブで治療された患者16人中11人が報告時に治療中であった。コホート全体での療法の期間中央値は27ヵ月で、範囲は2~52ヵ月であった。[ 6 ]進行性の甲状腺髄様がんでバンデタニブの投与を受けた小児および青年17人のコホートにおける長期治療成績の評価では、6.7年のPFS期間中央値および88.2%の5年全生存率が報告された。[ 7 ]
- カボザンチニブ。 カボザンチニブ(RETおよびMETキナーゼおよびVEGFRの阻害薬)も、切除不能な甲状腺髄様がんに対する有効性が示されている(成人患者35人中10人[29%]が部分奏効を得た)。[ 8 ]カボザンチニブは2012年11月に、転移性甲状腺髄様がんの成人の治療についてFDAに承認された。
-
バンデタニブ。バンデタニブ(RETキナーゼ、血管内皮成長因子受容体(VEGFR)、および上皮成長因子受容体の信号伝達を阻害する薬)は、切除不能な局所進行性または転移性病変を有する成人患者における症候性または進行性甲状腺髄様がんの治療に対して米国食品医薬品局(FDA)により承認されている。承認はランダム化プラセボ対照第III相試験に基づいたもので、この試験では、バンデタニブ投与にランダムに割り付けられた患者に無増悪生存(PFS)の顕著な改善が示された(ハザード比、0.35);またこの試験では、バンデタニブが投与された患者で客観的奏効率の優位性も示された(44% vs プラセボ群で1%)。[
4
][
5
]
(詳しい情報については、小児の多発性内分泌腫瘍[MEN]症候群の治療ならびに内分泌および神経内分泌腫瘍の遺伝学に関するPDQ要約の甲状腺髄様がん[MTC]の治療のセクションを参照のこと。)
甲状腺髄様がんに対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再発または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的なvariant(多様体ないしバリアント)が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
参考文献- Machens A, Elwerr M, Thanh PN, et al.: Impact of central node dissection on postoperative morbidity in pediatric patients with suspected or proven thyroid cancer. Surgery 160 (2): 484-92, 2016.[PUBMED Abstract]
- Wells SA, Asa SL, Dralle H, et al.: Revised American Thyroid Association guidelines for the management of medullary thyroid carcinoma. Thyroid 25 (6): 567-610, 2015.[PUBMED Abstract]
- Machens A, Elwerr M, Lorenz K, et al.: Long-term outcome of prophylactic thyroidectomy in children carrying RET germline mutations. Br J Surg 105 (2): e150-e157, 2018.[PUBMED Abstract]
- Wells SA, Robinson BG, Gagel RF, et al.: Vandetanib in patients with locally advanced or metastatic medullary thyroid cancer: a randomized, double-blind phase III trial. J Clin Oncol 30 (2): 134-41, 2012.[PUBMED Abstract]
- Thornton K, Kim G, Maher VE, et al.: Vandetanib for the treatment of symptomatic or progressive medullary thyroid cancer in patients with unresectable locally advanced or metastatic disease: U.S. Food and Drug Administration drug approval summary. Clin Cancer Res 18 (14): 3722-30, 2012.[PUBMED Abstract]
- Fox E, Widemann BC, Chuk MK, et al.: Vandetanib in children and adolescents with multiple endocrine neoplasia type 2B associated medullary thyroid carcinoma. Clin Cancer Res 19 (15): 4239-48, 2013.[PUBMED Abstract]
- Kraft IL, Akshintala S, Zhu Y, et al.: Outcomes of Children and Adolescents with Advanced Hereditary Medullary Thyroid Carcinoma Treated with Vandetanib. Clin Cancer Res 24 (4): 753-765, 2018.[PUBMED Abstract]
- Kurzrock R, Sherman SI, Ball DW, et al.: Activity of XL184 (Cabozantinib), an oral tyrosine kinase inhibitor, in patients with medullary thyroid cancer. J Clin Oncol 29 (19): 2660-6, 2011.[PUBMED Abstract]
-
手術:甲状腺髄様がんの小児に対する主な治療法は手術である。研究者らにより、基礎のカルシトニン血清値が40pg/mL未満の場合、遺伝性甲状腺髄様がん患者には予防的central node dissectionは実施すべきではないと結論付けられている。[
1
]
- 小児がん治療に関する特別な考慮事項
-
小児および青年におけるがんはまれであるが、小児がんの全発生率は1975年以降徐々に増加している。[ 1 ]小児および青年のがん患者については、小児期および青年期に発生するがんの治療経験を有するがん専門家から構成される集学的チームのある医療機関への紹介を検討すべきである。この集学的チームのアプローチとは、至適生存期間および至適QOLを得られるような治療、支持療法、およびリハビリテーションを小児が必ず受けられるようにするため、以下に示す医療専門家などの技術を集結したものである。
- プライマリケア医。
- 小児外科医。
- 放射線腫瘍医。
- 小児内科腫瘍医/血液医。
- リハビリテーション専門医。
- 小児専門看護師。
- 社会福祉士。
- チャイルドライフ専門員。
- 心理士。
(小児および青年のがんの支持療法に関する具体的な情報については、PDQの支持療法および緩和ケアの要約を参照のこと。)
米国小児科学会によって、小児がん施設とそれらが小児がん患者の治療において担う役割に関するガイドラインが概説されている。[ 2 ]このような小児がん施設では、小児および青年に発症するほとんどの種類のがんに関する臨床試験が行われており、大半の患者とその家族に参加する機会が与えられている。小児および青年のがんに関する臨床試験は一般に、現在標準とされている治療法と、それより効果的であると思われる治療法とを比較するようデザインされる。小児がんの治癒を目指した治療法の進歩の大部分は、このような臨床試験によって達成されたものである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
小児および青年のがん患者の生存において、劇的な改善が達成されている。1975年から2010年の間に、小児がんの死亡率は50%以上低下した。[ 3 ]小児および青年のがん生存者では、治療から数ヵ月または数年経過後もがん療法の副作用が持続または発現することがあるため、綿密なモニタリングが必要である。(小児および青年のがん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)に関するPDQ要約を参照のこと。)
小児がんはまれな疾患であり、米国において20歳未満で診断される症例は年間約15,000例である。[ 4 ]米国の2002年希少疾患対策法(Rare Diseases Act of 2002)では、希少疾患を罹患者が20万人未満の疾患と定めている。そのため、小児がんはすべて希少疾患とみなされる。
まれな腫瘍の定義は小児および成人のグループ間で統一されていない。成人のまれながんは年間発生率が10万人当たり6例未満のがんとして定義され、欧州連合で診断されるすべてのがんの最大24%および米国で診断されるすべてのがんの約20%を占めると推定される。[ 5 ][ 6 ]また、小児のまれな腫瘍の指定は、以下に示すように国際的グループ間で統一されていない:
- イタリアの小児にまれな腫瘍に関する共同プロジェクト(Tumori Rari in Eta Pediatrica [TREP])では、小児にまれな腫瘍を年間発生率が100万人当たり2例未満で、他の臨床試験の対象とならない腫瘍と定義している。[ 7 ]
- 小児腫瘍学グループはまれな小児がんについて、International Classification of Childhood CancerのサブグループXIにリスト化されているものと定義することを選択しており、その中には、甲状腺がん、黒色腫および非黒色腫皮膚がん、および多種類のがん腫(例、副腎皮質がん、上咽頭がん、乳がんおよび大腸がんなどのほとんどの成人型のがん腫)がある。[
8
]これらの診断は、0~14歳の小児に診断されるがんの約4%を占めるのに対し、15~19歳の青年に診断されるがんでは約20%を占める。[
9
]
サブグループXI内のがんのほとんどは黒色腫または甲状腺がんのいずれかであり、サブグループXIの残りのがんの種類は、0~14歳の小児がんの1.3%および15~19歳の青年のがんの5.3%を占めるに過ぎない。
このようなまれながんは、個々の診断を受ける患者の発生率が低いこと、青年集団にまれながんが多いこと、およびまれながんの青年についての臨床試験が行われていないことから、研究がきわめて困難である。
これらの腫瘍に関する情報は、PDQ要約の甲状腺がんの治療(成人)のように成人のがんに関連する情報源でも記載されている場合がある。
参考文献- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010.[PUBMED Abstract]
- Corrigan JJ, Feig SA; American Academy of Pediatrics: Guidelines for pediatric cancer centers. Pediatrics 113 (6): 1833-5, 2004.[PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- Ward E, DeSantis C, Robbins A, et al.: Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 64 (2): 83-103, 2014 Mar-Apr.[PUBMED Abstract]
- Gatta G, Capocaccia R, Botta L, et al.: Burden and centralised treatment in Europe of rare tumours: results of RARECAREnet-a population-based study. Lancet Oncol 18 (8): 1022-1039, 2017.[PUBMED Abstract]
- DeSantis CE, Kramer JL, Jemal A: The burden of rare cancers in the United States. CA Cancer J Clin 67 (4): 261-272, 2017.[PUBMED Abstract]
- Ferrari A, Bisogno G, De Salvo GL, et al.: The challenge of very rare tumours in childhood: the Italian TREP project. Eur J Cancer 43 (4): 654-9, 2007.[PUBMED Abstract]
- Pappo AS, Krailo M, Chen Z, et al.: Infrequent tumor initiative of the Children's Oncology Group: initial lessons learned and their impact on future plans. J Clin Oncol 28 (33): 5011-6, 2010.[PUBMED Abstract]
- Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2012. Bethesda, Md: National Cancer Institute, 2015. Also available online. Last accessed February 20, 2020.[PUBMED Abstract]
- 本要約の変更点(06/08/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
臨床像および予後因子
本文に、計57人の甲状腺髄様がん患者および17人のC細胞過形成患者が特定されたGerman Society for Pediatric Oncology and HematologyのMalignant Endocrine Tumorsレジストリー研究の結果に関する記述が追加された(引用、参考文献12としてKuhlen et al.および証拠レベル:3iA)。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、小児甲状腺がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Denise Adams, MD(Children's Hospital Boston)
- Karen J. Marcus, MD, FACR (Dana-Farber Cancer Institute/Boston Children's Hospital)
- Paul A. Meyers, MD(Memorial Sloan-Kettering Cancer Center)
- Thomas A. Olson, MD (Aflac Cancer and Blood Disorders Center of Children's Healthcare of Atlanta - Egleston Campus)
- Alberto S. Pappo, MD(St. Jude Children's Research Hospital)
- Arthur Kim Ritchey, MD(Children's Hospital of Pittsburgh of UPMC)
- Carlos Rodriguez-Galindo, MD(St. Jude Children's Research Hospital)
- Stephen J. Shochat, MD(St. Jude Children's Research Hospital)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Childhood Thyroid Cancer Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/thyroid/hp/child-thyroid-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389315]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する