ご利用について
医療専門家向けの本PDQがん情報要約では、若年性骨髄単球性白血病の治療について、専門家の査読を経た、証拠に基づく情報を包括的に提供している。本要約は、患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。医療上の意思決定のための正式なガイドラインや推奨事項を提供するものではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的にレビューされ、随時更新される。本要約は独自の文献レビューの結果を反映するものであり、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 発生率
-
若年性骨髄単球性白血病(JMML)は、発生頻度が小児急性骨髄性白血病(AML)の約1/10である、まれな白血病である。年間発生率は100万人当たり約1~2例である。[ 1 ]JMMLは幼児で最もよくみられる骨髄増殖性腫瘍であり、発症年齢の中央値は約1.8歳である。男児に多い(男女比はおよそ2.5:1)。
参考文献- Passmore SJ, Chessells JM, Kempski H, et al.: Paediatric myelodysplastic syndromes and juvenile myelomonocytic leukaemia in the UK: a population-based study of incidence and survival. Br J Haematol 121 (5): 758-67, 2003.[PUBMED Abstract]
- 臨床像
-
診断時によくみられる臨床的特徴としては以下のものがある:[ 1 ]
白血球数の増加と循環血中単球数の増加がみられることもある。[ 1 ]
参考文献- Niemeyer CM, Arico M, Basso G, et al.: Chronic myelomonocytic leukemia in childhood: a retrospective analysis of 110 cases. European Working Group on Myelodysplastic Syndromes in Childhood (EWOG-MDS) Blood 89 (10): 3534-43, 1997.[PUBMED Abstract]
- WHO分類
-
世界保健機関(WHO)は、若年性骨髄単球性白血病(JMML)をRAS経路の活性化に起因する小児期早期の骨髄増殖性腫瘍(MPN)として分類している。[ 1 ]
急性骨髄性白血病(AML)の分類に関する情報については、「小児急性骨髄性白血病の治療」の小児AMLのWHO分類のセクションを参照のこと。
参考文献- Khoury JD, Solary E, Abla O, et al.: The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 36 (7): 1703-1719, 2022.[PUBMED Abstract]
- 診断基準
-
若年性骨髄単球性白血病(JMML)を示唆する臨床像を呈する小児において、確定診断に現在用いられている基準を表1に示す。[ 1 ]
表1.血液リンパ系腫瘍のWHO分類第5版によるJMMLの診断基準 GM-CSF = 顆粒球マクロファージコロニー刺激因子;JMML = 若年性骨髄単球性白血病;WHO = 世界保健機関。 aPTPN11、KRAS、またはNRAS(ヌーナン症候群の原因となる)の生殖細胞系多様体は、JMML様の一過性の骨髄増殖性疾患引き起こす可能性がある。 bときにヘテロ接合性のスプライス部位の多様体がみられる症例もある。 cRRASまたはRRAS2など。 d遺伝学的基準を満たさない症例または遺伝子検査が利用できない場合。これらの患者は、臨床基準、血液学的基準、および検査基準に加えて、以下の基準を満たさなければならない。 臨床基準、血液学的基準、および臨床検査基準(診断にはすべての基準を満たす必要がある) 1.末梢血単球数が1×109/L以上である 2.芽球および前単球が末梢血および骨髄に占める割合が20%未満である 3.臓器浸潤の臨床所見が認められる(最も多いのは脾腫) 4.BCR::ABL1融合遺伝子が認められない 5.KMT2A再構成が認められない 遺伝学的基準(診断には1つの基準を満たせばよい) 1.典型的なRAS経路の構成要素または調節因子の多様体: a) PTPN11、KRAS、またはNRASのクローン性の体細胞多様体a b) NF1のクローン性体細胞多様体または生殖細胞系多様体およびNF1のヘテロ接合性の消失または複合ヘテロ接合性 c) CBLのクローン性体細胞多様体または生殖細胞系多様体およびCBLのヘテロ接合性の消失b 2.典型的でないRAS経路のクローン性の病的多様体cまたはRAS経路の上流に位置する遺伝子(ALK、PDGFRB、ROS1など)を活性化する融合 その他の基準(診断には2つ以上の基準を満たす必要がある)d 1.循環血中に骨髄系(前骨髄球、骨髄球、後骨髄球)および赤血球系前駆細胞を認める 2.ヘモグロビンF値が年齢の割に高い 3.過形成骨髄を伴う血小板減少を認める(しばしば巨核球低形成を伴う)。異形成の特徴は明らかな場合もあれば明らかでない場合もある 4.骨髄系前駆細胞がGM-CSFに対して高い感受性を示す(コロニー形成アッセイにより、または外来性GM-CSFの非存在下もしくは低用量の存在下でSTAT5のリン酸化を測定することにより検出する) 参考文献- Khoury JD, Solary E, Abla O, et al.: The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 36 (7): 1703-1719, 2022.[PUBMED Abstract]
- 発生機序および危険因子
-
若年性骨髄単球性白血病(JMML)の発生機序には、関連する症候群とともに、RASがん遺伝子経路の活性化が密接に関係している(図1を参照のこと)。[ 1 ][ 2 ]さらに、特有なRNAの発現およびDNAメチル化パターンも報告されている。それらのパターンは年齢などの臨床因子と相関し、予後と関連すると考えられている。[ 3 ][ 4 ]
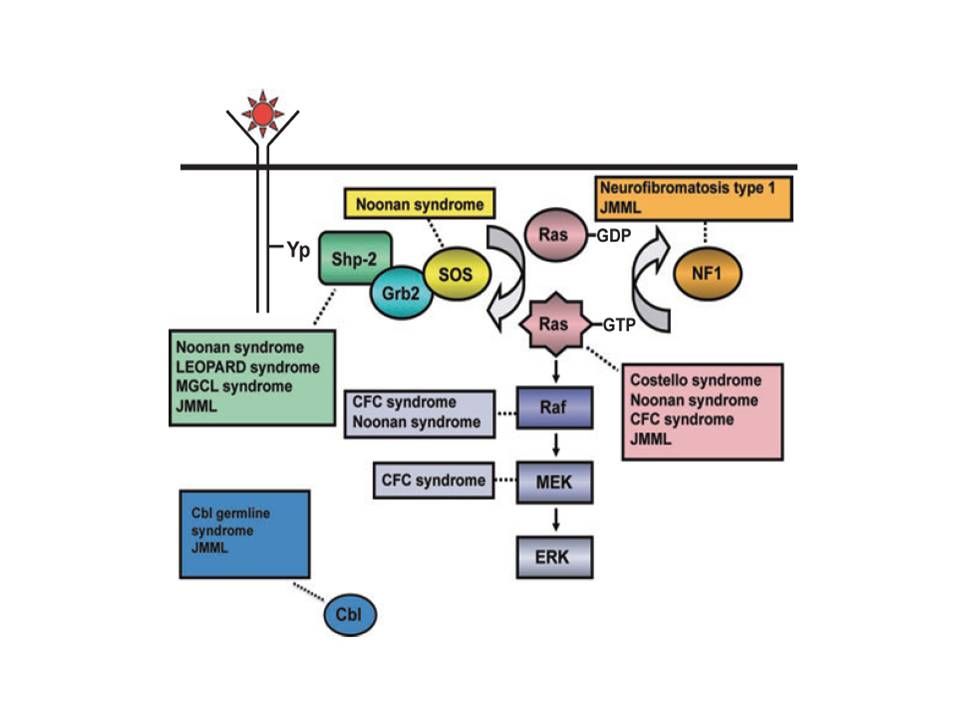
図1.リガンド刺激によるRas活性化、Ras-Erk経路、ならびに先天性神経心顔面皮膚障害およびJMMLに寄与することが現在までに判明している遺伝子変異を示した模式図。NL/MGCL:Noonan-like/multiple giant cell lesion、CFC:心顔面皮膚、JMML:若年性骨髄単球性白血病。Elsevieから許可を得て転載:Leukemia Research, 33 (3), Rebecca J. Chan, Todd Cooper, Christian P. Kratz, Brian Weiss, Mignon L. Loh, Juvenile myelomonocytic leukemia: A report from the 2nd International JMML Symposium, Pages 355-62, Copyright 2009. JMMLの発生リスク増加と関連がみられる症候群および遺伝的特徴としては以下のものがある:[ 5 ][ 6 ]
参考文献- Chan RJ, Cooper T, Kratz CP, et al.: Juvenile myelomonocytic leukemia: a report from the 2nd International JMML Symposium. Leuk Res 33 (3): 355-62, 2009.[PUBMED Abstract]
- Loh ML: Recent advances in the pathogenesis and treatment of juvenile myelomonocytic leukaemia. Br J Haematol 152 (6): 677-87, 2011.[PUBMED Abstract]
- Bresolin S, Zecca M, Flotho C, et al.: Gene expression-based classification as an independent predictor of clinical outcome in juvenile myelomonocytic leukemia. J Clin Oncol 28 (11): 1919-27, 2010.[PUBMED Abstract]
- Olk-Batz C, Poetsch AR, Nöllke P, et al.: Aberrant DNA methylation characterizes juvenile myelomonocytic leukemia with poor outcome. Blood 117 (18): 4871-80, 2011.[PUBMED Abstract]
- Stiller CA, Chessells JM, Fitchett M: Neurofibromatosis and childhood leukaemia/lymphoma: a population-based UKCCSG study. Br J Cancer 70 (5): 969-72, 1994.[PUBMED Abstract]
- Choong K, Freedman MH, Chitayat D, et al.: Juvenile myelomonocytic leukemia and Noonan syndrome. J Pediatr Hematol Oncol 21 (6): 523-7, 1999 Nov-Dec.[PUBMED Abstract]
- Niemeyer CM, Arico M, Basso G, et al.: Chronic myelomonocytic leukemia in childhood: a retrospective analysis of 110 cases. European Working Group on Myelodysplastic Syndromes in Childhood (EWOG-MDS) Blood 89 (10): 3534-43, 1997.[PUBMED Abstract]
- Tartaglia M, Niemeyer CM, Fragale A, et al.: Somatic mutations in PTPN11 in juvenile myelomonocytic leukemia, myelodysplastic syndromes and acute myeloid leukemia. Nat Genet 34 (2): 148-50, 2003.[PUBMED Abstract]
- Kratz CP, Niemeyer CM, Castleberry RP, et al.: The mutational spectrum of PTPN11 in juvenile myelomonocytic leukemia and Noonan syndrome/myeloproliferative disease. Blood 106 (6): 2183-5, 2005.[PUBMED Abstract]
- Strullu M, Caye A, Lachenaud J, et al.: Juvenile myelomonocytic leukaemia and Noonan syndrome. J Med Genet 51 (10): 689-97, 2014.[PUBMED Abstract]
- Loh ML, Sakai DS, Flotho C, et al.: Mutations in CBL occur frequently in juvenile myelomonocytic leukemia. Blood 114 (9): 1859-63, 2009.[PUBMED Abstract]
- Muramatsu H, Makishima H, Jankowska AM, et al.: Mutations of an E3 ubiquitin ligase c-Cbl but not TET2 mutations are pathogenic in juvenile myelomonocytic leukemia. Blood 115 (10): 1969-75, 2010.[PUBMED Abstract]
- Niemeyer CM, Kang MW, Shin DH, et al.: Germline CBL mutations cause developmental abnormalities and predispose to juvenile myelomonocytic leukemia. Nat Genet 42 (9): 794-800, 2010.[PUBMED Abstract]
- Pérez B, Mechinaud F, Galambrun C, et al.: Germline mutations of the CBL gene define a new genetic syndrome with predisposition to juvenile myelomonocytic leukaemia. J Med Genet 47 (10): 686-91, 2010.[PUBMED Abstract]
- Hecht A, Meyer JA, Behnert A, et al.: Molecular and phenotypic diversity of CBL-mutated juvenile myelomonocytic leukemia. Haematologica 107 (1): 178-186, 2022.[PUBMED Abstract]
- 若年性骨髄単球性白血病(JMML)のゲノム情報
-
JMMLの分子遺伝学的特徴
JMMLにおけるゲノムの全体像は、RAS経路の次の5つの遺伝子のいずれかにおける多様体を特徴とする:NF1、NRAS、KRAS、PTPN11、およびCBL。[ 1 ][ 2 ][ 3 ]RAS経路活性化多様体を有するJMMLと診断された連続症例118例の集積研究では、変異がみられた遺伝子としてはPTPN11が最も多く、全症例の51%を占めていた(19%が生殖細胞系および32%が体細胞変異)(図2を参照)。[ 1 ]NRAS多様体を有する患者が全症例の19%を占め、KRAS多様体を有する患者が15%を占めていた。NF1多様体は症例の8%を占め、CBL多様体は症例の11%を占めていた。これら5つの遺伝子の多様体は一般的に相互排他的であるが、症例の4%~17%はこのようなRAS経路の遺伝子の2つに多様体を有しており[ 1 ][ 2 ][ 3 ]、これは予後不良と関連する所見である。[ 1 ][ 3 ]
JMMLにおける白血病細胞の多様体の発生率は非常に低いが、前述の5つのRAS経路遺伝子以外のさらなる多様体が認められている。[ 1 ][ 2 ][ 3 ]転写抑制因子複合体PRC2の遺伝子に二次的なゲノム変化が認められている(例:全症例の7%~8%でASXL1の変異がみられた)。成人の骨髄増殖性腫瘍に関連する遺伝子の一部には、JMMLでも低率で変異が認められる(例:全症例の6%~9%でSETBP1の変異がみられた)。[ 1 ][ 2 ][ 3 ][ 4 ]JAK3多様体もJMML症例のわずかな割合(4%~12%)で認められている。[ 1 ][ 2 ][ 3 ][ 4 ]生殖細胞系PTPN11および生殖細胞系CBL多様体を有する症例はさらなる多様体を低率で示した(図2を参照のこと)。[ 1 ]疾患を定義するRAS経路の多様体以外の多様体の存在が、より不良な予後に関連している。[ 1 ][ 2 ]
JMMLのゲノムの全体像を記載した報告では、150人中16人(11%)の患者で典型的なRAS経路の多様体が認められなかったことが明らかにされた。これら16人の患者のうち、3人は受容体チロシンキナーゼが関与するインフレーム融合(DCTN1::ALK、RANBP2::ALK、およびTBL1XR1::ROS1遺伝子融合)を有することが観察された。これらの患者は全員が7モノソミーを有し、生後56カ月以上であった。ALK融合が認められた1人の患者は、クリゾチニブ + 従来の化学療法で治療され、分子遺伝学的完全寛解を達成し、同種骨髄移植に進んだ。[ 3 ]
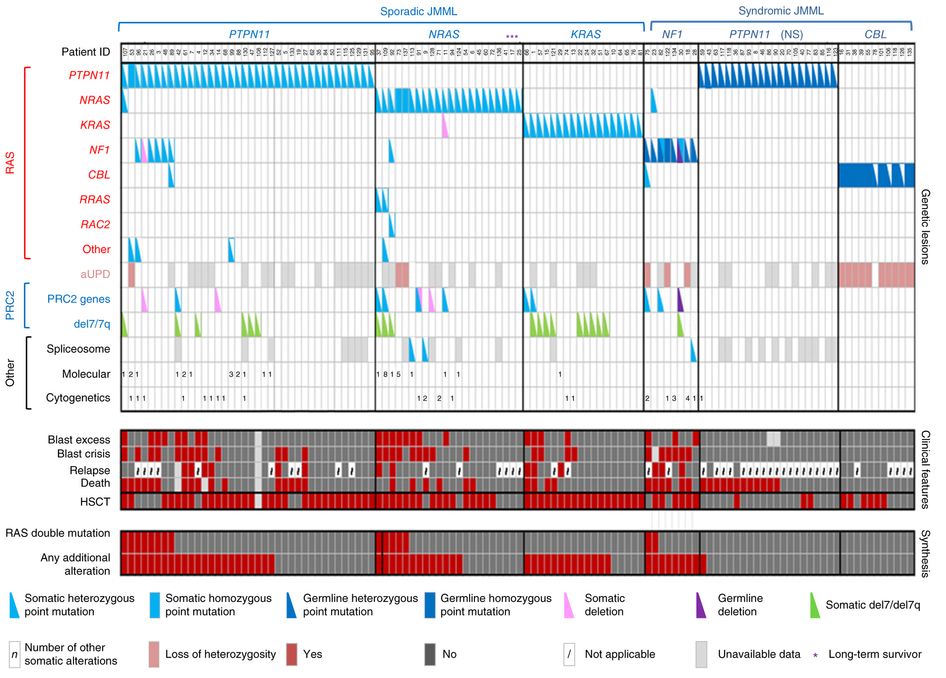
図2.個別のJMML症例における変異プロファイル。詳細な遺伝子解析を受けたJMML患者118人について、RAS経路およびPRC2ネットワークで反復ヒットが生じた生殖細胞系および体細胞変異が示されている。芽球過剰は、診断時点で骨髄中にある有核細胞のうち芽球数が10%以上から20%未満の場合と定義された。急性転化’(blast crisis)は、骨髄中にある有核細胞のうち芽球数が20%以上の割合と定義された。NS = ヌーナン症候群。Macmillan Publishers Ltdから許諾を得て転載:Nature Genetics (Caye A, Strullu M, Guidez F, et al.: Juvenile myelomonocytic leukemia displays mutations in components of the RAS pathway and the PRC2 network.Nat Genet 47 [11]: 1334-40, 2015), copyright (2015). ゲノムおよび分子遺伝学的予後因子
以下を含むいくつかのゲノム因子がJMML患者の予後に影響を及ぼす:
-
RAS経路以外の多様体の数:JMMLの患児における予後予測因子として、疾患を定義するRAS経路のもの以外の多様体の数がある。[
1
][
2
]
- ある研究での観察によると、診断時に同定された体細胞変異(病的多様体または7モノソミー)の数は、64人(65.3%)で0または1つ、34人(34.7%)で2つ以上であった。[ 2 ]多変量解析では、多様体の数(2つ以上 vs 0~1つ)はイベントフリー生存期間(EFS)および全生存期間(OS)不良の予測因子として有意性を維持した。2つ以上の変異があると診断された患者では、比較的年長かつ男児である割合が高く、それらの患者では7モノソミーまたは体細胞NF1多様体の保有率が高いことも実証された。[ 2 ]
- 別の研究では、約60%の患者において疾患を定義するRAS経路のもの以外の多様体が認められた。それらの患者では、追加の多様体が認められなかった患者と比較して、OSが不良であった(3年OS率、それぞれ61% vs 85%)。[ 1 ]
- 3つ目の研究では、多様体が0~1つの患者と比較して、多様体が2つ以上ある患者ではOSが不良になる傾向が観察された。[ 3 ]
-
RAS経路の二重多様体:JMMLに関連する5つの典型的なRAS経路遺伝子(NF1、NRAS、KRAS、PTPN11、およびCBL)における多様体は、一般に相互排他的であるが、4%~17%の症例ではこれらのRAS経路遺伝子の2つに多様体が認められる。[
1
][
2
]この所見には予後不良との関連が報告されている。[
1
][
2
]
-
DNAメチル化プロファイル:
- ある研究において、39人のJMML患者からなる発見コホートと40人の患者からなる検証コホートに対して、DNAメチル化プロファイリングが適用された。両コホートともメチル化レベルが高、中、低と明確に異なるJMMLのサブセットが観察された。メチル化レベルが最も低かった患者群は生存率が最も高く、メチル化レベルが低かった15人の患者群では1人を除く全員で自然消退が得られた。高メチル化にEFS率低下との関連が認められた。[ 5 ]
- 別の研究では、106人のJMML患者からなるコホートに対して、DNAメチル化プロファイリングが適用された。この研究では、メチル化プロファイルが高かった1つのサブグループとメチル化プロファイルが低かった1つのサブグループが観察された。高メチル化群では、低メチル化群よりもOS率が有意に低かった(5年OS率でそれぞれ46% vs 73%)。また高メチル化群では、低メチル化群よりも5年無移植生存率も有意に低かった(2.2%;95%CI、0.2%-10.1% vs 41.2%;95%CI、27.1%-54.8%)。高メチル化に複数の多様体、胎児ヘモグロビン高値、比較的高い年齢、および診断時の血小板数低値との関連が認められた。ヌーナン症候群の患者はすべて低メチル化群であった。[ 3 ]
- ある研究では、CBL多様体を有するJMML患者33人について調査された。この研究では、メチル化レベルが低い患者31人と中等度の患者2人が同定された。メチル化レベルが中等度の小児はいずれもHSCT後に再発した。メチル化レベルが低かった31人の患者では、治療法(経過観察のみも含まれる)にばらつきがあったため、メチル化プロファイルが治療法の決定や治療成績に及ぼす影響を十分に評価することができなかった。しかしながら、メチル化状態は自然消退の予測因子ではなかった。[ 6 ]
-
LIN28B過剰発現:LIN28B過剰発現は、JMML患児の約半数に認められ、生物学的に特徴的なJMMLサブセットが同定される。LIN28Bは幹細胞の再生を調節するRNA結合蛋白の1つである。[
7
]
参考文献- Caye A, Strullu M, Guidez F, et al.: Juvenile myelomonocytic leukemia displays mutations in components of the RAS pathway and the PRC2 network. Nat Genet 47 (11): 1334-40, 2015.[PUBMED Abstract]
- Stieglitz E, Taylor-Weiner AN, Chang TY, et al.: The genomic landscape of juvenile myelomonocytic leukemia. Nat Genet 47 (11): 1326-33, 2015.[PUBMED Abstract]
- Murakami N, Okuno Y, Yoshida K, et al.: Integrated molecular profiling of juvenile myelomonocytic leukemia. Blood 131 (14): 1576-1586, 2018.[PUBMED Abstract]
- Sakaguchi H, Okuno Y, Muramatsu H, et al.: Exome sequencing identifies secondary mutations of SETBP1 and JAK3 in juvenile myelomonocytic leukemia. Nat Genet 45 (8): 937-41, 2013.[PUBMED Abstract]
- Stieglitz E, Mazor T, Olshen AB, et al.: Genome-wide DNA methylation is predictive of outcome in juvenile myelomonocytic leukemia. Nat Commun 8 (1): 2127, 2017.[PUBMED Abstract]
- Hecht A, Meyer JA, Behnert A, et al.: Molecular and phenotypic diversity of CBL-mutated juvenile myelomonocytic leukemia. Haematologica 107 (1): 178-186, 2022.[PUBMED Abstract]
- Helsmoortel HH, Bresolin S, Lammens T, et al.: LIN28B overexpression defines a novel fetal-like subgroup of juvenile myelomonocytic leukemia. Blood 127 (9): 1163-72, 2016.[PUBMED Abstract]
-
RAS経路以外の多様体の数:JMMLの患児における予後予測因子として、疾患を定義するRAS経路のもの以外の多様体の数がある。[
1
][
2
]
- 臨床的予後因子
-
過去には、化学療法を実施しても、90%を超える若年性骨髄単球性白血病(JMML)患者が死亡した。[ 1 ]しかしながら、現在では造血幹細胞移植の適用により、約50%の生存率が認められている。[ 2 ]患者は、以下の3つの異なる臨床経過をたどるようである:
- 急速進行性疾患および早期死亡。
- 一時的な疾患安定後に進行および死亡。
- 進行するまで、最大で9年間の臨床的改善、またはまれに長期生存。
治療を行った場合の生存期間に関する予後良好因子としては以下のものがある:[ 3 ][ 4 ]
- 年齢が2歳未満であること。
- 血小板数が33×109/Lを超えていること。
- 年齢調整胎児ヘモグロビンが低値であること。
対照的に、2歳以上であることと診断時の血中胎児ヘモグロビン値が高いことは、予後不良の予測因子である。[ 3 ][ 4 ]
参考文献- Freedman MH, Estrov Z, Chan HS: Juvenile chronic myelogenous leukemia. Am J Pediatr Hematol Oncol 10 (3): 261-7, 1988 Fall.[PUBMED Abstract]
- Locatelli F, Nöllke P, Zecca M, et al.: Hematopoietic stem cell transplantation (HSCT) in children with juvenile myelomonocytic leukemia (JMML): results of the EWOG-MDS/EBMT trial. Blood 105 (1): 410-9, 2005.[PUBMED Abstract]
- Niemeyer CM, Arico M, Basso G, et al.: Chronic myelomonocytic leukemia in childhood: a retrospective analysis of 110 cases. European Working Group on Myelodysplastic Syndromes in Childhood (EWOG-MDS) Blood 89 (10): 3534-43, 1997.[PUBMED Abstract]
- Passmore SJ, Chessells JM, Kempski H, et al.: Paediatric myelodysplastic syndromes and juvenile myelomonocytic leukaemia in the UK: a population-based study of incidence and survival. Br J Haematol 121 (5): 758-67, 2003.[PUBMED Abstract]
- がんの小児の治療に関する特別な考慮事項
-
小児および青年のがんはまれであるが、全体の発生率は1975年以降徐々に上昇してきている。[ 1 ]小児および青年のがん患者は、小児期および青年期に発生するがんの治療経験を有するがん専門医で構成される集学的チームを擁する医療機関に紹介すべきである。[ 2 ]この集学的チームのアプローチには、小児が至適な生存期間および生活の質を達成できる治療、支持療法、およびリハビリテーションを受けられることを保証するべく、以下に該当する小児専門医およびその他の専門職の技能が必要とされる。
- プライマリケア医
- 小児外科医
- 病理医
- 小児放射線腫瘍医
- 小児腫瘍内科医および血液専門医
- リハビリテーション専門医
- 小児腫瘍専門看護師
- ソーシャルワーカー
- チャイルドライフ専門職
- 心理士
- 栄養士
がんの小児および青年に対する支持療法に関する具体的な情報については、支持療法および緩和ケアの要約を参照のこと。
米国小児科学会によって、小児がん施設とそれらががんの小児および青年の治療において担う役割に関するガイドラインが概説されている。[ 3 ]それらの施設では、小児および青年に発生するがん種の大半について、それらを対象とする臨床試験が実施されており、大半の患者とその家族に参加の機会が提供されている。がんと診断された小児および青年を対象とする臨床試験は一般に、より優れている可能性がある治療法を最新の標準治療と比較するべくデザインされている。診断されたがんに対して標準治療が存在しない場合は、他の種類の臨床試験によって新しい治療法が検証される。小児がんに対する根治的治療法の特定において得られた進歩は、その大半が臨床試験を通じて達成されたものである。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Smith MA, Seibel NL, Altekruse SF, et al.: Outcomes for children and adolescents with cancer: challenges for the twenty-first century. J Clin Oncol 28 (15): 2625-34, 2010.[PUBMED Abstract]
- Wolfson J, Sun CL, Wyatt L, et al.: Adolescents and Young Adults with Acute Lymphoblastic Leukemia and Acute Myeloid Leukemia: Impact of Care at Specialized Cancer Centers on Survival Outcome. Cancer Epidemiol Biomarkers Prev 26 (3): 312-320, 2017.[PUBMED Abstract]
- American Academy of Pediatrics: Standards for pediatric cancer centers. Pediatrics 134 (2): 410-4, 2014. Also available online. Last accessed December 15, 2023.[PUBMED Abstract]
- JMMLの治療
-
若年性骨髄単球性白血病(JMML)に対する治療選択肢としては以下のものがある:
- 造血幹細胞移植(HSCT)
HSCT
現時点でJMMLを根治できる可能性が最も高い治療法はHSCTである。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ]
証拠(HSCT):
- European Working Group on Childhood Myelodysplastic Syndromesの研究では、ブスルファン、シクロホスファミド、およびメルファランの一般的な前処置レジメンによる治療(抗胸腺細胞グロブリンを併用した場合も含む)を受けた複数施設の移植レシピエント100人が対象とされた。レシピエントはさまざまな強度の移植前化学療法または分化誘導薬による治療を受けており、脾像摘出術を受けた患者も含まれていた。[
2
]
- 5年イベントフリー生存率は、HLA一致家族ドナー細胞によるHSCTを受けたJMML患児が55%、非血縁ドナー細胞によるHSCTを受けたJMML患児が49%であった。
- 多変量解析では、急性骨髄性白血病(AML)向けの治療と類似したかつての化学療法を施行した場合と化学療法を低用量で施行するか施行しない場合とが比較され、生存期間に対する影響がみられないことが示された。
- 移植前の脾臓摘出術または脾臓の大きさについても、生存期間に対する影響は観察されなかった。
- 血縁ドナーと非血縁ドナーの比較では、成績に差はみられなかった。
- 転帰および再発リスクに関する予後不良因子であることが示されたものは、年齢4歳以上と性別が女性であることのみであった(年齢による相対リスク[RR]、2.24[1.07-4.69];P = 0.032;性別によるRR、2.22[1.09-4.50];P = 0.028)。[ 2 ]
- ある研究では、臍帯血移植で以下の結果が得られた:[
6
][証拠レベルC2]
- 5年無病生存率は44%であった。
- 診断時に1.4歳未満の小児、核型が7モノソミー以外の小児、およびHLA一致度5/6または6/6の臍帯血ユニットを移植された小児で成績の改善がみられた。
- これにより、臍帯血もこの集団の小児に対するドナーソースになりうることが示唆される。
- 一般に骨髄破壊的HSCTに不適格な患者に対して、移植の有害な副作用を減らすための強度減弱前処置レジメンの使用についても少数の患者で報告されている。[
7
][
8
]
- Children's Oncology Groupは、JMMLの小児を対象として標準強度の前処置レジメン(ブスルファン/シクロホスファミド/メルファラン)を強度減弱レジメン(ブスルファン/フルダラビン)と比較するランダム化試験を実施した。[
9
]
- この試験は、中間解析で強度減弱レジメンを受けた小児における再発/残存病変の頻度(9人中7人)が標準強度のレジメンを受けた小児(6人中1人)より高いことが明らかになった時点で登録が早期に中止された。
- Children's Oncology Groupは、JMMLの小児を対象として標準強度の前処置レジメン(ブスルファン/シクロホスファミド/メルファラン)を強度減弱レジメン(ブスルファン/フルダラビン)と比較するランダム化試験を実施した。[
9
]
HSCT後のJMML小児における治療失敗では、疾患再発が主な原因で、症例の30%~40%にみられる。[ 1 ][ 2 ][ 3 ]ドナーリンパ球輸注の役割は明らかではないが[ 10 ]、再発したJMML患者の約50%が2回目のHSCTによる治療を受けて効果が得られることを示す報告がある。[ 11 ]
あるプロスペクティブ研究では、造血幹細胞移植後に再発したJMMLの小児患者4人がアザシチジンで治療された。3人がアザシチジンに反応し、2回目の移植に進むことができた。[ 12 ]
JMMLの治療における従来の抗白血病療法の役割は確定していない。JMMLの治療における特定薬物の役割の決定は、奏効判定基準についてコンセンサスが得られていないため、複雑である。[ 13 ]JMMLに対する抗白血病活性が示されている薬剤として、エトポシド、シタラビン、チオプリン系薬剤(thioguanineおよびメルカプトプリン)、イソトレチノイン、ファルネシル阻害薬などがあるが、この中で転帰を改善する効果が示されているものはない。[ 13 ][ 14 ][ 15 ][ 16 ][ 17 ];[ 18 ][証拠レベルB4]
参考文献- Smith FO, King R, Nelson G, et al.: Unrelated donor bone marrow transplantation for children with juvenile myelomonocytic leukaemia. Br J Haematol 116 (3): 716-24, 2002.[PUBMED Abstract]
- Locatelli F, Nöllke P, Zecca M, et al.: Hematopoietic stem cell transplantation (HSCT) in children with juvenile myelomonocytic leukemia (JMML): results of the EWOG-MDS/EBMT trial. Blood 105 (1): 410-9, 2005.[PUBMED Abstract]
- Yusuf U, Frangoul HA, Gooley TA, et al.: Allogeneic bone marrow transplantation in children with myelodysplastic syndrome or juvenile myelomonocytic leukemia: the Seattle experience. Bone Marrow Transplant 33 (8): 805-14, 2004.[PUBMED Abstract]
- Baker D, Cole C, Price J, et al.: Allogeneic bone marrow transplantation in juvenile myelomonocytic leukemia without total body irradiation. J Pediatr Hematol Oncol 26 (3): 200-3, 2004.[PUBMED Abstract]
- Locatelli F, Niemeyer CM: How I treat juvenile myelomonocytic leukemia. Blood 125 (7): 1083-90, 2015.[PUBMED Abstract]
- Locatelli F, Crotta A, Ruggeri A, et al.: Analysis of risk factors influencing outcomes after cord blood transplantation in children with juvenile myelomonocytic leukemia: a EUROCORD, EBMT, EWOG-MDS, CIBMTR study. Blood 122 (12): 2135-41, 2013.[PUBMED Abstract]
- Yabe M, Sako M, Yabe H, et al.: A conditioning regimen of busulfan, fludarabine, and melphalan for allogeneic stem cell transplantation in children with juvenile myelomonocytic leukemia. Pediatr Transplant 12 (8): 862-7, 2008.[PUBMED Abstract]
- Koyama M, Nakano T, Takeshita Y, et al.: Successful treatment of JMML with related bone marrow transplantation after reduced-intensity conditioning. Bone Marrow Transplant 36 (5): 453-4; author reply 454, 2005.[PUBMED Abstract]
- Dvorak CC, Satwani P, Stieglitz E, et al.: Disease burden and conditioning regimens in ASCT1221, a randomized phase II trial in children with juvenile myelomonocytic leukemia: A Children's Oncology Group study. Pediatr Blood Cancer 65 (7): e27034, 2018.[PUBMED Abstract]
- Yoshimi A, Bader P, Matthes-Martin S, et al.: Donor leukocyte infusion after hematopoietic stem cell transplantation in patients with juvenile myelomonocytic leukemia. Leukemia 19 (6): 971-7, 2005.[PUBMED Abstract]
- Yoshimi A, Mohamed M, Bierings M, et al.: Second allogeneic hematopoietic stem cell transplantation (HSCT) results in outcome similar to that of first HSCT for patients with juvenile myelomonocytic leukemia. Leukemia 21 (3): 556-60, 2007.[PUBMED Abstract]
- Rubio-San-Simón A, van Eijkelenburg NKA, Hoogendijk R, et al.: Azacitidine (Vidaza®) in Pediatric Patients with Relapsed Advanced MDS and JMML: Results of a Phase I/II Study by the ITCC Consortium and the EWOG-MDS Group (Study ITCC-015). Paediatr Drugs 25 (6): 719-728, 2023.[PUBMED Abstract]
- Bergstraesser E, Hasle H, Rogge T, et al.: Non-hematopoietic stem cell transplantation treatment of juvenile myelomonocytic leukemia: a retrospective analysis and definition of response criteria. Pediatr Blood Cancer 49 (5): 629-33, 2007.[PUBMED Abstract]
- Castleberry RP, Emanuel PD, Zuckerman KS, et al.: A pilot study of isotretinoin in the treatment of juvenile chronic myelogenous leukemia. N Engl J Med 331 (25): 1680-4, 1994.[PUBMED Abstract]
- Woods WG, Barnard DR, Alonzo TA, et al.: Prospective study of 90 children requiring treatment for juvenile myelomonocytic leukemia or myelodysplastic syndrome: a report from the Children's Cancer Group. J Clin Oncol 20 (2): 434-40, 2002.[PUBMED Abstract]
- Loh ML: Childhood myelodysplastic syndrome: focus on the approach to diagnosis and treatment of juvenile myelomonocytic leukemia. Hematology Am Soc Hematol Educ Program 2010: 357-62, 2010.[PUBMED Abstract]
- Hasle H: Myelodysplastic and myeloproliferative disorders in children. Curr Opin Pediatr 19 (1): 1-8, 2007.[PUBMED Abstract]
- Stieglitz E, Ward AF, Gerbing RB, et al.: Phase II/III trial of a pre-transplant farnesyl transferase inhibitor in juvenile myelomonocytic leukemia: a report from the Children's Oncology Group. Pediatr Blood Cancer 62 (4): 629-36, 2015.[PUBMED Abstract]
- 臨床評価段階にある治療選択肢
-
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーを務める臨床試験に関する情報については、ClinicalTrials.govのウェブサイトを参照のこと。
以下は、現在実施されている国および/または医療機関が主導する臨床試験の例である:
- NCT05849662(若年性骨髄単球性白血病[JMML]の初発患者を対象としたトラメチニブとアザシチジンの第I/II相研究):この臨床試験では、JMML患者を対象としてトラメチニブとアザシチジンの併用の安全性および有効性が検討される。
- 本要約の最新更新(2024/06/14)
-
PDQがん情報要約は、定期的にレビューされ、新たな情報が得られ次第更新される。このセクションでは、上記の日付で本要約に加えられた最新の変更内容を記載する。
若年性骨髄単球性白血病(JMML)の治療
本文に以下の記述が追加された;あるプロスペクティブ研究では、造血幹細胞移植後に再発したJMMLの小児患者4人がアザシチジンで治療された。3人がアザシチジンに反応し、2回目の移植に進むことができた(参考文献12としてRubio-San-Simón et al.を引用)。
臨床評価段階にある治療選択肢
JMMLの初発患者を対象として実施中のオープン臨床試験としてNCT05849662が追加された。
本要約の作成および更新作業はPDQ Pediatric Treatment Editorial Boardが行っており、同委員会は編集面においてNCIから独立している。本要約は独自の文献レビューの結果を反映するものであり、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の要約方針および役割に関する詳しい情報については、本PDQ要約についておよびPDQ® Cancer Information for Health Professionalsのページを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、若年性骨髄単球性白血病の治療について、専門家の査読を経た、証拠に基づく情報を包括的に提供している。本要約は、患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。医療上の意思決定のための正式なガイドラインや推奨事項を提供するものではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的にレビューされ、随時更新される。本要約は独自の文献レビューの結果を反映するものであり、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、直近で発表された記事をレビューし、個々の記事について以下を行うべきかどうかを判断する:
- ミーティングで議論する
- 本文で引用する
- すでに引用されている既存の記事と差し替える、既存の記事を更新する
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Alan Scott Gamis, MD, MPH (Children's Mercy Hospital)
- Karen J. Marcus, MD, FACR (Dana-Farber Cancer Institute/Boston Children's Hospital)
- Jessica Pollard, MD (Dana-Farber/Boston Children's Cancer and Blood Disorders Center)
- Michael A. Pulsipher, MD (Huntsman Cancer Institute at University of Utah)
- Rachel E. Rau, MD (University of Washington School of Medicine, Seatle Children’s)
- Lewis B. Silverman, MD(Dana-Farber Cancer Institute/Boston Children's Hospital)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
- Sarah K. Tasian, MD (Children's Hospital of Philadelphia)
本要約の内容についてコメントまたは質問がある場合は、NCIウェブサイトのEmail UsからCancer.govに連絡されたい。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用されている参考文献の一部には証拠レベルの指定が明記されている。それらの指定は、読者が特定の介入またはアプローチの利用を支持している証拠の強さを評価する上で参考になることを意図したものである。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を策定するにあたり公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約として特定することはできない。ただし、著者は“NCI’s PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋】.”のような一文を記載することができる。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Juvenile Myelomonocytic Leukemia Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>. Available at: https://www.cancer.gov/types/leukemia/hp/child-aml-treatment-pdq/childhood-jmml-treatment-pdq. Accessed <MM/DD/YYYY>.
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する