ご利用について
医療専門家向けの本PDQがん情報要約では、小児中枢神経系胚細胞腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 小児中枢神経系(CNS)胚細胞腫瘍に関する一般情報
-
胚細胞腫瘍(GCT)を含む原発性脳腫瘍は、小児の最も一般的な充実性腫瘍をともに構成する多様な疾病からなる1つのグループである。CNS腫瘍の最新の分類では、組織像に加えて、初めて分子パラメータを採用して、脳腫瘍の疾患群を定義している。これによって、胚芽腫やグリオーマなどの一部の種類のCNS腫瘍が再構成されることになった;しかしながら、この改訂された分類スキームによると、頭蓋内GCTを分類するために使用される分子パラメータはない。腫瘍部位および疾患の程度(脳浸潤および腫瘍の拡がり)は、依然として治療および予後に影響する重要な因子である。
原発性CNS GCTは、多種多様な腫瘍群で、北米および欧州より日本および他のアジア諸国で多くみられる。北米で、原発性脳腫瘍全体の約4%を占め、最高の発生率は10~19歳にみられ、男性の松果体部位に多く発生する。[ 1 ][ 2 ][ 3 ]
CNS GCTは、腫瘍マーカーを含む臨床病理学的および検査的特徴に基づいて、胚細胞腫と胚細胞腫以外の胚細胞腫瘍(NGGCT)に大きく分類される。[ 4 ][ 5 ]日本における代替の治療上の分類では、予後に基づいて3つのグループに区別している:予後良好(胚細胞腫など)、中間の予後(悪性転換を伴う奇形腫など)、予後不良(卵黄嚢腫瘍、絨毛がん、胎児性がん、およびこれらの混合腫瘍など)。[ 4 ]
PDQ小児脳腫瘍の治療要約は、主に中枢神経系腫瘍に関する世界保健機関の分類に従って構成されている。[ 4 ][ 5 ]CNS腫瘍の分類の詳しい説明と各種の脳腫瘍に対応する治療要約へのリンクについては、小児脳腫瘍および脊髄腫瘍の治療の概要に関するPDQ要約を参照のこと。
発生率
西洋諸国におけるGCTは、小児における原発性脳腫瘍の3~4%を占めている;しかしながら、日本およびアジアのシリーズでは、CNS GCTの発生率が小児CNS腫瘍の約15%であると報告されている。[ 3 ][ 6 ][ 7 ][ 8 ]このような違いについて、ゲノム的および環境的な要因は依然として不明である。
解剖学
CNS GCTは通常、脳の松果体および/または鞍上部の孤立性または多発性病変として発生する(図1を参照のこと)。最も多い原発部位は松果体(45%)で、次に多いのが下垂体漏斗または下垂体柄内の鞍上部(30%)である。これらの部位のいずれも実質外(extra-axial)または非実質(nonparenchymal)のCNS部位と考えられる。患者の約5~10%が鞍上部および松果体部の両方に生じた同時性腫瘍を呈するが、その組織像は胚細胞腫が最も頻度が高い。[ 8 ]GCTの発生率は女児よりも男児の方が高く、男児では松果体原発腫瘍が優勢である。まれではあるが、この他の病変の部位としては、基底核、脳室、視床、大脳半球、髄質が挙げられる。[ 9 ][ 10 ]
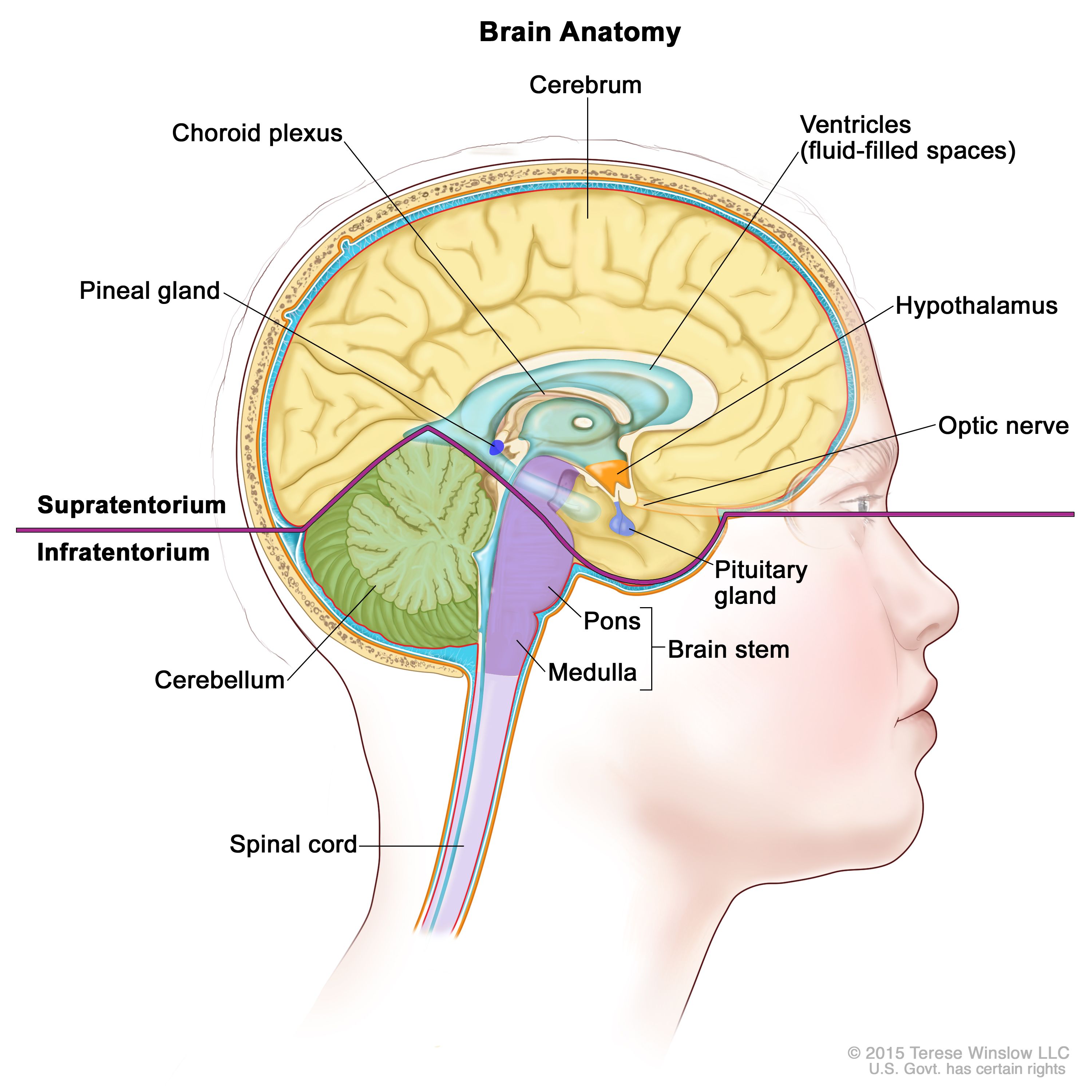
図1.脳内部の解剖図。テント上には、大脳、脳室(青色の部分が脳脊髄液)、脈絡叢、視床下部、松果体、下垂体、視神経がある。テント下には、小脳、脳幹(脳橋、延髄)がある。 分子的特徴
頭蓋内GCT 62例についての1件の研究では、次世代塩基配列決定法、一塩基多型アレイ、発現アレイにより、KIT/RASシグナル伝達経路(症例の50%)およびAKT/mTOR経路(症例の19%)における高頻度の変異が明らかになった。[ 11 ]
CNS腫瘍形成に関与している可能性のある遺伝子および具体的な経路を特定するために、一塩基多型分析法および定量的リアルタイムポリメラーゼ連鎖反応を用いたDNAコピー数変化およびヘテロ接合性の消失に関する腫瘍のプロファイリングが実施された。これらの研究により、CCND2(12p13)およびRB1(13q14)の変化が明らかになり、腫瘍の形成にサイクリン/CDK-RB-E2F経路が関与している可能性が示唆された。PRDM14(8q13)の増幅も認められた。[ 12 ]
頭蓋内GCT 49例を対象とした別の研究では、KITおよびRASの変異性活性化(56%)、ゲノム全体の低メチル化、染色体不安定性(12pの増加が82%で、13qの欠失が45%でみられた)が高率で確認された。ゲノム全体の低メチル化は発生初期の原始胚細胞のそれと類似していた。[ 13 ]
臨床的特徴
CNS GCTの徴候および症状は、以下に示す脳内の腫瘍の位置に依存する:
遺尿症、食欲不振、精神的愁訴[ 17 ]などの非特異的症状が診断の遅れにつながる一方、頭蓋内圧亢進または視覚の変化の徴候は早期診断につながる傾向がある。[ 18 ]
診断的評価
CNS GCTのX線像の特徴から、胚細胞腫とNGGCTまたは他のCNS腫瘍とを信頼性をもって鑑別することはできない。GCTの診断は以下に基づく:
CNS GCTが疑われる場合の診断および臨床的障害や転移の範囲の評価は、通常以下の検査で確認できる:
可能であれば、内分泌機能低下および頭蓋内圧亢進の症状が消退した後に、ベースラインの神経心理学検査を実施すべきである。
GCTの診断では、血清および/またはCSFにおいて特徴的な腫瘍マーカーの上昇がみられる場合を除いて、しばしば腫瘍の生検が必要となる。腫瘍マーカーが陰性またはわずかに上昇しているが診断基準を下回っている場合や、何らかの非特徴的な所見がみられる場合は、腫瘍の生検が実施される。
適切な病期分類および純粋な胚細胞腫とNGGCTの鑑別がきわめて重要である。化学療法および放射線療法の計画は、GCTの種類および疾患の程度に応じて著しく異なる。
参考文献- Matsutani M, Sano K, Takakura K, et al.: Primary intracranial germ cell tumors: a clinical analysis of 153 histologically verified cases. J Neurosurg 86 (3): 446-55, 1997.[PUBMED Abstract]
- Matsutani M; Japanese Pediatric Brain Tumor Study Group: Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol 54 (3): 311-6, 2001.[PUBMED Abstract]
- Ostrom QT, Gittleman H, Liao P, et al.: CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncol 19 (suppl_5): v1-v88, 2017.[PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. Lyon, France: IARC Press, 2016.[PUBMED Abstract]
- Louis DN, Ohgaki H, Wiestler OD, et al.: The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 114 (2): 97-109, 2007.[PUBMED Abstract]
- Committee of Brain Tumor Registry of Japan: Report of Brain Tumor Registry of Japan (1969-1996). Neurol Med Chir (Tokyo) 43 (Suppl): i-vii, 1-111, 2003.[PUBMED Abstract]
- The Committee of Brain Tumor Registry of Japan: Brain Tumor Registry of Japan (2001–2004). Neurol Med Chir (Tokyo) 54 (Suppl): 1-102, 2014. Also available online. Last accessed December 17, 2019.[PUBMED Abstract]
- Weksberg DC, Shibamoto Y, Paulino AC: Bifocal intracranial germinoma: a retrospective analysis of treatment outcomes in 20 patients and review of the literature. Int J Radiat Oncol Biol Phys 82 (4): 1341-51, 2012.[PUBMED Abstract]
- Goodwin TL, Sainani K, Fisher PG: Incidence patterns of central nervous system germ cell tumors: a SEER Study. J Pediatr Hematol Oncol 31 (8): 541-4, 2009.[PUBMED Abstract]
- Villano JL, Propp JM, Porter KR, et al.: Malignant pineal germ-cell tumors: an analysis of cases from three tumor registries. Neuro Oncol 10 (2): 121-30, 2008.[PUBMED Abstract]
- Wang L, Yamaguchi S, Burstein MD, et al.: Novel somatic and germline mutations in intracranial germ cell tumours. Nature 511 (7508): 241-5, 2014.[PUBMED Abstract]
- Terashima K, Yu A, Chow WY, et al.: Genome-wide analysis of DNA copy number alterations and loss of heterozygosity in intracranial germ cell tumors. Pediatr Blood Cancer 61 (4): 593-600, 2014.[PUBMED Abstract]
- Schulte SL, Waha A, Steiger B, et al.: CNS germinomas are characterized by global demethylation, chromosomal instability and mutational activation of the Kit-, Ras/Raf/Erk- and Akt-pathways. Oncotarget 7 (34): 55026-55042, 2016.[PUBMED Abstract]
- Afzal S, Wherrett D, Bartels U, et al.: Challenges in management of patients with intracranial germ cell tumor and diabetes insipidus treated with cisplatin and/or ifosfamide based chemotherapy. J Neurooncol 97 (3): 393-9, 2010.[PUBMED Abstract]
- Hoffman HJ, Otsubo H, Hendrick EB, et al.: Intracranial germ-cell tumors in children. J Neurosurg 74 (4): 545-51, 1991.[PUBMED Abstract]
- Sethi RV, Marino R, Niemierko A, et al.: Delayed diagnosis in children with intracranial germ cell tumors. J Pediatr 163 (5): 1448-53, 2013.[PUBMED Abstract]
- Malbari F, Gershon TR, Garvin JH, et al.: Psychiatric manifestations as initial presentation for pediatric CNS germ cell tumors, a case series. Childs Nerv Syst 32 (8): 1359-62, 2016.[PUBMED Abstract]
- Crawford JR, Santi MR, Vezina G, et al.: CNS germ cell tumor (CNSGCT) of childhood: presentation and delayed diagnosis. Neurology 68 (20): 1668-73, 2007.[PUBMED Abstract]
- Allen J, Chacko J, Donahue B, et al.: Diagnostic sensitivity of serum and lumbar CSF bHCG in newly diagnosed CNS germinoma. Pediatr Blood Cancer 59 (7): 1180-2, 2012.[PUBMED Abstract]
- 小児CNS胚細胞腫瘍の細胞分類
-
頭蓋内胚細胞腫瘍(GCT)の発生機序は不明である。胚細胞理論(germ cell theory)では、中枢神経系(CNS)GCTは、異常に移動し、悪性転換を起こした原始胚細胞から発生すると提唱されている。61例のGCTに関するゲノムワイドメチル化プロファイリング研究で、この仮説が裏付けられる。[ 1 ]対立する仮説の胎児性細胞理論(embryonic cell theory)では、GCTは、正常な発達段階の信号を逃し、CNS GCTに進行する多能性の胎児性細胞から発生すると提唱されている。[ 2 ][ 3 ]
GCTにみられるゲノムの変化を比較した過去の研究では、GCTが全身性であるか、CNS原発であるかにかかわらず、コピー数の変化はほぼ同じであることが示された。[ 4 ]
世界保健機関は、CNS GCTを以下のグループに分類している:[ 5 ]
さまざまなCNS GCTの顕微鏡的外観に加えて、血清および脳脊髄液(CSF)中にみられる腫瘍マーカー(腫瘍細胞により分泌されるα-フェトプロテイン[AFP]やヒト絨毛性ゴナドトロピンのβサブユニット[β-HCG]などの蛋白)が診断に役立つ(表1および表2を参照のこと)。
CNS GCTの診断および分類は、組織像単独、腫瘍マーカー単独、または両者の併用に基づいて行うことができる。[ 5 ][ 6 ][ 7 ]AFPおよびβ-HCG上昇の存在およびその程度に基づいて予後判定に腫瘍マーカーを使用する試みがある。これは進展している段階であり、北米、欧州、および日本における共同研究グループでは、わずかに異なる基準を採用している。例えば、米国および欧州のグループでは、血清および/またはCSFのAFP値が10ng/dL以上、かつ/または血清および/またはCSFのβ-HCG値が50IU/L以上である場合に分泌性または混合型GCTの腫瘍であるとみなしている;しかしながら、いくつかの欧州のグループおよびアジアのグループでは、血清および/またはCSFのAFP値が50ng/mL以上、かつ/またはβ-HCG値が100IU/L以上である場合に分泌性GCTの腫瘍と指定している。純粋な胚細胞腫および奇形腫の患者は、通常、腫瘍マーカーが陰性であるが、胚細胞腫の患者では、非常に低レベルのβ-HCGが検出されることがある。[ 8 ]
予後良好な胚細胞腫では、合胞体栄養細胞性成分によって低レベルのβ-HCGを分泌する可能性がある。胚細胞腫以外の胚細胞腫瘍(NGGCT)は、一種の悪性NGGCT(胎児性がん、卵黄嚢腫瘍、内胚葉洞腫瘍、絨毛がんなど)からなることも、GCT成分として奇形腫または胚細胞腫成分などの複数の要素を含むこともある。
表1.免疫組織化学的マーカーおよび胚細胞腫瘍の多様体 腫瘍のタイプ β-HCG AFP PLAP c-kit AFP = α-フェトプロテイン;HCG = ヒト絨毛性ゴナドトロピン;PLAP = 胎盤性アルカリフォスファターゼ;+ = 陽性;- = 陰性;± = 不確定。 胚細胞腫 ± - ± + 胚細胞腫(合胞体栄養細胞性) + - ± + 胎児性がん + + + - 卵黄嚢腫瘍 - + ± - 絨毛がん + - ± - 奇形腫 未熟奇形腫 ± ± - ± 成熟奇形腫 - - - - 混合型胚細胞腫瘍 ± ± ± ± 表2.血清および脳脊髄液マーカーならびに胚細胞腫瘍の多様体 腫瘍のタイプ β-HCG AFP AFP = α-フェトプロテイン;HCG = ヒト絨毛性ゴナドトロピン。 胚細胞腫 正常またはわずかな上昇、診断指標とはならない 陰性 胎児性がん 上昇 上昇 卵黄嚢腫瘍 陰性 大幅な上昇 絨毛がん 大幅な上昇 陰性 奇形腫 陰性 上昇、診断指標とはならない 画像所見とともに腫瘍マーカーの上昇がみられれば、CNS GCTの代替の診断マーカーとして用いられ、組織学的診断が不必要になる場合がある。AFPおよびβ-HCGが最も有用な腫瘍マーカーであるが、胎盤性アルカリフォスファターゼやc-kitなど、他のマーカーが研究されている。CSF蛋白マーカーの値のみで異なるGCTの種類を識別することはいくぶん恣意的であり、大陸間で基準はさまざまである。純粋な胚細胞腫および奇形腫の患者は、通常、腫瘍マーカーが陰性であるが、胚細胞腫の患者では、非常に低レベルのβ-HCGが検出されることがある。[ 9 ]胚細胞腫とNGGCTの鑑別に使用されているβ-HCG値が欧州で50mIU/mL、北米で100mIU/mLとなっている点に疑念があることがデータで示唆されるため、β-HCG分泌胚芽腫に対するマーカー閾値の確定に向けた努力が現在行われている。
GCTの臨床試験では、腫瘍マーカーおよび組織像の使用が発展している。例えば、COG-ACNS1123(NCT01602666)試験では、患者が以下のいずれか1つを有する場合に、患者は生検による確認なしに胚細胞腫レジメンへの割り付けに適格となる:
- 松果体腫瘍または鞍上部原発腫瘍を有し、AFP値が正常で、血清および/またはCSF中のβ-HCG値が5~50mIU/mLの場合。
- 二病巣性(松果体と鞍上部)の症状、鞍上部位、尿崩症、AFP値が正常、血清および/またはCSF中のβ-HCG値が100mIU/mL未満の場合。
日本小児脳腫瘍研究グループ(Japanese Pediatric Brain Tumor Study Group)などによってCNS GCTに対する別の分類スキームが提唱されており、これらのグループでは、表3に示すように、異なる組織学的多様体の予後分類に基づいて層別化を行っている。純粋な胚細胞腫および成熟奇形腫は予後良好群に分類される;絨毛がん、卵黄嚢腫瘍、胎児性がん、またはこれら3つの組織学的亜型が混在する腫瘍は予後不良群に分類される。[ 10 ]
表3.日本小児脳腫瘍研究グループ(Japanese Pediatric Brain Tumor Study Group)の分類 予後グループ 腫瘍のタイプ 予後良好 純粋な胚細胞腫 成熟奇形腫 中間的な予後 合胞体栄養細胞性巨細胞を有する胚細胞腫 未熟奇形腫 主に胚細胞腫または奇形腫で構成される混合腫瘍 悪性転換を伴う奇形腫 予後不良 絨毛がん 胎児性がん 絨毛がん、卵黄嚢腫瘍、または胎児性がんで構成される混合腫瘍 卵黄嚢腫瘍 参考文献- Fukushima S, Yamashita S, Kobayashi H, et al.: Genome-wide methylation profiles in primary intracranial germ cell tumors indicate a primordial germ cell origin for germinomas. Acta Neuropathol 133 (3): 445-462, 2017.[PUBMED Abstract]
- Sano K, Matsutani M, Seto T: So-called intracranial germ cell tumours: personal experiences and a theory of their pathogenesis. Neurol Res 11 (2): 118-26, 1989.[PUBMED Abstract]
- Teilum G: Embryology of ovary, testis, and genital ducts. In: Teilum G: Special Tumors of Ovary and Testis and Related Extragonadal Lesions: Comparative Pathology and Histological Identification. Philadelphia, Pa: J. B. Lippincott, 1976, pp 15-30.[PUBMED Abstract]
- Schneider DT, Zahn S, Sievers S, et al.: Molecular genetic analysis of central nervous system germ cell tumors with comparative genomic hybridization. Mod Pathol 19 (6): 864-73, 2006.[PUBMED Abstract]
- Rosenblum MK, Nakazato Y, Matsutani M: Germ cell tumours. In: Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. Lyon, France: IARC Press, 2016, pp 286-91.[PUBMED Abstract]
- Murray MJ, Bartels U, Nishikawa R, et al.: Consensus on the management of intracranial germ-cell tumours. Lancet Oncol 16 (9): e470-e477, 2015.[PUBMED Abstract]
- Allen J, Chacko J, Donahue B, et al.: Diagnostic sensitivity of serum and lumbar CSF bHCG in newly diagnosed CNS germinoma. Pediatr Blood Cancer 59 (7): 1180-2, 2012.[PUBMED Abstract]
- Calaminus G, Bamberg M, Harms D, et al.: AFP/beta-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics 36 (2): 71-7, 2005.[PUBMED Abstract]
- Frazier AL, Olson TA, Schneider DT, et al.: Germ cell tumors. In: Pizzo PA, Poplack DG, eds.: Principles and Practice of Pediatric Oncology. 7th ed. Philadelphia, Pa: Lippincott Williams and Wilkins, 2015, pp 899-918.[PUBMED Abstract]
- Matsutani M; Japanese Pediatric Brain Tumor Study Group: Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol 54 (3): 311-6, 2001.[PUBMED Abstract]
- 小児CNS胚細胞腫瘍の病期情報
-
胚細胞腫瘍(GCT)に対して普遍的に受け入れられている臨床病期分類システムはないが、修正Chang病期分類システムが伝統的に用いられている。[ 1 ]中枢神経系GCTの病期分類評価には以下が含まれる:
- 磁気共鳴画像法(MRI)。全脳のMRIに加えて、脊椎のMRIが必要である。
- 腰椎の脳脊髄液(CSF)。医学的に許容できる場合は、腰椎のCSFを入手して腫瘍マーカー(α-フェトプロテイン[AFP]およびヒト絨毛性ゴナドトロピンのβサブユニット[β-HCG])を測定し、細胞病理学的検査を実施すべきである。
AFPおよびβ-HCGの血清腫瘍マーカーがしばしば検査される;しかしながら、腰椎CSFが安全に採取できる場合、これらはCSF腫瘍マーカーの代わりにならない。[ 2 ]
CSF細胞診が陰性の限局性疾患の患者はM0(転移なし)と考えられる;CSF細胞診が陽性の患者や滴下転移(drop metastasis;頭蓋内病変から発生する脊髄または頭蓋くも膜下腔の転移)を有する患者はM+(転移陽性)と考えられる。転移病変を有する患者はより高い総放射線量を受け、照射野をより広範囲にする場合があるため、適切な病期分類がきわめて重要である。
GCTは診断時に、またはいずれの病期でも脳脊髄軸全体に播種する可能性がある。胚細胞腫では、側面方向または第三脳室の上衣下の播種および実質性浸潤など、いくつかの拡がりのパターンが起こりうる。まれに、肺および骨への頭蓋外転移も報告されている。[ 3 ][ 4 ]
鞍上部および松果体内に限局して2つの病巣が認められる頭蓋内胚細胞腫の患者では、北米(COG ACNS1123 [NCT01602666])および欧州(SIOP CNS GCT II [NCT01424839])の進行中の研究で、同時性、限局性、非転移性腫瘍の患者と同じ方法で治療が行われている。
参考文献- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013.[PUBMED Abstract]
- Fujimaki T, Mishima K, Asai A, et al.: Levels of beta-human chorionic gonadotropin in cerebrospinal fluid of patients with malignant germ cell tumor can be used to detect early recurrence and monitor the response to treatment. Jpn J Clin Oncol 30 (7): 291-4, 2000.[PUBMED Abstract]
- Jennings MT, Gelman R, Hochberg F: Intracranial germ-cell tumors: natural history and pathogenesis. J Neurosurg 63 (2): 155-67, 1985.[PUBMED Abstract]
- Gay JC, Janco RL, Lukens JN: Systemic metastases in primary intracranial germinoma. Case report and literature review. Cancer 55 (11): 2688-90, 1985.[PUBMED Abstract]
- 小児CNS胚細胞腫瘍の治療法選択肢の概要
-
奇形腫、胚細胞腫、およびこの他の胚細胞腫以外の胚細胞腫瘍(NGGCT)では予後が異なり、別個の治療レジメンが必要である。諸研究により以下のことが確認されている:[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ]
- 3歳超の小児および成人への放射線療法は、胚細胞腫およびNGGCTに対する治療の重要な要素となっているが、選択的な総線量および照射野の大きさについての議論がなされている。
- 中枢神経系に発生する胚細胞腫瘍(GCT)は性腺および性腺外GCTに類似しており、化学療法への感受性を示している。
- 胚細胞腫は化学療法感受性が高く、放射線感受性も有する腫瘍である。頭蓋脊髄照射および局所ブースト放射線療法のみで治癒可能である。しかしながら、ネオアジュバントまたは照射前化学療法の使用により、放射線療法の線量および照射容積の縮小が可能となり、それにより放射線療法に関係した長期的影響を軽減できる。北米において、限局性胚細胞腫患者は、全脳室への照射に加え腫瘍部位への追加放射線療法を行うことで効果的に治療される。化学療法に対する反応にかかわらず、腫瘍床への限局的照射は治療として不十分であると考えられる。[ 6 ]
- NGGCTでは、より強化されたネオアジュバント化学療法とその後の局所または脳脊髄照射の併用療法により、過去10年間で、非常に優れた生存率が得られている。[ 7 ][ 8 ]
表4では、小児CNS GCTの新規診断例および再発例に対する治療法の選択肢について概説している。
表4.小児中枢神経系(CNS)胚細胞腫瘍(GCT)に対する治療法選択肢 治療群 治療法の選択肢 新たに診断された小児胚細胞腫 放射線療法 ネオアジュバント化学療法とその後の反応に基づく放射線療法 新たに診断された小児奇形腫 手術 補助療法、亜全切除を受けた患者に対して(見解の一致をみていない): -局所放射線療法 -化学療法 -定位放射線手術 新たに診断された胚細胞腫以外の小児GCT 化学療法とその後の放射線療法 必要であれば手術 再発小児CNS GCT 化学療法とその後の追加放射線療法 追加放射線療法の有無を問わない、大量化学療法と幹細胞救援 小児および青年のがん患者の生存において、劇的な改善が達成されている。1975年から2010年の間に、小児がんの死亡率は50%以上低下した。[ 9 ]小児および青年がん生存者には、治療から数ヵ月または数年経過後もがん療法の副作用が持続または発現することがあるため、綿密なモニタリングが必要である。(小児および青年がん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)に関するPDQ要約を参照のこと。)
参考文献- Osuka S, Tsuboi K, Takano S, et al.: Long-term outcome of patients with intracranial germinoma. J Neurooncol 83 (1): 71-9, 2007.[PUBMED Abstract]
- Allen JC, Kim JH, Packer RJ: Neoadjuvant chemotherapy for newly diagnosed germ-cell tumors of the central nervous system. J Neurosurg 67 (1): 65-70, 1987.[PUBMED Abstract]
- Kellie SJ, Boyce H, Dunkel IJ, et al.: Primary chemotherapy for intracranial nongerminomatous germ cell tumors: results of the second international CNS germ cell study group protocol. J Clin Oncol 22 (5): 846-53, 2004.[PUBMED Abstract]
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013.[PUBMED Abstract]
- Calaminus G, Bamberg M, Harms D, et al.: AFP/beta-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics 36 (2): 71-7, 2005.[PUBMED Abstract]
- Joo JH, Park JH, Ra YS, et al.: Treatment outcome of radiation therapy for intracranial germinoma: adaptive radiation field in relation to response to chemotherapy. Anticancer Res 34 (10): 5715-21, 2014.[PUBMED Abstract]
- Goldman S, Bouffet E, Fisher PG, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 33 (22): 2464-71, 2015.[PUBMED Abstract]
- Calaminus G, Frappaz D, Kortmann RD, et al.: Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol 19 (12): 1661-1672, 2017.[PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- 新たに診断された小児CNS胚細胞腫の治療
-
新たに診断された小児CNS胚細胞腫に対する治療法選択肢
小児中枢神経系(CNS)胚細胞腫の新規診断例に対する治療法選択肢には以下のものがある:
放射線療法
胚細胞腫は放射線感受性が高く、従来から放射線療法単独による治療で効果が得られている。歴史的に、病変が非播種性の患者では、原発腫瘍領域へのブースト照射を併用する頭蓋脊髄照射による治療が行われている。頭蓋脊髄照射線量は24~36Gyであるが、研究では、これより低い線量が使用されている。局所腫瘍への放射線照射線量は40~50Gyとされている。低線量での頭蓋脊髄照射の研究では優れた転帰が示されている。[ 1 ]この修正により、90%を超える5年全生存率が得られている。[ 2 ];[ 3 ][証拠レベル:2A];[ 4 ][ 5 ][証拠レベル:3iA]こうした非常に優れた生存率により、研究者は、晩期合併症(晩期障害)を減らすために放射線療法の照射野および線量の縮小に重点的に取り組むことができるようになった。[ 3 ][ 6 ][ 7 ]
頭蓋脊髄照射と照射野を縮小させた放射線療法(全脳照射または全脳室照射)後の再燃パターンから、限局性胚細胞腫に対する頭蓋脊髄照射が不要であることが裏付けられている。[ 8 ][ 9 ][ 10 ]これらの結果に基づいて、限局性胚細胞腫患者に対する治療は、頭蓋脊髄軸全体または全脳への放射線療法の実施よりもむしろ、全脳室系への照射(24Gy)とその後の原発部位へのブースト照射(40~45Gy)に修正されている。この変更によって治療成績の低下には至っておらず、放射線療法による急性および長期毒性が最小限に抑えられると期待されている。ネオアジュバント化学療法後でも、腫瘍容積のみに向けた局所放射線療法は、全脳または全脳室放射線療法に比べて治療成績が不良である;したがって、局所放射線療法は推奨されない。[ 7 ]
ネオアジュバント化学療法とその後の反応に基づく放射線療法
放射線療法の線量、および関連する神経発生関連の罹病率を減らすべく、化学療法が検討されている。数件の研究で、非常に優れた生存率を維持するこのアプローチの実施可能性が確認されているが、治療を受けた患者数が少ない。[ 11 ][ 12 ][ 13 ][証拠レベル:2A];[ 14 ][ 15 ][証拠レベル:3iA];[ 16 ][証拠レベル:3iiiC]
CNS胚細胞腫では、シクロホスファミド、イホスファミド、エトポシド、シスプラチン、カルボプラチンなどの化学療法薬の効果が高い。原発腫瘍が鞍上部の患者で尿崩症の可能性があるため、大量の水分補給を必要とする化学療法薬(例、シクロホスファミド、イホスファミド、およびシスプラチン)の投与を受けている患者では、しばしば管理がかなり困難である。[ 17 ]
国際的な研究者グループにより、主として比較的年齢の低い小児に対する化学療法単独アプローチが研究されている。この研究では、化学療法単独で治療された胚細胞腫患者の84%で完全奏効を達成することができた。これらの患者の50%が腫瘍の再燃または進行であった;再発の多くは局所性、局所性 + 脳室内、および脳室内単独で、放射線療法を含む追加の治療を必要とする軟髄膜播種がCNSのいたるところに見られることもある。[ 18 ]その後の研究でも引き続き、化学療法後の放射線療法の必要性および全脳室への照射(24Gy)と局所の腫瘍部位に対するブースト照射(総線量40Gy)の必要性が高いことが裏付けられている。[ 19 ][証拠レベル:2A];[ 20 ][証拠レベル:3iiiA]24Gyの頭蓋脊髄照射と局所の腫瘍部位に対するブースト照射(総線量40Gy)を受けた転移性胚細胞腫患者でも、非常に優れた結果が報告されている。[ 21 ][証拠レベル:2A]
2つの病巣が認められる病変の最適な管理法はほとんど明らかになっていないが、ほとんどの研究者がこの病態をM0と病期判定すべき多巣性の原発病変の一形態であるとみなしている。患者60人についてのメタアナリシスでは、頭蓋脊髄照射の単独実施後に非常に優れた無増悪生存率がもたらされることが示された。化学療法 + 全脳室への照射を含む局所放射線療法の併用によっても、非常に優れた疾患制御が得られた。[ 22 ][証拠レベル:3iiDiii]
新たに診断された小児CNS胚細胞腫に対して臨床評価段階にある治療法の選択肢
特定の患者には、初期段階の臨床試験が利用できる場合がある。これらの試験は、小児腫瘍学グループ(COG)、Pediatric Brain Tumor Consortium、または他の団体を通して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
参考文献- Bamberg M, Kortmann RD, Calaminus G, et al.: Radiation therapy for intracranial germinoma: results of the German cooperative prospective trials MAKEI 83/86/89. J Clin Oncol 17 (8): 2585-92, 1999.[PUBMED Abstract]
- Shibamoto Y, Abe M, Yamashita J, et al.: Treatment results of intracranial germinoma as a function of the irradiated volume. Int J Radiat Oncol Biol Phys 15 (2): 285-90, 1988.[PUBMED Abstract]
- Cho J, Choi JU, Kim DS, et al.: Low-dose craniospinal irradiation as a definitive treatment for intracranial germinoma. Radiother Oncol 91 (1): 75-9, 2009.[PUBMED Abstract]
- Huang PI, Chen YW, Wong TT, et al.: Extended focal radiotherapy of 30 Gy alone for intracranial synchronous bifocal germinoma: a single institute experience. Childs Nerv Syst 24 (11): 1315-21, 2008.[PUBMED Abstract]
- Eom KY, Kim IH, Park CI, et al.: Upfront chemotherapy and involved-field radiotherapy results in more relapses than extended radiotherapy for intracranial germinomas: modification in radiotherapy volume might be needed. Int J Radiat Oncol Biol Phys 71 (3): 667-71, 2008.[PUBMED Abstract]
- Chen MJ, Santos Ada S, Sakuraba RK, et al.: Intensity-modulated and 3D-conformal radiotherapy for whole-ventricular irradiation as compared with conventional whole-brain irradiation in the management of localized central nervous system germ cell tumors. Int J Radiat Oncol Biol Phys 76 (2): 608-14, 2010.[PUBMED Abstract]
- Joo JH, Park JH, Ra YS, et al.: Treatment outcome of radiation therapy for intracranial germinoma: adaptive radiation field in relation to response to chemotherapy. Anticancer Res 34 (10): 5715-21, 2014.[PUBMED Abstract]
- Rogers SJ, Mosleh-Shirazi MA, Saran FH: Radiotherapy of localised intracranial germinoma: time to sever historical ties? Lancet Oncol 6 (7): 509-19, 2005.[PUBMED Abstract]
- Shikama N, Ogawa K, Tanaka S, et al.: Lack of benefit of spinal irradiation in the primary treatment of intracranial germinoma: a multiinstitutional, retrospective review of 180 patients. Cancer 104 (1): 126-34, 2005.[PUBMED Abstract]
- Hardenbergh PH, Golden J, Billet A, et al.: Intracranial germinoma: the case for lower dose radiation therapy. Int J Radiat Oncol Biol Phys 39 (2): 419-26, 1997.[PUBMED Abstract]
- Kretschmar C, Kleinberg L, Greenberg M, et al.: Pre-radiation chemotherapy with response-based radiation therapy in children with central nervous system germ cell tumors: a report from the Children's Oncology Group. Pediatr Blood Cancer 48 (3): 285-91, 2007.[PUBMED Abstract]
- Allen JC, DaRosso RC, Donahue B, et al.: A phase II trial of preirradiation carboplatin in newly diagnosed germinoma of the central nervous system. Cancer 74 (3): 940-4, 1994.[PUBMED Abstract]
- Buckner JC, Peethambaram PP, Smithson WA, et al.: Phase II trial of primary chemotherapy followed by reduced-dose radiation for CNS germ cell tumors. J Clin Oncol 17 (3): 933-40, 1999.[PUBMED Abstract]
- Khatua S, Dhall G, O'Neil S, et al.: Treatment of primary CNS germinomatous germ cell tumors with chemotherapy prior to reduced dose whole ventricular and local boost irradiation. Pediatr Blood Cancer 55 (1): 42-6, 2010.[PUBMED Abstract]
- Cheng S, Kilday JP, Laperriere N, et al.: Outcomes of children with central nervous system germinoma treated with multi-agent chemotherapy followed by reduced radiation. J Neurooncol 127 (1): 173-80, 2016.[PUBMED Abstract]
- O'Neil S, Ji L, Buranahirun C, et al.: Neurocognitive outcomes in pediatric and adolescent patients with central nervous system germinoma treated with a strategy of chemotherapy followed by reduced-dose and volume irradiation. Pediatr Blood Cancer 57 (4): 669-73, 2011.[PUBMED Abstract]
- Afzal S, Wherrett D, Bartels U, et al.: Challenges in management of patients with intracranial germ cell tumor and diabetes insipidus treated with cisplatin and/or ifosfamide based chemotherapy. J Neurooncol 97 (3): 393-9, 2010.[PUBMED Abstract]
- Balmaceda C, Heller G, Rosenblum M, et al.: Chemotherapy without irradiation--a novel approach for newly diagnosed CNS germ cell tumors: results of an international cooperative trial. The First International Central Nervous System Germ Cell Tumor Study. J Clin Oncol 14 (11): 2908-15, 1996.[PUBMED Abstract]
- da Silva NS, Cappellano AM, Diez B, et al.: Primary chemotherapy for intracranial germ cell tumors: results of the third international CNS germ cell tumor study. Pediatr Blood Cancer 54 (3): 377-83, 2010.[PUBMED Abstract]
- Alapetite C, Brisse H, Patte C, et al.: Pattern of relapse and outcome of non-metastatic germinoma patients treated with chemotherapy and limited field radiation: the SFOP experience. Neuro Oncol 12 (12): 1318-25, 2010.[PUBMED Abstract]
- Calaminus G, Kortmann R, Worch J, et al.: SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol 15 (6): 788-96, 2013.[PUBMED Abstract]
- Weksberg DC, Shibamoto Y, Paulino AC: Bifocal intracranial germinoma: a retrospective analysis of treatment outcomes in 20 patients and review of the literature. Int J Radiat Oncol Biol Phys 82 (4): 1341-51, 2012.[PUBMED Abstract]
- 新たに診断された小児CNS奇形腫の治療
-
新たに診断された小児CNS奇形腫に対する治療法選択肢
奇形腫は、分化組織の有無に基づき、成熟または未熟奇形腫と指定される。日本小児脳腫瘍研究グループ(Japanese Pediatric Brain Tumor Study Group)では、分類と治療の強度(化学療法および放射線療法)を決定するため奇形腫を予後良好群(成熟奇形腫)と中間的な予後群(未熟奇形腫)に層別化している(表3を参照のこと)一方で、小児腫瘍学グループでは、未熟奇形腫を他の胚細胞腫以外の胚細胞腫瘍とともに分類している。
小児中枢神経系奇形腫の新規診断例に対する治療法選択肢には以下のものがある:
- 手術。
- 補助療法、亜全切除を受けた患者に対して(見解の一致をみていない)。
- 局所放射線療法。
- 化学療法。
- 定位放射線手術。
奇形腫に対する一次治療は、最大限の外科的切除である。亜全摘腫瘍に対して局所放射線療法および/または補助化学療法を行う補助治療には議論の余地が残されているが、小規模の施設内シリーズで定位放射線手術使用の有用性が示唆されている。[ 1 ][ 2 ][証拠レベル:3iA]
参考文献- Huang X, Zhang R, Zhou LF: Diagnosis and treatment of intracranial immature teratoma. Pediatr Neurosurg 45 (5): 354-60, 2009.[PUBMED Abstract]
- Lee YH, Park EK, Park YS, et al.: Treatment and outcomes of primary intracranial teratoma. Childs Nerv Syst 25 (12): 1581-7, 2009.[PUBMED Abstract]
- 新たに診断された胚細胞腫以外の小児CNS胚細胞腫瘍の治療
-
胚細胞腫以外の中枢神経系(CNS)胚細胞腫瘍(NGGCT)を有する小児の予後は、胚細胞腫の小児に比べて不良なままであるが、集学的治療法の追加により、その差は小さくなっている。現在の治療レジメンによるNGGCTの10年全生存率(OS)は70~80%である。[ 1 ][ 2 ]NGGCTは放射線感受性が高いが、標準的な頭蓋脊髄照射単独後の生存率は不良で、5年生存率は20~45%である。再燃を来すNGGCT患者のほとんどが18ヵ月以内に再燃する。
新たに診断された小児CNS NGGCTに対する治療法選択肢
新たに診断された小児CNS NGGCTに対する治療法選択肢には以下のものがある:
- 化学療法とその後の放射線療法。
- 化学療法に対する反応が部分的な腫瘍または治療中や治療後にサイズが大きくなる腫瘍(増殖性奇形腫症候群の可能性がある)に対して手術。
CNS NGGCTに対する至適治療レジメンは不明のままである。
化学療法とその後の放射線療法
使用されている抗がん剤にはカルボプラチン、エトポシド、ブレオマイシン、イホスファミド、およびビンブラスチンがあり、さまざまに組み合わされる。放射線療法前に化学療法を使用することで生存率が増加しているが、特異的な化学療法レジメンおよび治療期間のほか、放射線の至適な照射野、タイミング、および線量は依然として研究段階にある。[ 1 ][ 3 ][ 4 ]播種のないNGGCT患者に対して、頭蓋脊髄照射で用いるものより狭い範囲の放射線照射野(例、全脳室に加え局所腫瘍部位に対する追加照射)を提唱している研究者もいる。化学療法および局所放射線療法により治療された患者における腫瘍の再燃パターンに関しては、見解が分かれている。[ 1 ][ 2 ][ 5 ][ 6 ]
証拠(化学療法とその後の放射線療法):
- 1件の小児腫瘍学グループ(COG)研究(ACNS0122[NCT00047320])で、限局性NGGCTの小児に対するネオアジュバント化学療法とその後の放射線療法が評価された。[
7
]ネオアジュバント化学療法は、カルボプラチン/エトポシドとイホスファミド/エトポシドを交互に用いる6コースで構成されていた。化学療法完了後、反応が得られた患者は36Gyの頭蓋脊髄放射線療法と腫瘍床への54Gyの照射を受けた。
- 中央審査に基づくと、87%の患者が部分奏効(PR)または完全奏効(CR)のいずれかを示した。
- この研究の適格患者102人について、5年イベントフリー生存(EFS)率は84% ± 4%で、OSは93% ± 3%であった。
- 導入化学療法後にCRまたはPRを達成した患者、あるいはセカンドルック手術中に悪性腫瘍成分がないことが示されてCRまたはPRを達成した患者全員について、3年経過時のEFSは92%で、OSは98%であった。
- 欧州のSIOP-CNS-GCT-96(NCT00293358)試験では、非転移性の患者に対するシスプラチン/エトポシド/イホスファミドによる4コースからなるネオアジュバント化学療法とその後の局所放射線療法(54Gy)が評価された。[
8
]
- 限局性腫瘍の患者(n = 116)で、5年無増悪生存率が72% ± 4%、OS率が82% ± 4%であることが示された。
手術
化学療法を受けた患者のわずかな割合で、腫瘍マーカーの正常化を認めるものの、放射線学的完全奏効に至らない場合がある。ときに、腫瘍マーカーが正常化した場合でも、腫瘤の大きさが増大し続けることがある。この状態は、しばしば増殖性奇形腫症候群と診断され、放射線療法併用の有無を問わず、化学療法に対するより成熟した胚細胞成分(未熟奇形腫など)による反応不足を示す場合がある。[ 7 ][ 9 ][ 10 ]このような状況では、腫瘍量減量、組織像の確認、および混合型胚細胞腫瘍成分の除外のために、通常は手術が必要である。
セカンドルック手術は、残存腫瘤に奇形腫、線維化、または残存NGGCTのいずれが含まれているかの決定に役立つ。[ 2 ][ 11 ]セカンドルック手術で、化学療法後の成熟奇形腫または線維化が見つかった場合の一般的なアプローチは、患者が化学療法で完全奏効を達成したかのように放射線療法を開始することである。しかしながら、活発な腫瘍が観察される場合は、一般的に代替治療アプローチが検討される。[ 7 ]
新たに診断された小児CNS NGGCTに対して臨床評価段階にある治療法の選択肢
特定の患者には、初期段階の臨床試験が利用できる場合がある。これらの試験は、COG、Pediatric Brain Tumor Consortium、または他の団体を通して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
参考文献- Robertson PL, DaRosso RC, Allen JC: Improved prognosis of intracranial non-germinoma germ cell tumors with multimodality therapy. J Neurooncol 32 (1): 71-80, 1997.[PUBMED Abstract]
- Baranzelli M, Patte C, Bouffet E, et al.: Carboplatin-based chemotherapy (CT) and focal irradiation (RT) in primary germ cell tumors (GCT): A French Society of Pediatric Oncology (SFOP) experience (meeting abstract). [Abstract] Proceedings of the American Society of Clinical Oncology 18: A-538, 140A, 1999.[PUBMED Abstract]
- Matsutani M; Japanese Pediatric Brain Tumor Study Group: Combined chemotherapy and radiation therapy for CNS germ cell tumors--the Japanese experience. J Neurooncol 54 (3): 311-6, 2001.[PUBMED Abstract]
- Calaminus G, Bamberg M, Jürgens H, et al.: Impact of surgery, chemotherapy and irradiation on long term outcome of intracranial malignant non-germinomatous germ cell tumors: results of the German Cooperative Trial MAKEI 89. Klin Padiatr 216 (3): 141-9, 2004 May-Jun.[PUBMED Abstract]
- Aoyama H, Shirato H, Ikeda J, et al.: Induction chemotherapy followed by low-dose involved-field radiotherapy for intracranial germ cell tumors. J Clin Oncol 20 (3): 857-65, 2002.[PUBMED Abstract]
- Kim JW, Kim WC, Cho JH, et al.: A multimodal approach including craniospinal irradiation improves the treatment outcome of high-risk intracranial nongerminomatous germ cell tumors. Int J Radiat Oncol Biol Phys 84 (3): 625-31, 2012.[PUBMED Abstract]
- Goldman S, Bouffet E, Fisher PG, et al.: Phase II Trial Assessing the Ability of Neoadjuvant Chemotherapy With or Without Second-Look Surgery to Eliminate Measurable Disease for Nongerminomatous Germ Cell Tumors: A Children's Oncology Group Study. J Clin Oncol 33 (22): 2464-71, 2015.[PUBMED Abstract]
- Calaminus G, Frappaz D, Kortmann RD, et al.: Outcome of patients with intracranial non-germinomatous germ cell tumors-lessons from the SIOP-CNS-GCT-96 trial. Neuro Oncol 19 (12): 1661-1672, 2017.[PUBMED Abstract]
- Yagi K, Kageji T, Nagahiro S, et al.: Growing teratoma syndrome in a patient with a non-germinomatous germ cell tumor in the neurohypophysis--case report. Neurol Med Chir (Tokyo) 44 (1): 33-7, 2004.[PUBMED Abstract]
- Kim CY, Choi JW, Lee JY, et al.: Intracranial growing teratoma syndrome: clinical characteristics and treatment strategy. J Neurooncol 101 (1): 109-15, 2011.[PUBMED Abstract]
- Oya S, Saito A, Okano A, et al.: The pathogenesis of intracranial growing teratoma syndrome: proliferation of tumor cells or formation of multiple expanding cysts? Two case reports and review of the literature. Childs Nerv Syst 30 (8): 1455-61, 2014.[PUBMED Abstract]
- 再発小児CNS胚細胞腫瘍の治療
-
小児中枢神経系(CNS)胚細胞腫瘍(GCT)について再燃の最も一般的なパターンは原発腫瘍部位における局所再発である;しかしながら、再燃の30%は原発腫瘍部位以外で発生および/または軟髄膜への転移を併発する。再燃患者、特に胚細胞腫以外の胚細胞腫瘍(NGGCT)の患者に対する治療成績は、依然として不良である。
再発小児CNS GCTに対する治療法の選択肢
再発小児CNS GCTに対する治療法選択肢には以下のものがある:
- 化学療法とその後の追加放射線療法。
- 追加放射線療法の有無を問わない、大量化学療法と幹細胞救援。
最初に化学療法単独で治療された胚細胞腫患者には、化学療法とその後の放射線療法による治療が有益となる。[ 1 ][ 2 ]再発時には化学療法とその後に実施する再照射が利用されている。[ 2 ][ 3 ][ 4 ]
以前に放射線療法を受けた純粋な胚細胞腫患者には、幹細胞救助を伴う骨髄除去的化学療法が用いられている。[ 5 ][ 6 ]少数の全身性再燃NGGCT患者に対しては、大量化学療法と自家幹細胞救援でも治癒が得られる可能性がある。[ 4 ][ 5 ][ 6 ][ 7 ][ 8 ]
再発疾患の患者はすべて、臨床試験への登録を考慮すべきである。現在実施中の米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトから入手することができる。
再発小児CNS GCTに対して臨床評価段階にある治療法の選択肢
特定の患者には、初期段階の臨床試験が利用できる場合がある。これらの試験は、小児腫瘍学グループ(COG)、Pediatric Brain Tumor Consortium、または他の団体を通して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再発または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的多様体が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
参考文献- Merchant TE, Sherwood SH, Mulhern RK, et al.: CNS germinoma: disease control and long-term functional outcome for 12 children treated with craniospinal irradiation. Int J Radiat Oncol Biol Phys 46 (5): 1171-6, 2000.[PUBMED Abstract]
- Sawamura Y, Ikeda JL, Tada M, et al.: Salvage therapy for recurrent germinomas in the central nervous system. Br J Neurosurg 13 (4): 376-81, 1999.[PUBMED Abstract]
- Hu YW, Huang PI, Wong TT, et al.: Salvage treatment for recurrent intracranial germinoma after reduced-volume radiotherapy: a single-institution experience and review of the literature. Int J Radiat Oncol Biol Phys 84 (3): 639-47, 2012.[PUBMED Abstract]
- Murray MJ, Bailey S, Heinemann K, et al.: Treatment and outcomes of UK and German patients with relapsed intracranial germ cell tumors following uniform first-line therapy. Int J Cancer 141 (3): 621-635, 2017.[PUBMED Abstract]
- Siegert W, Beyer J, Strohscheer I, et al.: High-dose treatment with carboplatin, etoposide, and ifosfamide followed by autologous stem-cell transplantation in relapsed or refractory germ cell cancer: a phase I/II study. The German Testicular Cancer Cooperative Study Group. J Clin Oncol 12 (6): 1223-31, 1994.[PUBMED Abstract]
- Modak S, Gardner S, Dunkel IJ, et al.: Thiotepa-based high-dose chemotherapy with autologous stem-cell rescue in patients with recurrent or progressive CNS germ cell tumors. J Clin Oncol 22 (10): 1934-43, 2004.[PUBMED Abstract]
- Beyer J, Kramar A, Mandanas R, et al.: High-dose chemotherapy as salvage treatment in germ cell tumors: a multivariate analysis of prognostic variables. J Clin Oncol 14 (10): 2638-45, 1996.[PUBMED Abstract]
- Motzer RJ, Mazumdar M, Bosl GJ, et al.: High-dose carboplatin, etoposide, and cyclophosphamide for patients with refractory germ cell tumors: treatment results and prognostic factors for survival and toxicity. J Clin Oncol 14 (4): 1098-105, 1996.[PUBMED Abstract]
- 小児CNS胚細胞腫瘍の長期的影響
-
中枢神経系(CNS)胚細胞腫瘍(GCT)のかなりの割合の小児が、尿崩症および汎下垂体機能低下症などの内分泌疾患を発症する。ほとんどの症例で、これらの内分泌疾患は、腫瘍を制御できても、永久に残存し、ホルモン補充療法を続ける必要がある。[ 1 ][ 2 ]
CNS GCT患者の全生存率は有意に改善されているが、患者は原発腫瘍部位およびその治療により重大な晩期合併症(晩期障害)に直面している。治療に関連した晩期合併症(晩期障害)には以下のものがある:
最新の臨床試験および治療アプローチは、CNS GCTの治療による長期の続発症を最小限に抑えることに向けられている。
小児および青年がん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)に関するPDQ要約を参照のこと。
参考文献- Rosenblum MK, Matsutani M, Van Meir EG: CNS germ cell tumours. In: Kleihues P, Cavenee WK, eds.: Pathology and Genetics of Tumours of the Nervous System. Lyon, France: International Agency for Research on Cancer, 2000, pp 208-14.[PUBMED Abstract]
- Hoffman HJ, Otsubo H, Hendrick EB, et al.: Intracranial germ-cell tumors in children. J Neurosurg 74 (4): 545-51, 1991.[PUBMED Abstract]
- Osuka S, Tsuboi K, Takano S, et al.: Long-term outcome of patients with intracranial germinoma. J Neurooncol 83 (1): 71-9, 2007.[PUBMED Abstract]
- Balmaceda C, Finlay J: Current advances in the diagnosis and management of intracranial germ cell tumors. Curr Neurol Neurosci Rep 4 (3): 253-62, 2004.[PUBMED Abstract]
- Odagiri K, Omura M, Hata M, et al.: Treatment outcomes, growth height, and neuroendocrine functions in patients with intracranial germ cell tumors treated with chemoradiation therapy. Int J Radiat Oncol Biol Phys 84 (3): 632-8, 2012.[PUBMED Abstract]
- Liang SY, Yang TF, Chen YW, et al.: Neuropsychological functions and quality of life in survived patients with intracranial germ cell tumors after treatment. Neuro Oncol 15 (11): 1543-51, 2013.[PUBMED Abstract]
- Acharya S, DeWees T, Shinohara ET, et al.: Long-term outcomes and late effects for childhood and young adulthood intracranial germinomas. Neuro Oncol 17 (5): 741-6, 2015.[PUBMED Abstract]
- Jabbour SK, Zhang Z, Arnold D, et al.: Risk of second tumor in intracranial germinoma patients treated with radiation therapy: the Johns Hopkins experience. J Neurooncol 91 (2): 227-32, 2009.[PUBMED Abstract]
- 最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- 本要約の変更点(12/17/2019)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、小児中枢神経系胚細胞腫瘍の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Kenneth J. Cohen, MD, MBA (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Karen J. Marcus, MD, FACR (Dana-Farber Cancer Institute/Boston Children's Hospital)
- Roger J. Packer, MD (Children's National Health System)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Childhood Central Nervous System Germ Cell Tumors Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/brain/hp/child-cns-germ-cell-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389498]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する