ご利用について
医療専門家向けの本PDQがん情報要約では、黒色腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 黒色腫に関する一般情報
-
黒色腫とは、メラニン色素を産生し神経堤に由来する細胞であるメラノサイトに発生する悪性腫瘍のことである。黒色腫の大半は皮膚に発生するが、粘膜表面のほか、ブドウ膜などの神経堤細胞が遊走する部位に発生をみることもある。ブドウ膜黒色腫は、発生率、予後因子、分子的特徴、治療法の点で、皮膚黒色腫とは明らかに異なる。(詳しい情報については、眼内[ブドウ膜]黒色腫の治療に関するPDQ要約を参照のこと。)
発生率および死亡率
米国において、2020年に推定される黒色腫の新規症例数および死亡数:[ 1 ]
皮膚がんは米国で最も多く診断される悪性腫瘍であり、2012年、330万人に540万例のがんが診断されている。[ 1 ]浸潤性黒色腫が皮膚がんに占める割合は約1%であるが、死亡数は最も多い。[ 1 ][ 2 ]発生率は過去30年間増加し続けている。[ 1 ]高齢男性のリスクが最も高い;しかしながら、黒色腫は25~29歳の若年成人に最も多くみられるがんであり、15~29歳間で2番目に多いがんである。[ 3 ]眼内黒色腫は最も一般的な眼のがんであり、年間の診断数は約2,000例である。
危険因子
黒色腫の危険因子には、内因性の因子(遺伝子および表現型)と外因性の因子(環境または曝露)の両方がある:
解剖学
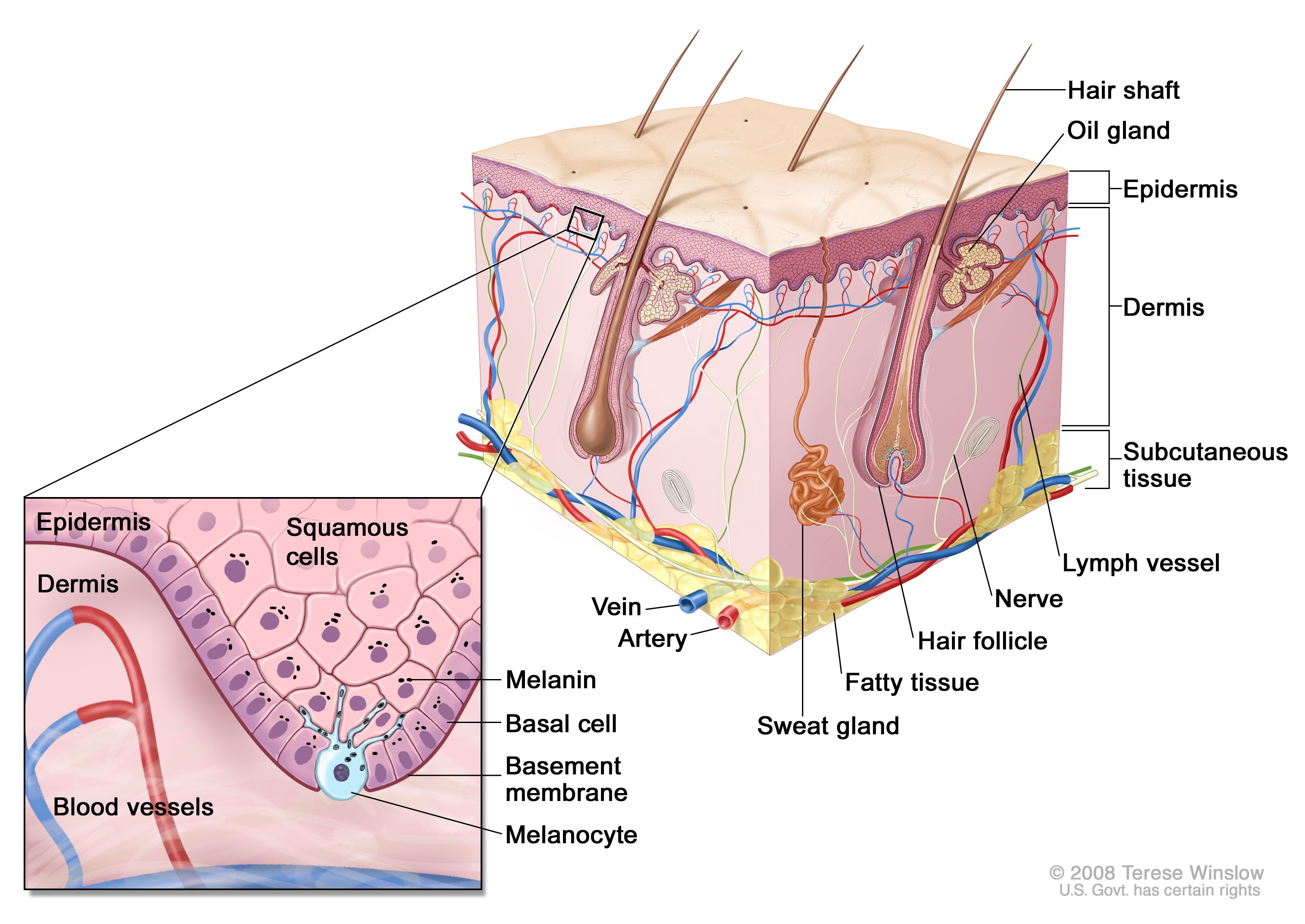
正常皮膚の略図。メラノサイトは正常皮膚にも存在し、黒色腫の原因細胞となる。相対的に血管が少ない表皮には、基底細胞がんおよび扁平上皮がんの原因細胞である基底細胞ケラチノサイトおよび扁平上皮ケラチノサイトの両方が存在する。表皮と真皮の境界は、基底細胞ケラチノサイトの直下に位置する基底膜領域にある。 スクリーニング
(詳しい情報については、皮膚がんのスクリーニングに関するPDQ要約を参照のこと。)
臨床的特徴
黒色腫は主として成人に発生し、50%を超える症例では外見上は正常にみえる皮膚部位に発生している。黒色腫は粘膜表面やブドウ膜に至るまで、どの身体部位にも発生しうるが、女性では四肢に発生することが多く、男性では体幹または頭頸部に発生することが最も多い。[ 4 ]
悪性転化を示唆する母斑の初期徴候には以下のものがある:
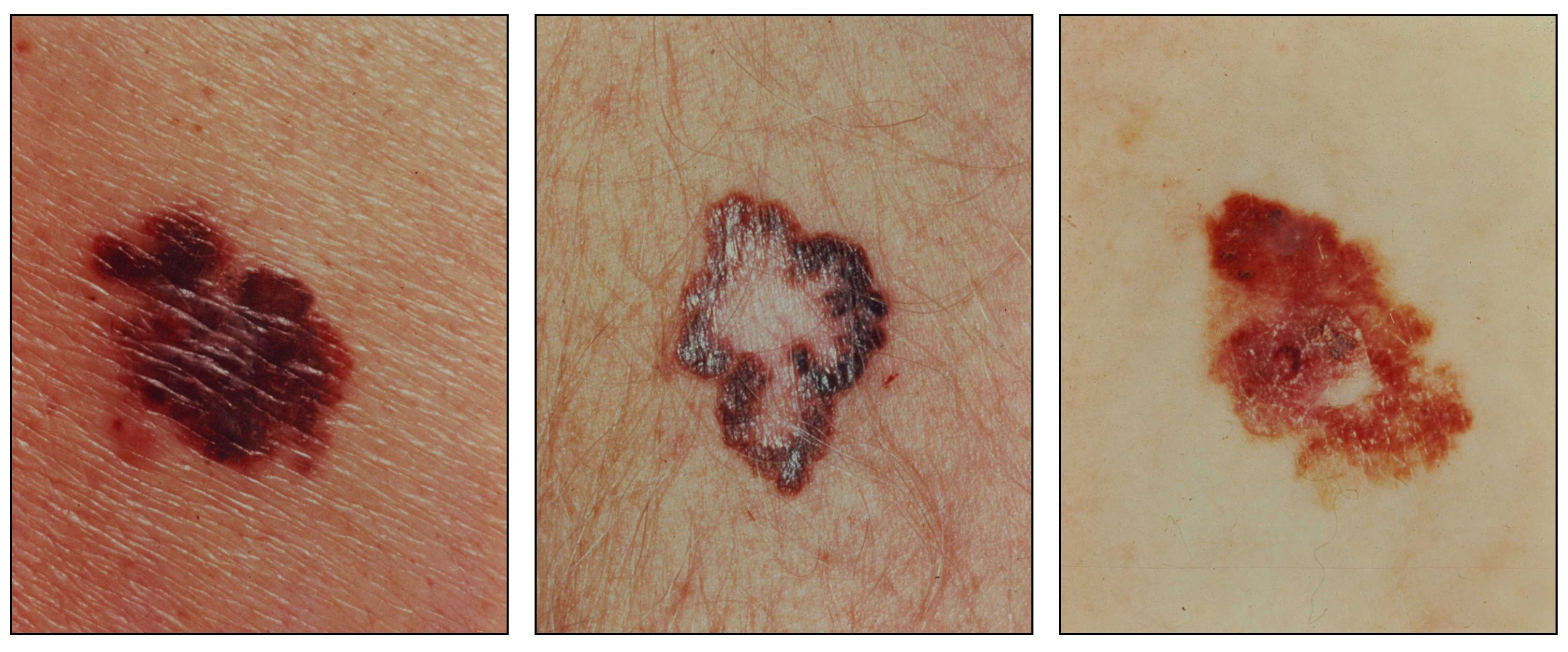
特徴的な非対称性、不明瞭な境界、色の不均一、および大きな径を認める黒色腫。 診断
疑わしい病変に対しては、生検(できれば局所切除による)を実施すべきである。疑わしい病変は決して切削または焼灼してはならない。標本は経験豊富な病理医が評価し、顕微鏡的病期を明らかにすべきである。
良性の色素性病変と初期の黒色腫とを識別することは難しく、熟練した皮膚病理医でも見解が分かれうることが諸研究から明らかにされている。一人ひとりの患者に対する誤診の可能性を低くするために、第三者で資格を有する別の病理医によるレビューが必要である。[ 5 ][ 6 ]黒色腫および良性色素性病変の組織学的診断について病理医間での一致に関する研究が行われており、医師の見解はきわめて多様であることが明らかになっている。[ 5 ][ 6 ]
証拠(組織学的評価における不一致):
予後因子
予後は、原発腫瘍および転移性腫瘍の特徴に左右される。2009年に改訂された米国がん合同委員会の病期分類には、以下のような最も重要な予後因子が組み込まれている:[ 4 ][ 7 ][ 8 ][ 9 ]
若年者、女性、四肢に黒色腫を有する患者の方が、一般的に予後は良好である。[ 4 ][ 7 ][ 8 ][ 9 ]
I期黒色腫の顕微鏡的衛星病巣の有無は組織学的な予後不良因子でありうるが、この点には議論が存在する。[ 10 ]活発(brisk)、非活発(nonbrisk)、なし(absent)に分類される腫瘍浸潤リンパ球の存在が予後因子となりうるか研究中である。[ 11 ]
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Melanoma. Bethesda, Md: National Library of Medicine, 2012. Available online. Last accessed January 31, 2019.[PUBMED Abstract]
- Bleyer A, O'Leary M, Barr R, et al., eds.: Cancer Epidemiology in Older Adolescents and Young Adults 15 to 29 Years of Age, Including SEER Incidence and Survival: 1975-2000. Bethesda, Md: National Cancer Institute, 2006. NIH Pub. No. 06-5767. Also available online. Last accessed August 16, 2019.[PUBMED Abstract]
- Slingluff CI Jr, Flaherty K, Rosenberg SA, et al.: Cutaneous melanoma. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 1643-91.[PUBMED Abstract]
- Corona R, Mele A, Amini M, et al.: Interobserver variability on the histopathologic diagnosis of cutaneous melanoma and other pigmented skin lesions. J Clin Oncol 14 (4): 1218-23, 1996.[PUBMED Abstract]
- Farmer ER, Gonin R, Hanna MP: Discordance in the histopathologic diagnosis of melanoma and melanocytic nevi between expert pathologists. Hum Pathol 27 (6): 528-31, 1996.[PUBMED Abstract]
- Balch CM, Soong S, Ross MI, et al.: Long-term results of a multi-institutional randomized trial comparing prognostic factors and surgical results for intermediate thickness melanomas (1.0 to 4.0 mm). Intergroup Melanoma Surgical Trial. Ann Surg Oncol 7 (2): 87-97, 2000.[PUBMED Abstract]
- Manola J, Atkins M, Ibrahim J, et al.: Prognostic factors in metastatic melanoma: a pooled analysis of Eastern Cooperative Oncology Group trials. J Clin Oncol 18 (22): 3782-93, 2000.[PUBMED Abstract]
- Balch CM, Gershenwald JE, Soong SJ, et al.: Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 27 (36): 6199-206, 2009.[PUBMED Abstract]
- León P, Daly JM, Synnestvedt M, et al.: The prognostic implications of microscopic satellites in patients with clinical stage I melanoma. Arch Surg 126 (12): 1461-8, 1991.[PUBMED Abstract]
- Mihm MC, Clemente CG, Cascinelli N: Tumor infiltrating lymphocytes in lymph node melanoma metastases: a histopathologic prognostic indicator and an expression of local immune response. Lab Invest 74 (1): 43-7, 1996.[PUBMED Abstract]
- Shen P, Guenther JM, Wanek LA, et al.: Can elective lymph node dissection decrease the frequency and mortality rate of late melanoma recurrences? Ann Surg Oncol 7 (2): 114-9, 2000.[PUBMED Abstract]
- Tsao H, Cosimi AB, Sober AJ: Ultra-late recurrence (15 years or longer) of cutaneous melanoma. Cancer 79 (12): 2361-70, 1997.[PUBMED Abstract]
- 黒色腫の細胞分類および分子分類
-
悪性黒色腫の臨床病理学的な細胞分類を記述する用語は、歴史的経緯に的を絞った記述と考えるべきである。これらの用語に独立した予後的意義または治療的意義はない。細胞分類には以下のものがある:
- 表在拡大型。
- 結節型。
- 悪性黒子型。
- 末端黒子型(手掌/足底および爪下)。
- その他のまれな型:
- 粘膜黒子型(口腔および外陰部)。
- 線維形成型。
- 疣贅型。
ゲノム分類
皮膚黒色腫
Cancer Genome Atlas(TCGA)Networkにより、331人の患者からの333の皮膚黒色腫について統合的なマルチプラットフォーム・キャラクタリゼーションが実施された。[ 1 ]DNA、RNA、および蛋白レベルで6種類の分子解析が用いられ、研究者らにより、以下に示す4つの主要なゲノムサブタイプが同定された:
- BRAF変異型。
- RAS変異型。
- NF1変異型。
- トリプル野生型。
ゲノムサブタイプは、薬物の標的および臨床試験デザインを示唆するほか、標的療法に対する臨床上の意思決定の指針となりうる。詳しい情報については表1を参照のこと。
現在のところ、標的療法はBRAF変異型サブタイプの黒色腫についてのみ効力を実証しており、米国食品医薬品局の承認を受けている。BRAF + MEK阻害剤による併用療法は、単一阻害剤単独よりも治療成績の改善を示している;しかしながら、実質的にすべての患者が治療に対する抵抗性を獲得し再燃する。(詳しい情報については、本要約の個別の治療法セクションを参照のこと。)したがって、臨床試験は依然として、BRAF変異型や他のゲノムサブタイプの黒色腫患者に対して重要な選択肢となっている。
ゲノムサブタイプに関係なく、黒色腫の治療にはさまざまな免疫療法が承認されている。(詳しい情報については、本要約の個別の治療法セクションを参照のこと。)免疫療法の有益性は、特定の変異または分子的サブタイプには関連していない。TCGA解析により、(各分子的サブタイプ内のサブセットにおいて)生存の改善に関連し、免疫療法に影響しうる免疫マーカーが同定された。予測バイオマーカーの同定は、依然として活発に研究されている分野である。
表1.マルチプラットフォーム解析:皮膚黒色腫における変異、コピー数、全ゲノム、miRNA/RNA発現、蛋白発現a ゲノムサブタイプ 変異を有するサンプル(%) 増加したリンパ球浸潤(%) 標的療法に対する臨床的管理の意味合い FDA = 米国食品医薬品局;WT = 野生型。 a対応する正常なサンプルを伴った原発性黒色腫;N = 67(20%)。対応する正常なサンプルを伴った転移性黒色腫;N = 266(80%)。対応するは、同じ患者からのサンプルと定義されている。 bトリプルWTは、BRAF、NRAS、HRAS、およびKRASと、NF1変異が認められない不均一なサブグループと定義された。 c免疫療法に対する適応は、ゲノムサブタイプによって決定されているか、制限されているかは不明である。 d単独療法 vs 併用療法のリスクと有益性については、治療法の選択肢で詳しく述べる。 e研究はこれらの例を含んでいるが、これらに限定されない。臨床試験は、clinicaltrials.govに記載されている。 f変異がFDA承認の測定法で診断されると、適応となる。 FDA承認 研究e(単剤または併用) BRAF変異型 52 ~ 30 BRAF阻害剤f CDK阻害剤、PI3K/Akt/mTOR阻害剤、ERK阻害剤、IDH1阻害剤、EZH2阻害剤、オーロラキナーゼ阻害剤、ARID2クロマチンリモデラー – ベムラフェニブ -ダブラフェニブ MEK阻害剤 -トラメチニブ -コビメチニブ BRAF + MEK阻害剤の併用 -ベムラフェニブ + コビメチニブ -ダブラフェニブ + トラメチニブ RAS変異型(NRAS、HRAS、およびKRAS) 28 ~ 25 MEK阻害剤、CDK阻害剤、PI3K/Akt/mTOR阻害剤、ERK阻害剤、IDH1阻害剤、EZH2阻害剤、オーロラキナーゼ阻害剤、ARID2クロマチンリモデラー NF1変異型 14 ~ 25 PI3K/Akt/mTOR阻害剤、ERK阻害剤、IDH1阻害剤、EZH2阻害剤、ARID2クロマチンリモデラー トリプルWTb 14.5 ~ 40 KIT変異/増幅CDK阻害剤(すなわち、イマチニブおよびダサチニブ)、MDM2/p53相互作用阻害剤、PI3K/Akt/mTOR阻害剤、IDH1阻害剤、EZH2阻害剤 ブドウ膜黒色腫
ブドウ膜黒色腫は皮膚黒色腫とは明らかに異なる。1件のシリーズでは、ブドウ膜黒色腫186例の83%で、GNAQまたはGNA11において常時活性型の体細胞変異を起こしていることが判明した。[ 2 ][ 3 ](詳しい情報については、眼内[ブドウ膜]黒色腫の治療に関するPDQ要約を参照のこと。)
参考文献- Cancer Genome Atlas Network: Genomic Classification of Cutaneous Melanoma. Cell 161 (7): 1681-96, 2015.[PUBMED Abstract]
- Van Raamsdonk CD, Bezrookove V, Green G, et al.: Frequent somatic mutations of GNAQ in uveal melanoma and blue naevi. Nature 457 (7229): 599-602, 2009.[PUBMED Abstract]
- Van Raamsdonk CD, Griewank KG, Crosby MB, et al.: Mutations in GNA11 in uveal melanoma. N Engl J Med 363 (23): 2191-9, 2010.[PUBMED Abstract]
- 黒色腫の病期情報
-
臨床病期分類は、所属リンパ節転移または遠隔転移が認められるかどうかに基づいている。臨床的に原発部位に限局している黒色腫の場合は、局所浸潤の厚さと深さが増すほど、リンパ節転移または全身転移の可能性が高くなり、予後も不良になる。黒色腫は局所進行(リンパ行性に)および/または血流経路によって遠隔転移を来しうる。いずれの臓器にも転移するが、肺および肝がよくみられる転移部位である。
悪性黒色腫の顕微鏡的病期分類は、病変の垂直方向の厚さをmm単位で組織学的に検査した所見(ブレスロー分類)および/または局所浸潤の解剖学的レベル(クラーク分類)に基づいて決定する。ブレスローの侵襲の厚さはより再現性が高く、厚さ1.5mmを超える病変では悪性黒色腫の進展をより正確に予測できるため、常に報告すべきである。
原発腫瘍の正確な顕微鏡的病期分類を行うためには、経験豊富な病理医に標本全体を注意深く組織学的に評価してもらう必要がある。
クラーク分類(浸潤のレベル)
表2.クラーク分類(浸潤のレベル) 浸潤のレベル 説明 レベルI 表皮に限局する病変(上皮内黒色腫);浸潤性病変ではない。 レベルII 真皮乳頭層に浸潤しているが、乳頭層と網状層の境界面には達していない。 レベルIII 浸潤が真皮乳頭層全体に拡大しているが、真皮網状層には浸潤していない。 レベルIV 真皮網状層に浸潤しているが、皮下組織には浸潤していない。 レベルV 真皮網状層を貫通して皮下組織に浸潤している。 AJCC病期分類とTNMの定義
米国がん合同委員会(AJCC)は黒色腫を定義するためにTNM(腫瘍、リンパ節、転移)分類による病期判定を指定している。[ 1 ]
この病期分類システムを用いて病期判定されるがんには、皮膚黒色腫が含まれる。この病期分類システムを用いて病期判定されないがんには、結膜黒色腫、ブドウ膜黒色腫、頭頸部に発生する粘膜の黒色腫、尿道、膣、直腸、および肛門の粘膜の黒色腫、メルケル細胞がん、および扁平上皮がんが含まれる。[ 1 ]
AJCC予後的病期グループ-臨床病期(cTNM)
表3.cTNM分類における0期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的;LDH = 乳酸脱水素酵素;No. = 数。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. b厚さおよび潰瘍の状態は該当せず。 0 Tis、N0、M0 Tis = 上皮内黒色腫。b N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表4.cTNM分類におけるIA期およびIB期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的;LDH = 乳酸脱水素酵素;No. = 数。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. IA T1a、N0、M0 T1a = 0.8mm未満/潰瘍を伴わない。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 IB T1b、N0、M0 T1b = 0.8mm未満で、潰瘍を伴う;0.8~1.0mmで潰瘍を伴うこともあれば伴わないこともある。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 T2a、N0、M0 T2a = 1.0mm超~2.0mm/潰瘍を伴わない。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表5.cTNM分類におけるIIA期、IIB期、およびIIC期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的;LDH = 乳酸脱水素酵素;No. = 数。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. IIA T2b、N0、M0 T2b = 1.0mm超~2.0mm/潰瘍を伴う。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 T3a、N0、M0 T3a = 2.0mm超~4.0mm/潰瘍を伴わない。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 IIB T3b、N0、M0 T3b = 2.0mm超~4.0mm/潰瘍を伴う。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 T4a、N0、M0 T4a = 4.0mm超/潰瘍を伴わない。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 IIC T4b、N0、M0 T4b = 4.0mm超/潰瘍を伴う。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表6.cTNM分類におけるIII期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的;LDH = 乳酸脱水素酵素;No. = 数。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. b例えば、切削生検による診断。 c例えば、原発不明または完全に退縮した黒色腫。 d厚さおよび潰瘍の状態は該当せず。 eセンチネルリンパ節生検で検出されたもの。 III すべてのT、Tis、N1以上、M0 TX = 原発腫瘍の評価が不可能。b、d N1a = 臨床的に潜伏性の1つのリンパ節転移e/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 T0 = 原発腫瘍を認めない。c、d Tis = 上皮内黒色腫。d N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T1a = 0.8mm未満/潰瘍を伴わない。 N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T1b = 0.8mm未満で、潰瘍を伴う;0.8~1.0mmで潰瘍を伴うこともあれば伴わないこともある。 N2a = 臨床的に潜伏性の2つまたは3つのリンパ節転移e/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T2a = 1.0mm超~2.0mm/潰瘍を伴わない。 N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T2b = 1.0mm超~2.0mm/潰瘍を伴う。 N2c = 臨床的に潜伏性または臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T3a = 2.0mm超~4.0mm/潰瘍を伴わない。 N3a = 臨床的に潜伏性の4つ以上のリンパ節転移e/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T3b = 2.0mm超~4.0mm/潰瘍を伴う。 N3b = 4つ以上のリンパ節転移で少なくともそのうち1つが臨床的に発見されているか、または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T4a = 4.0mm超/潰瘍を伴わない。 N3c = 2つ以上の臨床的に潜伏性または臨床的に発見されたリンパ節転移および/または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T4b = 4.0mm超/潰瘍を伴う。 表7.cTNM分類におけるIV期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;c = 臨床的;CNS = 中枢神経系;LDH = 乳酸脱水素酵素;No. = 数。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. b例えば、センチネルリンパ節生検が実施されておらず、別の理由で以前に所属リンパ節が切除されている。(例外:T1黒色腫には病理学的N分類は必要とされず、cNを用いる)。 IV すべてのT、すべてのN、M1 すべてのT = 説明については、表6を参照のこと。 NX = 所属リンパ節の評価が不可能b;N0 = 所属リンパ節に転移を認めない;N1以上 = 説明については、表6を参照のこと。 M1 = 遠隔転移を認める。 -M1a = 皮膚、筋などの軟部組織、および/または所属リンパ節以外のリンパ節への遠隔転移を認める[M1a(0) = LDH値の上昇を認めない;M1a(1) = LDH値の上昇を認める]。 -M1b = M1a部位の病変を伴うまたは伴わない肺への遠隔転移を認める[M1b(0) = LDH値の上昇を認めない;M1b(1) = LDH値の上昇を認める]。 -M1c = M1aまたはM1b部位の病変を伴うまたは伴わないCNS以外の内臓部位への遠隔転移を認める[M1c(0) = LDH値の上昇を認めない;またはM1c(1) = LDH値の上昇を認める]。 -M1d = M1a、M1b、またはM1c部位の病変を伴うまたは伴わないCNSへの遠隔転移を認める[M1d(0) = LDH値の上昇を認めない;M1d(1) = LDH値の上昇を認める]。 AJCC予後的病期グループ-病理学的病期(pTNM)
表11.pTNM分類におけるIIIA期、IIIB期、IIIC期、およびIIID期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;LDH = 乳酸脱水素酵素;No. = 数;p = 病理学的。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. bセンチネルリンパ節生検で検出されたもの。 c例えば、原発不明または完全に退縮した黒色腫。 d厚さおよび潰瘍の状態は該当せず。 IIIA T1a/b-T2a、N1aまたはN2a、M0 T1a = 0.8mm未満/潰瘍を伴わない/T1b = 0.8mm未満で潰瘍を伴う;0.8~1.0mmで潰瘍を伴うこともあれば伴わないこともある。 N1a = 臨床的に潜伏性の1つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない;またはN2a = 臨床的に潜伏性の2つまたは3つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 T2a = 1.0mm超~2.0mm/潰瘍を伴わない。 IIIB T0、N1b、N1c、M0 T0 = 原発腫瘍を認めない。c、d N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T1a/b-T2a、N1b/cまたはN2b、M0 T1a = 0.8mm未満/潰瘍を伴わない/T1b = 0.8mm未満で潰瘍を伴う;0.8~1.0mmで潰瘍を伴うこともあれば伴わないこともある。 N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない;/N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める;または M0 = 遠隔転移を認めない。 T2a = 1.0mm超~2.0mm/潰瘍を伴わない。 N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T2b/T3a、N1a-N2b、M0 T2b = 1.0mm超~2.0mm/潰瘍を伴う/T3a = 2.0mm超~4.0mm/潰瘍を伴わない。 N1a = 臨床的に潜伏性の1つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 N2a = 臨床的に潜伏性の2つまたは3つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 IIIC T0、N2b、N2c、N3b、またはN3c、M0 T0 = 原発腫瘍を認めない。c、d N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N2c = 臨床的に潜伏性または臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 N3b = 4つ以上のリンパ節転移で少なくともそのうち1つが臨床的に発見されているか、または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない;または N3c = 2つ以上の臨床的に潜伏性または臨床的に発見されたリンパ節転移および/または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T1a-T3a、N2cまたはN3a/b/c、M0 T1a = 0.8mm未満/潰瘍を伴わない/T1b = 0.8mm未満で潰瘍を伴う;0.8~1.0mmで潰瘍を伴うこともあれば伴わないこともある。 N2c = 臨床的に潜伏性または臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める;または M0 = 遠隔転移を認めない。 T2a = 1.0mm超~2.0mm/潰瘍を伴わない。 T2b = 1.0mm超~2.0mm/潰瘍を伴う。 N3a = 臨床的に潜伏性の4つ以上のリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N3b = 4つ以上のリンパ節転移で少なくともそのうち1つが臨床的に発見されているか、または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 T3a = 2.0mm超~4.0mm/潰瘍を伴わない。 N3c = 2つ以上の臨床的に潜伏性または臨床的に発見されたリンパ節転移および/または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T3b/T4a、すべてのN N1以上、M0 T3b = 2.0mm超~4.0mm/潰瘍を伴う/T4a = 4.0mm超/潰瘍を伴わない。 N1a = 臨床的に潜伏性の1つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 N2a = 臨床的に潜伏性の2つまたは3つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N2c = 臨床的に潜伏性または臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 N3a = 臨床的に潜伏性の4つ以上のリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N3b = 4つ以上のリンパ節転移で少なくともそのうち1つが臨床的に発見されているか、または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N3c = 2つ以上の臨床的に潜伏性または臨床的に発見されたリンパ節転移および/または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 T4b、N1a-N2c、M0 T4b = 4.0mm超/潰瘍を伴う。 N1a = 臨床的に潜伏性の1つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N1b = 臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N1c = 所属リンパ節に病変を認めない/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 N2a = 臨床的に潜伏性の2つまたは3つのリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N2b = 2つまたは3つのリンパ節転移で少なくともそのうち1つが臨床的に発見されている/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N2c = 臨床的に潜伏性または臨床的に発見された1つのリンパ節転移/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 IIID T4b、N3a/b/c、M0 T4b = 4.0mm超/潰瘍を伴う。 N3a = 臨床的に潜伏性の4つ以上のリンパ節転移b/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 M0 = 遠隔転移を認めない。 N3b = 4つ以上のリンパ節転移で少なくともそのうち1つが臨床的に発見されているか、または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)は認めない。 N3c = 2つ以上の臨床的に潜伏性または臨床的に発見されたリンパ節転移および/または数を問わず互いに癒着したリンパ節転移の存在/in-transit転移、衛星転移、および/または微小衛星転移(microsatellite metastasis)を認める。 表12.pTNM分類におけるIV期の定義a 病期 TNM T分類(厚さ/潰瘍の状態) N分類(腫瘍が転移している所属リンパ節の数/in-transit転移、衛星転移、および/または微小衛星転移[microsatellite metastasis]の存在) M分類(解剖学的部位/LDH値) イラスト T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;cN = 臨床的N;CNS = 中枢神経系;LDH = 乳酸脱水素酵素;No. = 数;p = 病理学的。 a出典:AJCC:Melanoma of the skin.In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp.563–85. b例えば、センチネルリンパ節生検が実施されておらず、別の理由で以前に所属リンパ節が切除されている。(例外:T1黒色腫には病理学的N分類は必要とされず、cNを用いる)。 c病理学的病期0期(上皮内黒色腫)およびT1は、病理学的病期判定を完了するためにリンパ節の病理学的評価を必要としない;病理学的病期の割り付けにはcNの情報を用いる。 d厚さおよび潰瘍の状態は該当せず。 IV すべてのT、Tis、すべてのN、M1 すべてのT = 説明については、表6を参照のこと。 NX = 所属リンパ節の評価が不可能d;N0 = 所属リンパ節に転移を認めない;N1以上 = 説明については、表6を参照のこと。 M1 = 遠隔転移を認める。 
Tis = 上皮内黒色腫。b、c -M1a = 皮膚、筋などの軟部組織、および/または所属リンパ節以外のリンパ節への遠隔転移を認める[M1a(0) = LDH値の上昇を認めない;M1a(1) = LDH値の上昇を認める]。 -M1b = M1a部位の病変を伴うまたは伴わない肺への遠隔転移を認める[M1b(0) = LDH値の上昇を認めない;M1b(1) = LDH値の上昇を認める]。 -M1c = M1aまたはM1b部位の病変を伴うまたは伴わないCNS以外の内臓部位への遠隔転移を認める[M1c(0) = LDH値の上昇を認めない;M1c(1) = LDH値の上昇を認める]。 -M1d = M1a、M1b、またはM1c部位の病変を伴うまたは伴わないCNSへの遠隔転移を認める[M1d(0) = LDH値の上昇を認めない;M1d(1) = LDH値の上昇を認める]。 参考文献- Melanoma of the Skin. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 563–85.[PUBMED Abstract]
- 黒色腫に対する治療法選択肢の概要
-
表13.黒色腫の標準治療法の選択肢 標準治療法の選択肢 a異常な分子生物学的経路に関する理解の進歩により新薬開発が急速に進んでいるため、すべての病期の黒色腫患者にとって臨床試験は重要な選択肢である。多くの臨床試験で、標準治療法の選択肢が利用可能である。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。 0期黒色腫 切除 I期黒色腫 切除+/−リンパ節の管理 II期黒色腫 切除+/−リンパ節の管理 切除可能なIII期黒色腫 切除+/−リンパ節の管理 切除不能のIII期、IV期、再発黒色腫 病変内局注療法 免疫療法 シグナル伝達阻害剤 化学療法 局所の緩和療法 切除
外科的切除は、現在でも黒色腫治療の第一療法である。皮膚黒色腫は、腫瘍が原発部位以外に拡大していなければ治癒の可能性が高い。局所黒色腫の治療では、原発巣の顕微鏡的病期に応じて病巣辺縁に一定の幅をとり、外科的切除を行う。
リンパ節の管理
センチネルリンパ節生検(SLNB)
1~4mmを超える原発腫瘍を有する患者の所属リンパ節における潜在転移の有無を評価するために、リンパ節マッピングおよびSLNBを考慮でき、これにより、所属リンパ節郭清による病的状態を免れることができる患者、および補助療法が有益な患者を同定できる可能性がある。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ][ 6 ]
センチネルリンパ節を正確に同定するには、原発黒色腫の広範囲切除前にリンパ節マッピングとSLNの切除を施行すべきである。
数件の研究でSLNBの診断精度が実証されており、偽陰性率は0~2%である。[ 1 ][ 6 ][ 7 ][ 8 ][ 9 ][ 10 ][ 11 ]転移性黒色腫が認められれば、二次治療で完全所属リンパ節郭清を施行する。
完全リンパ節郭清(CLND)
局所コントロールに関してセンチネルリンパ節が顕微鏡的または肉眼的に陽性である患者には、CLNDを考慮できるほか、CLNDが生存率に影響を及ぼすかどうかを判定するMulticenter Selective Lymphadenectomy Trial II(NCT00297895)への参加を検討してもよい。正確なリンパ節マッピングを行うために、SLNBは原発黒色腫を広範囲切除する前に実施すべきである。
補助療法
補助療法の選択肢は、完全寛解後に再発リスクが高い患者に拡がっており、至適治療に関するデータがまだ得られつつある。イピリムマブは、米国食品医薬品局(FDA)により補助療法として承認された最初のチェックポイント阻害薬であり、10mg/kg(ipi10)でプラセボと比較して全生存(OS)の改善が実証されている(EORTC 18071 [NCT00636168])。[ 12 ]しかしながら、イピリムマブは、この用量で重大な毒性を有する。North American Intergroup Trial E1609(NCT01274338)では、ipi10および3mg/kgの低量イピリムマブ(ipi3)(転移性黒色腫に承認)が検討され、高用量インターフェロン(HDI)と比較された。ipi3では、OSの有意な改善が示されたが、ipi10では有意な改善がみられなかった。[ 13 ]これらのデータから、黒色腫の補助療法としてのHDIの支持が取り消される。より新しいチェックポイント阻害薬が現れていることから、ipi3の役割はまだ確定していない。
より新しいチェックポイント阻害薬(ニボルマブおよびペムブロリズマブ)および併用シグナル伝達阻害薬(ダブラフェニブ + トラメチニブ)の大規模なランダム化試験では、毒性がイピリムマブより低く、無再燃生存(RFS)に対する臨床的に著しい効果が実証される。CheckMate 238(NCT02388906)では、ニボルマブがipi10と比較され、ニボルマブはRFSおよび安全性プロファイルにおいて優れていた。[ 14 ]これらの試験のすべてで、OSに関するデータが得られつつある。
プログラム細胞死リガンド1発現またはBRAF変異に関係なく、イピリムマブ、ニボルマブ、およびペムブロリズマブを用いた免疫療法の有益性が認められている。シグナル伝達阻害剤を用いる併用療法は、BRAF変異を有する患者に対する追加の選択肢である。
RFSおよびOSをさらに延長させるとともに、毒性がより少なく、治療スケジュールがより短い治療法を特定するようにデザインされた臨床試験への参加は、すべての患者にとって重要な選択肢である。
患肢灌流
高リスクの原発性I期四肢黒色腫の患者を対象として完了した第III相多施設ランダム化試験(SWOG-8593)でメルファランの患肢灌流が施行されたが、手術単独の場合と比較して、無病生存率またはOSについて便益は示されなかった。[ 5 ]
切除不能のIII期、IV期、再発黒色腫に対する体系的治療
遠隔部位に転移した黒色腫が治癒することはまれであるが、治療法の選択肢は急速に増加している。チェックポイントの阻害そしてマイトジェン活性化プロテインキナーゼ経路の標的化という2つのアプローチが、ランダム化試験でダカルバジン(DTIC)と比較され、OSの改善が実証されている。いずれも単剤での使用で治癒が得られることはないようであるが、併用の初期データは有望である。新しい薬剤と併用療法の開発が急速に進んでいることから、初期治療や増悪に際して、患者と医師には臨床試験での治療を考慮するよう勧める。
免疫療法
チェックポイント阻害剤
3つのチェックポイント阻害剤-ペムブロリズマブ、ニボルマブ、およびイピリムマブ-は現在ではFDAにより承認されている。いずれも、切除不能または進行黒色腫において異なる対照薬よりもOSに影響する能力があることを実証している。(詳しい情報については、本要約の切除不能なIII期、IV期、再発黒色腫の治療のセクションのペムブロリズマブ、ニボルマブ、およびイピリムマブのサブセクションを参照のこと。)免疫療法の至適順序、免疫療法と標的療法、および免疫療法の併用または免疫療法 + 標的療法がOSの増加に優れているかどうかを明らかにするために、複数の第III相試験が進行中である。
インターロイキン-2(IL-2)
IL-2は、計8件の第I相および第II相研究において、以前に転移性黒色腫の治療を受けた患者の少数(6~7%)で示された持続的完全奏効(CR)率のために、1998年にFDAにより承認された。高用量IL-2と他の治療法を比較し、OSに対する相対的影響を評価する第III相試験は、これまでに実施されていない。
シグナル伝達阻害剤
諸研究ではこれまでのところ、BRAFおよびMEK阻害剤の両方が、黒色腫の自然経過に有意な影響を及ぼしうることを示しているが、これらの薬剤は単剤では治癒をもたらさないようである。
BRAF阻害剤
ベムラフェニブ
FDAにより2011年に承認されたベムラフェニブは、切除不能または進行黒色腫の患者において無増悪生存(PFS)およびOSを改善することが実証されている。ベムラフェニブは経口投与可能な低分子の選択的BRAF V600Eキナーゼ阻害剤であり、その適応はFDA承認の検査でBRAF V600E変異が示された患者に限られる。[ 11 ]
ダブラフェニブ
ダブラフェニブは経口投与可能な低分子の選択的BRAF阻害剤で、2013年にFDAの承認を受け、国際多施設試験(BREAK-3[NCT01227889])におけるDTICとの比較でPFSの改善が示された。
MEK阻害剤
トラメチニブ
トラメチニブは、経口投与可能な低分子の選択的MEK1およびMEK2阻害剤であり、BRAF V600EまたはV600K変異を有する切除不能または転移性黒色腫患者に対する使用について、2013年にFDAの承認を受けた。トラメチニブは、DTICと比較してPFSを改善させることが示された。
コビメチニブ
コビメチニブは、BRAF阻害剤、ベムラフェニブとの併用において2015年にFDAにより承認された経口投与可能な低分子の選択的MEK阻害剤である。(詳しい情報については、本要約のシグナル伝達阻害剤併用療法のセクションを参照のこと。)
c-KIT阻害剤
初期のデータから、c-KITに活性化突然変異または増幅がみられる粘膜または末端の黒色腫は、さまざまなc-KIT阻害剤に感受性があることが示唆されている。[ 15 ][ 16 ][ 17 ]切除不能III期またはIV期黒色腫で、c-KIT変異を有する患者に対して、第II相および第III相試験が利用可能である。
シグナル伝達阻害剤併用療法
BRAF V600EまたはV600K変異を有する切除不能または転移性黒色腫患者に対する使用について、ダブラフェニブとトラメチニブの併用が2014年にFDAから迅速承認を受けた。この併用はダブラフェニブ単剤よりも持続的奏効率が高いことが示された。完全承認には、実施中の臨床試験の完了とOSに対する臨床的有益性の実証が待たれる。
BRAF V600EまたはV600K変異を有する切除不能または転移性黒色腫患者に対する使用について、ベムラフェニブとコビメチニブの併用も2015年にFDAにより承認された。発表された第III相試験のデータにより、BRAFおよびMEK阻害剤の別の併用 vs BRAF阻害剤 + プラセボ―ダブラフェニブ + トラメチニブ vs ダブラフェニブ + プラセボ―を用いた場合のPFSの改善が支持されている。OSのデータはまだ不完全である。
化学療法
DTIC
DTICは、全奏効率に基づいて1970年に承認された。第III相試験での全奏効率は10~20%であり、CRが観察されることはまれである。OSへの影響はランダム化試験では実証されていない。[ 18 ][ 19 ][ 20 ][ 21 ]前治療歴のない転移性黒色腫患者を対象とした、イピリムマブおよびベムラフェニブに関する最近の登録試験で、対照群としてDTICが用いられたが、そのOSは他と比べて劣ることが示された。
テモゾロミド
経口アルキル化剤の1つであるテモゾロミドは、OSを主要エンドポイントとした第III相ランダム化試験においてDTICの静脈内投与と同等と考えられる結果が出た;ただし、この試験はテモゾロミドの優越性を証明するために設計されたものであり、その目的は達成されなかったため、非劣性の統計的証明に十分なサンプルサイズを備えていないという問題が残された。[ 19 ]
参考文献- Shen P, Wanek LA, Morton DL: Is adjuvant radiotherapy necessary after positive lymph node dissection in head and neck melanomas? Ann Surg Oncol 7 (8): 554-9; discussion 560-1, 2000.[PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998.[PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000.[PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998.[PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998.[PUBMED Abstract]
- Wong SL, Balch CM, Hurley P, et al.: Sentinel lymph node biopsy for melanoma: American Society of Clinical Oncology and Society of Surgical Oncology joint clinical practice guideline. J Clin Oncol 30 (23): 2912-8, 2012.[PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996.[PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000.[PUBMED Abstract]
- Eggermont AM, Suciu S, Santinami M, et al.: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 372 (9633): 117-26, 2008.[PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004.[PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011.[PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med 375 (19): 1845-1855, 2016.[PUBMED Abstract]
- Tarhini AA, Lee SJ, Hodi FS, et al.: Phase III Study of Adjuvant Ipilimumab (3 or 10 mg/kg) Versus High-Dose Interferon Alfa-2b for Resected High-Risk Melanoma: North American Intergroup E1609. J Clin Oncol 38 (6): 567-575, 2020.[PUBMED Abstract]
- Leo F, Cagini L, Rocmans P, et al.: Lung metastases from melanoma: when is surgical treatment warranted? Br J Cancer 83 (5): 569-72, 2000.[PUBMED Abstract]
- Hodi FS, Friedlander P, Corless CL, et al.: Major response to imatinib mesylate in KIT-mutated melanoma. J Clin Oncol 26 (12): 2046-51, 2008.[PUBMED Abstract]
- Guo J, Si L, Kong Y, et al.: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol 29 (21): 2904-9, 2011.[PUBMED Abstract]
- Carvajal RD, Antonescu CR, Wolchok JD, et al.: KIT as a therapeutic target in metastatic melanoma. JAMA 305 (22): 2327-34, 2011.[PUBMED Abstract]
- Chapman PB, Einhorn LH, Meyers ML, et al.: Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17 (9): 2745-51, 1999.[PUBMED Abstract]
- Middleton MR, Grob JJ, Aaronson N, et al.: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol 18 (1): 158-66, 2000.[PUBMED Abstract]
- Avril MF, Aamdal S, Grob JJ, et al.: Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phase III study. J Clin Oncol 22 (6): 1118-25, 2004.[PUBMED Abstract]
- Robert C, Thomas L, Bondarenko I, et al.: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 364 (26): 2517-26, 2011.[PUBMED Abstract]
- Ollila DW, Hsueh EC, Stern SL, et al.: Metastasectomy for recurrent stage IV melanoma. J Surg Oncol 71 (4): 209-13, 1999.[PUBMED Abstract]
- Gutman H, Hess KR, Kokotsakis JA, et al.: Surgery for abdominal metastases of cutaneous melanoma. World J Surg 25 (6): 750-8, 2001.[PUBMED Abstract]
- 0期黒色腫の治療
-
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- I期黒色腫の治療
-
I期黒色腫に対する標準治療法の選択肢
I期黒色腫に対する標準治療法の選択肢としては以下のものがある:
切除
厚さ2mm以下の病変は1cmの切除縁をとる根治的切除で保存的に治療しうることを示す証拠がある。
黒色腫の部位にもよるが、現在では大部分の患者に外来治療のみでこの切除術を施行することが可能である。
証拠(切除):
- 1件のランダム化臨床試験では、厚さ2mm以下の黒色腫の患者において、切除縁を狭くとる場合(1cm)と広くとる場合(3cm以上)との比較が行われた。[
1
][
2
][証拠レベル:1iiA]
- 転移病巣の発生、無病生存(DFS)、全生存(OS)のいずれにおいても、これら2群間に差は観察されなかった。
- 別の2件のランダム化試験では、切除縁を2cmとる場合とより広く(4cmまたは5cm)とる場合との比較が行われた。[
3
][
4
][証拠レベル:1iiA]
- 局所再発、遠隔転移、OSのいずれについても両群間に統計的有意差は認められなかった;両試験とも、中央値で10年以上の追跡調査がなされた。
- Intergroup Melanoma Surgical Trialでは、切除縁の4cmから2cmへの縮小が以下の2点に関連していた:[
5
][証拠レベル:1iiA]
- 植皮の必要性の統計的に有意な減少(46%から11%に減少;P < 0.001)。
- 入院期間の短縮。
- 高リスクの原発性I期四肢黒色腫の患者を対象とした第III相多施設ランダム化試験(SWOG-8593)でメルファランの患肢灌流が施行されたが、手術単独の場合と比較して、DFSまたはOSについて便益は示されなかった。[ 6 ][ 7 ]
リンパ節の管理
選択的所属リンパ節郭清の有益性は、I期の黒色腫患者では証明されていない。[ 8 ]
中程度の厚さの腫瘍および/または潰瘍形成がみられる腫瘍を有する患者に対しリンパ節マッピングならびにセンチネルリンパ節生検(SLNB)を行うことで、潜在リンパ節病巣を有する患者を同定できる場合がある。これらの患者には、所属リンパ節郭清および補助療法が有益となる可能性がある。[ 6 ][ 9 ][ 10 ][ 11 ]
証拠(即時のリンパ節郭清 vs 観察とその後のリンパ節郭清):
- International Multicenter Selective Lymphadenectomy Trial(MSLT-1[JWCI-MORD-MSLT-1193])には、中程度の厚さ(この試験では1.2~3.5mmと定義)の原発性黒色腫患者1,269人が対象として含まれていた。[
12
][証拠レベル:1iiB]
- 広範囲切除 + SLNB後に、リンパ節陽性に対して直ちに完全リンパ節郭清を実施する群と、リンパ節を観察し、その後のリンパ節再発に対してリンパ節郭清を遅れて実施する群にそれぞれランダムに割り付けられた患者の間では、中央値にして59.8ヵ月経過時の黒色腫特異的な生存の優位性(主要エンドポイント)は認められなかった。
- この試験は顕微鏡的リンパ節転移を有する患者におけるリンパ節郭清の影響の差を検出するようには設計されなかった。
- Sunbelt Melanoma Trial(UAB-9735[NCT00004196])は、ポリメラーゼ連鎖反応法でのみ検出される超顕微鏡的なセンチネルリンパ節(SLN)転移を来した患者(すなわち、組織学および免疫組織化学検査ではSLNが陰性である患者)において、高用量インターフェロンα-2b補助療法を伴うまたは伴わないリンパ節郭清と、経過観察との間で、DFSおよびOSに対する効果の差を明らかにすることを目的とした第III相試験である。
- この研究から生存率データは報告されていない。
I期黒色腫に対する臨床評価段階にある治療法の選択肢
I期の黒色腫患者に対して臨床評価段階にある治療法の選択肢としては以下のものがある:
- 超顕微鏡的SLN転移の新たな検出手法を評価する臨床試験。臨床病期がI期の患者のうち、潜在リンパ節病巣のある症例では治療失敗の割合が高いことから、補助療法を併用するまたは併用しない所属リンパ節郭清が有益である患者を同定するために、複数の臨床試験で超顕微鏡的SLN転移を検出する新たな技術が評価されている。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Veronesi U, Cascinelli N: Narrow excision (1-cm margin). A safe procedure for thin cutaneous melanoma. Arch Surg 126 (4): 438-41, 1991.[PUBMED Abstract]
- Veronesi U, Cascinelli N, Adamus J, et al.: Thin stage I primary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N Engl J Med 318 (18): 1159-62, 1988.[PUBMED Abstract]
- Cohn-Cedermark G, Rutqvist LE, Andersson R, et al.: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0.8-2.0 mm. Cancer 89 (7): 1495-501, 2000.[PUBMED Abstract]
- Balch CM, Soong SJ, Smith T, et al.: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 8 (2): 101-8, 2001.[PUBMED Abstract]
- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993.[PUBMED Abstract]
- Essner R, Conforti A, Kelley MC, et al.: Efficacy of lymphatic mapping, sentinel lymphadenectomy, and selective complete lymph node dissection as a therapeutic procedure for early-stage melanoma. Ann Surg Oncol 6 (5): 442-9, 1999 Jul-Aug.[PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998.[PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998.[PUBMED Abstract]
- Gershenwald JE, Thompson W, Mansfield PF, et al.: Multi-institutional melanoma lymphatic mapping experience: the prognostic value of sentinel lymph node status in 612 stage I or II melanoma patients. J Clin Oncol 17 (3): 976-83, 1999.[PUBMED Abstract]
- Mraz-Gernhard S, Sagebiel RW, Kashani-Sabet M, et al.: Prediction of sentinel lymph node micrometastasis by histological features in primary cutaneous malignant melanoma. Arch Dermatol 134 (8): 983-7, 1998.[PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 355 (13): 1307-17, 2006.[PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Final trial report of sentinel-node biopsy versus nodal observation in melanoma. N Engl J Med 370 (7): 599-609, 2014.[PUBMED Abstract]
- 1件のランダム化臨床試験では、厚さ2mm以下の黒色腫の患者において、切除縁を狭くとる場合(1cm)と広くとる場合(3cm以上)との比較が行われた。[
1
][
2
][証拠レベル:1iiA]
- II期黒色腫の治療
-
II期黒色腫に対する標準治療法の選択肢
II期黒色腫に対する標準治療法の選択肢としては以下のものがある:
切除
厚さ2~4mmの黒色腫には、2~3cmまたはそれ以下の切除縁が必要である。
厚さが4mmを超える黒色腫の患者については治療の指針となるデータがほとんど存在しない;しかしながら、大半のガイドラインでは、解剖学的に可能な場合は常に3cmの切除縁をとることが推奨されている。
黒色腫の部位にもよるが、大部分の患者に外来治療のみで切除を施行することが可能である。
証拠(切除):
- Intergroup Melanoma Surgical Trial Task 2bでは、厚さ1~4mmの黒色腫の患者において、切除縁を2cmとる場合と4cmとる場合の比較が行われた。[
1
]
- 中央値で10年以上の追跡が行われたが、局所再発率と生存率のどちらにも2群間で有意差は認められなかった。
- 切除縁の4cmから2cmへの縮小は、以下の2点に関連していた:
- 植皮の必要性の統計的に有意な減少(46%から11%に減少;P < 0.001)。
- 入院期間の短縮。
- 英国で実施された研究では、厚さが2mmを超える黒色腫の患者が切除縁を1cmとる群と3cmとる群のいずれかにランダムに割り付けられた。[
2
]
- 切除縁が1cmであった患者の局所再発がより高率であった(ハザード比[HR]、1.26;95%信頼区間[CI]、1.00-1.59;P = 0.05)。
- 生存率に差は見られなかった(HR、1.24;95%CI、0.96-1.61;P = 0.1)。
- この研究は、厚さ2mm以上の黒色腫には1cmの切除縁では不十分な場合があることを示唆している。
リンパ節の管理
リンパ節マッピングおよびセンチネルリンパ節生検(SLNB)
リンパ節マッピングおよびSLNBは、II期の黒色腫患者の所属リンパ節における潜在転移の有無を評価するために用いられている。これにより、所属リンパ節郭清(LND)による病的状態を免れる患者および補助療法が有益な患者を同定できる可能性がある。[ 3 ][ 4 ][ 5 ][ 6 ][ 7 ]
センチネルリンパ節を正確に同定するには、原発黒色腫の広範囲切除前にリンパ節マッピングとSLNの切除を施行すべきである。
原発腫瘍の認められる部位にvital blue dyeおよび放射性医薬品を投与し、病巣が転移するリンパ流域にある最初のリンパ節を同定して切除し、顕微鏡的に検査する。数件の研究でSLNBの診断精度が実証されており、偽陰性率は0~2%である。[ 3 ][ 8 ][ 9 ][ 10 ][ 11 ][ 12 ]転移性黒色腫が認められれば、二次治療で完全所属リンパ節郭清を施行する。
所属リンパ節郭清
これまでのところ、所属リンパ節に認められる黒色腫の微小転移の臨床的意義に関するプロスペクティブ試験のデータは発表されていない。いくつかの証拠によると、腫瘍の厚さが中程度かつ潜在転移が疑われる患者では、リンパ節転移の臨床徴候が認められるまでリンパ節郭清を遅らせるよりも、直ちに所属リンパ節郭清を施行する方が生存率は良好である。[ 13 ]この知見は、特定のランダム化試験データを事後にサブセット分析して得られたものであるため、慎重に検討する必要がある。
証拠(所属リンパ節郭清):
- International Multicenter Selective Lymphadenectomy Trial(MSLT-1[JWCI-MORD-MSLT-1193])には、中程度の厚さ(この試験では1.2~3.5mmと定義)の原発性黒色腫患者1,269人が対象として含まれていた。[
14
][証拠レベル:1iiB]
- 広範囲切除 + SLNB後に、リンパ節陽性に対して直ちに完全リンパ節郭清を実施する群と、リンパ節を観察し、その後のリンパ節再発に対してリンパ節郭清を遅れて実施する群にそれぞれランダムに割り付けられた患者の間では、中央値にして59.8ヵ月経過時の黒色腫特異的な生存の優位性(主要エンドポイント)は認められなかった。
- この試験は顕微鏡的リンパ節転移を有する患者におけるリンパ節郭清の影響の差を検出するようには設計されなかった。
- 他の3件のプロスペクティブ・ランダム化試験でも、予防的所属LNDの生存に対する有益性は示されなかった。[ 15 ][ 16 ][ 17 ]
II期黒色腫に対する臨床評価段階にある治療法の選択肢
術後全身補助療法は、II期の患者で十分に検討されているわけではない;そのため、再燃リスクの高い患者にとって、臨床試験が重要な治療法の選択肢となる。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993.[PUBMED Abstract]
- Thomas JM, Newton-Bishop J, A'Hern R, et al.: Excision margins in high-risk malignant melanoma. N Engl J Med 350 (8): 757-66, 2004.[PUBMED Abstract]
- Gershenwald JE, Thompson W, Mansfield PF, et al.: Multi-institutional melanoma lymphatic mapping experience: the prognostic value of sentinel lymph node status in 612 stage I or II melanoma patients. J Clin Oncol 17 (3): 976-83, 1999.[PUBMED Abstract]
- McMasters KM, Reintgen DS, Ross MI, et al.: Sentinel lymph node biopsy for melanoma: controversy despite widespread agreement. J Clin Oncol 19 (11): 2851-5, 2001.[PUBMED Abstract]
- Cherpelis BS, Haddad F, Messina J, et al.: Sentinel lymph node micrometastasis and other histologic factors that predict outcome in patients with thicker melanomas. J Am Acad Dermatol 44 (5): 762-6, 2001.[PUBMED Abstract]
- Essner R: The role of lymphoscintigraphy and sentinel node mapping in assessing patient risk in melanoma. Semin Oncol 24 (1 Suppl 4): S8-10, 1997.[PUBMED Abstract]
- Chan AD, Morton DL: Sentinel node detection in malignant melanoma. Recent Results Cancer Res 157: 161-77, 2000.[PUBMED Abstract]
- Morton DL, Wen DR, Wong JH, et al.: Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 127 (4): 392-9, 1992.[PUBMED Abstract]
- Reintgen D, Cruse CW, Wells K, et al.: The orderly progression of melanoma nodal metastases. Ann Surg 220 (6): 759-67, 1994.[PUBMED Abstract]
- Thompson JF, McCarthy WH, Bosch CM, et al.: Sentinel lymph node status as an indicator of the presence of metastatic melanoma in regional lymph nodes. Melanoma Res 5 (4): 255-60, 1995.[PUBMED Abstract]
- Uren RF, Howman-Giles R, Thompson JF, et al.: Lymphoscintigraphy to identify sentinel lymph nodes in patients with melanoma. Melanoma Res 4 (6): 395-9, 1994.[PUBMED Abstract]
- Bostick P, Essner R, Glass E, et al.: Comparison of blue dye and probe-assisted intraoperative lymphatic mapping in melanoma to identify sentinel nodes in 100 lymphatic basins. Arch Surg 134 (1): 43-9, 1999.[PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998.[PUBMED Abstract]
- Morton DL, Thompson JF, Cochran AJ, et al.: Sentinel-node biopsy or nodal observation in melanoma. N Engl J Med 355 (13): 1307-17, 2006.[PUBMED Abstract]
- Veronesi U, Adamus J, Bandiera DC, et al.: Delayed regional lymph node dissection in stage I melanoma of the skin of the lower extremities. Cancer 49 (11): 2420-30, 1982.[PUBMED Abstract]
- Sim FH, Taylor WF, Ivins JC, et al.: A prospective randomized study of the efficacy of routine elective lymphadenectomy in management of malignant melanoma. Preliminary results. Cancer 41 (3): 948-56, 1978.[PUBMED Abstract]
- Balch CM, Soong SJ, Bartolucci AA, et al.: Efficacy of an elective regional lymph node dissection of 1 to 4 mm thick melanomas for patients 60 years of age and younger. Ann Surg 224 (3): 255-63; discussion 263-6, 1996.[PUBMED Abstract]
- Intergroup Melanoma Surgical Trial Task 2bでは、厚さ1~4mmの黒色腫の患者において、切除縁を2cmとる場合と4cmとる場合の比較が行われた。[
1
]
- 切除可能なIII期黒色腫の治療
-
切除可能なIII期黒色腫に対する標準治療法の選択肢
切除可能なIII期黒色腫に対する標準治療法の選択肢としては以下のものがある:
切除
原発腫瘍に対し、腫瘍の厚さと位置により1~3cmの切除縁で広範囲局所切除を施行する。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ][ 6 ][ 7 ]切除の結果生じる欠損を閉じるために植皮が必要になる場合がある。
リンパ節の管理
センチネルリンパ節生検(SLNB)
1~4mmを超える原発腫瘍を有する患者の所属リンパ節における潜在転移の有無を評価するために、リンパ節マッピングおよびSLNBを考慮でき、これにより、所属リンパ節郭清による病的状態を免れることができる患者、および補助療法が有益な患者を同定できる可能性がある。[ 3 ][ 8 ][ 9 ][ 10 ][ 11 ][ 12 ]
センチネルリンパ節(SLN)を正確に同定するには、原発巣の広範囲切除前にリンパ節マッピングとSLNの切除を施行すべきである。
数件の研究でSLNBの診断精度が実証されており、偽陰性率は0~2%である。[ 8 ][ 12 ][ 13 ][ 14 ][ 15 ][ 16 ][ 17 ]転移性黒色腫が認められれば、二次治療で完全所属リンパ節郭清を施行する。
完全リンパ節郭清(CLND)
局所コントロールに関してセンチネルリンパ節が顕微鏡的または肉眼的に陽性である患者には、CLNDを考慮できるほか、CLNDが生存率に影響を及ぼすかどうかを判定するMulticenter Selective Lymphadenectomy Trial II(NCT00297895)への参加を検討してもよい。正確なリンパ節マッピングを行うために、SLNBは原発巣を広範囲切除する前に実施すべきである。
補助療法
完全切除後に再発リスクの高い患者に対する補助療法の選択肢が拡がっており、至適治療に関するデータがまだ得られつつある。イピリムマブは、米国食品医薬品局(FDA)により補助療法として承認された最初のチェックポイント阻害薬であり、10mg/kg(ipi10)でプラセボと比較して全生存(OS)の改善が実証されている(EORTC 18071 [NCT00636168])。[ 18 ]しかしながら、ipi10は、この用量で重大な毒性を有する。North American Intergroup Trial E1609(NCT01274338)では、ipi10および3mg/kgの低量イピリムマブ(ipi3)(転移性黒色腫に承認)が高用量インターフェロン(HDI)と比較された。ipi3では、OSの有意な改善が示されたが、ipi10では有意な改善がみられなかった。[ 19 ]これらのデータから、黒色腫の補助療法としてのHDIの支持が取り消される。より新しいチェックポイント阻害薬が現れていることから、ipi3の役割はまだ確定していない。
より新しいチェックポイント阻害薬(ニボルマブおよびペムブロリズマブ)および併用シグナル伝達阻害薬(ダブラフェニブ + トラメチニブ)の大規模なランダム化試験では、毒性がイピリムマブより低く、無再燃生存(RFS)に対する臨床的に著しい効果が実証される。CheckMate 238(NCT02388906)では、ニボルマブがipi10と比較され、ニボルマブはRFSおよび安全性プロファイルにおいて優れていた。[ 20 ]これらの試験のすべてで、OSに関するデータが得られつつある。
プログラム死リガンド1(PD-L1)発現またはBRAF変異に関係なく、イピリムマブ、ニボルマブ、およびペムブロリズマブを用いた免疫療法の有益性が示されている。シグナル伝達阻害剤を用いる併用療法は、BRAF変異を有する患者に対する追加の選択肢である。
RFSおよびOSをさらに延長させるとともに、毒性がより少なく、治療スケジュールがより短い治療法を特定する臨床試験への参加は、すべての患者にとって重要な選択肢である。
免疫療法
チェックポイント阻害剤
ニボルマブ
証拠(ニボルマブ):
- 1件の多国籍ランダム化二重盲検試験(CheckMate 238[NCT02388906])において、IIIB期、IIIC期、またはIV期黒色腫を完全切除された患者がニボルマブまたはイピリムマブを受ける群に1:1の比率でランダムに割り付けられた。[
20
][証拠レベル:1iDii]主要エンドポイントはRFSで、ランダム化から最初の再発、新たな原発性黒色腫発生、またはすべての原因による死亡日までの期間と定義された。除外された患者としては、ランダム化の12週間以上前に切除を受けた患者、自己免疫疾患を有する患者、全身グルココルチコイドを使用している患者、黒色腫に対して以前に全身療法を受けた患者、およびEastern Cooperative Oncology Group(ECOG)のパフォーマンスステータス(PS)が1を超える患者が挙げられた。ニボルマブは3mg/kgの用量で2週間ごとに静注(IV)され、イピリムマブは10mg/kgの用量で3週間ごとに4回投与された後、最大1年間または疾患が再発するまで3ヵ月ごとに対応するプラセボとともに投与された。
計906人の患者がランダムに割り付けられた:ニボルマブ群に453人の患者およびイピリムマブ群に453人の患者。ベースラインの患者の特徴は均衡がとられた。約81%の患者がIII期疾患を有し、32%が潰瘍性原発黒色腫を有し、48%が肉眼的リンパ節転移を有し、62%ではPD-L1発現が5%未満であり、42%にBRAF変異が認められた。
- European Organisation for Research and Treatment of Cancer(EORTC)のIndependent Data Monitoring Committeeにより、プロトコルで規定された中間解析時に研究が中止されたが、この時点ですべての患者が少なくとも18ヵ月以上追跡され、360の無再発生存イベントが発生していた。RFS期間中央値は両治療群で未達であった。12ヵ月経過時に、ニボルマブで治療された患者のRFS率が70.5%(95%信頼区間[CI]、66.1-74.0)であったのに対して、イピリムマブで治療された患者では60.8%(95%CI、56.0-65.2)であった。ニボルマブによる治療を受けた患者453人中154人(34%)で再発または死亡が認められたのに対して、イピリムマブによる治療を受けた患者では453人中206人(45.5%)で再発または死亡が認められた(ハザード比[HR]再発または死亡、0.65;97.56%CI、0.51-0.83;P < 0.001)。RFSのサブグループ解析では、PD-L1発現またはBRAF V600変異に関係なく、ニボルマブが良好であった。
- ニボルマブによる治療を受けた患者では、グレード3~4の重篤な有害事象(AE)および死亡を含めて、AEが少なかった。AEが認められたことにより、ニボルマブは患者の9.7%で、イピリムマブは患者の42.6%で中止された。イピリムマブでは2例の治療関連死(例、骨髄造血不全および結腸炎)が発生したが、ニボルマブで治療された患者での治療関連死はなかった。AEのプロファイルは転移がんの設定で見られるチェックポイント阻害剤の毒性の種類に類似しており、免疫関連イベントが消化管系、肝臓系、および皮膚に最も一般的に見られた。グレード3または4のAEはニボルマブで治療された患者の14%およびイピリムマブで治療された患者の46%に発生した。
ペムブロリズマブ
証拠(ペムブロリズマブ):
- 1件の多国籍ランダム化二重盲検試験(MK-3475-054/KEYNOTE-054[NCT02362594])において、IIIA期、IIIB期、またはIIIC期黒色腫を完全切除された患者がペムブロリズマブまたはプラセボを受ける群に1:1の比率でランダムに割り付けられた。[
21
][証拠レベル:1iDii]主要エンドポイントはRFSで、ランダム化から最初の再発日またはすべての原因によって死亡する日までの期間と定義された。再発が証拠付けられた場合、患者はペムブロリズマブへのクロスオーバーまたはペムブロリズマブによる再治療が可能であった。ペムブロリズマブは、3週間ごとに計18回(約1年間)、200mgの静注(IV)として投与された。
計1,019人の患者がランダムに割り付けられた:ペムブロリズマブ群に514人の患者およびプラセボ群に505人の患者。ベースラインの患者の特徴は均衡がとられた。約40%の患者が潰瘍性原発黒色腫を有し、66%が肉眼的リンパ節転移を有し、84%ではPD-L1発現が陽性(22C3抗体解析で黒色腫のスコアが2を超える)であり、44%にBRAF変異が認められた。
- EORTC Independent Data Monitoring Committeeにより、351イベント(再発または死亡)が発生して修正された中間解析時に発表された結果がレビューされた。肯定的な結果が得られ、RFSの中間解析が最終解析となった。患者は引き続きOSおよび効力に関する他の副次エンドポイントについてモニタリングされる。
- 追跡期間中央値15ヵ月時に、12ヵ月RFS率は、ペムブロリズマブ群で75.4%(95%CI、71.3-78.9) vs プラセボ群で61.0%(95%CI、56.5-65.1)であった。PD-L1発現が陽性であるか陰性であるか、またはBRAF変異状態に関係なく、ペムブロリズマブは効果を維持した。
- 約14%の患者では、AEによりペムブロリズマブが中止された。ペムブロリズマブに関係すると考えられるグレード3、4、または5のAEが15%の患者で発生した。治療による死亡(筋炎)は1例であった。
イピリムマブ
証拠(イピリムマブ):
- North American Intergroupのオープンラベル3群試験E1609(NCT01274338)では、高リスクの黒色腫患者の補助療法として、2用量のイピリムマブが高用量インターフェロン(HDI)と比較された。[
19
]計1,670人の切除後の患者(米国がん合同委員会第7版によりIIIB期、IIIC期、M1a期、またはM1b期と定義)がイピリムマブ3mg/kg(ipi3)またはイピリムマブ10mg/kg(ipi10)を3週間ごとに4回(寛解導入期)、その後に同用量を12週間ごとに4回(維持期)投与する群、またはHDI 2,000万単位/m2/日を週5日で4週間(寛解導入期)、その後に1,000万単位/m2を隔日に週3日で48週間(維持期)皮下投与する群に(1:1:1で)ランダムに割り付けられた。[
19
][証拠レベル:1iiA].
本試験は、RFSとOSの2つの複合主要エンドポイントを用いて、ipi3 vs HDIを評価し、その後にipi10 vs HDIを評価する階層的解析デザインであった。イベントまでの時間が予想より長かったことから、追跡期間中央値が57.4ヵ月(範囲、0.03ヵ月-86.6ヵ月)であることを考慮して、本デザインはデータカットオフ日の最終解析で修正された。
- ipi3では、OSがHDIと比較して有意に改善した(HR、0.78;95%反復CI、0.61-0.99;P = 0.044)が、RFSでは有意な改善がみられなかった(HR、0.85;95%CI、0.66-1.09;P = 0.065)。
- ipi10では、HDIと比較してOSまたはRFSの有意な改善がみられなかった(それぞれHR、0.88;95.6%CI、0.69-1.12および探索的HR、0.84;99.4%CI、0.65-1.09)。
- 救援療法が用いられた患者の割合は、ipi3後が69.7%、ipi10後が51.6%、HDI後が86.2%であった。
ipi3における毒性がipi10より低かった;しかしながら、いずれにも治療関連の投与中止および死亡がみられた。
- 治療関連の投与中止は、ipi3群が34.9%、ipi10群が54.1%であった。
- 治療と関連があるかもしれない死亡がipi3群で3例、ipi10群で5例、HDI群で2例にみられた。
本研究では、高リスク黒色腫患者に対する補助療法として、HDIの役割を支持する証拠はないと結論された。さらに、ipi3では、HDIと比較したipi10よりも優れたOSデータが得られている。CheckMate 238で、ニボルマブがRFSの改善においてipi10より優れていることが実証されたが、OSデータがまだ得られつつあることから、単剤補助療法としてのイピリムマブの役割は不明である。
- 1件の多国籍ランダム化二重盲検試験(EORTC 18071 [NCT00636168])において、III期黒色腫の完全切除を受けた患者がイピリムマブまたはプラセボを受ける群に(1:1の比率で)ランダムに割り付けられた。[
22
][証拠レベル:1iiDii]1mm超のリンパ節転移を有する、in-transit転移を有する、ランダム化の12週間以上前に切除を受けている、自己免疫疾患を有する、以前にまたは同時に免疫抑制療法を受けている、黒色腫に対して以前に全身療法を受けている、およびECOGのPSが1を超える患者は除外された。イピリムマブの用量は10mg/kg、3週間ごとに4回投与、その後は3ヵ月ごと、最長3年間であった。主要エンドポイントは、再発または死亡(原因を問わない)でいずれか早い方として定義されたRFSで、独立判定委員会により評価された。
- 計951人の患者が登録された(イピリムマブ群に475人の患者およびプラセボ群に476人の患者)。年齢中央値は51歳で、94%の患者でPSが0であった。
- 中央値2.7年間の追跡調査の時点で、528例のRFSイベントが発生していた:イピリムマブ群で234例(49%;220例の再発、14例の死亡)およびプラセボ群で294例(62%;289例の再発、5例の死亡)。RFS期間中央値は、イピリムマブ群で26ヵ月(95%CI、19-39)に対してプラセボ群で17ヵ月(95%CI、13-22)であった。HRは0.75(95%CI、0.64-0.90);P < 0.002であった。イピリムマブの効果はサブグループで一貫していた。
- イピリムマブは52%の患者で有害事象(AE)のために中止された。患者は中央値で4回のイピリムマブを受けた;イピリムマブ群の患者の36%が6ヵ月以上治療を継続し、26%が1年以上治療を継続した。薬物関連イベントにより5人の患者が死亡した:3人が大腸炎に続発して死亡し、1人が心筋炎で死亡し、1人はギラン・バレー症候群を伴う多臓器不全で死亡した。最も一般的なAEは本質的に、消化管、肝臓、および内分泌に関連するもので、発疹、疲労、および頭痛が挙げられた。
追跡期間中央値5.3年時に解析が更新された。[ ]
- 5年RFS率はイピリムマブで治療された患者で40.8%およびプラセボを投与された患者で30.3%(HR再発または死亡、0.76;95%CI、0.64-0.89;P < 0.001)であり、RFS率中央値は、イピリムマブで治療された患者で27.6%およびプラセボを投与された患者で17.1%であった。
- 副次エンドポイントである5年OS率は、イピリムマブで治療された患者で65.4%であったのに対して、プラセボを投与された患者で54.4%であった(HR死亡、0.72;95.1%CI、0.58-0.88;P = 0.001)。
プラセボと比較して10mg/kgの高用量イピリムマブを検討した本試験(EORTC 18071)からのデータは、補助療法の設定でのイピリムマブ承認の根拠として役立った。しかしながら、その後のインターグループ試験E1609(上述)では、転移例に承認された用量でもある低量(3mg/kg)イピリムマブによる良好な治療結果が実証された。
インターフェロンα-2b
証拠(高用量インターフェロンα):
- 1件の多施設ランダム化比較研究(EST-1690)では、インターフェロンα-2bの高用量レジメンが、低用量レジメン(体表面積m2当たり300万単位/日を週3回、104週間、皮下投与)または経過観察のいずれかと比較された。この試験の病期別の登録基準には、II期およびIII期黒色腫の患者が設定された。この3群比較試験には642人の患者が登録した。[
14
][証拠レベル:1iiA]
- 中央値で52ヵ月間の追跡調査時点で、高用量インターフェロン投与を受けたすべての患者(臨床病期がII期の患者を含む)のRFSは観察群よりも統計的に有意に良好であった(P = 0.03)。
- 低用量インターフェロン投与群では、観察群と比較して、RFSに関する統計的に有意な優位性は認められなかった。
- 推定5年RFS率は、高用量インターフェロン投与群で44%、低用量インターフェロン投与群で40%、観察群で35%であった。
- 高用量および低用量のどちらに関しても、インターフェロン投与が経過観察と比べてOSに有益であるということは示されなかった(HR、1.0;P = 0.995)。
- 高用量群と観察群のプール解析(EST-1684およびEST-1690)では、高用量投与はRFSに対して有意な優位性を有するが、生存に対しては有意な有益性はないことが示唆されている。
- 米国内の多施設ランダム化試験であるECOG-1697[NCT00003641]では、厚さが2mm以上でリンパ節転移陰性の黒色腫患者か、または厚さに関係なくセンチネルリンパ節転移陽性の患者において、短期間(1ヵ月)の高用量インターフェロン静脈内投与と経過観察を比較して評価した。インターフェロン治療での有益性が認められなかったため、この試験は中間解析時に中止された。
- 半減期が長く、皮下投与が可能なペグインターフェロンα-2bは、完全リンパ節郭清などの外科的完全切除から84日以内に顕微鏡的または肉眼的にリンパ節転移が認められた黒色腫の補助療法として、2011年に米国食品医薬品局により承認された。
ペグインターフェロンα-2aの承認に対する根拠となったEORTC-18991(NCT00006249)試験では、III期の黒色腫を切除した患者1,256人が、最大5年間、毎週ペグインターフェロンα-2bの皮下投与を受ける群か観察群のいずれかにランダムに割り付けられた。[ 15 ][証拠レベル:1iiDii]
- RFSは独立判定委員会により判定され、インターフェロンを投与された患者で改善された(34.8ヵ月 vs 観察群で25.5ヵ月;HR、0.82;95%CI、0.71-0.96;P = 0.011)。
- 両群間でOS中央値における差は観察されなかった(HR、0.98;95%CI、0.82-1.16)。
- ペグインターフェロンが投与された患者の3分の1が、毒性のために治療を中止した。
シグナル伝達阻害剤の併用
ダブラフェニブ + トラメチニブ
証拠(ダブラフェニブ + トラメチニブ):
- 1件の多国籍ランダム化二重盲検試験(COMBI-AD[NCT01682083])において、IIIA期、IIIB期、またはIIIC期黒色腫でBRAF V600EまたはV600K変異を有し、完全リンパ節郭清を受けた患者がダブラフェニブ + トラメチニブまたは2剤の対応するプラセボ錠を受ける群に1:1の比率でランダムに割り付けられた。[
23
][証拠レベル:1iDii]主要エンドポイントはRFSで、ランダム化から最初の再発日またはすべての原因によって死亡する日までの期間と定義された。ランダム化割り付けの12週間以上前に切除を受けた患者およびECOGのPSが1を超える患者は除外された。ダブラフェニブは150mg、1日2回 + トラメチニブは2mg、1日1回(併用療法)の用量で疾患再発、受け入れらない毒性作用、または死亡が発生しない限り12ヵ月間投与された。計870人の患者がランダムに割り付けられた(併用療法群に438人の患者およびプラセボ群に432人の患者)。ベースラインの患者の特徴は均衡がとられた。ほとんどの患者(91%)がV600E変異を有したのに対し、9%の患者がV600K変異を有した。ほとんどの患者(92%)では、ECOGのPSが0であった。
- 主要解析のデータカットオフ日に、最短追跡期間は2.5年(中央値、2.8年)で、すべての患者が試験の治療を完了していた。併用療法を受けた患者438人中163人(37%)およびプラセボを投与された患者432人中247人(57%)に疾患の再発が報告された(RFSに対するHR、0.47;95%CI、0.39-0.59;P < 0.001)。RFS期間中央値は、併用群では到達しておらず(95%CI、44.5-到達せず)、プラセボ群では16.6ヵ月(95%CI、12.7-22.1)であった。HR死亡は0.57;95%CI、0.42-0.79;P = 0.0006であった。この結果は中間解析時にプロトコルで規定されていた統計的有意性の境界(P = 0.000019)を満たさなかった。
- 併用療法群では、26%の患者で治療の中止に至るAEが認められ、38%の患者では用量減量が必要となり、66%の患者では投与の中断が必要であった。プラセボ群では、3%の患者で治療の中止に至るAEが認められ、3%の患者では用量減量が必要となり、15%の患者では投与の中断が必要であった。併用療法を受けた患者の36%で重篤なAEが発生したのに対して、プラセボ群の患者では10%に重篤なAEが発生した。併用療法群では、肺炎の結果として1例の死亡が報告された。
切除可能なIII期黒色腫に対する臨床評価段階にある治療法の選択肢
切除可能なIII期黒色腫に対して臨床評価段階にある治療法の選択肢としては以下のものがある:
- ワクチンを含む免疫療法を併用する試験。
- 既知の変異(例、c-KIT)を標的にしている補助療法の試験。
- 病変内局注療法。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Veronesi U, Cascinelli N: Narrow excision (1-cm margin). A safe procedure for thin cutaneous melanoma. Arch Surg 126 (4): 438-41, 1991.[PUBMED Abstract]
- Veronesi U, Cascinelli N, Adamus J, et al.: Thin stage I primary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N Engl J Med 318 (18): 1159-62, 1988.[PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000.[PUBMED Abstract]
- Cohn-Cedermark G, Rutqvist LE, Andersson R, et al.: Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0.8-2.0 mm. Cancer 89 (7): 1495-501, 2000.[PUBMED Abstract]
- Balch CM, Soong SJ, Smith T, et al.: Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1-4 mm melanomas. Ann Surg Oncol 8 (2): 101-8, 2001.[PUBMED Abstract]
- Heaton KM, Sussman JJ, Gershenwald JE, et al.: Surgical margins and prognostic factors in patients with thick (>4mm) primary melanoma. Ann Surg Oncol 5 (4): 322-8, 1998.[PUBMED Abstract]
- Balch CM, Urist MM, Karakousis CP, et al.: Efficacy of 2-cm surgical margins for intermediate-thickness melanomas (1 to 4 mm). Results of a multi-institutional randomized surgical trial. Ann Surg 218 (3): 262-7; discussion 267-9, 1993.[PUBMED Abstract]
- Shen P, Wanek LA, Morton DL: Is adjuvant radiotherapy necessary after positive lymph node dissection in head and neck melanomas? Ann Surg Oncol 7 (8): 554-9; discussion 560-1, 2000.[PUBMED Abstract]
- Hochwald SN, Coit DG: Role of elective lymph node dissection in melanoma. Semin Surg Oncol 14 (4): 276-82, 1998.[PUBMED Abstract]
- Cascinelli N, Morabito A, Santinami M, et al.: Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet 351 (9105): 793-6, 1998.[PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998.[PUBMED Abstract]
- Wong SL, Balch CM, Hurley P, et al.: Sentinel lymph node biopsy for melanoma: American Society of Clinical Oncology and Society of Surgical Oncology joint clinical practice guideline. J Clin Oncol 30 (23): 2912-8, 2012.[PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996.[PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000.[PUBMED Abstract]
- Eggermont AM, Suciu S, Santinami M, et al.: Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomised phase III trial. Lancet 372 (9633): 117-26, 2008.[PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004.[PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011.[PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy. N Engl J Med 375 (19): 1845-1855, 2016.[PUBMED Abstract]
- Tarhini AA, Lee SJ, Hodi FS, et al.: Phase III Study of Adjuvant Ipilimumab (3 or 10 mg/kg) Versus High-Dose Interferon Alfa-2b for Resected High-Risk Melanoma: North American Intergroup E1609. J Clin Oncol 38 (6): 567-575, 2020.[PUBMED Abstract]
- Weber J, Mandala M, Del Vecchio M, et al.: Adjuvant Nivolumab versus Ipilimumab in Resected Stage III or IV Melanoma. N Engl J Med 377 (19): 1824-1835, 2017.[PUBMED Abstract]
- Eggermont AMM, Blank CU, Mandala M, et al.: Adjuvant Pembrolizumab versus Placebo in Resected Stage III Melanoma. N Engl J Med 378 (19): 1789-1801, 2018.[PUBMED Abstract]
- Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.: Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol 16 (5): 522-30, 2015.[PUBMED Abstract]
- Long GV, Hauschild A, Santinami M, et al.: Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N Engl J Med 377 (19): 1813-1823, 2017.[PUBMED Abstract]
- 1件の多国籍ランダム化二重盲検試験(CheckMate 238[NCT02388906])において、IIIB期、IIIC期、またはIV期黒色腫を完全切除された患者がニボルマブまたはイピリムマブを受ける群に1:1の比率でランダムに割り付けられた。[
20
][証拠レベル:1iDii]主要エンドポイントはRFSで、ランダム化から最初の再発、新たな原発性黒色腫発生、またはすべての原因による死亡日までの期間と定義された。除外された患者としては、ランダム化の12週間以上前に切除を受けた患者、自己免疫疾患を有する患者、全身グルココルチコイドを使用している患者、黒色腫に対して以前に全身療法を受けた患者、およびEastern Cooperative Oncology Group(ECOG)のパフォーマンスステータス(PS)が1を超える患者が挙げられた。ニボルマブは3mg/kgの用量で2週間ごとに静注(IV)され、イピリムマブは10mg/kgの用量で3週間ごとに4回投与された後、最大1年間または疾患が再発するまで3ヵ月ごとに対応するプラセボとともに投与された。
- 切除不能なIII期、IV期、再発黒色腫の治療
-
切除不能なIII期、IV期、再発黒色腫に対する治療法の選択肢
切除不能なIII期、IV期、再発黒色腫に対する治療法の選択肢としては以下のものがある:
- 病変内局注療法。
- 免疫療法。
-
シグナル伝達阻害剤。
-
BRAF(V-Rafマウス肉腫ウイルスがん遺伝子ホモログB1)阻害剤(BRAF V600変異が検査で陽性となった患者に対して)。
-
マイトジェン活性化プロテインキナーゼ(MEK)阻害剤。
-
KIT阻害薬。
-
シグナル伝達阻害剤を用いる併用療法。
-
BRAF(V-Rafマウス肉腫ウイルスがん遺伝子ホモログB1)阻害剤(BRAF V600変異が検査で陽性となった患者に対して)。
- 化学療法。
- 局所の緩和療法。
2つのアプローチ-チェックポイントの阻害およびマイトジェン活性化プロテインキナーゼ(MAPK)経路の標的化-が、複数のランダム化試験で無増悪生存(PFS)と全生存(OS)の改善を実証した。抗PD-1単剤療法(ペムブロリズマブまたはニボルマブ)は、単剤の抗CTLA-4(イピリムマブ)を用いた治療または研究者が選択した化学療法と比較した場合に安全性プロファイルがより良好であったことから、効力アウトカムの改善を実証した。抗PD-1および抗CTLA-4免疫療法の併用(ニボルマブおよびイピリムマブ)もまた、イピリムマブと比較してPFSおよびOSを延長させるが、この併用は重大な毒性作用に関連している。
新しい薬剤や併用療法の開発のほか、残る問題の説明が急速に進んでいることから、初期治療や増悪に際して、患者と医師には臨床試験の検討が推奨されている。臨床試験では以下の問題が扱われている:
- 毒性作用を低下させ、効力を維持するために併用免疫療法に最適な投与量。
- 単剤療法よりも併用免疫療法から利益が得られる患者の選択方法。
- 効力のバイオマーカーとしてのPD-L1発現の役割。
- 維持療法の役割。
- 免疫療法と標的療法など、治療順序の価値。
病変内局注療法
talimogene laherparepvec(T-VEC)
T-VECは遺伝子改変単純ヘルペスウイルス1型(HSV1)腫瘍溶解療法で、初回手術後に再発した黒色腫患者における切除不能な皮膚、皮下、およびリンパ節病変への局所病変内注入として承認されている。T-VECは腫瘍内で増殖して溶解を引き起こし、顆粒球-マクロファージコロニー刺激因子(GM-CSF)を産生させるようにデザインされている。ウイルス由来のGM-CSFに伴う抗原の放出により、抗腫瘍免疫応答が促進される;ただし、正確な作用機序は不明である。
米国食品医薬品局(FDA)によるT-VECの承認は、病変の縮小を実証したデータに基づく;しかしながら、OSの改善のほか、内臓転移への効果または生活の質の改善は示されていない。
証拠(T-VEC):
- 1件の多国籍ランダム化オープンラベル試験(NCT00769704)では、436人の患者が2:1の比率で6ヵ月以上または注入可能な病変がなくなるまで継続する病変内T-VEC投与またはGM-CSF皮下投与のいずれかにランダムに割り付けられた。[
1
][証拠レベル:1iiDiv]適格患者は、二次元的に測定可能な切除不能病変のあるIIIB期、IIIC期、およびIV期黒色腫を有する患者であった。主要エンドポイントは持続的奏効率(DRR)(6ヵ月以上持続する完全奏効[CR]または部分奏効[PR])で、独立した審査により評価された。この研究は、初再発部位、肝転移の存在、疾患の病期、および以前の補助全身療法以外の治療により層別化された。
- 患者の年齢中央値は63歳(範囲、22-94歳)、患者の70%でベースライン時のEastern Cooperative Oncology Group(ECOG)パフォーマンスステータス(PS)スコアが0で、30%がIII期疾患を有し、70%がIV期疾患(27%がM1a;21%がM1b;および22%がM1c)を有した。53%の患者が、黒色腫に対して以前に治療を受けていた。
- 初回用量のみ、106プラーク形成単位(pfu)/mLですべての病変を併せて最大4mL投与された。その後の用量は8pfu/mLですべての注入病変を併せて最大4.0mL投与され、注入量は病変の大きさに基づいていた。内臓病変への注入は許可されなかった。
- T-VEC治療群の患者では、16%(95%信頼区間[CI]、12.0-20.5)でDRRが得られたのに対して、GM-CSF群の患者のDRRは2%(95%CI、0-4.5)であった。その後の解析で、T-VEC vs GM-CSF間のDRRにおける差はより早期の疾患および治療未経験の疾患で比較的大きくなる可能性があることが示唆されている。IIIB期およびIIIC期患者のDRRはT-VEC群で33% vs GM-CSF群で0%であった;IV期M1a疾患の患者ではそれぞれ、16% vs 2%;IV期M1b疾患の患者ではそれぞれ、3% vs 4%;IV期M1c疾患の患者ではそれぞれ、8% vs 3%であった。第一選択治療としてT-VECまたはGM-CSFで治療された患者のDRRは24% vs 0%であった;しかしながら、第二選択以降の治療として治療を受けた患者のDRRは10% vs 4%であった。
- T-VEC曝露の持続期間中央値は23週間(5.3ヵ月)で、26人の患者が1年以上曝露した。T-VEC群における最も一般的な有害事象(AE)は、疲労(50%)、悪寒(49%)、発熱(43%)、吐き気(36%)、インフルエンザ様疾患(30%)、および注入部位の痛みであった。T-VECに対する毒性作用のために治療を中止した割合が4%であったのに対し、GM-CSF群では2%であった。T-VECで治療された患者における10例の死亡のうち、8例の死亡はPD-1、サルモネラ感染症の結果であると考えられ、1例は心筋梗塞と考えられた;研究者の所見によると、いずれの死亡も治療には無関係であると考えられた。
使用上の注意:T-VECは生の弱毒HSVであり、致死的な播種性ヘルペス感染を引き起こすことがある。免疫低下患者または妊娠中の患者では、本薬物は禁忌である。医療提供者および親しい知人は本薬物を注入した病変に直接触れないようにすべきである。製剤、投与、および取り扱いのためのバイオハザード予防措置はラベルに記載されている。
治療サイクルおよび病変の大きさごとの詳細な処方情報はFDAラベルで提供されている。
免疫療法
チェックポイント阻害剤
抗PD-1およびPD-L1
PD-1経路は、T細胞疲弊を媒介する主要な免疫抑制性因子である。この経路の遮断は、T細胞の活性化、増殖、エフェクター機能の亢進につながる場合がある。PD-1にはPD-L1およびPD-L2という2つのリガンドがある。2つの抗PD-1抗体、ペムブロリズマブおよびニボルマブは、ランダム化試験におけるOSの改善に基づいてFDAにより承認された。
ペムブロリズマブ
証拠(ペムブロリズマブ):
-
前治療歴のある患者。イピリムマブの最終投与後、およびBRAF V600変異陽性の場合は以前のBRAF阻害薬による治療後の24週以内に増悪した切除不能または転移性黒色腫の患者、計173人が、3週間ごとにペムブロリズマブの2mg/kgまたは10mg/kgの投与を受ける群のいずれかにランダムに割り付けられた。自己免疫疾患の患者、免疫抑制が必要な病態の患者、またはイピリムマブによる治療に起因する重度の免疫関連の有害事象(irAE)の病歴を有する患者は、試験から除外された。
- 年齢中央値は61歳;60%が男性;67%はECOG PSが0、33%はECOG PSが1であった。患者の18%はBRAF V600変異陽性の腫瘍を有し、39%は乳酸デヒドロゲナーゼ(LDH)値が高く、64%はM1c疾患であり、9%に脳転移を認め、72%は進行黒色腫に対する2つ以上の療法を受けていた。主要アウトカム評価項目はRECIST(Response Evaluation Criteria In Solid Tumors、バージョン1.1)基準に基づいて、盲検下での独立中央判定により評価された全奏効率(ORR)であった。[ ][証拠レベル:1iiDiv]
- 独立中央判定によるORRは、2mg/kg投与群で26%(95%CI、-14-13;P = 0.96)であり、患者81人中にCR1例とPR20例を認めた。追跡期間中央値は8ヵ月であり、全患者に対して最短でも6ヵ月の追跡が実施された。客観的奏効を認めた患者21人中、18人に1.4ヵ月以上~8.5ヵ月以上の持続的奏効がみられた。
- 10mg/kg投与群の奏効率は同様に26%であり、奏効した患者は76人中20人であった。奏効は、BRAF V600変異を有する患者とそうでない患者の両方で得られた。
- 承認された用量は、3週間ごとに30分の静注(IV)による2mg/kgの投与であった。
2mg/kgの投与を受けた患者の7%でAEのためにペムブロリズマブが中止され、研究者らは3%を薬物関連のAEと判定した。最も一般的なAEと、2mg/kg投与群および10mg/kg投与群でのその発生率を以下に示す:
- 疲労(33% vs 37%)。
- そう痒(23% vs 19%)。
- 発疹(18% vs 18%)。
他の一般的なAEには、咳嗽、吐き気、食欲低下、便秘、関節痛、下痢などがあった。重篤なAEで最も頻繁に生じたものには腎不全、呼吸困難、肺炎、蜂窩織炎などがあり、これらはペムブロリズマブによる治療を受けた計411人の患者の2%以上にみられた。その他の臨床的に著しいirAEには、肺臓炎、大腸炎、下垂体炎、甲状腺機能亢進症、甲状腺機能低下症、腎炎、肝炎などがあった。
FDAラベルには、irAEが疑われる症例に対する推奨事項として、薬物投与の中断およびコルチコステロイド薬の投与などが記載されている。
-
前治療歴のない患者および前治療歴のある患者。1件の多施設国際試験(KEYNOTE 006[NCT01866319])では、転移性黒色腫の患者834人が1:1:1の比率でペムブロリズマブ(2週間または3週間ごとに10mg/kgを静注)または4サイクルのイピリムマブ(3週間ごとに3mg/kg)を受ける群にランダムに割り付けられた。[
3
]患者は、ECOG PS(0 vs 1)、治療の選択(第一選択治療 vs 第二選択治療)、およびPD-L1発現(陽性 vs 陰性)で層別化された。主要エンドポイントはPFSとOSであった。[
3
][証拠レベル:1iiA]
約66%の患者は、進行黒色腫に対して以前に全身療法を受けていなかった。患者の36%にBRAF V600変異が存在し、そのうち約50%が以前にBRAF阻害剤による治療を受けていた。研究には、BRAF V600変異を有し、LDH高値で疾患の症状が認められるか、疾患が急速に進行している患者で、迅速な臨床的便益が得られうる抗BRAF療法を受けていなかった者は登録されなかった。患者の約80%では組織標本のPD-L1が陽性であった。
- 追跡期間中央値23ヵ月で、プロトコルにより規定されたOSの最終解析が実施された。OS中央値は、いずれのペムブロリズマブ群でも未到達であった;しかしながら、OSはイピリムマブ群が16.0ヵ月であった(2週間ごとのペムブロリズマブ vs イピリムマブでHR、0.68;95%CI、0.53-0.87;P= 0.0009および3週間ごとのペムブロリズマブ vs イピリムマブで0.68;95%CI、0.53-0.86;P = 0.0008)。24ヵ月での生存率は、2週間ごとおよび3週間ごとにペムブロリズマブを投与した群が55%であったのに対して、イピリムマブ群では43%であった。[ ]
- PD-L1陰性腫瘍を有する患者を除くすべてのサブグループで便益が示された。しかしながら、このサブセットは小規模(患者の18%)でCIが広範囲に及んだため、この研究から最終的な結論を下すことはできなかった。
ニボルマブ
証拠(ニボルマブ):
-
前治療歴のある患者。迅速承認は、多施設オープンラベル試験(CheckMate 037[NCT01721746])においてニボルマブを投与され、6ヵ月以上追跡された最初の120人の患者の計画された非比較の中間解析に基づいており、この試験では患者が2:1の比率でニボルマブ(2週間ごとに3mg/kg)または研究者が選択した化学療法(ダカルバジン[DTIC] 1,000mg/m2、3週間ごとに静注またはカルボプラチン[曲線下面積6] + パクリタキセル175mg/m2、3週間ごとの併用)を受けるようにランダムに割り付けられた。[FDAラベル][証拠レベル:3iiiDiv]患者は、イピリムマブによる治療とBRAF阻害剤による治療(BRAF V600変異陽性例の場合)後に増悪した切除不能または転移性の黒色腫を有することとされた。自己免疫疾患の患者、免疫抑制が必要な病態の患者、またはイピリムマブによる治療に起因する重篤なirAEの病歴を有する患者は、試験から除外された。
- 患者の年齢中央値は58歳であった;65%の患者が男性であった;58%の患者でECOG PSが0であった。BRAF V600変異は22%の患者で認められた;76%がM1c疾患であった;56%にLDH高値が認められた;18%が脳転移の既往を有した;および68%が転移性疾患に対して以前に2回以上全身療法を受けていた。
- ORRとOSが、複合主要エンドポイントであった。RECIST 1.1基準および独立中央判定により評価したところ、CR4例およびPR34例でORRは32%(95%CI、23-41)であった。奏効が得られた患者38人中、33人(87%)に2.6ヵ月以上~10.0ヵ月以上の持続的奏効がみられた。
- 奏効は、BRAF V600変異を有する患者とそうでない患者の両方で得られた。
- 安全性の解析は268人の患者に基づいている。ニボルマブは9%の患者でAEが認められたため中止された。41%の患者で重篤なAEが発生し、42%の患者でグレード3およびグレード4のAEが発生した。最も一般的なAEとして、発疹、咳嗽、上気道感染、および末梢浮腫がみられた。他の重要なAEとして、心室性不整脈、虹彩毛様体炎、アミラーゼおよびリパーゼ高値、めまい、および神経障害がみられた。
FDAラベルには、irAEが疑われる場合の推奨事項として、薬物投与の中断およびコルチコステロイド薬の投与などが記載されている。
-
前治療歴のない患者。1件の二重盲検多施設共同試験(CheckMate 066 [NCT01721772])において、BRAF変異を認めない切除不能なIII期またはIV期黒色腫の患者計418人が、ニボルマブ(3mg/kgを2週間ごと)およびDTICに対応するプラセボ(3週間ごと)またはDTIC(1,000mg/m2、3週間ごとおよびニボルマブに対応するプラセボを2週間ごと)のいずれかを投与する群に(1:1の比率で)ランダムに割り付けられた。主要エンドポイントはOSであった。[
5
][証拠レベル:1iA]本試験は、BRAF変異を認めない患者における標準の第一選択治療がDTICとなっている国であるヨーロッパ、イスラエル、オーストラリア、カナダ、および南米の80施設で実施された。
- DMSBによる安全性のレビュー中にOSにおける潜在的な差が示された。2014年6月10日に、予定外の中間データベースロックからの簡略化した報告を見直したところ、ニボルマブを支持するOSの有意差が示された。DMSBは研究を非盲検化し、DTIC群の患者がニボルマブを受けることを許可すべきであると勧告した。予定のサンプルサイズは患者約410人であった;計418人の患者が登録された。
- クロスオーバー修正前の研究の二重盲検分の結果によると、ニボルマブ群ではOS期間中央値に達しておらず、DTIC群で10.8ヵ月(95%CI、9.3-12.1)であったことが示された。1年OS率は、ニボルマブ群で72.9%(95%CI、65.5-78.9)およびDTIC群で42.1%(95%CI、33.0-50.9)であった。HR死亡は0.42;99.79%CI、0.25-0.73;P < 0.001であった。
- ニボルマブ群での最も一般的なAEは、疲労(19.9%)、そう痒(17%)、吐き気(16.5%)、および下痢(16%)であった。ニボルマブ群では6.8%の患者がAEのために研究の治療を中止したのに対し、DTIC群では11.7%の患者が研究の治療を中止した。免疫学的な病因により発生した可能性のあるAEの部位には、消化管、肝臓、肺、腎臓、内分泌、および皮膚が挙げられる;しかしながら、研究の治療を延期、グルココルチコイドの投与、またはニボルマブの管理ガイドラインに応じて両方を実施することで大多数のAEが解消した。どちらの治療群でも薬物に関連したAEによる死亡は発生しなかった。
-
転移性黒色腫におけるニボルマブ投与レジメンの変更。
- 集団の薬物動態反応解析および用量/曝露反応解析では、フラット用量のニボルマブ240mg、2週間ごとの投与は、3mg/kgの投与レジメンと薬物動態学的に同等であると考えられた。2つの用量の臨床的安全性および効力は体重および黒色腫、非小細胞肺がんおよび腎細胞がんの腫瘍の種類において類似しているようであった。[ ]
- 単剤療法としてFDAに承認された投与レジメンは、疾患の増悪または耐え難い毒性作用がみられるまで3mg/kgから240mg、IV、2週間ごとに変更されている。イピリムマブと併用する場合は、ニボルマブ1mg/kg、IVの投与レジメンはイピリムマブの治療が完了するまで変更されず、イピリムマブの投与が完了したら、ニボルマブレジメンは疾患の増悪または耐え難い毒性作用がみられるまで240mg、2週間ごとに変更される。
抗細胞傷害性Tリンパ球抗原-4(CTLA-4)
イピリムマブ
イピリムマブはCTLA-4に結合するヒトモノクローナル抗体であり、その結合によって、T細胞の活性化、増殖、エフェクター機能をダウンレギュレートするCTLA-4の機能を阻害する。
イピリムマブは複数のランダム化試験でOSの延長により臨床的有益性が実証されており、2011年にFDAの承認を受けた。前治療歴のない患者と前治療歴のある患者を対象にした2件のプロスペクティブ・ランダム化国際試験で、イピリムマブの使用が支持された。[ 7 ][ 8 ]
証拠(イピリムマブ):
-
前治療歴のある患者:以前に治療を受けた切除不能なIII期またはIV期黒色腫を有し、HLA-A*0201陽性であった患者、計676人が、3群の多国籍ランダム化(3:1:1)二重盲検二重プラセボ試験に登録された。計403人の患者が、イピリムマブ(3mg/kg、3週間ごとに4回投与)と糖蛋白100(gp100)ペプチド・ワクチンを併用する群にランダムに割り付けられた。患者137人がイピリムマブ(3mg/kg、3週間ごとに4回)の投与を受け、患者136人がgp100ワクチンの投与を受けた。患者はベースライン時の転移の有無、およびIL-2療法を以前に受けたかどうかで層別化された。患者のうち82人がベースライン時に脳への転移を来していた。[
8
][証拠レベル:1iA]
- OS期間中央値は、イピリムマブ単独投与を受けた患者で10ヵ月、イピリムマブとgp100ワクチンとの併用を受けた患者で10.1ヵ月であったのに対し、gp100ワクチン単独投与を受けた患者では6.4ヵ月であった(イピリムマブの単独投与 vs gp100単独投与のHR、0.66;P < 0.003;イピリムマブ + ワクチンの併用 vs gp100単独投与のHR、0.68;P < 0.001)。
- 1年経過時の解析では、イピリムマブで治療された患者の44%およびイピリムマブとワクチンの併用を受けた患者の45%が生存していたのに対し、ワクチン単独を受けた患者の生存率は25%であった。
- イピリムマブで治療された患者の10~15%にグレード3ないしグレード4のirAEが発生した。最も頻度が高かったirAEには、下痢または大腸炎、および内分泌関連のイベント(例えば、下垂体の炎症)などがある。これらのイベントには、治療の休止およびコルチコステロイドなどの抗炎症薬が必要とされ、4例ではインフリキシマブ(抗腫瘍壊死因子α抗体)の開始が必要であった。
- 薬物関連死亡は14例(2.1%)で、7例はirAEに関連していた。
-
前治療歴のない患者:1件の多施設国際試験では、転移性黒色腫に対して前治療歴のない患者502人(補助療法は認められた)が、1:1の比率でイピリムマブ(10mg/kg) + DTIC(850mg/m2)か、またはプラセボ + DTIC(850mg/m2)を1、4、7、10週目に投与後、22週目まで3週間ごとにDTICを単独投与する群にランダムに割り付けられた。疾患が安定しているか、客観的奏効が得られ、用量制限毒性が認められなかった患者はその後、維持療法として12週間ごとのイピリムマブまたはプラセボを投与された。主要エンドポイントは生存率であった。患者はECOG PSおよび転移病期に従って層別化された。患者の約70%はECOG PSが0で、残りの患者はECOG PSが1であった。約55%の患者はM1c期の疾患であった。[
7
][証拠レベル:1iA]
- OS期間中央値は、イピリムマブ-DTIC群で11.2ヵ月(95%CI、9.4-13.6)、プラセボ-DTIC群で9.1ヵ月(95%CI、7.8-10.5)であった。イピリムマブ-DTIC群の推定生存率は、1年経過時で47.3%、2年経過時で28.5%、および3年経過時で20.8%であった(HR死亡、0.72;P < 0.001);プラセボ-DTIC群では、1年経過時で36.3%、2年経過時で17.9%、3年経過時で12.2%であった。
- 最も一般的な研究薬関連のAEは、免疫関連として分類されたAEであった。グレード3または4のirAEは、イピリムマブ + DTICで治療された患者の38.1%にみられたのに対し、プラセボ + DTICで治療された患者では4.4%でみられ、肝炎と腸炎が最も一般的であった。
- 薬物関連死亡は発生しなかった。
医師と患者は、免疫関連の有害反応は重度または致死的な場合があることに留意すべきである。早期の同定と治療(場合によっては、製造者により提供された免疫関連の有害反応管理ガイドに従った全身グルココルチコイドまたは他の免疫抑制薬の投与)が必要である。[ 9 ]
高用量IL-2
IL-2は、8件の第I相および第II相研究において示された持続的CRのために1998年にFDAにより承認された。高用量IL-2と他の治療法を比較し、OSに対する相対的影響を評価する第III相試験は、これまでに実施されていない。
証拠(高用量IL-2):
- 以下は、1985年から1993年に22の施設で実施された8件の単施設試験および多施設試験から得られた患者270人のプール解析に基づく:
この治療法を改良する方法についての研究が盛んに行われている。
二重免疫調節(Dual immunomodulation)
T細胞は、T細胞機能を阻害する複数の受容体を同時発現する。前臨床研究のデータと早期の臨床データは、CTLA-4およびPD-1という2種類の抑制性受容体をともに遮断することが、いずれか一方の遮断よりも有効である可能性を示唆している。[ 12 ]これを受けて、それぞれの単剤と併用を比較する第III相試験(NCT01844505)が実施されることになった。
二重のチェックポイント阻害(dual checkpoint inhibition)
CTLA-4阻害剤 + PD-1阻害剤
証拠(イピリムマブ + ニボルマブ):
-
前治療歴のない患者。1件の国際ランダム化二重盲検試験(CheckMate 067)において、切除不能III期またはIV期黒色腫の前治療歴のない患者945人が1:1:1の比率で以下の治療群にランダムに割り付けられた:
- 治療群1:ニボルマブ単独、3mg/kg、2週間ごと + プラセボ;
- 治療群2:ニボルマブ(1mg/kg、3週間ごと) + イピリムマブ(3mg/kg、3週間ごとを4回投与)に続いて、3mgのニボルマブ、2週間ごと;または
- 治療群3:イピリムマブ単独(3mg/kg、3週間ごとを4回投与 + プラセボ)。
PFSとOSが、複合主要エンドポイントであった。この研究は、ニボルマブ + イピリムマブの併用とイピリムマブ単剤療法、およびニボルマブ単剤療法とイピリムマブ単剤療法を比較する検出力を有していた;この研究はイピリムマブ + ニボルマブの併用とニボルマブを比較する検出力は有していなかった。
患者は、免疫組織化学検査により中央検査施設で評価された腫瘍のPD-L1状態(陽性 vs 陰性または不明確)、BRAF変異状態(V600変異-陽性 vs 野生型)、および米国がん合同委員会の病期に従って層別化された。[ ][証拠レベル:1iiA]
- ベースライン時の特徴として、患者の74%でECOG PSが0であった;36%にLDH高値が認められた;31.5%にBRAF変異が認められた;および58%がM1c期の疾患であった。少数の患者(23.6%)で腫瘍のPD-L1が陽性であった。
- PFSのプロスペクティブに定義された複合主要解析は、全患者に対する最短でも9ヵ月の追跡後に実施された。 ニボルマブ単独またはイピリムマブと併用する治療により、イピリムマブ単独よりも有意に長いPFSが得られた。結果は事前に規定された層別化因子全体で一貫していた。PFS期間中央値は、ニボルマブ群で6.9ヵ月(95%CI、4.3-9.5)、ニボルマブ + イピリムマブ群で11.5ヵ月(95%CI、8.9-16.7)、およびイピリムマブ群で2.9ヵ月(95%CI、2.8-3.4)であった。
- OSのプロスペクティブに規定された複合主要解析は、28ヵ月経過時に実施された。467例が死亡し、この時点のOS率はニボルマブ群で59%、併用群で64%、イピリムマブ群で45%であった(イピリムマブ群と比較した併用群に対するHR死亡、0.55[98%CI、0.42-0.72;P < 0.001];イピリムマブ群と比較したニボルマブ群に対するHR死亡、0.63[98%CI、0.48-0.81;P < 0.001])。[ ]
- 最小追跡期間36ヵ月間の記述的解析により、以下のデータが明らかにされた:
- OS率はニボルマブ群で52%、併用治療群患者で58%、およびイピリムマブ群で34%であった。
- OS期間中央値は併用群では到達していなかった(95%CI、38.2ヵ月-到達せず)。単剤のニボルマブ群とイピリムマブ群におけるOS期間中央値は、それぞれ37.6ヵ月(95%CI、29.1-到達せず)および19.9ヵ月(95%CI、16.9-24.6)であった。
- イピリムマブと比較した併用のHR死亡は0.55(99.5%CI、0.45-0.69;P < 0.001)であった;イピリムマブと比較したニボルマブのHRは0.65(99.5%CI、0.53-0.80;P < 0.001)であった。
- AEは併用群で最も高く、注意深いモニタリングを行う必要がある。グレード3~4の治療関連のAEがニボルマブ群の患者の16.3%、イピリムマブ群の患者の27.3%、および併用群患者の55%で発生した。治療中止の最も頻度の高い理由は、2つの単剤治療群で疾患進行であった-ニボルマブ群で49%およびイピリムマブ群で65%。併用群における治療中止の最も頻度の高い理由は、毒性作用であった(38%)。
- 4人の治療関連死が報告され、死因は好中球減少(ニボルマブ群)、結腸穿孔(イピリムマブ群)、肝臓壊死、および自己免疫心筋炎(イピリムマブおよびニボルマブ併用群)であった。
- PD-L1発現レベルと3年OS率との関連についての解析で、発現レベル単独ではOSの予測バイオマーカーとしては正確ではないことが示された。
-
脳に転移した黒色腫。1件のオープンラベル多施設第II相試験(CheckMate 204[NCT02320058])において、放射線照射を受けていない測定可能な脳転移が1つ以上認められる患者が、全身二重免疫療法による治療に適格とされた。[
15
][証拠レベル:3iiiDiv]適格性には、即時介入を必要としていないこと、神経学的徴候または症状が認められないこと、研究治療の14日以内にグルココルチコイドを使用していないことが要求された。患者は以前に定位放射線手術または最大3つの脳転移の切除を受けている可能性があった。PD-L1発現陽性は必要とされなかった。
治療は、ニボルマブ(1mg/kg) + イピリムマブ(3mg/kg)を3週間ごと、最大4回投与に続いて、疾患進行または許容できない毒性作用が発生するまでニボルマブ(3mg/kgの)、2週間ごとで構成された。
主要エンドポイントはRECIST基準に基づいて研究者により評価された頭蓋内臨床的有益性の割合で、完全奏効、部分奏効、または6ヵ月以上持続する疾患の安定が得られた患者のパーセントと定義された。米国内の計28の地域で101人の患者が登録し、このうち94人が少なくとも6ヵ月間追跡された;この集団のデータを以下に報告する。
- (脳における)臨床的有益性は57%の患者(95%CI、47-68)で示された;24人の患者(26%)でCRが得られ、28人の患者(30%)でPRが得られ、2人の患者(2%)で6ヵ月以上持続する疾患の安定が得られた。頭蓋外病変を有する患者において類似した客観的奏効率(50%)が示されたが、CRが得られた患者は少なかった(7%)。
- サブグループ解析では、PD-L1陽性とPD-L1陰性の両方の患者で反応が示された(94人中20人の患者ではベースライン状態が不明であった)。
- 94人の患者に対する追跡期間中央値は14ヵ月であった。頭蓋内反応までの期間中央値は2.3ヵ月(範囲、1.1~10.8ヵ月)で、頭蓋外反応までの期間は2.1ヵ月(範囲、1.1~15.0ヵ月)であった。
- 神経系におけるすべてのグレードの最も一般的な治療関連のAEは頭痛(21人の患者[22%])で、3人の患者(3%)ではグレード3または4の頭痛がみられた。グレード3または4の他の治療関連の神経系AEは、脳浮腫(2人の患者[2%])、頭蓋内出血(1人の患者[1%])、末梢性運動ニューロパチー(1人の患者[1%])、失神(1人の患者[1%])であった。これらのAEはそれぞれ、治療中止に至り、末梢性運動ニューロパチーが報告された1人の症例は不可逆性であった。1例の死亡が研究者により、研究の治療に関係するものと評価された(グレード5の免疫関連心筋炎)。
- 33人の患者(35%)で疾患進行が示された;17人の患者(18%)では頭蓋内の進行のみがみられ、4人の患者(4%)では頭蓋外の進行のみがみられ、12人の患者(13%)では頭蓋内と頭蓋外の部位の両方で進行がみられた。
シグナル伝達阻害剤
これまでのところ、諸研究はBRAFおよびMEK(マイトジェン活性化ERK[細胞外シグナル調節キナーゼ]活性化キナーゼ)阻害剤は両方とも、単剤としても併用の場合でも、黒色腫の自然経過に有意な影響を及ぼしうることを示しているが、これらの薬剤は治癒はもたらさないようである。
BRAF阻害剤
BRAF阻害剤はBRAFが野生型で上流のRASに変異がみられる腫瘍細胞においてマイトジェン活性化プロテインキナーゼ(MAPK)経路をダウンレギュレートせずに亢進させうることが前臨床モデルのデータによって実証されているため、BRAF阻害剤による治療はBRAFが野生型の黒色腫には推奨されない。[ 16 ][ 17 ][ 18 ][ 19 ]
ベムラフェニブ
ベムラフェニブは経口投与可能な低分子の選択的BRAFキナーゼ阻害剤であり、BRAF V600E突然変異の検査が陽性の切除不能または転移性黒色腫患者に対して、2011年にFDAにより承認された。
証拠(ベムラフェニブ):
- 前治療歴のない患者:ベムラフェニブの承認の裏付けになった国際多施設試験(BRIM-3[NCT01006980])では、前治療歴のないIIIC期またはIV期の黒色腫患者2,107人を対象にBRAF V600変異のスクリーニングが実施され、Cobas 4800 BRAF V600 Mutation Testで675人の患者が同定された。[
20
]患者は、ベムラフェニブ(960mg、1日2回経口投与)またはDTIC(1,000mg/m2 IV、3週間ごと)にランダムに割り付けられた。複合主要エンドポイントは、OSとPFSであった。予定されていた中間解析時に、DMSBにより、OSおよびPFSの両エンドポイントはベムラフェニブの支持について事前に規定された統計的有意性の基準を満たしたことが確認され、DTIC群の患者はベムラフェニブ投与へのクロスオーバーが許可されるべきであると推奨された。[
20
][証拠レベル:1iiAおよび1iiDiii]
- 計675人の患者がOSについて評価された;ベムラフェニブ群では生存期間中央値に達しておらず、データは生存曲線の信頼性が高いKaplan-Meier推定値を得るには時期尚早であったものの、ベムラフェニブ群のOSはDTIC群のOSよりも明らかに優れていた。
- ベムラフェニブ群におけるHR死亡は0.37(95%CI、0.26-0.55;P < 0.001)であった。ベムラフェニブ群における生存利益は、事前に規定された各サブグループ(例えば、年齢、性別、ECOG PS、腫瘍病期、LDH、地域)で観察された。
- ベムラフェニブ群における腫瘍増悪のHRは0.26(95%CI、0.20-0.33;P < 0.001)であった。推定されたPFS期間中央値は、ベムラフェニブ群で5.3ヵ月であったのに対し、DTIC群では1.6ヵ月であった。
- 20人の患者はBRAF V600E以外の変異を有していた:19人がBRAF V600K、1人がBRAF V600Dであった。BRAF V600K変異を有する4人の患者で、ベムラフェニブが奏効した。
- ベムラフェニブの投与を受けた患者の38%およびDTICの投与を受けた患者の16%では、AEによって投与量の変更または中断が必要となった。ベムラフェニブ群での最も一般的なAEは、皮膚関連のイベント、関節痛、および疲労であった。皮膚扁平上皮がん(SCC)および/または角化棘細胞腫は18%の患者に発生し、単純切除で治療された。DTIC群での最も一般的なAEは、疲労、吐き気、嘔吐、および好中球減少であった。(がんへの対処に関する詳しい情報については、PDQの支持療法および緩和ケアの要約を参照のこと。)
-
前治療歴のある患者:BRAF V600EまたはBRAF V600K変異を有する計132人の患者がベムラフェニブに関する1件の第II相多施設試験に登録され、960mgを1日2回経口投与された。登録された患者の61%がM1c期疾患で、49%ではLDHの濃度が高かった。すべての患者が、以前に進行黒色腫に対する治療を1回以上受けていた。追跡期間中央値は12.9ヵ月であった。[
21
][証拠レベル:3iiiDiv]
- 独立判定委員会(IRC)の報告によると、奏効率は53%(95%CI、44-62)で、8人(6%)の患者がCRを達成した。
- IRCの評価による奏効期間中央値は6.7ヵ月(95%CI、5.6-8.6)であった。6週間後の最初の放射線学的評価時にはほとんどの反応が明白になった;しかしながら、一部の患者では治療を6ヵ月以上継続した後でなければ反応が得られなかった。
ダブラフェニブ
ダブラフェニブは、経口投与可能な低分子の選択的BRAF阻害剤であり、FDA承認の検査によりBRAF V600E変異陽性が検出された切除不能または転移性黒色腫患者を対象として2013年にFDAにより承認された。ダブラフェニブおよび他のBRAF阻害剤は、複数のin vitro実験で、MAPKシグナル伝達を逆説的に刺激し腫瘍促進をもたらす可能性が示唆されているため、BRAFが野生型の黒色腫の治療には推奨されない。
証拠(ダブラフェニブ):
- 1件の多施設国際試験(BREAK-3 [NCT01227889])で、ダブラフェニブとDTICの比較が行われた。切除不能なIII期またはIV期黒色腫でBRAF V600E変異を有する計250人の患者が、3:1の比率(ダブラフェニブ、150mg、1日1回経口投与またはDTIC 1,000mg/m2、3週間ごとに静注)でランダムに割り付けられた。IL-2は進行黒色腫に対する前治療として許可された。主要エンドポイントはPFSであった;患者は病勢進行時には盲検化されたIRCによる確認後にクロスオーバーが可能であった。[
22
][証拠レベル:1iiDiii]
- 126件のイベントが発生し、PFSに対するHRは0.30(95%CI、0.18-0.51;P < 0.0001)であった。推定されたPFS期間中央値はダブラフェニブ群で5.1ヵ月であったのに対し、DTIC群では2.7ヵ月であった。OSのデータは追跡期間中央値とクロスオーバーが可能であったことで制限がある。ダブラフェニブを投与された患者におけるPR率は47%およびCR率は3%であったのに対し、DTICを投与された患者のPR率は5%およびCR率は2%であった。
- ダブラフェニブで治療された患者における最も頻度の高いAEは、皮膚関連の所見(すなわち、角質増殖、乳頭腫、手掌・足底発赤知覚不全)、発熱、疲労、頭痛、および関節痛であった。皮膚SCCまたは角化性棘細胞腫は12人の患者に、基底細胞がんは4人の患者に、菌状息肉腫は1人の患者に、新規の黒色腫は2人の患者に発生した。
MEK阻害剤
トラメチニブ
trametinibはMEK1およびMEK2に対する経口投与可能な低分子の選択的阻害剤である。BRAFはMEK1およびMEK2蛋白を活性化し、続いてそれらの蛋白がMAPKを活性化する。前臨床研究のデータから、MEK阻害剤は一部のBRAF変異ヒト黒色腫の増殖を抑制し、細胞死を誘発できることが示唆されている。
トラメチニブは、BRAF V600EまたはV600K変異がFDA承認の検査で検出された切除不能または転移性黒色腫患者に対する使用について、2013年にFDAによる承認を受けた。
証拠(トラメチニブ):
- 計1,022人の患者がBRAF変異についてスクリーニングを受け、322人の患者が適格と判定された(BRAF V600Eは281人、BRAF V600Kは40人、および両方の変異を有するのは1人であった)。[
23
]1回の前治療(生物学的療法または化学療法)は許容された;しかしながら、BRAFまたはMEK阻害剤による前治療は許容されなかった。患者は、2:1の比率でトラメチニブ(2mg、1日1回)または静注化学療法(DTIC 1,000mg/m2、3週間ごと、またはパクリタキセル175mg/m2、3週間ごと)にランダムに割り付けられた。化学療法群にランダムに割り付けられた患者にはクロスオーバーが許可された;したがって、主要エンドポイントはPFSとされた。
- 研究者による評価では、トラメチニブ投与患者におけるPFSは4.8ヵ月であったのに対し、化学療法群では1.5ヵ月(PFSまたは死亡に対するHR、0.45;95%CI、0.33-0.63;P < 0.001)であった。治療群に関して盲検化された放射線学的レビューでも同様の結果が得られた。OS期間中央値は未達である。
- トラメチニブ群の患者の35%および化学療法群の患者の22%では、AEによって投与が中断された。トラメチニブ群の患者の27%および化学療法群の患者の10%では、AEによって投与量が減量された。
- 最も一般的なAEとして、発疹、下痢、吐き気、嘔吐、疲労、末梢浮腫、脱毛、高血圧、および便秘がみられた。心筋症(7%)、間質性肺疾患(2.4%)、中心性漿液性網膜症(1%未満)、および網膜静脈閉塞症(1%未満)は、まれではあるがトラメチニブに関連する重大なAEである。研究中に皮膚SCCは観察されなかった。(がんへの対処に関する詳しい情報については、PDQの支持療法および緩和ケアの要約を参照のこと。)
コビメチニブ
コビメチニブは、BRAF阻害剤、ベムラフェニブとの併用において2015年にFDAにより承認された低分子の選択的MEK阻害剤である。(詳しい情報については、本要約のシグナル伝達阻害剤を用いる併用療法のセクションを参照のこと。)
KIT阻害薬。
初期のデータから、c-KITに活性化突然変異または増幅がみられる粘膜または末端の黒色腫は、さまざまなc-KIT阻害剤に感受性があることが示唆されている。[ 24 ][ 25 ][ 26 ]切除不能III期またはIV期黒色腫で、c-KIT変異を有する患者に対して、第II相および第III相試験が利用可能である。
マルチキナーゼ阻害剤
シグナル伝達阻害剤を用いる併用療法
BRAF-MEK阻害剤の3つの異なる併用とBRAF阻害剤の単剤療法を比較した第III相試験の結果から、BRAF阻害剤の単剤療法よりも優れた効力が一貫して示されている。
BRAF V600変異を有する患者におけるBRAF阻害剤単剤療法への二次耐性は、MAPK経路の再活性化に関連している可能性がある。そのため、同じ経路の異なる部分または複数の経路内の一部を阻害するシグナル伝達阻害剤の併用について、研究が盛んに行われている。
BRAF阻害剤 + MEK阻害剤。
ダブラフェニブ + トラメチニブ
証拠(ダブラフェニブ + トラメチニブ):
-
前治療歴のない患者。クロスオーバーを行わない1件の国際二重盲検第III相試験(COMBI-d [NCT01584648])では、前治療歴のないBRAF V600EまたはV600K変異を有する切除不能なIIIC期またはIV期黒色腫の患者423人が、ダブラフェニブ(150mgを1日2回経口投与) + トラメチニブ(2mgを1日1回経口投与)の併用またはダブラフェニブ + プラセボのいずれかを投与する群にランダムに割り付けられた。主要エンドポイントは研究者が評価したPFSであった。プロトコルには、主要エンドポイント解析時において事前に規定されたOSについての中間解析が含まれていた。患者は、ベースライン時のLDH値とBRAF表現型で層別化された。[
28
][証拠レベル:1iDiii]
- PFS期間中央値は併用群で9.3ヵ月であったのに対し、ダブラフェニブ + プラセボ群で8.8ヵ月であった。HR死亡または増悪に対するHRは0.75(95%CI、0.57-0.99;P = 0.03)であった。OSの最終解析時の更新データにより、PFS期間中央値は併用群で11.0ヵ月であったのに対し、ダブラフェニブ + プラセボ群で8.8ヵ月であったことが明らかにされた。PFSまたは死亡に対するHRは0.67(95%CI、0.53-0.84;P = 0.0004;複数の検査について未調整)であった。[ ]
- 事前に規定されたOSの最終解析が70%のイベント時に実施された。OS期間中央値は、ダブラフェニブ + トラメチニブ群で25.1ヵ月(66%のイベント) vs ダブラフェニブ + プラセボ群で18.7ヵ月(76%のイベント)であった。HRは0.71(95%CI、0.55-0.92;P = 0.01)であった。
- 併用群の患者の9%およびダブラフェニブ単独で治療された患者の5%で、研究薬の永久的な中止が報告された。
- グレード3~グレード4のAEの発生率は両群でほぼ同じであった:併用群での発生率は35%で、ダブラフェニブ単独群での発生率は37%であった。併用群で発熱がより頻繁に発生したが、いずれの群でも研究薬を一時的に直ちに中止することで治療された;グルココルチコイドの予防的投与により反復性の発熱を防止できる可能性がある。MAPK経路の矛盾した活性化に関係すると考えられる皮膚のSCCなど、過剰増殖性の皮膚イベントは、MEK阻害剤を追加することにより発生頻度が低下した。まれであるが重大なAEには、駆出率の低下および網脈絡膜症があった。
-
前治療歴のない患者。1件の国際オープンラベル第III相試験(COMBI-v [NCT01597908])では、前治療歴のないBRAF V600変異を有する転移性黒色腫の患者704人が、第一選択治療として標準用量のダブラフェニブ + トラメチニブの併用またはベムラフェニブのいずれかを投与する群にランダムに割り付けられた。主要エンドポイントはOSであった。[
30
][証拠レベル:1iiA]
- 最終的な288件のイベントのうち202件が発生した場合に、OSについての中間解析が計画された。DMSBではプロトコルに従って、実際のイベント(222件)について調整された効力の境界が用いられた(効力に対する両側のP < 0.0214および、無益性のP > 0.2210)。DMSBは、効力が示されたために試験を中止し、中間解析をOSの最終解析とみなすように推奨した。併用治療群へのクロスオーバーが可能なようにプロトコルの修正が発表された。
- 併用群では計100人の患者(28%)およびベムラフェニブ群では計122人の患者(35%)が死亡した(HR、0.69;95%CI、0.53-0.89;P = 0.005)。ベムラフェニブで治療された患者に対するOS期間中央値は17.2ヵ月であった;併用治療群ではOS期間中央値に達していなかった。
ベムラフェニブ + コビメチニブ
証拠(ベムラフェニブ + コビメチニブ):
-
前治療歴のない患者。1件の国際第III相試験では、切除不能なIIIC期またはIV期のBRAF V600変異陽性黒色腫で前治療歴のない患者495人が、ベムラフェニブ(960mg、1日1回経口投与)およびコビメチニブ(60mg、1日1回経口投与を21日間実施に続いて7日間休薬)の併用またはベムラフェニブ + プラセボのいずれかを受けるようにランダムに割り付けられた。主要エンドポイントは研究者が評価したPFSであった。PFS時のクロスオーバーは許可されなかった。患者は病期および地域で層別化された。OSについて2回の中間解析が事前に規定され、最初の中間解析は主要エンドポイントの解析時とされた。[
31
][証拠レベル:1iDiii]
- PFS期間中央値は、併用群で9.9ヵ月であったのに対し、ベムラフェニブ + プラセボで治療された患者では6.2ヵ月であった。HR死亡または増悪に対するHRは0.51(95%CI、0.39-0.68;P = 0.001)であった。
- OSに関する最初の中間解析は両群のイベント数が少なかったため不完全であった;そのため、両研究群で生存期間中央値に達していなかった。
- AEによる治療中止率の発生率は両群でほぼ同じであった:併用で治療された患者での治療中止率は13%で、ベムラフェニブ単独で治療された患者での治療中止率は12%であった。併用群におけるAEによる死亡は6例で、ベムラフェニブ単独群におけるAEによる死亡は3例であった。
- グレード3~グレード4のAEの発生率は両群でほぼ同じであった:併用で治療された患者での発生率は62%で、ベムラフェニブ単独で治療された患者での発生率は58%であった。まれであるが重大なAEには、網脈絡膜症、網膜剥離、駆出率の低下、およびQT延長があった。皮膚のSCCなどの過剰増殖性の皮膚イベントは、MAPK経路の矛盾した活性化に関係すると考えられ、MEK阻害薬を追加することにより発生頻度が低下した。
エンコラフェニブ + ビニメチニブ
エンコラフェニブは、FDA承認の検査によりBRAF V600EまたはV600K変異が検出された切除不能または転移性黒色腫の治療として低分子のMEK阻害剤であるビニメチニブとの併用で承認された低分子のBRAF阻害剤である。この併用により、ベムラフェニブと比較してPFSおよびOSの改善が実証されている;ただし、どちらも単剤療法としては承認されていない。
証拠(エンコラフェニブ + ビニメチニブ):
-
以前に未治療の黒色腫または第一選択の免疫療法中またはその後の疾患進行。1件の国際オープンラベル第III相試験(COLUMBUS[NCT01909453])では、BRAF V600変異陽性のIIIB期、IIIC期、IV期黒色腫を有する577人の患者が、1:1:1の比率で、エンコラフェニブ(450mg、1日1回) + ビニメチニブ(45mg、1日2回)またはエンコラフェニブ単剤療法(300mg、1日1回)またはベムラフェニブ単剤療法(960mg、1日2回)のいずれかを受けるようにランダムに割り付けられた。[
32
][
33
]主要エンドポイントは盲検化されたIRCで評価する併用 vs ベムラフェニブのPFSで、副次エンドポイントはOSであった。
- 少数の患者(約5%)が、以前にチェックポイント阻害剤療法を受けていた。
- 追跡期間中央値16.6ヵ月時に、PFS期間中央値は併用群で14.9ヵ月(95%CI、11.0-18.5)に対してベムラフェニブ群で7.3ヵ月(95%CI、5.6-8.2)であった。HR進行または死亡は0.54(95%CI、0.41-0.71;両側でP < 0.0001)であった。
- 追跡期間中央値36.8ヵ月時にOSの副次エンドポイントについて、OS期間中央値は併用群の患者で33.6ヵ月(95%CI、24.4-39.2)であったのに対してベムラフェニブで治療された患者では16.9ヵ月(95%CI、14.0-24.5)であった(HR、0.61;95%CI、0.47-0.79;P < 0.0001)。研究薬の中止後の治療は、併用群の患者の42%およびベムラフェニブ群の患者の62%が受けた。[ ][ ][証拠レベル:1iiA]
- グレード3~4のAE発生率は、併用群で58%およびベムラフェニブ群で63%であった。併用群の34%で重篤なAEが発生したのに対して、ベムラフェニブ群では37%に重篤なAEが発生した。併用群における最も一般的なAEとして、消化管症状およびガンマグルタミルトランスフェラーゼ(GGT)値の上昇、クレアチンホスホキナーゼ(CPK)値の上昇、左室機能不全(8%)および漿液性網膜症(20%)が挙げられ、ほとんどがグレード1~2であった(医薬品表示にモニタリングガイドラインが提供されている)。ベムラフェニブを投与された患者では、発熱および皮膚毒性がより多く発生した。AEによる研究薬の中止は、併用群で15%およびベムラフェニブ群で17%であった。治療に関連していると考えられる死亡はなかった;しかしながら、併用群において自殺による1例の死亡が発生した。
化学療法
DTICは、ORRに基づいて1970年に承認された。第III相試験でのORRは10~20%であり、CRが観察されることはまれである。OSへの影響はランダム化試験では実証されていない。[ 7 ][ 20 ][ 34 ][ 35 ][ 36 ]前治療歴のない転移性黒色腫患者を対象とした、イピリムマブおよびベムラフェニブに関する最近の登録試験で、対照群としてDTICが用いられたが、そのOSは他と比べて劣ることが示された。
DTICと同じ活性成分に加水分解する経口アルキル化剤のテモゾロミドは、主要エンドポイントをOSとした第III相ランダム化試験においてDTIC(静脈内投与)と同等であったようである;ただし、この試験は優越性の証明に設計されたものであり、同等性の証明にはサンプルサイズが不十分であった。[ 35 ]
DTICおよびニトロソウレア系抗がん剤のカルムスチンならびにロムスチンの客観的奏効率は、約10~20%である。[ 34 ][ 37 ][ 38 ][ 39 ]CRが得られた限られた数の患者では長期間の寛解がみられることもあるが、反応は通常3~6ヵ月と短期間である。[ 37 ][ 39 ]
1件のランダム化試験でDTIC静注とテモゾロミド経口投与が比較された;OS期間はDTICが6.4ヵ月であったのに対し、テモゾロミドが7.7ヵ月であった(HR、1.18;95%CI、0.92-1.52)。これらのデータからDTICとテモゾロミドとの類似性が示唆されたが、DTICおよびテモゾロミドのいずれについても生存利益は実証されていないため、FDAは類似性証示に基づくテモゾロミドの承認を行わなかった。[ 35 ][証拠レベル:1iiA]
European Organisation for Research and Treatment of Cancer(EORTC)による1件の多施設試験(EORTC)(EORTC-18032 [NCT00101218])において、投与スケジュールを延長し用量を増量したテモゾロミドがDTICと比較され、859人の患者がランダムに割り付けられた。テモゾロミド群ではOSまたはPFSにおける改善はみられず、この用量とスケジュールでは、標準用量の単剤のDTICよりも毒性作用が多くみられた。[ 40 ][証拠レベル:1iiA]
前治療歴のない転移性黒色腫患者を対象にした2件の第III相ランダム化試験(ベムラフェニブ[ 20 ]およびイピリムマブ[ 7 ]のFDA承認につながった試験)には、標準治療群としてDTICが含められた。ベムラフェニブ(BRAF V600変異黒色腫における)およびイピリムマブは、これら2件の別個の試験でDTICよりもOSが優れていることが示された。
このほか、単剤で中等度の活性を有する薬物には、ビンカアルカロイド系薬剤、白金化合物、およびタキサンがある。[ 37 ][ 38 ]
化学療法を組み込んだ併用レジメン(例えば、多剤化学療法[ 41 ][ 42 ]、化学療法とタモキシフェンの併用[ 43 ][ 44 ][ 45 ]、化学療法と免疫療法の併用[ 10 ][ 11 ][ 41 ][ 46 ][ 47 ][ 48 ][ 49 ]など)を開発する試みがなされているが、これらの併用によるOSの改善は実証されていない。
化学療法と生化学療法(すなわち、同じ化学療法 + インターフェロン単独またはIL-2との併用)とを比較した18件のランダム化試験(このうち15件では生存に関する情報が示されていた)の発表データに対するメタアナリシスでは、OSへの影響は報告されなかった。[ 50 ][証拠レベル:1iiA]
局所の緩和療法
遠隔転移およびリンパ節領域転移を認める黒色腫は、所属リンパ節郭清により緩和が得られることがある。肺、消化管、骨、ときに脳に認められる孤立性転移巣は、切除すれば緩和が得られることがあり、場合によっては長期生存を期待できる。[ 47 ][ 48 ][ 49 ]
黒色腫は比較的放射線抵抗性の腫瘍であるが、症状緩和目的の放射線療法により症状が軽減できる場合がある。複数のレトロスペクティブ研究で、以下の患者に、放射線療法による症状の緩和およびいくらかの腫瘍の退縮がみられることが示されている:[ 51 ][ 52 ]
- 複数の脳転移。
- 骨転移。
- 脊髄圧迫。
骨転移または脊髄転移をみた黒色腫の症状を緩和するために最も有効な照射量分割法は明らかにされていないが、腫瘍耐性を抑えるために一回に高照射量を投与する手技が用いられることがある。(詳しい情報については、がん性疼痛に関するPDQ要約を参照のこと。)
切除不能なIII期、IV期、再発黒色腫に対する臨床評価段階にある治療法の選択肢
- 免疫療法—免疫調節剤の単剤投与および併用。
- 標的療法—単剤および併用療法。
- BRAFおよびMEK阻害剤に加えて、P13K(ホスホイノシチド3-キナーゼ)、Akt(蛋白キナーゼB)、CDK(サイクリン依存性キナーゼ)阻害剤などのシグナル伝達阻害剤。
- 抗血管新生薬。前臨床研究のデータから、血管内皮増殖因子の産生増加は、BRAF阻害剤への耐性に関係しうることが示唆されている。[ 53 ]
- 特定の黒色腫を有する集団に対する標的療法。
- 黒色腫のより小規模のサブセットにおいては、活性化変異が、NRAS(神経芽腫RASウイルス[v-ras]がん遺伝子ホモログ)(15~20%)、c-KIT(慢性的に日光による損傷を受けた皮膚に発生する黒色腫の28~39%、または末端部および粘膜の黒色腫)、CDK4(サイクリン依存性キナーゼ4)(5%未満)に発生する一方で、ブドウ膜黒色腫においてはGNAQの変異の頻度が高い。これらの変異によって活性化された経路を標的として開発された薬物が現在、臨床試験中である。
- 免疫療法と標的療法の併用。
- 病変内局注(例えば、腫瘍崩壊性ウイルス)。
- すべての既知病巣の外科的完全切除 vs 最適な医学療法。
- 四肢の切除不能黒色腫に対する患肢灌流療法。
- 切除不能黒色腫に対する全身療法。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Andtbacka RH, Kaufman HL, Collichio F, et al.: Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. J Clin Oncol 33 (25): 2780-8, 2015.[PUBMED Abstract]
- Robert C, Ribas A, Wolchok JD, et al.: Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 384 (9948): 1109-17, 2014.[PUBMED Abstract]
- Robert C, Schachter J, Long GV, et al.: Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 372 (26): 2521-32, 2015.[PUBMED Abstract]
- Schachter J, Ribas A, Long GV, et al.: Pembrolizumab versus ipilimumab for advanced melanoma: final overall survival results of a multicentre, randomised, open-label phase 3 study (KEYNOTE-006). Lancet 390 (10105): 1853-1862, 2017.[PUBMED Abstract]
- Robert C, Long GV, Brady B, et al.: Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 372 (4): 320-30, 2015.[PUBMED Abstract]
- Zhao X, Suryawanshi S, Hruska M, et al.: Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors. Ann Oncol 28 (8): 2002-2008, 2017.[PUBMED Abstract]
- Robert C, Thomas L, Bondarenko I, et al.: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 364 (26): 2517-26, 2011.[PUBMED Abstract]
- Hodi FS, O'Day SJ, McDermott DF, et al.: Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 363 (8): 711-23, 2010.[PUBMED Abstract]
- Yervoy (Ipilimumab): Serious and Fatal Immune-Mediated Adverse Reactions [Medication Guide]. Princeton, NJ: Bristol-Myers Squibb, 2011. Available online. Last accessed January 31, 2019.[PUBMED Abstract]
- Atkins MB, Lotze MT, Dutcher JP, et al.: High-dose recombinant interleukin 2 therapy for patients with metastatic melanoma: analysis of 270 patients treated between 1985 and 1993. J Clin Oncol 17 (7): 2105-16, 1999.[PUBMED Abstract]
- Atkins MB, Kunkel L, Sznol M, et al.: High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J Sci Am 6 (Suppl 1): S11-4, 2000.[PUBMED Abstract]
- Postow MA, Chesney J, Pavlick AC, et al.: Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 372 (21): 2006-17, 2015.[PUBMED Abstract]
- Larkin J, Chiarion-Sileni V, Gonzalez R, et al.: Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. N Engl J Med 373 (1): 23-34, 2015.[PUBMED Abstract]
- Wolchok JD, Chiarion-Sileni V, Gonzalez R, et al.: Overall Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. N Engl J Med 377 (14): 1345-1356, 2017.[PUBMED Abstract]
- Tawbi HA, Forsyth PA, Algazi A, et al.: Combined Nivolumab and Ipilimumab in Melanoma Metastatic to the Brain. N Engl J Med 379 (8): 722-730, 2018.[PUBMED Abstract]
- Heidorn SJ, Milagre C, Whittaker S, et al.: Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression through CRAF. Cell 140 (2): 209-21, 2010.[PUBMED Abstract]
- Hatzivassiliou G, Song K, Yen I, et al.: RAF inhibitors prime wild-type RAF to activate the MAPK pathway and enhance growth. Nature 464 (7287): 431-5, 2010.[PUBMED Abstract]
- Poulikakos PI, Zhang C, Bollag G, et al.: RAF inhibitors transactivate RAF dimers and ERK signalling in cells with wild-type BRAF. Nature 464 (7287): 427-30, 2010.[PUBMED Abstract]
- Su F, Viros A, Milagre C, et al.: RAS mutations in cutaneous squamous-cell carcinomas in patients treated with BRAF inhibitors. N Engl J Med 366 (3): 207-15, 2012.[PUBMED Abstract]
- Chapman PB, Hauschild A, Robert C, et al.: Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 364 (26): 2507-16, 2011.[PUBMED Abstract]
- Sosman JA, Kim KB, Schuchter L, et al.: Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 366 (8): 707-14, 2012.[PUBMED Abstract]
- Hauschild A, Grob JJ, Demidov LV, et al.: Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 380 (9839): 358-65, 2012.[PUBMED Abstract]
- Flaherty KT, Robert C, Hersey P, et al.: Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med 367 (2): 107-14, 2012.[PUBMED Abstract]
- Hodi FS, Friedlander P, Corless CL, et al.: Major response to imatinib mesylate in KIT-mutated melanoma. J Clin Oncol 26 (12): 2046-51, 2008.[PUBMED Abstract]
- Guo J, Si L, Kong Y, et al.: Phase II, open-label, single-arm trial of imatinib mesylate in patients with metastatic melanoma harboring c-Kit mutation or amplification. J Clin Oncol 29 (21): 2904-9, 2011.[PUBMED Abstract]
- Carvajal RD, Antonescu CR, Wolchok JD, et al.: KIT as a therapeutic target in metastatic melanoma. JAMA 305 (22): 2327-34, 2011.[PUBMED Abstract]
- Flaherty KT, Lee SJ, Zhao F, et al.: Phase III trial of carboplatin and paclitaxel with or without sorafenib in metastatic melanoma. J Clin Oncol 31 (3): 373-9, 2013.[PUBMED Abstract]
- Long GV, Stroyakovskiy D, Gogas H, et al.: Combined BRAF and MEK inhibition versus BRAF inhibition alone in melanoma. N Engl J Med 371 (20): 1877-88, 2014.[PUBMED Abstract]
- Long GV, Stroyakovskiy D, Gogas H, et al.: Dabrafenib and trametinib versus dabrafenib and placebo for Val600 BRAF-mutant melanoma: a multicentre, double-blind, phase 3 randomised controlled trial. Lancet 386 (9992): 444-51, 2015.[PUBMED Abstract]
- Robert C, Karaszewska B, Schachter J, et al.: Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 372 (1): 30-9, 2015.[PUBMED Abstract]
- Larkin J, Ascierto PA, Dréno B, et al.: Combined vemurafenib and cobimetinib in BRAF-mutated melanoma. N Engl J Med 371 (20): 1867-76, 2014.[PUBMED Abstract]
- Dummer R, Ascierto PA, Gogas HJ, et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 19 (5): 603-615, 2018.[PUBMED Abstract]
- Dummer R, Ascierto PA, Gogas HJ, et al.: Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 19 (10): 1315-1327, 2018.[PUBMED Abstract]
- Chapman PB, Einhorn LH, Meyers ML, et al.: Phase III multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma. J Clin Oncol 17 (9): 2745-51, 1999.[PUBMED Abstract]
- Middleton MR, Grob JJ, Aaronson N, et al.: Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol 18 (1): 158-66, 2000.[PUBMED Abstract]
- Avril MF, Aamdal S, Grob JJ, et al.: Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phase III study. J Clin Oncol 22 (6): 1118-25, 2004.[PUBMED Abstract]
- Anderson CM, Buzaid AC, Legha SS: Systemic treatments for advanced cutaneous melanoma. Oncology (Huntingt) 9 (11): 1149-58; discussion 1163-4, 1167-8, 1995.[PUBMED Abstract]
- Wagner JD, Gordon MS, Chuang TY, et al.: Current therapy of cutaneous melanoma. Plast Reconstr Surg 105 (5): 1774-99; quiz 1800-1, 2000.[PUBMED Abstract]
- Mays SR, Nelson BR: Current therapy of cutaneous melanoma. Cutis 63 (5): 293-8, 1999.[PUBMED Abstract]
- Patel PM, Suciu S, Mortier L, et al.: Extended schedule, escalated dose temozolomide versus dacarbazine in stage IV melanoma: final results of a randomised phase III study (EORTC 18032). Eur J Cancer 47 (10): 1476-83, 2011.[PUBMED Abstract]
- Kirkwood JM, Strawderman MH, Ernstoff MS, et al.: Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684. J Clin Oncol 14 (1): 7-17, 1996.[PUBMED Abstract]
- Kirkwood JM, Ibrahim JG, Sondak VK, et al.: High- and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190. J Clin Oncol 18 (12): 2444-58, 2000.[PUBMED Abstract]
- Kirkwood JM, Ibrahim J, Lawson DH, et al.: High-dose interferon alfa-2b does not diminish antibody response to GM2 vaccination in patients with resected melanoma: results of the Multicenter Eastern Cooperative Oncology Group Phase II Trial E2696. J Clin Oncol 19 (5): 1430-6, 2001.[PUBMED Abstract]
- Hancock BW, Wheatley K, Harris S, et al.: Adjuvant interferon in high-risk melanoma: the AIM HIGH Study--United Kingdom Coordinating Committee on Cancer Research randomized study of adjuvant low-dose extended-duration interferon Alfa-2a in high-risk resected malignant melanoma. J Clin Oncol 22 (1): 53-61, 2004.[PUBMED Abstract]
- Koops HS, Vaglini M, Suciu S, et al.: Prophylactic isolated limb perfusion for localized, high-risk limb melanoma: results of a multicenter randomized phase III trial. European Organization for Research and Treatment of Cancer Malignant Melanoma Cooperative Group Protocol 18832, the World Health Organization Melanoma Program Trial 15, and the North American Perfusion Group Southwest Oncology Group-8593. J Clin Oncol 16 (9): 2906-12, 1998.[PUBMED Abstract]
- Lee ML, Tomsu K, Von Eschen KB: Duration of survival for disseminated malignant melanoma: results of a meta-analysis. Melanoma Res 10 (1): 81-92, 2000.[PUBMED Abstract]
- Leo F, Cagini L, Rocmans P, et al.: Lung metastases from melanoma: when is surgical treatment warranted? Br J Cancer 83 (5): 569-72, 2000.[PUBMED Abstract]
- Ollila DW, Hsueh EC, Stern SL, et al.: Metastasectomy for recurrent stage IV melanoma. J Surg Oncol 71 (4): 209-13, 1999.[PUBMED Abstract]
- Gutman H, Hess KR, Kokotsakis JA, et al.: Surgery for abdominal metastases of cutaneous melanoma. World J Surg 25 (6): 750-8, 2001.[PUBMED Abstract]
- Ives NJ, Stowe RL, Lorigan P, et al.: Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients. J Clin Oncol 25 (34): 5426-34, 2007.[PUBMED Abstract]
- Rate WR, Solin LJ, Turrisi AT: Palliative radiotherapy for metastatic malignant melanoma: brain metastases, bone metastases, and spinal cord compression. Int J Radiat Oncol Biol Phys 15 (4): 859-64, 1988.[PUBMED Abstract]
- Herbert SH, Solin LJ, Rate WR, et al.: The effect of palliative radiation therapy on epidural compression due to metastatic malignant melanoma. Cancer 67 (10): 2472-6, 1991.[PUBMED Abstract]
- Martin MJ, Hayward R, Viros A, et al.: Metformin accelerates the growth of BRAF V600E-driven melanoma by upregulating VEGF-A. Cancer Discov 2 (4): 344-55, 2012.[PUBMED Abstract]
- 本要約の変更点(04/22/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更が加えられた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、黒色腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Russell S. Berman, MD (New York University School of Medicine)
- Alison Martin, MD (Martin and Associates Consulting)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Melanoma Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389469]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する




