ご利用について
医療専門家向けの本PDQがん情報要約では、神経芽腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 神経芽腫に関する一般情報
-
小児および青年のがん患者の生存において、劇的な改善が達成されている。[ 1 ]1975年から2010年の間に、小児がんの死亡率は50%以上低下した。[ 1 ][ 2 ][ 3 ]神経芽腫の5年生存率は、同じ期間に1歳未満の小児については86%から95%に、1~14歳の小児については34%から68%に増加した。[ 2 ]小児および青年のがん生存者には、治療から数ヵ月または数年経過後もがん治療の副作用が持続または発現することがあるため、綿密なモニタリングが必要である。(小児および青年がん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)に関するPDQ要約を参照のこと。)
発生率および疫学
神経芽腫は小児において最も一般的な頭蓋外固形腫瘍である。米国では毎年650例以上の症例が診断される。[ 4 ][ 5 ]有病率は7,000生児出生当たり約1例である;15歳未満の小児における年間発生率は100万人当たり約10.54例である。患者の約37%が乳児で診断され、90%は診断時年齢が5歳未満であり、診断時年齢中央値は生後19ヵ月である。[ 6 ]診断時の年齢に関するデータは、これが乳児期の疾患であり、生後1ヵ月以内での診断率が最も高いことを示している。[ 4 ][ 5 ][ 6 ]
黒人の小児における神経芽腫の発生率は白人の小児における発生率よりわずかに低い。[ 7 ]しかしながら、腫瘍の生物学的特性には人種差もあり、アフリカ系米国人は高リスク疾患で致死的転帰を来すことが多い。[ 8 ][ 9 ]
神経芽腫の乳児に対するスクリーニングについて調査した集団ベースの諸研究では、生後1年以内に臨床で発見されることなく自然退縮する神経芽腫が、臨床で発見される神経芽腫と少なくとも同じ程度に存在することが実証されている。[ 10 ][ 11 ][ 12 ]
疫学研究から、環境などの曝露は神経芽腫の発生率の増加または低下と明確に関連していないことが示されている。[ 13 ]
神経芽腫のスクリーニング(遺伝的素因および家族性神経芽腫)
家族性神経芽腫患者のまれなコホートにおける構成的DNAを解析した諸研究から、腫瘍のイニシエーションにおける複雑な遺伝子的根拠についての理解が得られている。神経芽腫患者の約1~2%は神経芽腫の家族歴を有する。こうした小児は平均して年齢が低く(診断時に生後9ヵ月)、約20%が多発性原発神経芽腫を有する。
生殖細胞変異。以下のものを含むいくつかの生殖細胞変異が神経芽腫の遺伝的素因と関連付けられている:
他のがん素因症候群。他のがん素因症候群に関連する遺伝子異常を有する小児は、神経芽腫や他の悪性疾患を発症するリスクが高いことがある。以下の症候群には主に古典的RAS経路の遺伝子が関与する:
さらに、神経芽腫は以下の症候群の患者でも報告されている:
散発性神経芽腫はまた、弱い生殖細胞系列素因によって発生率が高くなる場合がある。ゲノムワイド関連解析により、神経芽腫発症リスクの増加に関連する若干の効果の大きさを持ついくつかの一般的なゲノム変数(一塩基多型[SNP])が同定されている。これらのゲノムリスク変数のほとんどが、異なった神経芽腫の表現型(すなわち、高リスク vs 低リスク疾患)と有意に関連する。[ 27 ]
神経芽腫の素因およびサーベイランス
American Association for Cancer Research(AACR)によるスクリーニングの推奨が、2016年のChildhood Cancer Predisposition Workshopから発表された。AACRは、以下の個人は10歳になるまでに腫瘍を早期に発見するため生化学的およびX線撮影によるサーベイランスを受けるべきであると推奨している:[ 24 ]
サーベイランスは以下で構成される:[ 24 ]
サーベイランスは出生時または神経芽腫の素因の診断時に開始し、6歳までは3ヵ月ごとに継続し、その後10歳までは6ヵ月ごとに継続する。コステロ症候群の患者はカテコールアミン分泌性腫瘍が存在しない場合でも尿中カテコールアミンが上昇している場合があるため、値が非常に高いか、値がかなり上昇している場合にのみ、超音波および胸部X線以外の追加の検査を指示すべきである。[ 28 ]リー-フラウメニ症候群の患者は胸部X線を受けるべきではない。[ 24 ]
ベックウィズ-ヴィーデマン症候群の小児の約5%は、CDKN1Cの活性を低下させる変異の分子的病因を有する。遺伝的に亜型分類されたベックウィズ-ヴィーデマン症候群に関するすべての大規模研究をレビューしたところ、CDKN1C変異を有する70人の小児が明らかにされ、そのうち4.6%が神経芽腫を発症した;ウィルムス腫瘍または肝芽腫の症例は認められなかった。これらの小児に対する神経芽腫スクリーニングの経験は限られているため、一般的に受け入れられているガイドラインは存在しないが、この研究の著者らは4~6ヵ月ごとの尿中VMA/HVAによるスクリーニングを提唱している。ベックウィズ-ヴィーデマン症候群の他の遺伝的サブタイプにおける神経芽腫の有病率は1%未満であり、インプリンティング制御領域1にメチル化の遺伝子型増加がみられる123人の小児において神経芽腫瘍は認められなかった。[ 29 ]
神経芽腫のスクリーニング(一般集団)
現在のデータは、一般大衆における神経芽腫のスクリーニングを支持していない。生後3週間、6ヵ月、または1年におけるスクリーニングによって、その後の生物学的に不良な特性をもつ年長児の進行期神経芽腫の発生率が低下することはなく、また神経芽腫よる全死亡数は減少しなかった。[ 11 ][ 12 ]これらの年齢の乳児に対し神経芽腫のスクリーニングを実施することによる公衆衛生的利益は示されていない。(詳しい情報については、神経芽腫のスクリーニングに関するPDQ要約を参照のこと。)
証拠(神経芽腫スクリーニングを不支持):
神経芽腫のゲノムおよび生物学的特性
神経芽腫の分子的特徴
神経芽腫の小児は、診断時の臨床的因子および生物学的マーカーに基づいて予測される再燃リスクがさまざまなサブセットに細分できる。
後に検討する高リスク神経芽腫の主要なゲノム特性には以下のものがある:
染色体セグメントの異常
1p、1q、3p、11q、14q、17pに最も頻繁にみられる染色体セグメントの異常は、比較ゲノムハイブリダイゼーション法により最もよく検出され、ほとんどの高リスクおよび/または4期神経芽腫の腫瘍で認められる。[ 32 ][ 33 ][ 34 ][ 35 ][ 36 ]神経芽腫のすべての患者において、染色体切断点の数の多さ(すなわち、染色体セグメント異常の数の多さ)は、以下の特徴と相関していた:[ 32 ][ 33 ][ 34 ][ 35 ][ 36 ][証拠レベル:3iiD]
1件の国際共同研究で、高リスク神経芽腫患者556人が調査され、きわめて不良な転帰に関連する2つの型のセグメントコピー数の異常が同定された。6qの遠位側領域の欠失は6%の患者に発見され、10年生存率はわずか3.4%であった;MYCN遺伝子増幅に加えて、MYCN遺伝子座を包含しない領域の増幅が18%の患者に発見され、10年生存率は5.8%であった。[ 38 ]
転移を伴わない切除不能な原発神経芽腫を有する生後12ヵ月より年長の小児に関する1件の研究では、染色体セグメントの異常が大半で認められ、年長の小児ほど異常を有することが多く、また腫瘍細胞当たりの異常の数が多かった。生後12ヵ月~18ヵ月の小児では、染色体セグメントの異常の存在はイベントフリー生存(EFS)には有意な影響を及ぼしたが、全生存(OS)には及ぼさなかった。しかしながら、18ヵ月より年長の小児では、腫瘍の組織型に関係なく、染色体セグメントの異常を持つ小児(67%)と持たない小児(100%)ではOSに有意な差が認められた。[ 36 ]
染色体セグメント数の異常も、MYCN遺伝子増幅が認められない限局性切除不能または転移性神経芽腫の乳児における再発を予測する。[ 30 ][ 31 ]
MYCN遺伝子増幅
神経芽腫腫瘍の16~25%でMYCN増幅が検出される。[ 39 ]高リスク神経芽腫患者では、症例の40~50%がMYCNの増幅を示す。[ 40 ]
あらゆる病期の疾患で、MYCN遺伝子の増幅は、予後因子に関するほぼすべての多変量回帰分析で、無増悪期間およびOSの両方についてより不良な予後を強く予測する。[ 30 ][ 31 ]MYCNが増幅した限局性腫瘍コホートでは、高二倍体腫瘍の患者は二倍体腫瘍の患者よりも転帰が良好である。[ 41 ]しかしながら、MYCN増幅または何らかの染色体セグメントの異常を伴う高二倍体腫瘍の患者は、MYCN増幅を伴わない高二倍体腫瘍の患者と比較して相対的に予後不良である。[ 32 ]
神経芽腫患者4,672人におけるMYCNコピー数に関する小児腫瘍学グループの研究では、以下の結果が報告された:[ 42 ]
最も予後不良の臨床的および病理生物学的特性は、一定程度までMYCNの増幅と関連している;International Neuroblastoma Risk Group(INRG)研究の患者7,102人を対象とした多変量ロジスティック回帰分析では、併合された染色体セグメントの異常および17qの増加がMYCNの増幅と関連しない場合でも予後不良の特徴であった。しかしながら、別の予後不良の特徴である11qでの染色体セグメントの異常はMYCNの増幅とほぼ完全に相互排他的である。[ 43 ][ 44 ]
MYCNの状態が明らかになっているINRGデータベースの患者6,223人のコホートにおいて、MYCN増幅に伴うOSのハザード比(HR)は6.3(95%信頼区間[CI]、5.7-7.0;P < 0.001)であった。MYCN増幅がOSに対して最も大きく予後不良に影響したのは、最も年齢の低い患者であった(生後18ヵ月未満:HR、19.6;生後18ヵ月以上:HR、3.0)であった。MYCNの状態が転帰に最も影響を及ぼした患者は、生後18ヵ月未満の年齢、高い有糸分裂/核崩壊指数、低フェリチンなど、他の点では予後良好な特徴を有する患者であった。[ 45 ][証拠レベル:3iiiA]
腫瘍内不均一性MYCN増幅(hetMNA)とは、クラスターまたは単独の散在した細胞としてのMYCN増幅細胞と非MYCN増幅腫瘍細胞の共存のことをいう。hetMNAはまれに報告されており、空間的に腫瘍内に加えて、腫瘍と転移巣との間に同時に発生したり、時間的に疾患過程中に発生したりすることがある。International Society of Paediatric Oncology Europe Neuroblastoma(SIOPEN)の生物学グループは、この神経芽腫亜型の予後的意義について検討した。hetMNAを有することが同定され、1991年から2015年に診断された患者99人からの腫瘍組織が解析され、それ以外では非MYCN増幅の神経芽腫におけるMYCN増幅クローンの予後的意義が解明された。生後18ヵ月未満の患者は、すべての病期で年長の患者より良好な転帰を示した。このゲノム的背景は、再燃頻度および全生存と有意に相関していた。染色体異常が数的異常のみの症例で再燃はみられなかった。この研究から、hetMNAの腫瘍は、患者の年齢および病期などの臨床パターンと組み合わせて、腫瘍のゲノム的背景との関連で評価しなければならないことが示唆される。今後は、hetMNA病変が限局性の生後18ヵ月未満の患者を対象とした研究が必要である。[ 46 ]
神経芽腫におけるエクソンの変異
複数の報告で、小数の高リスク神経芽腫が発生率の低い反復変異遺伝子を持っていることが示されている。最も一般的な変異遺伝子はALKであり、患者の約10%で変異を生じている(下記参照)。変異の頻度がより低い他の遺伝子にはATRX、PTPN11、ARID1A、ARID1Bがある。[ 47 ][ 48 ][ 49 ][ 50 ][ 51 ][ 52 ][ 53 ]図2に示すように、ほとんどの神経芽腫症例で反復的に変化した遺伝子に変異はみられない。
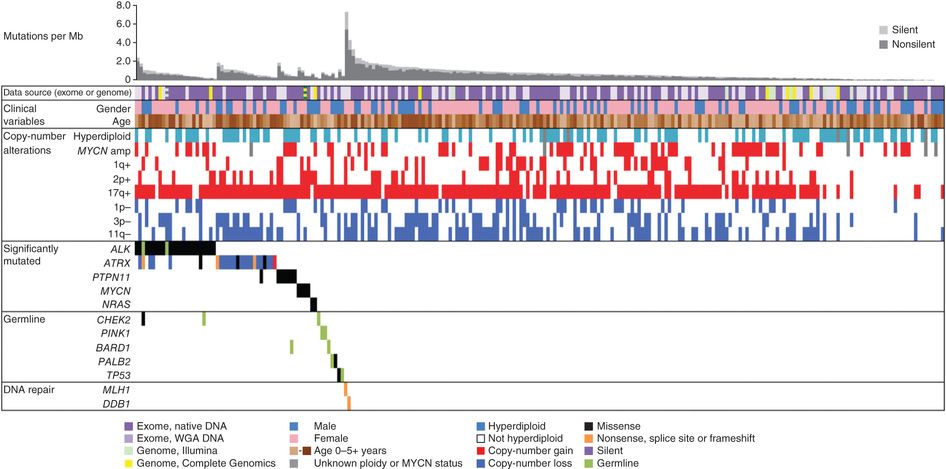
図2.データトラック(行)により神経芽腫症例(列)間の臨床データおよびゲノムデータの比較が容易になる。使用されたデータ源およびシークエンシング技術は、全ゲノム増幅(WGA)からの全エクソーム配列決定法(WES)(明紫色)、天然DNAからのWES(濃紫色)、Illumina社のWGS(緑色)、Complete Genomics社のWGS(黄色)であった。縞模様のブロックは2つのアプローチを用いて解析された症例を示す。臨床的変数(clinical variables)には性別(男性、青色;女性、ピンク)および年齢(茶色の範囲)があった。コピー数の変化(copy number alterations)はフローサイトメトリーにより測定した倍数性(高二倍体は1を超えるDNA指数を意味する)および塩基配列データから得られた臨床的に関連するコピー数の変化を示す。有意な変異を生じた遺伝子(significantly mutated genes)とは、神経芽腫における背景変異率、遺伝子の大きさ、および発現量を踏まえて統計的に有意な変異数を持つ遺伝子である。生殖細胞(germline)は、我々のコホートで有意な数の生殖細胞ClinVar変異または機能喪失型がん遺伝子変異を持つ遺伝子を指す。DNA修復(DNA Repair) は、2つの明らかに高頻度変異を生じている腫瘍において変異頻度の増加と関連している可能性のある遺伝子を指す。体細胞変異の予測される影響は凡例に従って色分けされている。Macmillan Publishers Ltdから許諾を得て転載:Nature Genetics (Pugh TJ, Morozova O, Attiyeh EF, et al.: The genetic landscape of high-risk neuroblastoma.Nat Genet 45 (3): 279-84, 2013), copyright (2013). 神経芽腫で最も一般的に認められるエクソンの変異であるALKは、細胞表面の受容体チロシンキナーゼであり、胎生期および新生児期の脳の発達中にのみ有意な水準で発現する。ALKにおける生殖細胞変異は、遺伝性神経芽腫の主要な原因として特定されている。体細胞性のALK活性化エクソン変異も神経芽腫の発がん因子であることが明らかになっている。[ 52 ]
ALK変異の存在は、高リスクおよび中リスクの神経芽腫患者における有意に不良な生存と相関している。ALK変異が1,596件の診断用神経芽腫試料で調べられ、以下の結果が認められた:[ 52 ]
副腎に発生した特徴的な原発性神経芽腫(n = 646)のゲノムデータと胸部交感神経節に発生した神経芽腫(n = 118)のゲノムデータを比較した1件の研究では、胸部腫瘍の16%にALK変異が認められた。[ 54 ]
クリゾチニブ(従来の治療に追加される)などの低分子ALKキナーゼ阻害薬が、新たに診断された高リスク神経芽腫でALKが活性化した患者を対象に検証されている(COG ANBL1531)。[ 52 ]
エクソンの変異のゲノム進化
神経芽腫の診断から再燃までのエクソンの変異のゲノム進化に関するデータは限定的である。再燃に関連する体細胞遺伝子変化を定義するために、診断時および再燃時の神経芽腫の腫瘍標本の23組のペアに対し全ゲノム配列決定法が適用されたのに対し[ 55 ]、2番目の研究は16組のペアの診断時および再燃時の試料を評価した。[ 56 ]両研究は、診断時の標本との比較で再燃時の標本に変異数の増加を認めた;このことは次世代シークエンシングに送られた神経芽腫の腫瘍標本の研究で確認されている。[ 57 ]
ディープシークエンシング研究では、(すべての診断時年齢の患者から得たすべての病期の)276の神経芽腫標本について、増幅されたちょうど2つのALK変異ホットスポットの超深度(33,000X)配列決定(very deep sequencing)が実施され、4.8%のクローン変異および追加の5%のサブクローン変異が明らかにされたことから、サブクローンALK遺伝子変異が一般的であることが示唆されている。[ 58 ]このように、深度配列決定により、治療中に生存し、再燃の一部をなすように増殖できる可能性のある神経芽腫腫瘍細胞の微小なサブセットにおける変異の存在を明らかにすることができる。
テロメア延長を促進するゲノムの変化
染色体の先端のテロメアの延長が細胞の生存を助長する。そうでなければテロメアは細胞の複製のたびに短縮化し、最終的に細胞の複製能力の消失を生じる。低リスク神経芽腫の腫瘍にはテロメア延長活性はほとんどない。テロメア延長を生じる異常な遺伝的機序が高リスク神経芽腫腫瘍で確認されている。[ 47 ][ 48 ][ 59 ]これまでに、相互排他的とみられる以下の3つの機序が報告されている:
予後と関連するさらなる生物学的因子
MYCおよびMYCNの発現
357例の未分化型/低分化型神経芽腫腫瘍の限定されたサブセットに関するMYCおよびMYCN蛋白の免疫染色から、MYC/MYCN蛋白の発現増加は予後的に重要であることが実証された。[ 61 ]68の腫瘍(19%)がMYCN蛋白を高度に発現しており、81の腫瘍ではMYCNが増幅していた。39の腫瘍(10.9%)はMYCを高度に発現しており、MYCNの高発現と相互排他的であった;MYC発現腫瘍では、MYCまたはMYCN遺伝子の増幅は示されなかった。本研究では染色体セグメントの異常は、検討されなかった。[ 61 ]
ニューロトロフィン受容体キナーゼ
ニューロトロフィン受容体キナーゼおよびそのリガンドの発現は高リスクおよび低リスクの腫瘍間で異なる。低リスク腫瘍ではTrkAが認められ、そのリガンドNGFがみられないことが腫瘍の自然退縮につながると仮定されている。それとは対照的に、TrkBはそのリガンドBDNFも発現する高リスク腫瘍で認められ、BDNFが神経芽腫細胞の増殖および生存を助長する。[ 62 ]
免疫系の阻害
抗GD2抗体は、抗体の抗神経芽腫活性を高めるための免疫系の修正とともに、神経芽腫の治療を助けるためにしばしば用いられる。こうした抗体の1つの臨床的有効性が、米国食品医薬品局によるジヌツキシマブの承認につながった。免疫療法に対する患者の反応は、一部には、免疫機能における患者間の変動が原因となっている場合がある。1つの施設でのみ神経芽腫の治療に用いられている3F8と呼ばれる抗GD2抗体は、神経芽腫細胞を死滅させるためにナチュラルキラー細胞を利用する。しかしながら、ナチュラルキラー細胞はHLA抗原とキラー免疫グロブリン受容体(KIR)のサブタイプとの相互作用により阻害されることがある。[ 63 ][ 64 ]この知見は、抗GD2抗体のジヌツキシマブと顆粒球マクロファージコロニー刺激因子およびインターロイキン-2とを併用した米国内のランダム化COG-ANBL0032(NCT00026312)研究で治療された患者の治療成績を解析して確認および拡大された。この研究で、特定のKIR/KIRリガンド遺伝子型は免疫療法で治療された患者において、より良好な治療成績と関連することが明らかにされた。[ 65 ][証拠レベル:1A]抑制性のKIR/KIRリガンドの存在は免疫療法の効果低下に関連した。したがって、患者の免疫系の遺伝子は神経芽腫向けの免疫療法に対する反応を判定する上で有用である。この免疫系の遺伝子型解析は特定の免疫療法に対する患者の選択の指針となりうるかどうかを判定するために、追加の研究が必要である。
臨床像
神経芽腫において最も頻度の高い徴候および症状は腫瘤および転移によるものであり、以下が含まれる:
青年における神経芽腫の臨床像は、小児における臨床像と類似する。唯一の例外は骨髄転移の発生頻度が青年では比較的低いことであり、肺や脳などのまれな部位への転移がより高頻度でみられる。[ 69 ]
眼球クローヌス/ミオクローヌス症候群
神経芽腫の患児にはまれに、小脳性運動失調や眼球クローヌス/ミオクローヌスなどの腫瘍随伴神経所見が生じる。[ 70 ]眼球クローヌス/ミオクローヌス症候群を呈する幼児のうち、約半数が神経芽腫を有することが明らかになる。[ 71 ][ 72 ]英国における年間発生率は小児100万人当たり眼球クローヌス/ミオクローヌス0.18例と推定されており、診断時平均年齢は1.5~2歳である。[ 73 ]
神経芽腫が発見される2~3日前の進行性の神経機能障害の発症が通常の症状であるが、原発腫瘍摘出からずっと後に神経学的症状がときに出現する。[ 71 ][ 74 ][ 75 ]眼球クローヌス/ミオクローヌス症候群を発症する神経芽腫患者はしばしば良好な生物学的特性をもつ神経芽腫を有し、生存率がきわめて優れているが、腫瘍に関連する死亡も報告されている。[ 71 ]
眼球クローヌス/ミオクローヌス症候群を伴う神経芽腫症例44例において、ゲノムコピー数プロファイルが解析された。腫瘍の再燃または疾患に関連する死亡は認められなかったため、全ゲノムプロファイルに予後的意義はなかった。[ 76 ]
眼球クローヌス/ミオクローヌス症候群は、未だ十分に特徴が解明されていない免疫機序により引き起こされるようである。[ 71 ]原発腫瘍には典型的にリンパ球が散在性に浸潤している。[ 77 ]脳脊髄液はB細胞数の増加を示し、オリゴクローナル免疫グロブリンバンドがしばしばみられる。B細胞関連サイトカインのステロイド反応性の上昇もしばしばみられる。[ 78 ]
免疫介入または単純に神経芽腫の摘出に対して神経学的に鋭敏に反応する患者もいるが、多くの症例では、改善は緩徐かつ部分的である。急性に発症した運動障害および運動失調に対して免疫学的治療で示された改善は、長期の神経心理学的障害(主に認知および行動障害で構成される)の改善とは明らかに関連していない。治療の結果得られる急速な改善の長期的な有益性は、症状の治療か、基礎にある神経芽腫の治療かに関係なく不明であるが、急速な改善は価値があると考えられる。[ 75 ][ 79 ]
急性症状に対して副腎皮質刺激ホルモンまたはコルチコステロイド療法が有効な場合があるが、コルチコステロイドが奏効しない患者もいる。[ 74 ][ 80 ]選択された症例では、種々の免疫調節薬、プラスマフェレーシス、静注γグロブリン、およびリツキシマブによる他の治療法が有効であることが報告されている。[ 74 ][ 81 ][ 82 ][ 83 ][ 84 ]併用免疫抑制療法が探索されており、短期成績が改善している。[ 85 ]化学療法で治療された患者では、おそらくは化学療法の免疫抑制作用のために、短期の神経学的な転帰が優れている。[ 70 ]
眼球クローヌス/ミオクローヌス運動失調症候群の患者を対象にした最初のランダム化オープンラベル第III相研究が、小児腫瘍学グループ(COG)により完了している。[ 86 ]神経芽腫および眼球クローヌス/ミオクローヌス運動失調症候群を新たに診断された8歳未満の患者が、プレドニゾンおよび腫瘍のリスク調整治療に加えて静注免疫グロブリン(IVIG)またはIVIGなしのいずれかを受けるようにランダムに割り付けられた。参加した53人の患者について、IVIG群の患者26人中21人(81%)で数週間から数ヵ月で眼球クローヌス/ミオクローヌス運動失調症候群に対する反応が得られたのに対し、IVIGなしの群の患者27人で反応が得られたのは11人(41%)であった(オッズ比[OR]、6.1;P = 0.0029)。この研究により、化学療法、コルチコステロイド、および免疫グロブリンで治療された患者では、免疫グロブリンを併用せずに化学療法およびコルチコステロイドで治療された患者と比較して短期の神経学的反応が改善することが実証されている。[ 86 ]この集団における長期の神経発達および学習の問題を評価するために、追加の追跡が必要である。
診断
神経芽腫の診断的評価には以下のものがある:
神経芽腫の診断には、小児腫瘍に精通している複数の病理医の参加が必要である。神経芽腫の中には、従来のヘマトキシリンおよびエオシン染色のみを用いる光学顕微鏡検査では、リンパ腫、原始神経外胚葉性腫瘍、横紋筋肉腫など小児の他の青色小型円形細胞腫瘍と形態学的に鑑別できないものがある。このような症例では、特異的な青色小型円形細胞腫瘍を診断するために、免疫組織化学的および細胞遺伝学的分析が必要となる。
国際合意により確立されている神経芽腫診断の必要最低基準では、診断を下すために以下のいずれか1つを満たす必要がある:
予後因子
神経芽腫患者の予後は、以下の因子に関連している:
治療の決定に役立てるため、これらの予後因子の一部を組み合わせてリスクグループが指定される。(詳しい情報については、本要約の国際神経芽腫リスクグループの病期分類システムのセクションおよび小児腫瘍学グループの神経芽腫リスク分類のセクションを参照のこと。)
治療の時代
米国における神経芽腫の5年生存率は1975年から2010年の間に、1歳未満の小児については86%から95%に増加し、1~14歳の小児については34%から68%に増加した。[ 2 ]神経芽腫のすべての乳児および小児の5年全生存(OS)率は、1974年から1989年の間に診断された場合の46%から、1999年から2005年の間に診断された場合の71%へと増加した。[ 94 ]患者の年齢、病期、および生物学的特性によって予後はきわめて不均一であるため、この単一の統計値は誤解を招く恐れがある。しかしながら、諸研究から、2000年から2010年の間に診断され、治療を受けた高リスク患者の生存率は、1990年から1999年の間に診断された患者と比較して有意に改善していることが示されている。[ 95 ](詳しい情報については、表1を参照のこと。)同様に、COG ANBL0531(NCT00499616)研究で、より早期に実施されたCOG-A3961(NCT00003093)研究と比較して、強度をかなり低下させた化学療法で治療された中リスク小児の多くのサブセットで同等の転帰が明らかにされた。[ 96 ]
診断時の年齢
乳児および小児
診断時年齢は5年生存率に大きな影響を及ぼす。1975年から2006年までの米国のSurveillance, Epidemiology, and End Results(SEER)の統計によると、年齢で層別化した5年生存率は以下の通りである:[ 94 ]
予後に対する患児の年齢の影響は、以下に明らかなように、臨床的および病理生物学的因子に強く影響される:
青年および若年成人
青年および成人が神経芽腫を発症することはまれであり、全症例の5%未満を占めるに過ぎない。この年齢層で神経芽腫が発生する場合、臨床経過は年齢の低い患者における神経芽腫よりも緩徐でありながら、de novoの化学療法抵抗性を示す。[ 49 ]神経芽腫は、病期や部位に関係なく、10歳より年長の青年または成人では長期予後が不良である。
青年および若年成人患者ではMYCNの増幅が認められることはまれである(10~21歳の患者で9%)が、進行期疾患の年長児では生存率が不良である。青年および若年成人集団の腫瘍では、染色体セグメント異常が見つかることが多く、ALKおよびATRX変異の頻度が他よりはるかに高い。[ 36 ][ 37 ][ 100 ]青年では、腫瘍の約40%にATRXの機能喪失型変異がみられるのに対して、この変異は比較的年齢の低い小児では20%未満で、1歳未満の乳児では0%である。[ 49 ]
青年および若年成人患者(15~39歳)に対する5年OS率は38%であった。[ 101 ][証拠レベル:3iA]10~21歳の患者の5年EFS率は32%、5年OS率は46%である;4期疾患では、10年EFS率は3%、10年OS率は5%である。[ 102 ]積極的な化学療法および手術はこれらの患者の50%以上において病的状態を最小限にとどめることが示されている。[ 69 ][ 103 ]局所放射線療法や自家幹細胞移植、確認された活性を有する薬物の使用など、その他の治療法は青年および成人に対する不良な予後を改善しうる。[ 102 ][ 103 ]
成人
44人の患者(18~71歳)を対象にした単一施設のシリーズによると、成人発症型神経芽腫の生物学は小児または青年の神経芽腫の生物学とは異なるようである。成人患者における遺伝子異常には、体細胞性のATRX変異(58%)およびALK変異(42%)が含まれたが、MYCN増幅は含まれなかった。4人の患者で生殖細胞検査が実施され、このうち2人に異常が認められた(1人はBRCA1変異を有し、もう1人はTP53およびNF1変異を有した)。局所領域疾患を有する11人の患者において、10年無増悪生存(PFS)率は35%、およびOS率は61%であった。4期神経芽腫の成人33人では、7人(21%)の患者が寛解導入化学療法および/または手術後に完全奏効(CR)を達成した。診断時に4期神経芽腫を有した患者における5年PFS率は10%で、5年経過時に病変が認められて生存していたほとんどの患者がその後の5年間で神経芽腫により死亡した;10年OS率は19%であった。寛解導入後のCRは、PFSおよびOSに対する唯一の予後因子であった。抗GD2免疫療法(m3F8またはhu3F8)は成人における忍容性が良好であった。[ 104 ]
腫瘍の組織型
神経芽腫の腫瘍の組織型は予後とリスクグループの割り付けに大きな影響を与える(詳しい情報については、本要約の神経芽腫瘍の細胞分類のセクションおよび表4を参照のこと)。
予後良好と考えられる組織学的特徴には以下のものがある:
有糸分裂/核崩壊指数の高さおよび未分化腫瘍細胞は予後不良の組織学的特性とみなされているが、その予後的価値は年齢に影響される。[ 108 ][ 109 ]
他の因子の中で組織型が転帰に及ぼす影響を調査した1件のCOG研究(P9641[NCT00003119])で、MYCN増幅を示さない1期および2期神経芽腫の小児915人中87%が初回手術による治療および経過観察を受けた。症状のある疾患を有するか、その発症リスクのある患者、診断時に切除された腫瘍が50%未満または手術のみの施行後に切除不能の進行性疾患を有した患者(13%)は化学療法および手術による治療を受けた。予後良好な組織像を有する小児では5年EFS率が90~94%およびOS率が99~100%であったのに対し、予後不良な組織像を有する小児ではEFS率は80~86%およびOS率は89~93%であった。[ 97 ]
生物学的特性
(詳しい情報については、本要約の神経芽腫のゲノムおよび生物学的特性のセクションを参照のこと。)
原発腫瘍部位
神経芽腫の臨床的特徴および生物学的特性は原発腫瘍部位によって異なる。臨床試験に登録され、International Risk Group Projectがまとめた患者8,389人分のデータに関する研究で、以下の結果が認められ、臨床的および生物学的データが完全でない、はるかに小規模の以前の研究が確認された:[ 110 ]
- 副腎腫瘍。副腎の原発腫瘍は、副腎以外の部位の原発腫瘍よりもMYCN増幅などの予後不良の特徴を伴うことが多く、研究者が年齢、病期、組織学的悪性度を調整した後でもその傾向が認められた。副腎神経芽腫は、4期腫瘍、染色体セグメントの異常、二倍体、予後不良なINPCの組織型の発生率の高さ、生後18ヵ月未満、乳酸脱水素酵素(LDH)とフェリチン高値とも関連していた。副腎腫瘍と比較した場合のMYCN増幅の相対リスクは、副腎以外の腹部腫瘍では0.7、腹部以外の傍脊椎腫瘍では約0.1であった。
- 胸部腫瘍。胸部腫瘍が胸部以外の腫瘍と比較された;研究者が年齢、病期、および組織学的悪性度を調整した後の結果から、胸部腫瘍患者の方が死亡および再発が少なく(HR、0.79;95%CI、0.67-0.92)、また胸部腫瘍はMYCN増幅の発生率が低いことが示された(調整後OR、0.20;95%CI、0.11-0.39)。
Therapeutically Applicable Research to Generate Effect Treatments(TARGET)およびゲノムワイド関連解析のデータセットを用いた1件の研究で、副腎に発生した特徴的な原発性神経芽腫(n = 646)のゲノムおよびエピゲノムデータと胸部交感神経節に発生した神経芽腫(n = 118)のゲノムおよびエピゲノムデータが比較された。副腎に発生した神経芽腫ではMYCN増幅などのDNA構造異常が認められる可能性が高かった一方、胸部の腫瘍は有糸分裂チェックポイントにおける欠損を示し、その結果、高二倍体となった。胸部の腫瘍は副腎の腫瘍よりもすべての症例(OR、1.89;P = 0.04)、およびMYCN増幅が認められない症例(OR、2.86;P = 0.003)でALKの機能獲得型異常がみられる可能性が高かった。胸部の腫瘍の16%ではALK変異がみられるため、この設定ではこれらの変異に対してルーチンの塩基配列決定を検討すべきである。[ 54 ]
TARGETコホートでは、副腎原発腫瘍患者の70%および胸部原発腫瘍患者の51%が4期であった;MYCN増幅が認められない症例におけるゲノムワイド関連解析では、副腎原発腫瘍患者の43%および胸部原発腫瘍患者の17%が4期であった。多変量解析により、副腎はゲノムワイド関連解析コホートにおいて不良な転帰の独立した予測因子であったが、MYCN増幅状態、疾患の病期、生後18ヵ月以上の年齢で調整後、TARGETコホートにおいて不良な転帰の予測因子とはならなかった。副腎神経芽腫は、ゲノムワイド関連解析コホートまたはTARGETコホートのいずれの類似した多変量解析でも不良なEFSの独立した予測因子ではなかった。[ 54 ]
神経芽腫の原発腫瘍部位が予後に及ぼす影響が腫瘍部位に関連する腫瘍の生物学の差に完全に依存するかどうかは不明である。
多発性神経芽細胞腫の発生はまれで、通常は乳児に発生し、一般に予後は良好である。[ 111 ]多発性原発神経芽腫の患者では、家族性神経芽腫およびALK遺伝子の生殖細胞変異を考慮すべきである。
疾患の病期
1990年代以前は、疾患の病期を割り付けるために画像および手術に基づくいくつかの分類システムが用いられていた。世界中で得られた結果の比較を容易にするため、神経芽腫国際病期分類システム(INSS)と呼ばれる外科的および病理学的病期分類システムが開発された。[ 93 ]INSSにより、診断時の病期に基づく転帰が予測されたが、生物学的変数との重要な相互作用も明らかにされた。[ 2 ][ 3 ][ 4 ][ 7 ][ 41 ][ 42 ][ 93 ][ 97 ][ 98 ]しかしながら、外科的アプローチは施設間で異なるため、局所領域に病変を有する患者のINSS病期もまたかなり異なっている可能性がある。最近になって、診断時の病変の範囲を画一的に定義するため、国際神経芽腫リスクグループの分類システム用に手術前の国際神経芽腫リスクグループの病期分類システム(INRGSS)が開発された。[ 30 ][ 112 ]INRGSSは現在、北米およびヨーロッパの共同グループ研究で用いられている。INSSとは異なり、INRGSS病期は局所領域リンパ節転移の影響を受けない。
詳しい情報については、本要約の以下のセクションを参照のこと:
治療への反応
治療への反応は転帰と関連している。COG ANBL0531(NCT00499616)研究において初回治療への反応が不良であった中リスク神経芽腫の患者において、20人中6人の患者ではその後に疾患が進行または再発し、1人の患者が死亡した。[ 96 ]例えば、高リスク疾患の患者では、寛解導入化学療法後の骨髄中における神経芽腫細胞の遺残は予後不良と関連しており、これは測定感度の高い微小残存病変の検査技術で評価可能である。[ 113 ][ 114 ][ 115 ]同様に、導入療法完了後にも2を超えるCurieスコア(Curieスコアリングに関する詳しい情報については、本要約のCurieスコアおよびSIOPENスコアのセクションを参照のこと)が測定されたMIBGの集積が認められる腫瘍の持続は、MYCNの増幅のない高リスク腫瘍患者について予後不良を予測する。MYCNが増幅していた腫瘍を有する高リスク患者について、導入療法完了後の0を超えるCurieスコアは不良な転帰に関連する。[ 116 ][ 117 ]
原発腫瘍の有糸分裂の治療関連の低下および組織学的分化度の上昇も反応を予測する。[ 118 ]
原発腫瘍の大きさの縮小に基づく予後判定の正確度はそれほど明確ではない。7ヵ所の大規模な国際的施設で実施された1件の研究で、229人の高リスク患者が、化学療法、原発腫瘍の外科的切除、腫瘍床への放射線照射、高用量の骨髄除去的治療 + 幹細胞移植、および大半の症例でのイソトレチノインおよびサイトカインで強化した抗GD2抗体免疫療法を含むさまざまな方法で治療された。原発腫瘍の反応が寛解導入化学療法後に3つの方法で測定された:最大径の30%以上の縮小、腫瘍容積の50%以上の縮小、腫瘍容積の65%以上の縮小(従来の放射線学的手法である3腫瘍径からの算出)。測定は診断時および原発腫瘍切除前の導入化学療法後に実施された。寛解導入化学療法終了時における原発腫瘍の反応のいずれの測定法も生存を予測しなかった。[ 119 ]
神経芽腫の自然退縮
自然退縮の現象は、神経芽腫の乳児、特に4Sパターンの転移がみられる乳児においてよくみられている。[ 120 ](詳しい情報については、本要約の神経芽腫の病期情報のセクションを参照のこと。)
自然退縮は一般的に、以下の特徴を有する腫瘍にのみ起こる:[ 121 ]
- 三倍体に近い数の染色体。
- MYCN増幅が認められないこと。
- 染色体1pの欠失が認められないこと。
自然退縮に関連する別の特徴には、テロメラーゼの発現がなく[ 122 ][ 123 ]、H-Ras蛋白の発現[ 124 ]、および神経成長因子受容体であるニューロトロフィン受容体TrkAの発現[ 125 ]がある。
諸研究からは、スクリーニングによって、または出生前あるいは偶然に行った超音波検査の所見として発見された無症状で小型の早期副腎神経芽腫を有するとみられる選択された乳児症例においては、腫瘍は、しばしば自然退縮し、外科的介入ないし組織診断をしなくとも安全に経過観察しうることが示唆されている。[ 126 ][ 127 ][ 128 ]
証拠(観察[自然退縮]):
- 1件のCOG研究において、生後6ヵ月未満で1期の小さな副腎腫瘤が画像検査で明らかにされ、十分に選択された乳児83人が生検を行わずに観察された。外科的介入は腫瘤が増殖するか進行した患者または尿中カテコールアミン代謝物値の上昇を示した患者にのみ実施された。[
91
]
- 81%の患者で手術が控えられ、2年間の追跡後に全員が生存していた(詳しい情報については、本要約の手術のサブセクションを参照のこと)。
- ドイツの1件の臨床試験において、自然退縮および/または無増悪は、MYCN増幅が認められない1期、2期、または3期腫瘍を有する生後12ヵ月以下の無症状の乳児93人のうち44人で認められた。これらはすべて、生検後および部分切除後または未切除で観察された。[ 92 ]一部の症例では、退縮は診断後1年を超えても生じなかった。
- カナダのケベック州とドイツで行われた神経芽腫のスクリーニング試験で、神経芽腫の発生率はスクリーニングを行わなかった場合の報告例の2倍であり、多くの神経芽腫が気付かれることなく、自然退縮していることを示唆している。[ 10 ][ 11 ][ 12 ]
参考文献- Childhood cancer by the ICCC. In: Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2010. Bethesda, Md: National Cancer Institute, 2013, Section 29. Also available online. Last accessed March 16, 2020.[PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- Childhood cancer. In: Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2010. Bethesda, Md: National Cancer Institute, 2013, Section 28. Also available online. Last accessed March 16, 2020.[PUBMED Abstract]
- Howlader N, Noone AM, Krapcho M, et al., eds.: SEER Cancer Statistics Review, 1975-2009 (Vintage 2009 Populations). Bethesda, Md: National Cancer Institute, 2012. Also available online. Last accessed February 13, 2020.[PUBMED Abstract]
- Gurney JG, Ross JA, Wall DA, et al.: Infant cancer in the U.S.: histology-specific incidence and trends, 1973 to 1992. J Pediatr Hematol Oncol 19 (5): 428-32, 1997 Sep-Oct.[PUBMED Abstract]
- London WB, Castleberry RP, Matthay KK, et al.: Evidence for an age cutoff greater than 365 days for neuroblastoma risk group stratification in the Children's Oncology Group. J Clin Oncol 23 (27): 6459-65, 2005.[PUBMED Abstract]
- Ward E, DeSantis C, Robbins A, et al.: Childhood and adolescent cancer statistics, 2014. CA Cancer J Clin 64 (2): 83-103, 2014 Mar-Apr.[PUBMED Abstract]
- Henderson TO, Bhatia S, Pinto N, et al.: Racial and ethnic disparities in risk and survival in children with neuroblastoma: a Children's Oncology Group study. J Clin Oncol 29 (1): 76-82, 2011.[PUBMED Abstract]
- Latorre V, Diskin SJ, Diamond MA, et al.: Replication of neuroblastoma SNP association at the BARD1 locus in African-Americans. Cancer Epidemiol Biomarkers Prev 21 (4): 658-63, 2012.[PUBMED Abstract]
- Takeuchi LA, Hachitanda Y, Woods WG, et al.: Screening for neuroblastoma in North America. Preliminary results of a pathology review from the Quebec Project. Cancer 76 (11): 2363-71, 1995.[PUBMED Abstract]
- Woods WG, Gao RN, Shuster JJ, et al.: Screening of infants and mortality due to neuroblastoma. N Engl J Med 346 (14): 1041-6, 2002.[PUBMED Abstract]
- Schilling FH, Spix C, Berthold F, et al.: Neuroblastoma screening at one year of age. N Engl J Med 346 (14): 1047-53, 2002.[PUBMED Abstract]
- Heck JE, Ritz B, Hung RJ, et al.: The epidemiology of neuroblastoma: a review. Paediatr Perinat Epidemiol 23 (2): 125-43, 2009.[PUBMED Abstract]
- Mossé YP, Laudenslager M, Longo L, et al.: Identification of ALK as a major familial neuroblastoma predisposition gene. Nature 455 (7215): 930-5, 2008.[PUBMED Abstract]
- Mosse YP, Laudenslager M, Khazi D, et al.: Germline PHOX2B mutation in hereditary neuroblastoma. Am J Hum Genet 75 (4): 727-30, 2004.[PUBMED Abstract]
- Raabe EH, Laudenslager M, Winter C, et al.: Prevalence and functional consequence of PHOX2B mutations in neuroblastoma. Oncogene 27 (4): 469-76, 2008.[PUBMED Abstract]
- van Limpt V, Schramm A, van Lakeman A, et al.: The Phox2B homeobox gene is mutated in sporadic neuroblastomas. Oncogene 23 (57): 9280-8, 2004.[PUBMED Abstract]
- Serra A, Häberle B, König IR, et al.: Rare occurrence of PHOX2b mutations in sporadic neuroblastomas. J Pediatr Hematol Oncol 30 (10): 728-32, 2008.[PUBMED Abstract]
- Satgé D, Moore SW, Stiller CA, et al.: Abnormal constitutional karyotypes in patients with neuroblastoma: a report of four new cases and review of 47 others in the literature. Cancer Genet Cytogenet 147 (2): 89-98, 2003.[PUBMED Abstract]
- Mosse Y, Greshock J, King A, et al.: Identification and high-resolution mapping of a constitutional 11q deletion in an infant with multifocal neuroblastoma. Lancet Oncol 4 (12): 769-71, 2003.[PUBMED Abstract]
- Moroni I, Bedeschi F, Luksch R, et al.: Costello syndrome: a cancer predisposing syndrome? Clin Dysmorphol 9 (4): 265-8, 2000.[PUBMED Abstract]
- Cotton JL, Williams RG: Noonan syndrome and neuroblastoma. Arch Pediatr Adolesc Med 149 (11): 1280-1, 1995.[PUBMED Abstract]
- Gutmann DH, Ferner RE, Listernick RH, et al.: Neurofibromatosis type 1. Nat Rev Dis Primers 3: 17004, 2017.[PUBMED Abstract]
- Kamihara J, Bourdeaut F, Foulkes WD, et al.: Retinoblastoma and Neuroblastoma Predisposition and Surveillance. Clin Cancer Res 23 (13): e98-e106, 2017.[PUBMED Abstract]
- Bougnères P, Pantalone L, Linglart A, et al.: Endocrine manifestations of the rapid-onset obesity with hypoventilation, hypothalamic, autonomic dysregulation, and neural tumor syndrome in childhood. J Clin Endocrinol Metab 93 (10): 3971-80, 2008.[PUBMED Abstract]
- Maas SM, Vansenne F, Kadouch DJ, et al.: Phenotype, cancer risk, and surveillance in Beckwith-Wiedemann syndrome depending on molecular genetic subgroups. Am J Med Genet A 170 (9): 2248-60, 2016.[PUBMED Abstract]
- Tolbert VP, Coggins GE, Maris JM: Genetic susceptibility to neuroblastoma. Curr Opin Genet Dev 42: 81-90, 2017.[PUBMED Abstract]
- Kratz CP, Rapisuwon S, Reed H, et al.: Cancer in Noonan, Costello, cardiofaciocutaneous and LEOPARD syndromes. Am J Med Genet C Semin Med Genet 157 (2): 83-9, 2011.[PUBMED Abstract]
- Mussa A, Molinatto C, Baldassarre G, et al.: Cancer Risk in Beckwith-Wiedemann Syndrome: A Systematic Review and Meta-Analysis Outlining a Novel (Epi)Genotype Specific Histotype Targeted Screening Protocol. J Pediatr 176: 142-149.e1, 2016.[PUBMED Abstract]
- Cohn SL, Pearson AD, London WB, et al.: The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J Clin Oncol 27 (2): 289-97, 2009.[PUBMED Abstract]
- Schleiermacher G, Mosseri V, London WB, et al.: Segmental chromosomal alterations have prognostic impact in neuroblastoma: a report from the INRG project. Br J Cancer 107 (8): 1418-22, 2012.[PUBMED Abstract]
- Janoueix-Lerosey I, Schleiermacher G, Michels E, et al.: Overall genomic pattern is a predictor of outcome in neuroblastoma. J Clin Oncol 27 (7): 1026-33, 2009.[PUBMED Abstract]
- Schleiermacher G, Michon J, Ribeiro A, et al.: Segmental chromosomal alterations lead to a higher risk of relapse in infants with MYCN-non-amplified localised unresectable/disseminated neuroblastoma (a SIOPEN collaborative study). Br J Cancer 105 (12): 1940-8, 2011.[PUBMED Abstract]
- Carén H, Kryh H, Nethander M, et al.: High-risk neuroblastoma tumors with 11q-deletion display a poor prognostic, chromosome instability phenotype with later onset. Proc Natl Acad Sci U S A 107 (9): 4323-8, 2010.[PUBMED Abstract]
- Schleiermacher G, Janoueix-Lerosey I, Ribeiro A, et al.: Accumulation of segmental alterations determines progression in neuroblastoma. J Clin Oncol 28 (19): 3122-30, 2010.[PUBMED Abstract]
- Defferrari R, Mazzocco K, Ambros IM, et al.: Influence of segmental chromosome abnormalities on survival in children over the age of 12 months with unresectable localised peripheral neuroblastic tumours without MYCN amplification. Br J Cancer 112 (2): 290-5, 2015.[PUBMED Abstract]
- Pugh TJ, Morozova O, Attiyeh EF, et al.: The genetic landscape of high-risk neuroblastoma. Nat Genet 45 (3): 279-84, 2013.[PUBMED Abstract]
- Depuydt P, Boeva V, Hocking TD, et al.: Genomic Amplifications and Distal 6q Loss: Novel Markers for Poor Survival in High-risk Neuroblastoma Patients. J Natl Cancer Inst 110 (10): 1084-1093, 2018.[PUBMED Abstract]
- Ambros PF, Ambros IM, Brodeur GM, et al.: International consensus for neuroblastoma molecular diagnostics: report from the International Neuroblastoma Risk Group (INRG) Biology Committee. Br J Cancer 100 (9): 1471-82, 2009.[PUBMED Abstract]
- Kreissman SG, Seeger RC, Matthay KK, et al.: Purged versus non-purged peripheral blood stem-cell transplantation for high-risk neuroblastoma (COG A3973): a randomised phase 3 trial. Lancet Oncol 14 (10): 999-1008, 2013.[PUBMED Abstract]
- Bagatell R, Beck-Popovic M, London WB, et al.: Significance of MYCN amplification in international neuroblastoma staging system stage 1 and 2 neuroblastoma: a report from the International Neuroblastoma Risk Group database. J Clin Oncol 27 (3): 365-70, 2009.[PUBMED Abstract]
- Campbell K, Gastier-Foster JM, Mann M, et al.: Association of MYCN copy number with clinical features, tumor biology, and outcomes in neuroblastoma: A report from the Children's Oncology Group. Cancer 123 (21): 4224-4235, 2017.[PUBMED Abstract]
- Plantaz D, Vandesompele J, Van Roy N, et al.: Comparative genomic hybridization (CGH) analysis of stage 4 neuroblastoma reveals high frequency of 11q deletion in tumors lacking MYCN amplification. Int J Cancer 91 (5): 680-6, 2001.[PUBMED Abstract]
- Maris JM, Hogarty MD, Bagatell R, et al.: Neuroblastoma. Lancet 369 (9579): 2106-20, 2007.[PUBMED Abstract]
- Campbell K, Shyr D, Bagatell R, et al.: Comprehensive evaluation of context dependence of the prognostic impact of MYCN amplification in neuroblastoma: A report from the International Neuroblastoma Risk Group (INRG) project. Pediatr Blood Cancer 66 (8): e27819, 2019.[PUBMED Abstract]
- Berbegall AP, Bogen D, Pötschger U, et al.: Heterogeneous MYCN amplification in neuroblastoma: a SIOP Europe Neuroblastoma Study. Br J Cancer 118 (11): 1502-1512, 2018.[PUBMED Abstract]
- Peifer M, Hertwig F, Roels F, et al.: Telomerase activation by genomic rearrangements in high-risk neuroblastoma. Nature 526 (7575): 700-4, 2015.[PUBMED Abstract]
- Valentijn LJ, Koster J, Zwijnenburg DA, et al.: TERT rearrangements are frequent in neuroblastoma and identify aggressive tumors. Nat Genet 47 (12): 1411-4, 2015.[PUBMED Abstract]
- Cheung NK, Zhang J, Lu C, et al.: Association of age at diagnosis and genetic mutations in patients with neuroblastoma. JAMA 307 (10): 1062-71, 2012.[PUBMED Abstract]
- Molenaar JJ, Koster J, Zwijnenburg DA, et al.: Sequencing of neuroblastoma identifies chromothripsis and defects in neuritogenesis genes. Nature 483 (7391): 589-93, 2012.[PUBMED Abstract]
- Sausen M, Leary RJ, Jones S, et al.: Integrated genomic analyses identify ARID1A and ARID1B alterations in the childhood cancer neuroblastoma. Nat Genet 45 (1): 12-7, 2013.[PUBMED Abstract]
- Bresler SC, Weiser DA, Huwe PJ, et al.: ALK mutations confer differential oncogenic activation and sensitivity to ALK inhibition therapy in neuroblastoma. Cancer Cell 26 (5): 682-94, 2014.[PUBMED Abstract]
- Janoueix-Lerosey I, Lequin D, Brugières L, et al.: Somatic and germline activating mutations of the ALK kinase receptor in neuroblastoma. Nature 455 (7215): 967-70, 2008.[PUBMED Abstract]
- Oldridge DA, Truong B, Russ D, et al.: Differences in Genomic Profiles and Outcomes Between Thoracic and Adrenal Neuroblastoma. J Natl Cancer Inst 111 (11): 1192-1201, 2019.[PUBMED Abstract]
- Eleveld TF, Oldridge DA, Bernard V, et al.: Relapsed neuroblastomas show frequent RAS-MAPK pathway mutations. Nat Genet 47 (8): 864-71, 2015.[PUBMED Abstract]
- Schramm A, Köster J, Assenov Y, et al.: Mutational dynamics between primary and relapse neuroblastomas. Nat Genet 47 (8): 872-7, 2015.[PUBMED Abstract]
- Padovan-Merhar OM, Raman P, Ostrovnaya I, et al.: Enrichment of Targetable Mutations in the Relapsed Neuroblastoma Genome. PLoS Genet 12 (12): e1006501, 2016.[PUBMED Abstract]
- Bellini A, Bernard V, Leroy Q, et al.: Deep Sequencing Reveals Occurrence of Subclonal ALK Mutations in Neuroblastoma at Diagnosis. Clin Cancer Res 21 (21): 4913-21, 2015.[PUBMED Abstract]
- Kurihara S, Hiyama E, Onitake Y, et al.: Clinical features of ATRX or DAXX mutated neuroblastoma. J Pediatr Surg 49 (12): 1835-8, 2014.[PUBMED Abstract]
- Mac SM, D'Cunha CA, Farnham PJ: Direct recruitment of N-myc to target gene promoters. Mol Carcinog 29 (2): 76-86, 2000.[PUBMED Abstract]
- Wang LL, Teshiba R, Ikegaki N, et al.: Augmented expression of MYC and/or MYCN protein defines highly aggressive MYC-driven neuroblastoma: a Children's Oncology Group study. Br J Cancer 113 (1): 57-63, 2015.[PUBMED Abstract]
- Maris JM, Matthay KK: Molecular biology of neuroblastoma. J Clin Oncol 17 (7): 2264-79, 1999.[PUBMED Abstract]
- Forlenza CJ, Boudreau JE, Zheng J, et al.: KIR3DL1 Allelic Polymorphism and HLA-B Epitopes Modulate Response to Anti-GD2 Monoclonal Antibody in Patients With Neuroblastoma. J Clin Oncol 34 (21): 2443-51, 2016.[PUBMED Abstract]
- Venstrom JM, Zheng J, Noor N, et al.: KIR and HLA genotypes are associated with disease progression and survival following autologous hematopoietic stem cell transplantation for high-risk neuroblastoma. Clin Cancer Res 15 (23): 7330-4, 2009.[PUBMED Abstract]
- Erbe AK, Wang W, Carmichael L, et al.: Neuroblastoma Patients' KIR and KIR-Ligand Genotypes Influence Clinical Outcome for Dinutuximab-based Immunotherapy: A Report from the Children's Oncology Group. Clin Cancer Res 24 (1): 189-196, 2018.[PUBMED Abstract]
- Citak C, Karadeniz C, Dalgic B, et al.: Intestinal lymphangiectasia as a first manifestation of neuroblastoma. Pediatr Blood Cancer 46 (1): 105-7, 2006.[PUBMED Abstract]
- Bourdeaut F, de Carli E, Timsit S, et al.: VIP hypersecretion as primary or secondary syndrome in neuroblastoma: A retrospective study by the Société Française des Cancers de l'Enfant (SFCE). Pediatr Blood Cancer 52 (5): 585-90, 2009.[PUBMED Abstract]
- Mahoney NR, Liu GT, Menacker SJ, et al.: Pediatric horner syndrome: etiologies and roles of imaging and urine studies to detect neuroblastoma and other responsible mass lesions. Am J Ophthalmol 142 (4): 651-9, 2006.[PUBMED Abstract]
- Conte M, Parodi S, De Bernardi B, et al.: Neuroblastoma in adolescents: the Italian experience. Cancer 106 (6): 1409-17, 2006.[PUBMED Abstract]
- Matthay KK, Blaes F, Hero B, et al.: Opsoclonus myoclonus syndrome in neuroblastoma a report from a workshop on the dancing eyes syndrome at the advances in neuroblastoma meeting in Genoa, Italy, 2004. Cancer Lett 228 (1-2): 275-82, 2005.[PUBMED Abstract]
- Rudnick E, Khakoo Y, Antunes NL, et al.: Opsoclonus-myoclonus-ataxia syndrome in neuroblastoma: clinical outcome and antineuronal antibodies-a report from the Children's Cancer Group Study. Med Pediatr Oncol 36 (6): 612-22, 2001.[PUBMED Abstract]
- Antunes NL, Khakoo Y, Matthay KK, et al.: Antineuronal antibodies in patients with neuroblastoma and paraneoplastic opsoclonus-myoclonus. J Pediatr Hematol Oncol 22 (4): 315-20, 2000 Jul-Aug.[PUBMED Abstract]
- Pang KK, de Sousa C, Lang B, et al.: A prospective study of the presentation and management of dancing eye syndrome/opsoclonus-myoclonus syndrome in the United Kingdom. Eur J Paediatr Neurol 14 (2): 156-61, 2010.[PUBMED Abstract]
- Pranzatelli MR: The neurobiology of the opsoclonus-myoclonus syndrome. Clin Neuropharmacol 15 (3): 186-228, 1992.[PUBMED Abstract]
- Mitchell WG, Davalos-Gonzalez Y, Brumm VL, et al.: Opsoclonus-ataxia caused by childhood neuroblastoma: developmental and neurologic sequelae. Pediatrics 109 (1): 86-98, 2002.[PUBMED Abstract]
- Hero B, Clement N, Øra I, et al.: Genomic Profiles of Neuroblastoma Associated With Opsoclonus Myoclonus Syndrome. J Pediatr Hematol Oncol 40 (2): 93-98, 2018.[PUBMED Abstract]
- Cooper R, Khakoo Y, Matthay KK, et al.: Opsoclonus-myoclonus-ataxia syndrome in neuroblastoma: histopathologic features-a report from the Children's Cancer Group. Med Pediatr Oncol 36 (6): 623-9, 2001.[PUBMED Abstract]
- Pranzatelli MR, Tate ED, McGee NR: Demographic, Clinical, and Immunologic Features of 389 Children with Opsoclonus-Myoclonus Syndrome: A Cross-sectional Study. Front Neurol 8: 468, 2017.[PUBMED Abstract]
- Catsman-Berrevoets CE, Aarsen FK, van Hemsbergen ML, et al.: Improvement of neurological status and quality of life in children with opsoclonus myoclonus syndrome at long-term follow-up. Pediatr Blood Cancer 53 (6): 1048-53, 2009.[PUBMED Abstract]
- Connolly AM, Pestronk A, Mehta S, et al.: Serum autoantibodies in childhood opsoclonus-myoclonus syndrome: an analysis of antigenic targets in neural tissues. J Pediatr 130 (6): 878-84, 1997.[PUBMED Abstract]
- Bell J, Moran C, Blatt J: Response to rituximab in a child with neuroblastoma and opsoclonus-myoclonus. Pediatr Blood Cancer 50 (2): 370-1, 2008.[PUBMED Abstract]
- Corapcioglu F, Mutlu H, Kara B, et al.: Response to rituximab and prednisolone for opsoclonus-myoclonus-ataxia syndrome in a child with ganglioneuroblastoma. Pediatr Hematol Oncol 25 (8): 756-61, 2008.[PUBMED Abstract]
- Pranzatelli MR, Tate ED, Travelstead AL, et al.: Rituximab (anti-CD20) adjunctive therapy for opsoclonus-myoclonus syndrome. J Pediatr Hematol Oncol 28 (9): 585-93, 2006.[PUBMED Abstract]
- Ertle F, Behnisch W, Al Mulla NA, et al.: Treatment of neuroblastoma-related opsoclonus-myoclonus-ataxia syndrome with high-dose dexamethasone pulses. Pediatr Blood Cancer 50 (3): 683-7, 2008.[PUBMED Abstract]
- Pranzatelli MR, Tate ED: Dexamethasone, Intravenous Immunoglobulin, and Rituximab Combination Immunotherapy for Pediatric Opsoclonus-Myoclonus Syndrome. Pediatr Neurol 73: 48-56, 2017.[PUBMED Abstract]
- de Alarcon PA, Matthay KK, London WB, et al.: Intravenous immunoglobulin with prednisone and risk-adapted chemotherapy for children with opsoclonus myoclonus ataxia syndrome associated with neuroblastoma (ANBL00P3): a randomised, open-label, phase 3 trial. Lancet Child Adolesc Health 2 (1): 25-34, 2018.[PUBMED Abstract]
- Vik TA, Pfluger T, Kadota R, et al.: (123)I-mIBG scintigraphy in patients with known or suspected neuroblastoma: Results from a prospective multicenter trial. Pediatr Blood Cancer 52 (7): 784-90, 2009.[PUBMED Abstract]
- Yang J, Codreanu I, Servaes S, et al.: I-131 MIBG post-therapy scan is more sensitive than I-123 MIBG pretherapy scan in the evaluation of metastatic neuroblastoma. Nucl Med Commun 33 (11): 1134-7, 2012.[PUBMED Abstract]
- Sharp SE, Shulkin BL, Gelfand MJ, et al.: 123I-MIBG scintigraphy and 18F-FDG PET in neuroblastoma. J Nucl Med 50 (8): 1237-43, 2009.[PUBMED Abstract]
- Jennings RW, LaQuaglia MP, Leong K, et al.: Fetal neuroblastoma: prenatal diagnosis and natural history. J Pediatr Surg 28 (9): 1168-74, 1993.[PUBMED Abstract]
- Nuchtern JG, London WB, Barnewolt CE, et al.: A prospective study of expectant observation as primary therapy for neuroblastoma in young infants: a Children's Oncology Group study. Ann Surg 256 (4): 573-80, 2012.[PUBMED Abstract]
- Hero B, Simon T, Spitz R, et al.: Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol 26 (9): 1504-10, 2008.[PUBMED Abstract]
- Brodeur GM, Pritchard J, Berthold F, et al.: Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment. J Clin Oncol 11 (8): 1466-77, 1993.[PUBMED Abstract]
- Horner MJ, Ries LA, Krapcho M, et al.: SEER Cancer Statistics Review, 1975-2006. Bethesda, Md: National Cancer Institute, 2009. Also available online. Last accessed January 31, 2020.[PUBMED Abstract]
- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Twist CJ, Schmidt ML, Naranjo A, et al.: Maintaining Outstanding Outcomes Using Response- and Biology-Based Therapy for Intermediate-Risk Neuroblastoma: A Report From the Children's Oncology Group Study ANBL0531. J Clin Oncol 37 (34): 3243-3255, 2019.[PUBMED Abstract]
- Strother DR, London WB, Schmidt ML, et al.: Outcome after surgery alone or with restricted use of chemotherapy for patients with low-risk neuroblastoma: results of Children's Oncology Group study P9641. J Clin Oncol 30 (15): 1842-8, 2012.[PUBMED Abstract]
- Baker DL, Schmidt ML, Cohn SL, et al.: Outcome after reduced chemotherapy for intermediate-risk neuroblastoma. N Engl J Med 363 (14): 1313-23, 2010.[PUBMED Abstract]
- Schmidt ML, Lukens JN, Seeger RC, et al.: Biologic factors determine prognosis in infants with stage IV neuroblastoma: A prospective Children's Cancer Group study. J Clin Oncol 18 (6): 1260-8, 2000.[PUBMED Abstract]
- Mazzocco K, Defferrari R, Sementa AR, et al.: Genetic abnormalities in adolescents and young adults with neuroblastoma: A report from the Italian Neuroblastoma group. Pediatr Blood Cancer 62 (10): 1725-32, 2015.[PUBMED Abstract]
- Chen I, Pasalic D, Fischer-Valuck B, et al.: Disparity in Outcomes for Adolescent and Young Adult Patients Diagnosed With Pediatric Solid Tumors Across 4 Decades. Am J Clin Oncol 41 (5): 471-475, 2018.[PUBMED Abstract]
- Mossé YP, Deyell RJ, Berthold F, et al.: Neuroblastoma in older children, adolescents and young adults: a report from the International Neuroblastoma Risk Group project. Pediatr Blood Cancer 61 (4): 627-35, 2014.[PUBMED Abstract]
- Kushner BH, Kramer K, LaQuaglia MP, et al.: Neuroblastoma in adolescents and adults: the Memorial Sloan-Kettering experience. Med Pediatr Oncol 41 (6): 508-15, 2003.[PUBMED Abstract]
- Suzuki M, Kushner BH, Kramer K, et al.: Treatment and outcome of adult-onset neuroblastoma. Int J Cancer 143 (5): 1249-1258, 2018.[PUBMED Abstract]
- Kubota M, Suita S, Tajiri T, et al.: Analysis of the prognostic factors relating to better clinical outcome in ganglioneuroblastoma. J Pediatr Surg 35 (1): 92-5, 2000.[PUBMED Abstract]
- Peuchmaur M, d'Amore ES, Joshi VV, et al.: Revision of the International Neuroblastoma Pathology Classification: confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma, nodular. Cancer 98 (10): 2274-81, 2003.[PUBMED Abstract]
- Isaacs H: Fetal and neonatal neuroblastoma: retrospective review of 271 cases. Fetal Pediatr Pathol 26 (4): 177-84, 2007 Jul-Aug.[PUBMED Abstract]
- Ikeda H, Iehara T, Tsuchida Y, et al.: Experience with International Neuroblastoma Staging System and Pathology Classification. Br J Cancer 86 (7): 1110-6, 2002.[PUBMED Abstract]
- Teshiba R, Kawano S, Wang LL, et al.: Age-dependent prognostic effect by Mitosis-Karyorrhexis Index in neuroblastoma: a report from the Children's Oncology Group. Pediatr Dev Pathol 17 (6): 441-9, 2014 Nov-Dec.[PUBMED Abstract]
- Vo KT, Matthay KK, Neuhaus J, et al.: Clinical, biologic, and prognostic differences on the basis of primary tumor site in neuroblastoma: a report from the international neuroblastoma risk group project. J Clin Oncol 32 (28): 3169-76, 2014.[PUBMED Abstract]
- Hiyama E, Yokoyama T, Hiyama K, et al.: Multifocal neuroblastoma: biologic behavior and surgical aspects. Cancer 88 (8): 1955-63, 2000.[PUBMED Abstract]
- Monclair T, Brodeur GM, Ambros PF, et al.: The International Neuroblastoma Risk Group (INRG) staging system: an INRG Task Force report. J Clin Oncol 27 (2): 298-303, 2009.[PUBMED Abstract]
- Burchill SA, Lewis IJ, Abrams KR, et al.: Circulating neuroblastoma cells detected by reverse transcriptase polymerase chain reaction for tyrosine hydroxylase mRNA are an independent poor prognostic indicator in stage 4 neuroblastoma in children over 1 year. J Clin Oncol 19 (6): 1795-801, 2001.[PUBMED Abstract]
- Seeger RC, Reynolds CP, Gallego R, et al.: Quantitative tumor cell content of bone marrow and blood as a predictor of outcome in stage IV neuroblastoma: a Children's Cancer Group Study. J Clin Oncol 18 (24): 4067-76, 2000.[PUBMED Abstract]
- Bochennek K, Esser R, Lehrnbecher T, et al.: Impact of minimal residual disease detection prior to autologous stem cell transplantation for post-transplant outcome in high risk neuroblastoma. Klin Padiatr 224 (3): 139-42, 2012.[PUBMED Abstract]
- Yanik GA, Parisi MT, Shulkin BL, et al.: Semiquantitative mIBG scoring as a prognostic indicator in patients with stage 4 neuroblastoma: a report from the Children's oncology group. J Nucl Med 54 (4): 541-8, 2013.[PUBMED Abstract]
- Yanik GA, Parisi MT, Naranjo A, et al.: Validation of Postinduction Curie Scores in High-Risk Neuroblastoma: A Children's Oncology Group and SIOPEN Group Report on SIOPEN/HR-NBL1. J Nucl Med 59 (3): 502-508, 2018.[PUBMED Abstract]
- George RE, Perez-Atayde AR, Yao X, et al.: Tumor histology during induction therapy in patients with high-risk neuroblastoma. Pediatr Blood Cancer 59 (3): 506-10, 2012.[PUBMED Abstract]
- Bagatell R, McHugh K, Naranjo A, et al.: Assessment of Primary Site Response in Children With High-Risk Neuroblastoma: An International Multicenter Study. J Clin Oncol 34 (7): 740-6, 2016.[PUBMED Abstract]
- Nickerson HJ, Matthay KK, Seeger RC, et al.: Favorable biology and outcome of stage IV-S neuroblastoma with supportive care or minimal therapy: a Children's Cancer Group study. J Clin Oncol 18 (3): 477-86, 2000.[PUBMED Abstract]
- Ambros PF, Brodeur GM: Concept of tumorigenesis and regression. In: Brodeur GM, Sawada T, Tsuchida Y: Neuroblastoma. New York, NY: Elsevier Science, 2000, pp 21-32.[PUBMED Abstract]
- Hiyama E, Hiyama K, Yokoyama T, et al.: Correlating telomerase activity levels with human neuroblastoma outcomes. Nat Med 1 (3): 249-55, 1995.[PUBMED Abstract]
- Hiyama E, Reynolds CP: Telomerase as a biological and prognostic marker in neuroblastoma. In: Brodeur GM, Sawada T, Tsuchida Y: Neuroblastoma. New York, NY: Elsevier Science, 2000, pp 159-174.[PUBMED Abstract]
- Kitanaka C, Kato K, Ijiri R, et al.: Increased Ras expression and caspase-independent neuroblastoma cell death: possible mechanism of spontaneous neuroblastoma regression. J Natl Cancer Inst 94 (5): 358-68, 2002.[PUBMED Abstract]
- Brodeur GM, Minturn JE, Ho R, et al.: Trk receptor expression and inhibition in neuroblastomas. Clin Cancer Res 15 (10): 3244-50, 2009.[PUBMED Abstract]
- Yamamoto K, Ohta S, Ito E, et al.: Marginal decrease in mortality and marked increase in incidence as a result of neuroblastoma screening at 6 months of age: cohort study in seven prefectures in Japan. J Clin Oncol 20 (5): 1209-14, 2002.[PUBMED Abstract]
- Okazaki T, Kohno S, Mimaya J, et al.: Neuroblastoma detected by mass screening: the Tumor Board's role in its treatment. Pediatr Surg Int 20 (1): 27-32, 2004.[PUBMED Abstract]
- Fritsch P, Kerbl R, Lackner H, et al.: "Wait and see" strategy in localized neuroblastoma in infants: an option not only for cases detected by mass screening. Pediatr Blood Cancer 43 (6): 679-82, 2004.[PUBMED Abstract]
- 神経芽腫瘍の細胞分類
-
神経芽腫は小児期の青色小型円形細胞腫瘍の1つに分類される。神経芽腫は、これらの腫瘍のさまざまな悪性度を反映して、成熟した神経節腫から成熟度が低い神経節芽腫や未熟な神経芽腫まで多様な分化度をもつ細胞の集合体で構成される不均一な腫瘍グループである。[ 1 ]
神経芽腫には2つの細胞分類システムがある:
国際神経芽腫病理学分類(INPC:International Neuroblastoma Pathology Classification)システム
INPCシステムは元のShimada分類での経験から導き出されたものであり、表1ではこの2つの分類システムが比較されている。INPCでは、治療前に採取した腫瘍標本を以下の形態学的特徴について評価する:[ 2 ][ 3 ][ 4 ][ 5 ][ 6 ]
- シュワンストローマの量。
- 神経芽腫細胞の成熟度。
- 神経芽腫細胞の有糸分裂-核崩壊指数。
これらの組織学的パラメータと患者の年齢に基づいて、予後良好および予後不良が決定される。この分類システムの予後的意義も、ほぼ同じ基準を用いる他の分類システムの予後的意義も、数件の研究により確認されている(表1を参照のこと)。[ 2 ][ 3 ][ 4 ][ 6 ]
表1.国際神経芽腫病理学分類(Shimada分類)に従った神経芽腫瘍の予後評価a 国際神経芽腫病理学分類 元のShimada分類 予後グループ MKI = 有糸分裂-核崩壊指数。 a許可を得て転載。Copyright © 1999 American Cancer Society.All rights reserved.[ 2 ]Hiroyuki Shimada, Inge M. Ambros, Louis P. Dehner, Jun-ichi Hata, Vijay V. Joshi, Borghild Roald, Daniel O. Stram, Robert B. Gerbing, John N. Lukens, Katherine K. Matthay, Robert P. Castleberry, The International Neuroblastoma Pathology Classification (the Shimada System), Cancer, volume 86, issue 2, pages 364-72. b神経芽腫の亜型については別に詳述している。[ 7 ] cまれな亜型で、特にこの年齢グループで診断される。さらなる調査と分析が必要である。 dこれらの腫瘍カテゴリーに対する予後のグループ分けは患者の年齢と関係しない。 神経芽腫: (シュワンストローマ減少型)b ストローマ減少型 予後良好: 予後良好 予後良好 1.5歳未満 低分化型または分化型&MKIが低度または中等度の腫瘍 1.5~5歳 分化型&MKIが低度の腫瘍 予後不良: 予後不良 予後不良 1.5歳未満 a)未分化型腫瘍c b)MKIが高度の腫瘍 1.5~5歳 a)未分化型または低分化型腫瘍 b)MKIが中等度または高度の腫瘍 5歳以上 すべての腫瘍 神経節芽腫、混在型 (シュワンストローマ豊富型) ストローマ豊富混在型(予後良好) 予後良好d 神経節腫: (シュワンストローマ優位型) 成熟途中型 高分化型(予後良好) 予後良好d 成熟型 神経節腫 神経節芽腫、結節型 (シュワンストローマ豊富型/ストローマ優位型およびストローマ減少型の複合) ストローマ豊富結節型(予後不良) 予後不良d INPCシステムでMYCN増幅が認められるほとんどの神経芽腫もまた予後不良な組織像を有するが、約7%は予後良好な組織像を有する。MYCN増幅および予後良好な組織像が認められる神経芽腫患腫瘍のうち、ほとんどは遺伝子が増幅しているにもかかわらずMYCNを発現しておらず、これらの患児は腫瘍がMYCNを発現している患児よりも予後良好である。[ 8 ]
国際神経芽腫リスクグループ(INRG:International Neuroblastoma Risk Group)の分類システム
INRGでは、さまざまな臨床試験から得た8,800人以上の神経芽腫患者を対象に、サバイバルツリー解析を用いて35の予後因子を比較した。この分析には、以下のINPC(Shimada分類)の組織学的因子が含められた:[ 9 ][ 10 ]
- 診断カテゴリー。
- 分化度。
- 有糸分裂-核崩壊指数。
患者の年齢はすべてのリスク層別化システムに用いられるため、患者の年齢を用いなかった細胞分類システムは望ましく、最後の決定木にはINPCまたはShimada分類よりもむしろ基礎にある組織学的基準が用いられた。表2に示すように、2つの患者サブセットにおける予後グループは、組織学的所見によって最も明確に区別された。
表2.国際神経芽腫リスクグループによる神経芽腫患者サブセットの組織学的識別a INSS病期/組織学的亜型 症例数 EFS(%) OS(%) EFS = イベントフリー生存率;GN = 神経節腫;GNB = 神経節芽腫;INSS = 神経芽腫国際病期分類システム;NB = 神経芽腫;OS = 全生存率。 a出典:Cohn et al.[ 9 ] INSS 1期、2期、3期、4S期 5,131 83 ± 1 91 ± 1 GN、成熟途中型 162 97 ± 2 98 ± 2 GNB、混在型 NB 4,970 83 ± 1 90 ± 1 GNB、結節型 INSS 2期、3期;年齢が1歳半超 260 69 ± 3 81 ± 2 11qが正常で高分化型 16 80 ± 16 100 11qが異常で未分化型 49 61 ± 11 73 ± 11 INRG組織型亜型がINRGリスク分類スキームに組み入れられている。(詳しい情報については、本要約の神経芽腫に対する治療法選択肢の概要のセクションの表6を参照のこと。)
参考文献- Joshi VV, Silverman JF: Pathology of neuroblastic tumors. Semin Diagn Pathol 11 (2): 107-17, 1994.[PUBMED Abstract]
- Shimada H, Ambros IM, Dehner LP, et al.: The International Neuroblastoma Pathology Classification (the Shimada system). Cancer 86 (2): 364-72, 1999.[PUBMED Abstract]
- Shimada H, Umehara S, Monobe Y, et al.: International neuroblastoma pathology classification for prognostic evaluation of patients with peripheral neuroblastic tumors: a report from the Children's Cancer Group. Cancer 92 (9): 2451-61, 2001.[PUBMED Abstract]
- Goto S, Umehara S, Gerbing RB, et al.: Histopathology (International Neuroblastoma Pathology Classification) and MYCN status in patients with peripheral neuroblastic tumors: a report from the Children's Cancer Group. Cancer 92 (10): 2699-708, 2001.[PUBMED Abstract]
- Peuchmaur M, d'Amore ES, Joshi VV, et al.: Revision of the International Neuroblastoma Pathology Classification: confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma, nodular. Cancer 98 (10): 2274-81, 2003.[PUBMED Abstract]
- Teshiba R, Kawano S, Wang LL, et al.: Age-dependent prognostic effect by Mitosis-Karyorrhexis Index in neuroblastoma: a report from the Children's Oncology Group. Pediatr Dev Pathol 17 (6): 441-9, 2014 Nov-Dec.[PUBMED Abstract]
- Shimada H, Ambros IM, Dehner LP, et al.: Terminology and morphologic criteria of neuroblastic tumors: recommendations by the International Neuroblastoma Pathology Committee. Cancer 86 (2): 349-63, 1999.[PUBMED Abstract]
- Suganuma R, Wang LL, Sano H, et al.: Peripheral neuroblastic tumors with genotype-phenotype discordance: a report from the Children's Oncology Group and the International Neuroblastoma Pathology Committee. Pediatr Blood Cancer 60 (3): 363-70, 2013.[PUBMED Abstract]
- Cohn SL, Pearson AD, London WB, et al.: The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J Clin Oncol 27 (2): 289-97, 2009.[PUBMED Abstract]
- Okamatsu C, London WB, Naranjo A, et al.: Clinicopathological characteristics of ganglioneuroma and ganglioneuroblastoma: a report from the CCG and COG. Pediatr Blood Cancer 53 (4): 563-9, 2009.[PUBMED Abstract]
- 神経芽腫の病期情報
-
病期評価
神経芽腫患者の約70%に、診断時に転移巣がみられる。治療開始前に転移性疾患の徹底的な評価が実施される。典型的には、以下の検査が実施される:[ 1 ]
メタヨードベンジルグアニジン(MIBG)スキャン
転移病変の拡がりは、軟部組織、骨髄、および皮質骨を含む、あらゆる部位の病変に適用可能なMIBGスキャンを用いて評価される。神経芽腫の約90%でMIBGの集積が認められる。MIBGスキャンの感度および特異度は90~99%であり、MIBGの結合活性は原発部位と転移部位とで等しく分布する。[ 2 ]ヨウ素123(123I)の半減期は比較的短いが、放射線量が低く、画像品質が優れており、甲状腺への毒性が低く、コストが低いため、131Iよりも好ましい。
123I-MIBGを用いる画像検査は軟部組織転移および骨転移の確認に最適であり、1件のプロスペクティブ試験による比較ではポジトロン放射断層撮影-コンピュータ断層撮影(PET-CT)よりも優れていることが示された。[ 3 ]132人の神経芽腫小児を対象にしたレトロスペクティブ・レビューにおいて、99mテクネチウム(Tc)-メチレンジホスホン酸(99mTc-MDP)による骨シンチグラフィでは、123I-MIBGまたはPETスキャンを用いて決定された疾患の病期または臨床管理を変更しうる転移性病変の特有の部位は同定できなかった。骨スキャンはほとんどの症例で省略できると結論付けられた。[ 4 ]
診断時に実施されたベースラインのMIBGスキャンは、疾患の反応をモニタリングし、治療後のサーベイランスを実施する上で非常に優れた方法となる。[ 5 ]神経芽腫を新たに診断された患者60人において123I-MIBGとPETスキャンを一組にした場合のレトロスペクティブ分析により、神経芽腫国際病期分類システム(INSS)1期および2期患者に対するPETは原発腫瘍の範囲の測定で優れており、残存腫瘤検出の感度が高いことが実証された。対照的に、4期疾患に対する123I-MIBG画像検査法は、骨髄および骨転移の検出に優れていた。[ 6 ]
Curieスコア法およびSIOPENスコア法
疾患の範囲および予後的価値を評価するために複数のグループで半定量的なスコアリング方法が研究されている。疾患の範囲および反応の評価に最も一般的に用いられているスコアリング方法は、Curie法とInternational Society of Paediatric Oncology Europe Neuroblastoma(SIOPEN)法である。
-
Curieスコア法:CurieスコアはMIBGの集積が認められる腫瘍の範囲と重症度を予測するために開発された半定量的なスコアリングシステムである。MIBGの集積が認められる4期高リスク神経芽腫を新たに診断され、小児腫瘍学グループ(COG)のプロトコル、COG-A3973(NCT00004188)で治療された患者(N = 280)を対象に反応および生存に対する予後マーカーとして、Curieスコアリングシステムの使用が評価された。MYCNの増幅のない神経芽腫患者について、寛解導入化学療法後の2超のCurieスコアは、神経芽腫に対するこの他の既知の臨床的および生物学的因子(年齢、MYCN状態、倍数性、有糸分裂-核崩壊指数、組織学的悪性度など)とは関係なく、イベントのより高いリスクに関連した。[
7
]MYCNが増幅していた腫瘍を有する患者について、導入療法後の0を超えるCurieスコアは不良な転帰に関連した。
導入療法後のCurieスコアの予後的意義が独立した患者コホートで確認されている。[ 8 ]SIOPEN/HR-NBL1(NCT00030719)試験でプロスペクティブに登録された高リスク患者から得られた123I-MIBGスキャンのCurieスコアリングに関するレトロスペクティブ研究が実施された。10ヵ所の解剖学的部位のスキャンが評価され、各部位は病変の範囲に基づいて0~3点が付けられ、累積Curieスコアが生成された。SIOPEN/HR-NBL1において、診断時Curieスコアの予後に関する最適なカットポイントは12で、Curieスコアにより治療成績に有意な差が示された(5年イベントフリー生存[EFS]率、43.0% ± 5.7%[Curieスコア ≤ 12] vs 21.4% ± 3.6%[Curieスコア > 12]、P < 0.0001)。SIOPEN/HR-NBL1において、寛解導入化学療法後のCurieスコアの最適なカットポイントは2で、寛解導入後の2を超えるCurieスコアは不良な転帰に関連した(5年EFS率、39.2% ± 4.7%[Curieスコア ≤ 2] vs 16.4% ± 4.2%[Curieスコア > 2]、P < 0.0001)。Coxモデルにおいて寛解導入後のCurieスコアは、年齢およびMYCN遺伝子コピー数の共変量で調整した場合も独立した統計的有意性を維持した。[ 8 ]
- SIOPENスコア法:SIOPENでは独自にMIBGスキャンスコアリングシステムを開発しており、このシステムではCurieスコアリングシステムと比較して身体を10区域ではなく12区域に分割し、各区域におけるMIBGの取り込みを4段階ではなく6段階に割り付けている。[ 9 ]その後、SIOPENスコアリングシステムは、2件目の大規模臨床試験からのデータを用いて独立して妥当性が確認された。[ 10 ]
ドイツのPediatric Oncology Groupにより、1歳を超える4期神経芽腫患者58人を対象にした1件のレトロスペクティブ研究において、Curieスコア法とSIOPENスコア法の予後的価値が比較された。これらは、非常に類似した結果を示した。診断時の2以下のCurieスコアと診断時の4以下のSIOPENスコア(最良のカットオフ)は、これより高いスコアを用いた場合よりも有意に良好なEFS率および全生存(OS)率と相関していた。4サイクルの寛解導入化学療法後、SIOPENおよびCurieスコアリングにより完全奏効が示された患者では、転移病変において取り込みが残存する患者よりも治療成績が良好であったが、4~6サイクルの化学療法中にMIBG陽性転移のその後の消失は予後に影響しなかった。[ 11 ]
引用された臨床試験には、移植および免疫療法後のCurieスコアまたはSIOPENスコアによる寛解導入療法後の評価が含まれなかったが、そうした評価に伴うカットオフおよび転帰は導入療法前および導入療法後のスコアと異なる可能性がある。
ポジトロン放射断層撮影(PET)スキャン
MIBGが集積しない腫瘍を有する患者における疾患の範囲の評価にはフッ素18-フルデオキシグルコースPETスキャンが使用される。[ 6 ]
この他の病期分類検査および手技
神経芽腫の病期分類に用いられるこの他の検査および手技には以下のものがある:
- 骨髄穿刺および骨髄生検:骨髄転移を除外するため、両側腸骨稜の骨髄穿刺吸引および骨髄生検(コア生検)により骨髄が評価される。十分に評価するためには、コア生検の標本に骨髄が少なくとも1cm以上(軟骨を除く)含まれていなければならない。COG研究の多くが、2回のコア生検および2回の穿刺吸引を必要とする。他の検査で1期の腫瘍には骨髄の採取が不要な場合がある。[ 12 ]
- リンパ節の評価:触知可能なリンパ節は臨床的に検査し、疾患の範囲を評価するためにINSS病期分類を用いる場合は組織学的な確認が行われる。[ 1 ]身体診察では容易に同定できない領域のリンパ節の評価にはCT、磁気共鳴画像法(MRI)、または両方が用いられる。国際神経芽腫リスクグループ(INRG)病期分類システムではリンパ節の評価を必要としないが、リンパ節腫瘤は画像で明らかにされた危険因子(IDRF)に影響する場合がある(IDRFの一覧[元のIDRFおよびCOGのIDRF]を参照のこと)。
-
CTおよびMRIスキャン:
- 原発腫瘍と潜在的なリンパ節ドレナージ部位の三次元(3-D)画像検査は、胸部、腹部、および骨盤のCTスキャンおよび/またはMRIスキャンを用いて実施される。次善手段として、超音波検査も精密な三次元測定の実施に適していると一般的に考えられている。
- 傍脊椎腫瘍は、神経孔を通って進展し、脊髄を圧迫しうる。したがって、傍脊椎腫瘍に隣接する脊椎のMRIが病期評価の一部として含まれる。
- 脳/眼窩のCTおよび/またはMRIスキャンは、診察および/またはMIBGスキャンでの取り込みで臨床的に適応があれば実施される。
診断時に中枢神経系(CNS)転移が存在することはまれであり[ 13 ]、腰椎穿刺は、その後のCNS転移発生率の上昇に関係しうるため、避けられる。[ 14 ]
神経芽腫国際病期分類システム
神経芽腫国際病期分類システム(INSS)
INSSは、以前用いられていたEvansおよびPediatric Oncology Group病期分類システムのそれぞれから特定の特徴を組み合わせており[ 1 ][ 15 ]、表3で記載されている。このシステムは、疾患の病期分類とリスク層別化を世界的に一致させる第一段階となった。INSSは、1988年に開発された外科的病期分類システムであり、患者の病期判定において切除の範囲を評価するために用いられる。このため、異なる国では手術戦略の地域差から、そして経験を積んだ小児外科医の参加に制約がある可能性から病期の割り付けに若干のばらつきが生じた。神経芽腫の生物学および遺伝学に関する理解がさらに進んだ結果、COG研究のリスクグループと治療割り付けを容易にするため、INSS病期に加えて臨床的および生物学的因子を組み込んだリスク分類システムが開発された。[ 1 ][ 15 ][ 16 ][ 17 ]
表3.神経芽腫国際病期分類システム(INSS) 病期/予後グループ 記述 MIBG = メタヨードベンジルグアニジン。 1期 腫瘍は限局性で、肉眼的に完全切除されており、顕微鏡的腫瘍残存の有無は問わない;代表的な同側リンパ節に顕微鏡的転移を認めない(すなわち、原発巣に所属したリンパ節で原発巣とともに切除されたものには、転移を認めてもよい)。 2A期 腫瘍は限局性であるが、肉眼的に完全切除されていない;原発巣に付着していない代表的な同側リンパ節に顕微鏡的転移を認めない。 2B期 腫瘍は限局性で、肉眼的に完全切除されている、またはされておらず、原発巣に付着していない同側リンパ節に転移を認める。腫大している対側リンパ節に顕微鏡的転移があってはならない。 3期 切除不能な片側性腫瘍が正中線を越えて浸潤しており、所属リンパ節転移の有無は問わない;または、腫瘍は限局性かつ片側性であり、対側所属リンパ節に転移を認める;または、腫瘍は正中線上にあり、浸潤により両側に拡がっている(切除不能)か、あるいはリンパ節転移により両側に波及している。ここで、正中線とは脊柱と定義する。左右いずれかに原発して正中線を越えた腫瘍とは、脊柱の対側に浸潤したか、または脊柱の対側を越えて転移したものである。 4期 原発巣の状態は問わず、遠隔リンパ節、骨、骨髄、肝、皮膚、および/またはその他の臓器に播種を認める(4S期とされるものを除く)。 4S期 原発巣は1期、2A期、または2B期と定義される限局性であるが、皮膚、肝、および/または骨髄に限定した播種を認める(定義上、生後12ヵ月未満の幼児に限る)。[ 18 ]骨髄転移はごくわずかでなければならない(すなわち、骨生検または骨髄穿刺により悪性であることが同定された細胞が全有核細胞の10%未満)。より広範な骨髄転移が認められれば、4期と考える。MIBGスキャンの結果(実施した場合)は、骨髄病変陰性でなければならない。 INSSを組み入れたCOGの神経芽腫リスク分類は、本要約の神経芽腫に対する治療法選択肢の概要セクションの表6に記載されている。
INRGのデータベースからの研究で、リンパ節にのみ遠隔転移が認められ(4N期と呼ばれる)、腫瘍の生物学的特性が良好で、治療成績の良い(5年OS率、85%)傾向がある患者146人が同定され、それほど強力ではない治療法を検討できることが示唆されている。[ 19 ]
国際神経芽腫リスクグループの病期分類システム(INRGSS)
COGによるINSSの最後の使用は中リスクのANBL0531(NCT00499616)研究であり、この研究は2014年に終了した。その後の研究ではINRGSSが用いられている。INRGSSは、特にINRGの分類システムのために開発された術前の病期分類システムである(表4を参照のこと)。この病期分類システムは、進行中のCOGおよびSIOPEN臨床試験ではINSSに取って代わっている。疾患の範囲は、診断時、治療または手術前にIDRFおよび/または転移性腫瘍の有無で決定される。IDRFは、画像検査で発見された外科的危険因子で、診断時の腫瘍の全切除を潜在的にリスクのあるまたは困難なものにし、外科的合併症のリスクを高めうる。
表4.国際神経芽腫リスクグループの病期分類システムa 病期 記述 IDRF = 画像で明らかにされた危険因子;INSS = 神経芽腫国際病期分類システム。 a出典:Monclair et al.[ 20 ];[ 21 ] L1 IDRFの一覧aで定義された重要臓器への転移が認められない限局性腫瘍で、身体の1つの区画に限局している。 L2 IDRFが1つ以上認められる局所領域腫瘍。a M 遠隔転移疾患(MS期を除く)。 MS 生後18ヵ月未満の小児における転移性疾患で、転移は皮膚、肝臓、および/または骨髄に限定される。原発腫瘍はINSS 1期、2期、または3期の場合がある。 元の文献で定義されているIDRFには以下のものがある:[ 20 ][ 22 ]
- 次のように身体の2つの区画に同側腫瘍が進展している:頸部および胸部;胸部および腹部;腹部および骨盤。
- 次の隣接臓器/組織への浸潤:心膜、横隔膜、腎臓、肝臓、膵十二指腸部、腸間膜。
- 腫瘍による次の大血管への浸潤:椎骨動脈、内頸静脈、鎖骨下血管、頸動脈、大動脈、大静脈、胸部大血管、上腸間膜動脈根部および腹腔動脈の枝、腸骨血管。
- 気管または中枢気管支の圧迫。
- 腕神経叢への浸潤。
- 肝門部または肝十二指腸間膜への浸潤。
- 肋椎関節T9~T12間への浸潤。
- 坐骨切痕を越える腫瘍。
- 腎茎に浸潤している腫瘍。
- 頭蓋底への腫瘍進展。
- 脊柱管の3分の1を超えて浸潤している、クモ膜下腔が消滅している、または脊髄MRI信号が異常を示すほどの髄腔内腫瘍進展。
COGのIDRFでは解剖学的位置決定アプローチが用いられており、以下のものがある:[ 21 ][ 23 ];[ 22 ][証拠レベル:3iiiC]
- 頸部/頸胸椎移行部:腕神経叢、鎖骨下血管および/または椎骨動脈および/または頸動脈、内頸静脈、頭蓋底に拡がっている/巻き込んでいる腫瘍;気管を圧迫している腫瘍。
- 胸部:大動脈および/または大分枝に拡がっている/巻き込んでいる腫瘍;気管および/または主気管支を圧迫している腫瘍;肋椎関節T9~T12間へ浸潤している縦隔下部の腫瘍。
- 胸腹部:大動脈および/または大静脈に拡がっている/巻き込んでいる腫瘍。
- 腹部/骨盤:肝門部および/または肝十二指腸間膜、上腸間膜動脈根部、腹腔動脈幹起始部、および/または上腸間膜動脈起始部に拡がっている/巻き込んでいる腫瘍;片側または両側腎茎部、大動脈および/または大静脈に拡がっている/巻き込んでいる腫瘍;腸骨血管に拡がっている/巻き込んでいる腫瘍;坐骨切痕に拡がっている/巻き込んでいる骨盤腫瘍。
- 髄腔内腫瘍進展:横断面で脊柱管の3分の1を超えて浸潤しているおよび/または脊髄周囲のクモ膜下腔が消滅している、腹部脊髄信号が異常を示す;脊髄圧迫の症状を伴う砂時計腫瘍。
- 次の隣接臓器/組織への局所転移/浸潤:心膜、横隔膜、腎臓、肝臓、膵十二指腸部、腸間膜など。
- 次のように身体の2つの区画に腫瘍が拡がっている:頸部および胸部;胸部および腹部;腹部および骨盤。
- IDRFではなく、記録された患者の状態:多病巣性の、胸水、腹水。
外科的切除可能性の評価にIDRFを含めるべきである。IDRFが多くなるほど、手術による合併症が強く、完全切除の可能性が低くなる。
INSS 3期神経芽腫でMYCNの増幅が認められない1歳を超える患者143人からのデータを調査した2001年から2006年のヨーロッパのUnresectable Neuroblastoma試験におけるレトロスペクティブ研究で認められたように、IDRFを取り除く上で術前補助化学療法は必ずしも有効ではない。すべての患者が切除不能腫瘍と考えられる外科的危険因子を有していた。中央診断で確定されたサブセットにおいて、国際神経芽腫病理学分類(International Neuroblastoma Pathology Classification)で予後不良な組織像が53%の患者で明らかにされた。診断時に、228個のIDRFが確認された。[ 23 ];[ 24 ][証拠レベル:3iiA]
- カルボプラチン/エトポシドとビンクリスチン/シクロホスファミド/ドキソルビシンを交互に投与する4サイクルの化学療法後、IDRFの消失を示した患者はわずか32.2%であり、49%の患者ではIDRFに変化がなく、18.8%の患者では新たなIDRFが発生した。
- IDRFが減少したまたは消失した患者の71.2%で完全切除が可能であった。IDRFが減少したまたは消失した患者の84%(44人中37人)で、完全切除またはほぼ完全な切除が達成された。IDRFが安定していた患者の70%(56人中39人)および新たなIDRFが発生した患者の52%(25人中13人)で、完全切除またはほぼ完全な切除が達成された。
- 化学療法に対するIDRFの反応および外科的治療成績に基づいたEFSまたはOSにおける有意差は観察されなかった。手術前のIDRFの種類と切除範囲間で関連は認められなかった。
- 腫瘍が上腸間膜動脈および/または腹腔動脈幹に巻きついていた場合、(おそらくこの領域では完全切除の達成が困難なため)無病生存(DFS)およびOSが影響を受けた。
- 5コースを超える化学療法の延長はIDRF減少の役に立たず、DFSおよびOSの低下につながった。
INRGSSはこの病期分類システムを診断時の他の複数の変数を用いたリスク分類システムに組み入れている。[ 25 ](詳しい情報については、本要約の神経芽腫に対する治療法選択肢の概要のセクションの表6を参照のこと。)
INRGSSでは病期をL1期、L2期、M期、またはMS期に単純化している(詳しい情報については、表4およびIDRFの一覧[元のIDRFおよびCOGのIDRF]を参照のこと)。限局性腫瘍は、20個のIDRFのうち1つ以上認められるかという基準に基づいてL1期またはL2期疾患として分類される。[ 20 ]例えば、脊髄圧迫が認められる症例では、横断面で脊柱管の3分の1を超えて浸潤が認められる場合、クモ膜下腔が描出不可能な場合、または脊髄の磁気共鳴信号強度が異常な場合に、IDRFが1つ認められる。INRG共同研究ではまた、診断時と治療後の両方で骨髄における神経芽腫を発見し、定量化するための技術も定義されている。骨髄転移病変の定量化により、治療に対する反応のより正確な評価が行えるようになる可能性があるが、臨床試験にはまだ適用されていない。[ 26 ]
INRG Task Forceによる4S疾患カテゴリーを新たなMS定義のカテゴリーに置き換える決定は、L2原発腫瘍および4S転移パターンを有する少数の乳児(生後12~18ヵ月の患者を含む)は良好な転帰を有するという報告に基づいていた。[ 18 ][ 20 ]その後、実際のINRGデータの研究により、多くの生物学的特性からMS期患者(生後12~18ヵ月)の不良な転帰が予測されること、および予後良好な生物学的特性を有する乳児のみが従来の4S診断を受けた小児と同等の長期の転帰を有することが明らかにされた。[ 18 ]
INRGSS、術前の画像で明らかにされたIDRF、および生物学的因子を組み合わせることで、各患者は、転帰を予測して適切な治療アプローチを指示するリスク病期に割り当てられる。予めINSS病期が決定しておりMYCNの増幅が認められない限局性神経芽腫を対象にした以下のレトロスペクティブ研究でINRGSSの妥当性が調査された:
- 最初の研究では、SIOPEN試験からのデータが用いられ、INSS 1期(21%)、2期(45%)、および3期(94%)患者においてL2腫瘍が明らかにされた。INRGSSは転帰に対する予測値を示しており、L1期での5年EFS率は90%、OS率は96%であったのに対し、L2期ではEFS率が79%、OS率が89%であった。[ 20 ]
- 2番目の研究では、ヨーロッパの多施設研究、LNESG1(1995年から1999年に初回手術とその後に観察を行う試験)からのデータが用いられ、291人の小児がL1腫瘍を有し、全員が初回手術を受けた。L2患者のうち、118人が初回手術を受けたが、125人は手術を受けなかった(後者のグループの106人は術前補助化学療法を受けた)。[
27
]
- 5年EFS率およびOS率は、L1群で92%および98%で、初回手術を受けたL2群では86%および95%、初回手術を受けなかったL2群では73%および83%であった。
- 注目すべきことに、L2期腫瘍の患児の多くが初回手術を受けており、初回の外科的手技として生検のみを受けた患児より有意に優れた転帰を得た(5年OS率、93% vs 83%)。一次切除が実施されたL2腫瘍は、リスクが比較的低い切除可能性について選択された可能性がある。しかしながら、これらの患児では手術合併症の発生率も17%あった(vs L1の切除では5%)。
- 初回手術を受けた患児では、手術合併症を生じた患児はOS率が低かった(92% vs 97%、P = 0.05)が、治療成績に対するこの影響はL1腫瘍を有する患者においてのみ統計的に有意であった。
- L2患児に対する手術合併症は統計的にIDRFに関係していなかった。[ 27 ]
国際的なプロトコルのほとんどが、リスク層別化と治療の割り付けにおいてIDRFの収集と使用を組み入れ始めている。[ 28 ][ 29 ]COGでは2006年以降、INRGSSのデータを収集し、評価している。2014年に開始された1件のCOG試験では、外科医からの情報とともにINRGSSを用いてL1、L2、およびMS病変を有する患者を含めた高リスク以外の患者サブセットに対する治療法が決定されている(ANBL1232[NCT02176967])。INSSでは生後12ヵ月までの患児が4S期に分類されうるのに対し、INRGSSでは生後18ヵ月までの患児がMS期に分類されうることに留意すること。INSS 4S期の原発腫瘍は必ずINSS 1期または2期になるのに対し、MS期の原発腫瘍はINSS 3期になる場合がある。2018年8月に、高リスク患児のサブセットに対するCOG研究が開始された(ANBL1531[NCT03126916])。適格な患児には、1歳半を超えるM期疾患の患児、1歳半未満でMYCNの増幅が認められるM期疾患の患児、および年齢に関係なくMYCNの増幅が認められるL2期またはMS期疾患の患児が含まれる。標準化された命名法を用いることで、より統一された病期分類に大いに寄与し、それにより世界のさまざまな地域で実施された臨床試験の比較が容易になると予想される。
参考文献- Brodeur GM, Pritchard J, Berthold F, et al.: Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment. J Clin Oncol 11 (8): 1466-77, 1993.[PUBMED Abstract]
- Howman-Giles R, Shaw PJ, Uren RF, et al.: Neuroblastoma and other neuroendocrine tumors. Semin Nucl Med 37 (4): 286-302, 2007.[PUBMED Abstract]
- Papathanasiou ND, Gaze MN, Sullivan K, et al.: 18F-FDG PET/CT and 123I-metaiodobenzylguanidine imaging in high-risk neuroblastoma: diagnostic comparison and survival analysis. J Nucl Med 52 (4): 519-25, 2011.[PUBMED Abstract]
- Gauguet JM, Pace-Emerson T, Grant FD, et al.: Evaluation of the utility of (99m) Tc-MDP bone scintigraphy versus MIBG scintigraphy and cross-sectional imaging for staging patients with neuroblastoma. Pediatr Blood Cancer 64 (11): , 2017.[PUBMED Abstract]
- Kushner BH, Kramer K, Modak S, et al.: Sensitivity of surveillance studies for detecting asymptomatic and unsuspected relapse of high-risk neuroblastoma. J Clin Oncol 27 (7): 1041-6, 2009.[PUBMED Abstract]
- Sharp SE, Shulkin BL, Gelfand MJ, et al.: 123I-MIBG scintigraphy and 18F-FDG PET in neuroblastoma. J Nucl Med 50 (8): 1237-43, 2009.[PUBMED Abstract]
- Yanik GA, Parisi MT, Shulkin BL, et al.: Semiquantitative mIBG scoring as a prognostic indicator in patients with stage 4 neuroblastoma: a report from the Children's oncology group. J Nucl Med 54 (4): 541-8, 2013.[PUBMED Abstract]
- Yanik GA, Parisi MT, Naranjo A, et al.: Validation of Postinduction Curie Scores in High-Risk Neuroblastoma: A Children's Oncology Group and SIOPEN Group Report on SIOPEN/HR-NBL1. J Nucl Med 59 (3): 502-508, 2018.[PUBMED Abstract]
- Lewington V, Lambert B, Poetschger U, et al.: 123I-mIBG scintigraphy in neuroblastoma: development of a SIOPEN semi-quantitative reporting ,method by an international panel. Eur J Nucl Med Mol Imaging 44 (2): 234-241, 2017.[PUBMED Abstract]
- Ladenstein R, Lambert B, Pötschger U, et al.: Validation of the mIBG skeletal SIOPEN scoring method in two independent high-risk neuroblastoma populations: the SIOPEN/HR-NBL1 and COG-A3973 trials. Eur J Nucl Med Mol Imaging 45 (2): 292-305, 2018.[PUBMED Abstract]
- Decarolis B, Schneider C, Hero B, et al.: Iodine-123 metaiodobenzylguanidine scintigraphy scoring allows prediction of outcome in patients with stage 4 neuroblastoma: results of the Cologne interscore comparison study. J Clin Oncol 31 (7): 944-51, 2013.[PUBMED Abstract]
- Russell HV, Golding LA, Suell MN, et al.: The role of bone marrow evaluation in the staging of patients with otherwise localized, low-risk neuroblastoma. Pediatr Blood Cancer 45 (7): 916-9, 2005.[PUBMED Abstract]
- DuBois SG, Kalika Y, Lukens JN, et al.: Metastatic sites in stage IV and IVS neuroblastoma correlate with age, tumor biology, and survival. J Pediatr Hematol Oncol 21 (3): 181-9, 1999 May-Jun.[PUBMED Abstract]
- Kramer K, Kushner B, Heller G, et al.: Neuroblastoma metastatic to the central nervous system. The Memorial Sloan-kettering Cancer Center Experience and A Literature Review. Cancer 91 (8): 1510-9, 2001.[PUBMED Abstract]
- Brodeur GM, Seeger RC, Barrett A, et al.: International criteria for diagnosis, staging, and response to treatment in patients with neuroblastoma. J Clin Oncol 6 (12): 1874-81, 1988.[PUBMED Abstract]
- Castleberry RP, Shuster JJ, Smith EI: The Pediatric Oncology Group experience with the international staging system criteria for neuroblastoma. Member Institutions of the Pediatric Oncology Group. J Clin Oncol 12 (11): 2378-81, 1994.[PUBMED Abstract]
- Ikeda H, Iehara T, Tsuchida Y, et al.: Experience with International Neuroblastoma Staging System and Pathology Classification. Br J Cancer 86 (7): 1110-6, 2002.[PUBMED Abstract]
- Taggart DR, London WB, Schmidt ML, et al.: Prognostic value of the stage 4S metastatic pattern and tumor biology in patients with metastatic neuroblastoma diagnosed between birth and 18 months of age. J Clin Oncol 29 (33): 4358-64, 2011.[PUBMED Abstract]
- Morgenstern DA, London WB, Stephens D, et al.: Metastatic neuroblastoma confined to distant lymph nodes (stage 4N) predicts outcome in patients with stage 4 disease: A study from the International Neuroblastoma Risk Group Database. J Clin Oncol 32 (12): 1228-35, 2014.[PUBMED Abstract]
- Monclair T, Brodeur GM, Ambros PF, et al.: The International Neuroblastoma Risk Group (INRG) staging system: an INRG Task Force report. J Clin Oncol 27 (2): 298-303, 2009.[PUBMED Abstract]
- Brisse HJ, McCarville MB, Granata C, et al.: Guidelines for imaging and staging of neuroblastic tumors: consensus report from the International Neuroblastoma Risk Group Project. Radiology 261 (1): 243-57, 2011.[PUBMED Abstract]
- Newman EA, Nuchtern JG: Recent biologic and genetic advances in neuroblastoma: Implications for diagnostic, risk stratification, and treatment strategies. Semin Pediatr Surg 25 (5): 257-264, 2016.[PUBMED Abstract]
- Chen AM, Trout AT, Towbin AJ: A review of neuroblastoma image-defined risk factors on magnetic resonance imaging. Pediatr Radiol 48 (9): 1337-1347, 2018.[PUBMED Abstract]
- Avanzini S, Pio L, Erminio G, et al.: Image-defined risk factors in unresectable neuroblastoma: SIOPEN study on incidence, chemotherapy-induced variation, and impact on surgical outcomes. Pediatr Blood Cancer 64 (11): , 2017.[PUBMED Abstract]
- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Burchill SA, Beiske K, Shimada H, et al.: Recommendations for the standardization of bone marrow disease assessment and reporting in children with neuroblastoma on behalf of the International Neuroblastoma Response Criteria Bone Marrow Working Group. Cancer 123 (7): 1095-1105, 2017.[PUBMED Abstract]
- Monclair T, Mosseri V, Cecchetto G, et al.: Influence of image-defined risk factors on the outcome of patients with localised neuroblastoma. A report from the LNESG1 study of the European International Society of Paediatric Oncology Neuroblastoma Group. Pediatr Blood Cancer 62 (9): 1536-42, 2015.[PUBMED Abstract]
- Cecchetto G, Mosseri V, De Bernardi B, et al.: Surgical risk factors in primary surgery for localized neuroblastoma: the LNESG1 study of the European International Society of Pediatric Oncology Neuroblastoma Group. J Clin Oncol 23 (33): 8483-9, 2005.[PUBMED Abstract]
- Simon T, Hero B, Benz-Bohm G, et al.: Review of image defined risk factors in localized neuroblastoma patients: Results of the GPOH NB97 trial. Pediatr Blood Cancer 50 (5): 965-9, 2008.[PUBMED Abstract]
-
Curieスコア法:CurieスコアはMIBGの集積が認められる腫瘍の範囲と重症度を予測するために開発された半定量的なスコアリングシステムである。MIBGの集積が認められる4期高リスク神経芽腫を新たに診断され、小児腫瘍学グループ(COG)のプロトコル、COG-A3973(NCT00004188)で治療された患者(N = 280)を対象に反応および生存に対する予後マーカーとして、Curieスコアリングシステムの使用が評価された。MYCNの増幅のない神経芽腫患者について、寛解導入化学療法後の2超のCurieスコアは、神経芽腫に対するこの他の既知の臨床的および生物学的因子(年齢、MYCN状態、倍数性、有糸分裂-核崩壊指数、組織学的悪性度など)とは関係なく、イベントのより高いリスクに関連した。[
7
]MYCNが増幅していた腫瘍を有する患者について、導入療法後の0を超えるCurieスコアは不良な転帰に関連した。
- 神経芽腫に対する治療法選択肢の概要
-
北米における神経芽腫の小児のほとんどが、小児腫瘍学グループ(COG)の研究に登録していない場合でも、COGによるリスクグループの割り付けに従って治療されている。対照的に、進行中のCOG研究では、治療の割り付けに国際神経芽腫リスクグループ(INRG)のリスク分類が用いられている。治療の計画に依然として古いシステムを使用している医師もいるため、本要約で記述する治療は、国際神経芽腫リスクグループの病期分類システム(INRGSS)を用いているINRGのリスク分類とCOGの生物学研究、ANBL00B1(NCT00904241)で記述されているように、神経芽腫国際病期分類システム(INSS)を用いている2007年COGリスク層別化システムの両方に基づいている。COGはCOGリスク層別化スキームを改定中であり、次のバージョンではINRGSSに基づくことになっている。
以前のCOGリスク分類システムでは、小児はそれぞれ、以下の因子に基づいて低リスク、中リスク、または高リスク群に割り付けられていた(詳しい情報については、表7、表10、および表13を参照のこと):[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ][ 6 ]
以前のCOG研究において治療の選択に影響を及ぼしていた他の生物学的因子には、不均衡な11qのヘテロ接合性の消失および染色体1pのヘテロ接合性の消失があった。[ 7 ][ 8 ]しかしながら、2012年にはCOGの神経芽腫委員会により、リスク割り付けを目的とした予後良好なゲノム情報として、1p、3p、4p、11qにおけるコピー数の減少が認められないほか、1q、2p、17qにおけるコピー数の増加が認められないといったセグメントコピー数の異常が認められない高二倍体の神経芽腫細胞が定義された。この定義は、11qの異常のみが含まれるINRGSSとは一致しない;ただし、この基準は将来のバージョンで変更される可能性がある。
一般的に治療は、以下に示すように腫瘍が低リスク、中リスク、または高リスクのいずれに分類されるかに基づいている:
- 低リスク。低リスク腫瘍患者に対するアプローチは観察または切除で、化学療法は低リスクの生物学を示す症状のある患者に制限される。5年全生存率(OS)は1件の大規模COG研究において97%であった。[ 9 ]進行中のCOG研究では、低リスク腫瘍を有する患者の限定されたサブセットにおいて治療の縮小が調査されている。
- 中リスク。中リスク腫瘍患者にはしばしば根治的切除前に化学療法が実施され、化学療法のサイクル数は臨床的危険因子および腫瘍の生物学的危険因子のほか、治療への反応に基づいて決定される。最近の研究では、選択された患者が化学療法を受けることなくまたは切除を試みずに観察されている。1件の大規模COG研究における中リスク患者の3年OS率は約96%であった。[ 10 ]COG ANBL0531(NCT00499616)研究では、副作用をさらに減らすために中リスクの小児のいくつかのサブセットにおいて化学療法の期間が短縮され、強度が弱められた;治療成績の低下は認められなかった。[ 11 ]
- 高リスク。高リスク患者に対する治療は強化され、化学療法、手術、放射線療法、骨髄除去的治療と幹細胞移植(SCT)、イソトレチノイン、および免疫療法が含められており、約50%の生存率が得られている。1件のランダム化第III相COG研究(ANBL0532[NCT00567567])では、SCTと併用するタンデムサイクルの骨髄除去的治療がSCTと併用する単一サイクルの骨髄除去的治療と比較され、統計的に有意な生存の改善が観察された。タンデム移植を受けた患者の3年EFS率の方が、単回移植を受けた患者のEFS率よりも優れていた(P = 0.006);しかしながら、大部分の患者がランダム化されなかったことから、選択バイアスが存在した可能性がある。[ 12 ][証拠レベル:1iiA](詳しい情報については、本要約の高リスク神経芽腫に対する治療法の選択肢のセクションの地固め療法期のサブセクションを参照のこと。)
表5では、INSSに基づくリスク集団別の低リスク、中リスク、高リスク、4S期、および再発神経芽腫に対する治療法の選択肢について記述している。
表5.神経芽腫に対する治療法の選択肢 COGによるリスクグループの割り付け 治療法の選択肢 COG = 小児腫瘍学グループ;GM-CSF = 顆粒球マクロファージコロニー刺激因子;131I-MIBG = ヨウ素131-メタヨードベンジルグアニジン;SCT = 幹細胞移植。 低リスク神経芽腫 手術とその後の観察。 手術を併用するまたは併用しない化学療法(手術後に症状のある疾患または切除不能の進行性疾患に対して)。 生検なしの観察(小さい副腎腫瘍を伴う周産期の神経芽腫に対して)。 放射線療法(緊急治療の場合のみ)。 中リスク神経芽腫 手術を併用するまたは併用しない化学療法。 手術と観察(乳児に対して)。 放射線療法(必要な場合)。 高リスク神経芽腫 化学療法、手術、SCTと併用するタンデムサイクルの骨髄除去的治療、放射線療法、およびジヌツキシマブとインターロイキン-2/GM-CSFおよびイソトレチノインとを併用するレジメン。 4S期/MS期神経芽腫 支持療法と併用する観察(腫瘍の生物学的特性が予後良好な無症状の患者に対して)。 化学療法(症状のある患者、非常に年齢の低い乳児、または生物学的特性が予後不良な患者に対して)。 放射線療法(まれに、転移性疾患による肝腫大に関係した症状を有する患者に対して)。 再発神経芽腫 初発時に低リスクに分類された患者における局所領域での再発 手術とその後の観察または化学療法。 化学療法と場合によりその後の手術。 初発時に低リスクに分類された患者における転移性再発 観察(転移病変が4S期パターンで乳児に認められる場合)。 化学療法。 手術とその後の化学療法。 高リスク療法。 初発時に中リスクに分類された患者における局所領域での再発 手術(完全切除)。 手術(不完全切除)とその後の化学療法。 放射線療法(化学療法およびセカンドルック手術後に疾患進行がみられる患者に対してのみ)。 初発時に中リスクに分類された患者における転移性再発 高リスク療法。 初発時に高リスクに分類された患者における再発 免疫療法を併用する化学療法。 131I-MIBG単独、他の治療との併用、またはその後の幹細胞救助。 ALK阻害薬。 化学療法。 中枢神経系での再発 手術および放射線療法。 新たな治療アプローチ。 小児腫瘍学グループ(COG)の神経芽腫リスク分類
本要約の治療セクションは、すべての患者を低リスク群、中リスク群、または高リスク群に割り付けたCOGのリスクに基づく治療計画と一致するように構成されている。COGのリスクに基づく治療計画が進行中のANBL1232(NCT02176967)COG研究で用いられている一方、高リスク神経芽腫のANBL1531(NCT03126916)研究はINRGリスク分類に基づいている。このリスクベースの分類スキームは、以下の因子に基づいていた:
- 患者の診断時年齢。
- 腫瘍に関する特定の生物学的特性(MYCNの状態およびゲノムセグメントの異常、INPCの病理組織学的分類、および腫瘍のDNA指数)。
- INSSにより定義される腫瘍の病期。
表7(低リスク神経芽腫の治療セクション内)、表10(中リスク神経芽腫の治療セクション内)、および表13(高リスク神経芽腫の治療セクション内)では、低リスクCOG-P9641試験、中リスクCOG-A3961およびANBL0531(NCT00499616)試験、および高リスクCOG-A3973およびANBL0532(NCT00567567)研究での治療の割り付けに用いられたリスクグループの割り付け基準について記述されている。
MYCNの増幅を認める早期神経芽腫に対するリスク評価は、そのような腫瘍は非常にまれであるため見解の一致をみていない。数件の臨床試験グループから併合されたINSS 1期および2期神経芽腫患者87人の研究では、年齢、病期、初期治療のいずれも治療成績に影響しないことが実証された。イベントフリー生存(EFS)率は53%、OS率は72%であった。腫瘍が二倍体であるよりもむしろ高二倍体の患者の方が生存率が優れていた(EFS、82% ± 20% vs 37% ± 21%;OS、94% ± 11% vs 54% ± 15%)。[ 13 ]ヨーロッパの1件の研究において、4期および4S期疾患でMYCNの増幅が認められる乳児に対する全体的なEFS率およびOS率は治療後2~5年経過時でわずか30%であった。[ 14 ]COGでは、4期および4S期疾患でMYCN遺伝子の増幅がみられる乳児は高リスクとみなされる。[ 4 ]
国際神経芽腫リスクグループの分類
INRG分類スキームでは神経芽腫患者を、INRGの病期、年齢、組織学的分類、腫瘍分化の悪性度、MYCNの増幅、11qの異常(検査された唯一の染色体セグメントの異常)、および倍数性に基づいて16の治療前リスク群の1つに割り付ける。臨床試験(表6を参照のこと)に登録されていたことから高品質のデータを持つ8,800人の患者における転帰に従って4段階のリスクが定義された。全体的リスク分類において、組織型はL1期およびL2期の全腫瘍についての重要なリスク決定因子であり、分化度は生後18ヵ月より年長の患児における神経芽腫および結節性神経節芽腫を識別する。INRGの目標は、臨床試験の患者からの共有データを作成し、将来の試験のためにリスク群を定義することにある。[ 15 ]
表6.国際神経芽腫リスクグループ(INRG)の治療前分類スキームa INRG病期 組織学的分類 腫瘍分化度 11qの異常 倍数性 治療前リスクグループ GN = 神経節腫;GNB = 神経節芽腫;NA = 増幅なし。 a許可を得て転載。©(2015)米国臨床腫瘍学会。All rights reserved.Pinto N et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma, J Clin Oncol 33 (27), 2015: 3008-3017.[ 16 ] L1/L2 GN、成熟途中型、GNB、混在型 A(非常に低リスク) L1 すべて、GN、成熟途中型またはGNB、混在型を除く NA B(非常に低リスク) 増幅あり K(高リスク) L2 生後18ヵ月未満 すべて、GN、成熟途中型またはGNB、混在型を除く NA なし D(低リスク) あり G(中リスク) 生後18ヵ月以上 GNB、結節型神経芽腫 高分化型 NA なし E(低リスク) あり H(中リスク) 低分化型または未分化型 NA H(中リスク) 増幅あり N(高リスク) M 生後18ヵ月未満 NA 高二倍体 F(低リスク) 生後12ヵ月未満 NA 二倍体 I(中リスク) 生後12ヵ月~18ヵ月未満 NA 二倍体 J(中リスク) 生後18ヵ月未満 増幅あり O(高リスク) 生後18ヵ月以上 P(高リスク) MS 生後18ヵ月未満 NA なし C(非常に低リスク) あり Q(高リスク) 増幅あり R(高リスク) 現在のCOGのリスク分類システム、INRGのリスク分類スキーム、および特定の少数の患者サブセットの治療については、議論がなされている。[ 17 ][ 18 ][ 19 ]非常に低リスク、低リスク、中リスク、および高リスクサブセットのリスク群の定義および推奨される治療法は、新たなバイオマーカーが同定され、治療成績に関する追加のデータが分析されるにつれて進歩すると期待されている。例えば、生後12~18ヵ月の患児におけるINSS 4期神経芽腫へのリスクグループの割り付けは2005年に、腫瘍にMYCNの単一コピーが認められ、すべての生物学的特性が予後良好な患児においては変更された;これらの患児は以前は高リスクに分類されていたが、Pediatric Oncology GroupおよびChildren's Cancer Groupの両研究からのデータにより、これらの患者サブグループは中リスクとして治療が成功することが示唆された。[ 20 ][ 21 ][ 22 ]INRGの将来のバージョンにはリスクの割り付けのためにさらなる腫瘍ゲノム基準が含められることが予想される。[ 16 ]
神経芽腫の改定国際反応基準(INRC)
COGの臨床試験において最初に計画されたサイクル数の後に治療を中止するためには、リスクグループおよび治療割り付けに応じて特定の反応基準を満たす必要がある。[ 23 ][ 24 ][ 25 ]改定INRCは、以下との併用での三次元(3-D)画像検査の使用に依存している:
- メタヨードベンジルグアニジン(MIBG)スキャン。原発腫瘍、骨、およびリンパ節または軟部組織転移についてのMIBGスキャン。
- ポジトロン放射断層撮影(PET)スキャン。PETスキャンはMIBGで集積が認められない腫瘍を有する10%の患者においてMIBGの代わりに用いられる。
MIBGと99mTcスキャンの両方を受けた132人の患者を対象にしたレトロスペクティブ研究で病期分類の有益性が示されなかったため、99mテクネチウム(Tc)(99mTc)骨スキャンはもはや使用されていない。[ 26 ]
改定INRCにおける全般的な反応では、原発腫瘍、骨髄、および軟部組織と骨転移の腫瘍反応が統合される。軟部組織の原発部位および転移部位は、Response Evaluation Criteria in Solid Tumors(RECIST)およびMIBGで集積が認められない腫瘍の場合はヨウ素123(123I)-MIBGスキャンまたはフッ素18-フルデオキシグルコース(18F-FDG)PETスキャンを用いて評価される。骨髄は、組織学、免疫組織化学および細胞診、または免疫認識ツールを活用した免疫細胞学により評価される。腫瘍浸潤が5%未満の骨髄は微小病変として分類される。尿中カテコールアミン値は反応評価に含まれていない。[ 25 ]
INRCの全般的な反応基準の定義は以下の通りである:[ 23 ][ 24 ]
- 完全奏効:軟部組織や骨のいずれの部位にもMIBGの取り込み(またはMIBGで集積が認められない疾患ではPETスキャン陽性)の消失など、疾患の証拠が認められず、原発腫瘍の三次元画像検査での残存が10mm未満;標的リンパ節の短寸法が10mm未満;および2回の骨髄生検および2回の骨髄穿刺で腫瘍の組織像が認められない。
- 部分奏効:原発部位の最大径が30%以上低下し、および、新たな病変が認められず、および、MIBG(または18F-FDG PET)が安定または改善しており、および、絶対MIBG骨スコアの少なくとも50%以上の低下または18F-FDG PET集積骨病変数の50%以上の減少。
- 小さな反応:病変の少なくとも1つの構成要素で部分奏効または完全奏効が見られるが、他の少なくとも1つ以上の構成要素で病変が安定しており、および、病変が進行している構成要素が認められない。
- 病勢進行:新たな病変が認められる;測定可能な病変の最大径が20%増加、および最大径の少なくとも5mm以上の増加;過去に腫瘍が陰性であった骨髄が新たに陽性となった;軟部組織病変が新たにMIBG(または18F-FDG PET)で集積が認められるか、生検で陽性となった;骨に新たに集積が認められた;または相対MIBGスコアが1.25%以上増加している。
- 病勢安定化:部分奏効としては十分な縮小が認められず、病勢進行としても十分な増加が認められず、微小病変において定義されているように5%超の腫瘍浸潤が認められる場合がある。
初発時に1期または2期疾患であると考えられた乳児における転移性病変の発生を解釈する場合には、注意すべきである。このような患者における転移パターンが4S期の疾患パターン(皮膚、肝、および/または骨髄への転移、後者の転移は10%未満)と一致している場合、これらの患者は典型的にプロトコルの治療法からの排除基準となる進行性/転移性疾患としては分類されない。代わりに、これらの患者は4S期患者として管理される。
原発腫瘍の反応を全3腫瘍径で測定する必要があるか、またはRECISTの腫瘍反応の判定でのように、単一の最大径のみが同様に有用であるかについては議論が存在する。[ 27 ]INRCでは後者が使用のために採用されている。
手術
転移性疾患のない患者における標準治療では、以下を達成するために病期とリスク群に基づいて初回手術を実施する:
- 診断のために組織を入手する。L2期の腫瘍では、先行切除を試みてはならない。L2期の腫瘍では、切開生検またはコア生検のみが推奨される。片側副腎の原発性腫瘍、L1期の胸部腫瘍、またはL1期の頸部腫瘍では、先行して切除すべきである(外科医の裁量に従う)。[ 28 ][証拠レベル:3iiiC](画像で明らかにされた危険因子に関する詳しい情報については、国際神経芽腫リスクグループの病期分類システム[INRGSS]のセクションを参照のこと。)
- 原発腫瘍を可能な限り安全に多く切除する。これは、低リスク(出生前に診断された乳児を除く)および中リスク疾患に最も適している。
- 腫瘍に癒着していない所属リンパ節をサンプリングして病期を正確に判定する。これは、診断時に切除を受けた高リスク以外の患者に最も適している。L1とL2疾患を区別するためにリンパ節転移のみでは判断されない。
COGの報告では、小さな(L1)副腎腫瘤を有する生後6ヵ月未満の乳児における待機観察で非常に優れたEFSおよびOSが得られ、大多数の患者で外科的介入を回避できた。[ 29 ]中リスク神経芽腫の臨床試験(ANBL0531[NCT00499616])で記述された外科的ガイドラインに従って、4S期神経芽腫の患者では原発腫瘍はルーチンには切除されていない。
L1腫瘍(画像で明らかにされた外科的危険因子が認められないと定義されている)の患者では、腫瘍は切除可能であり、切除により外科的合併症を起こす可能性は低い。L2腫瘍(画像で明らかにされた外科的危険因子が1つ以上認められる)は、切除を試みるには危険すぎると考えられる場合には化学療法と、腫瘍が反応した場合にはその後の手術で治療される。最近のドイツの研究では選択された患者グループに対して組織の生検を実施しており、MYCNが認められないL1およびL2腫瘍の乳児を観察し、ほとんどの患者で追加の手術および化学療法が回避されている。[ 30 ]
生後18ヵ月を超える4期患者において化学療法後に原発腫瘍塊を肉眼的に完全切除する利点があるかどうかについては、依然として議論の余地がある。[ 31 ][ 32 ][ 33 ][ 34 ][ 35 ][ 36 ]3期および4期の神経芽腫患者を比較したメタアナリシスから、すべての年齢を併合した場合、肉眼的完全切除(90%超)は3期神経芽腫でのみ亜全切除より利点があり、4期では利点はないことが判明した。[ 37 ]また、小規模研究から、術前補助化学療法の後、切除の完全性は残っている画像で明らかにされた危険因子の数に影響されることが示唆された。[ 38 ]経験を積んだ外科医が手技を実施した場合、4期神経芽腫における原発腫瘍の90%以上の切除によってより高い局所制御率が得られたが、OSに対する統計的に有意な影響は示されなかった。[ 39 ]
放射線療法
現在の治療パラダイムで、低リスクまたは中リスクの神経芽腫患者に対する放射線療法は、腫瘍塊により生命を脅かすか、臓器不全の危険性がある症状がみられ、化学療法による迅速な効果が不十分であった腫瘍塊に対してのみ使用された。これらの患者において放射線療法が用いられる共通の状況としては、以下が挙げられる:
放射線療法は高リスク疾患を有する患者に対する標準ケアの一部となっており、通常は大量化学療法および幹細胞救助後に実施される。このアプローチの基礎は、21Gyの放射線療法の実施で原発腫瘍部位での再燃がわずか10%であったことを実証した単一施設の報告から最初に得られた。[ 42 ]その後の共同研究グループ試験で、移植後の原発腫瘍床への照射が組み込まれたが、至適線量は不明のままである。
脊髄圧迫の治療
脊髄圧迫は医学的緊急と考えられる。診断から治療前の比較的短期間に症状がみられる間なら神経学的回復の可能性が高いため、患者は即時治療を受ける。回復はまた神経学的欠損の重症度(脱力 vs 麻痺)にも依存する。以前よりも放射線療法の使用頻度は低いものの、脊髄圧迫の治療に化学療法、放射線療法、または手術のいずれを用いても、神経学的転帰に差はないようである。
完了したCOGの低リスクおよび中リスク神経芽腫臨床試験では、低リスクまたは中リスクの患者の脊髄圧迫には、速やかな化学療法の実施が推奨された。[ 41 ][ 43 ][ 44 ]この設定におけるグルココルチコイドの神経学的転帰に対する効果を調査した単一研究において、グルココルチコイドは初期症状緩和の改善に関連した。ただし、グルココルチコイドでは晩期に残存する障害を防止できなかった。[ 44 ]
重度の脊髄圧迫が直ちに改善しない小児または症状が悪化する小児には、神経外科的介入が有益となる可能性がある。椎弓切除術は後に脊柱後弯を引き起こす可能性があり、化学療法が必ずしも不要になるわけではない。[ 41 ][ 43 ][ 44 ]骨の切除を行わない手技である骨形成的椎弓切除術では、脊柱変形を引き起こす可能性は低いと考えられていた。骨形成的椎弓切除術に伴って融合が必要となる進行性脊柱変形の発生率は低いが、椎弓形成術により機能的神経学的欠損が改善されるという証拠はない。[ 45 ]
髄腔内進展が認められた神経芽腫生存者における長期的な健康問題の負担は重い。髄腔内進展が認められた患者の治療と転帰に関する28件の研究の系統的レビューでは、診断時の症状の重症度および治療法は、長期的な健康問題の存在に最も関連していた。特に、神経学的運動障害の重症度は、神経学的転帰を予測する可能性が最も高かった。[ 46 ]診断時の運動障害の重症度は追跡終了時の脊柱変形および括約筋機能障害に関連する一方、診断時の括約筋機能障害は長期の括約筋の問題と相関した。[ 47 ]このことは、症状が悪化して神経学的機能喪失が完了する前の治療の開始を支持している。
症状のある硬膜外脊髄圧迫を有する乳児34人を対象にしたシリーズでは、いったん対麻痺が定着してしまうと、手術および化学療法はどちらも満足の行く結果が得られなかった。症状の持続期間が長くなると、グレード3の運動障害および腸機能障害の頻度が増加した。症状のある硬膜外脊髄圧迫を有する乳児のほとんどが後遺症を発症し、約半数の患者では後遺症は重度であった。[ 48 ]
治療中または治療後のサーベイランス
治療中または治療後のサーベイランス検査により、かなりの割合の患者において無症状で予想外の再燃を発見できる。全般的なサーベイランス計画(尿中バニリルマンデル酸とホモバニリン酸検査が含まれる)において、疾患進行または再発を発見するための最も信頼性の高い画像検査の1つは123I-MIBGスキャンである。[ 49 ][ 50 ]
コンピュータ断層撮影スキャンを用いる横断的画像検査については、曝露する放射線量およびこの方法で再燃が発見される割合が小さいことから、見解の一致をみていない。[ 51 ]
小児がん治療に関する特別な考慮事項
小児および青年におけるがんはまれである(ただし、小児がんの全発生率は1975年以降徐々に増加している)。[ 52 ]小児および青年のがん患者は通常、小児期および青年期に発生するがんの治療経験を有するがん専門医から構成される集学的チームのある医療機関に紹介される。この集学的チームのアプローチとは、至適生存期間および至適QOLを得られるような治療、支持療法、およびリハビリテーションを小児が必ず受けられるようにするため、以下に示す医療専門家の技術を集結したものである。
- プライマリケア医。
- 小児病理医。
- 小児外科医。
- 小児放射線腫瘍医。
- 小児内科腫瘍医/血液医。
- 小児専門看護師。
- 社会福祉士。
- チャイルドライフ専門員。
(小児および青年のがんの支持療法に関する具体的な情報については、支持療法と緩和ケアに関するPDQ要約を参照のこと。)
米国小児科学会は、小児がん施設とそれらが小児がん患者の治療において担う役割に関するガイドラインを概説している。[ 53 ]このような小児がん施設では、小児および青年に発症するほとんどの種類のがんに関する臨床試験が行われており、大半の患者と家族に参加する機会が与えられている。小児および青年のがんに関する臨床試験は一般に、現在標準とされている治療法と、それより効果的であると思われる治療法とを比較するようデザインされる。小児がんの治癒を目指した治療法の進歩の大部分は、このような臨床試験によって達成されたものである。あるがんの診断に対する標準療法が存在しない場合は、他の種類の臨床試験により新しい療法の検討または定義を行う。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
参考文献- Cotterill SJ, Pearson AD, Pritchard J, et al.: Clinical prognostic factors in 1277 patients with neuroblastoma: results of The European Neuroblastoma Study Group 'Survey' 1982-1992. Eur J Cancer 36 (7): 901-8, 2000.[PUBMED Abstract]
- Moroz V, Machin D, Faldum A, et al.: Changes over three decades in outcome and the prognostic influence of age-at-diagnosis in young patients with neuroblastoma: a report from the International Neuroblastoma Risk Group Project. Eur J Cancer 47 (4): 561-71, 2011.[PUBMED Abstract]
- Look AT, Hayes FA, Shuster JJ, et al.: Clinical relevance of tumor cell ploidy and N-myc gene amplification in childhood neuroblastoma: a Pediatric Oncology Group study. J Clin Oncol 9 (4): 581-91, 1991.[PUBMED Abstract]
- Schmidt ML, Lukens JN, Seeger RC, et al.: Biologic factors determine prognosis in infants with stage IV neuroblastoma: A prospective Children's Cancer Group study. J Clin Oncol 18 (6): 1260-8, 2000.[PUBMED Abstract]
- Berthold F, Trechow R, Utsch S, et al.: Prognostic factors in metastatic neuroblastoma. A multivariate analysis of 182 cases. Am J Pediatr Hematol Oncol 14 (3): 207-15, 1992.[PUBMED Abstract]
- Matthay KK, Perez C, Seeger RC, et al.: Successful treatment of stage III neuroblastoma based on prospective biologic staging: a Children's Cancer Group study. J Clin Oncol 16 (4): 1256-64, 1998.[PUBMED Abstract]
- Attiyeh EF, London WB, Mossé YP, et al.: Chromosome 1p and 11q deletions and outcome in neuroblastoma. N Engl J Med 353 (21): 2243-53, 2005.[PUBMED Abstract]
- Spitz R, Hero B, Simon T, et al.: Loss in chromosome 11q identifies tumors with increased risk for metastatic relapses in localized and 4S neuroblastoma. Clin Cancer Res 12 (11 Pt 1): 3368-73, 2006.[PUBMED Abstract]
- Strother DR, London WB, Schmidt ML, et al.: Outcome after surgery alone or with restricted use of chemotherapy for patients with low-risk neuroblastoma: results of Children's Oncology Group study P9641. J Clin Oncol 30 (15): 1842-8, 2012.[PUBMED Abstract]
- Baker DL, Schmidt ML, Cohn SL, et al.: Outcome after reduced chemotherapy for intermediate-risk neuroblastoma. N Engl J Med 363 (14): 1313-23, 2010.[PUBMED Abstract]
- Twist CJ, Schmidt ML, Naranjo A, et al.: Maintaining Outstanding Outcomes Using Response- and Biology-Based Therapy for Intermediate-Risk Neuroblastoma: A Report From the Children's Oncology Group Study ANBL0531. J Clin Oncol 37 (34): 3243-3255, 2019.[PUBMED Abstract]
- Park JR, Kreissman SG, London WB, et al.: Effect of Tandem Autologous Stem Cell Transplant vs Single Transplant on Event-Free Survival in Patients With High-Risk Neuroblastoma: A Randomized Clinical Trial. JAMA 322 (8): 746-755, 2019.[PUBMED Abstract]
- Bagatell R, Beck-Popovic M, London WB, et al.: Significance of MYCN amplification in international neuroblastoma staging system stage 1 and 2 neuroblastoma: a report from the International Neuroblastoma Risk Group database. J Clin Oncol 27 (3): 365-70, 2009.[PUBMED Abstract]
- Canete A, Gerrard M, Rubie H, et al.: Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Paediatric Oncology European Neuroblastoma Experience. J Clin Oncol 27 (7): 1014-9, 2009.[PUBMED Abstract]
- Cohn SL, Pearson AD, London WB, et al.: The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report. J Clin Oncol 27 (2): 289-97, 2009.[PUBMED Abstract]
- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Kushner BH, Cheung NK: Treatment reduction for neuroblastoma. Pediatr Blood Cancer 43 (6): 619-21, 2004.[PUBMED Abstract]
- Kushner BH, Kramer K, LaQuaglia MP, et al.: Liver involvement in neuroblastoma: the Memorial Sloan-Kettering Experience supports treatment reduction in young patients. Pediatr Blood Cancer 46 (3): 278-84, 2006.[PUBMED Abstract]
- Navarro S, Amann G, Beiske K, et al.: Prognostic value of International Neuroblastoma Pathology Classification in localized resectable peripheral neuroblastic tumors: a histopathologic study of localized neuroblastoma European Study Group 94.01 Trial and Protocol. J Clin Oncol 24 (4): 695-9, 2006.[PUBMED Abstract]
- Schmidt ML, Lal A, Seeger RC, et al.: Favorable prognosis for patients 12 to 18 months of age with stage 4 nonamplified MYCN neuroblastoma: a Children's Cancer Group Study. J Clin Oncol 23 (27): 6474-80, 2005.[PUBMED Abstract]
- London WB, Castleberry RP, Matthay KK, et al.: Evidence for an age cutoff greater than 365 days for neuroblastoma risk group stratification in the Children's Oncology Group. J Clin Oncol 23 (27): 6459-65, 2005.[PUBMED Abstract]
- George RE, London WB, Cohn SL, et al.: Hyperdiploidy plus nonamplified MYCN confers a favorable prognosis in children 12 to 18 months old with disseminated neuroblastoma: a Pediatric Oncology Group study. J Clin Oncol 23 (27): 6466-73, 2005.[PUBMED Abstract]
- Brodeur GM, Pritchard J, Berthold F, et al.: Revisions of the international criteria for neuroblastoma diagnosis, staging, and response to treatment. J Clin Oncol 11 (8): 1466-77, 1993.[PUBMED Abstract]
- Brodeur GM, Seeger RC, Barrett A, et al.: International criteria for diagnosis, staging, and response to treatment in patients with neuroblastoma. J Clin Oncol 6 (12): 1874-81, 1988.[PUBMED Abstract]
- Park JR, Bagatell R, Cohn SL, et al.: Revisions to the International Neuroblastoma Response Criteria: A Consensus Statement From the National Cancer Institute Clinical Trials Planning Meeting. J Clin Oncol 35 (22): 2580-2587, 2017.[PUBMED Abstract]
- Gauguet JM, Pace-Emerson T, Grant FD, et al.: Evaluation of the utility of (99m) Tc-MDP bone scintigraphy versus MIBG scintigraphy and cross-sectional imaging for staging patients with neuroblastoma. Pediatr Blood Cancer 64 (11): , 2017.[PUBMED Abstract]
- Bagatell R, McHugh K, Naranjo A, et al.: Assessment of Primary Site Response in Children With High-Risk Neuroblastoma: An International Multicenter Study. J Clin Oncol 34 (7): 740-6, 2016.[PUBMED Abstract]
- Newman EA, Nuchtern JG: Recent biologic and genetic advances in neuroblastoma: Implications for diagnostic, risk stratification, and treatment strategies. Semin Pediatr Surg 25 (5): 257-264, 2016.[PUBMED Abstract]
- Nuchtern JG, London WB, Barnewolt CE, et al.: A prospective study of expectant observation as primary therapy for neuroblastoma in young infants: a Children's Oncology Group study. Ann Surg 256 (4): 573-80, 2012.[PUBMED Abstract]
- Hero B, Simon T, Spitz R, et al.: Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol 26 (9): 1504-10, 2008.[PUBMED Abstract]
- Adkins ES, Sawin R, Gerbing RB, et al.: Efficacy of complete resection for high-risk neuroblastoma: a Children's Cancer Group study. J Pediatr Surg 39 (6): 931-6, 2004.[PUBMED Abstract]
- Castel V, Tovar JA, Costa E, et al.: The role of surgery in stage IV neuroblastoma. J Pediatr Surg 37 (11): 1574-8, 2002.[PUBMED Abstract]
- La Quaglia MP, Kushner BH, Su W, et al.: The impact of gross total resection on local control and survival in high-risk neuroblastoma. J Pediatr Surg 39 (3): 412-7; discussion 412-7, 2004.[PUBMED Abstract]
- Simon T, Häberle B, Hero B, et al.: Role of surgery in the treatment of patients with stage 4 neuroblastoma age 18 months or older at diagnosis. J Clin Oncol 31 (6): 752-8, 2013.[PUBMED Abstract]
- Englum BR, Rialon KL, Speicher PJ, et al.: Value of surgical resection in children with high-risk neuroblastoma. Pediatr Blood Cancer 62 (9): 1529-35, 2015.[PUBMED Abstract]
- von Allmen D, Davidoff AM, London WB, et al.: Impact of Extent of Resection on Local Control and Survival in Patients From the COG A3973 Study With High-Risk Neuroblastoma. J Clin Oncol 35 (2): 208-216, 2017.[PUBMED Abstract]
- Mullassery D, Farrelly P, Losty PD: Does aggressive surgical resection improve survival in advanced stage 3 and 4 neuroblastoma? A systematic review and meta-analysis. Pediatr Hematol Oncol 31 (8): 703-16, 2014.[PUBMED Abstract]
- Irtan S, Brisse HJ, Minard-Colin V, et al.: Image-defined risk factor assessment of neurogenic tumors after neoadjuvant chemotherapy is useful for predicting intra-operative risk factors and the completeness of resection. Pediatr Blood Cancer 62 (9): 1543-9, 2015.[PUBMED Abstract]
- Wolden SL, Gollamudi SV, Kushner BH, et al.: Local control with multimodality therapy for stage 4 neuroblastoma. Int J Radiat Oncol Biol Phys 46 (4): 969-74, 2000.[PUBMED Abstract]
- Hsu LL, Evans AE, D'Angio GJ: Hepatomegaly in neuroblastoma stage 4s: criteria for treatment of the vulnerable neonate. Med Pediatr Oncol 27 (6): 521-8, 1996.[PUBMED Abstract]
- Katzenstein HM, Kent PM, London WB, et al.: Treatment and outcome of 83 children with intraspinal neuroblastoma: the Pediatric Oncology Group experience. J Clin Oncol 19 (4): 1047-55, 2001.[PUBMED Abstract]
- Kushner BH, Wolden S, LaQuaglia MP, et al.: Hyperfractionated low-dose radiotherapy for high-risk neuroblastoma after intensive chemotherapy and surgery. J Clin Oncol 19 (11): 2821-8, 2001.[PUBMED Abstract]
- De Bernardi B, Pianca C, Pistamiglio P, et al.: Neuroblastoma with symptomatic spinal cord compression at diagnosis: treatment and results with 76 cases. J Clin Oncol 19 (1): 183-90, 2001.[PUBMED Abstract]
- Simon T, Niemann CA, Hero B, et al.: Short- and long-term outcome of patients with symptoms of spinal cord compression by neuroblastoma. Dev Med Child Neurol 54 (4): 347-52, 2012.[PUBMED Abstract]
- McGirt MJ, Chaichana KL, Atiba A, et al.: Incidence of spinal deformity after resection of intramedullary spinal cord tumors in children who underwent laminectomy compared with laminoplasty. J Neurosurg Pediatr 1 (1): 57-62, 2008.[PUBMED Abstract]
- Kraal K, Blom T, van Noesel M, et al.: Treatment and outcome of neuroblastoma with intraspinal extension: A systematic review. Pediatr Blood Cancer 64 (8): , 2017.[PUBMED Abstract]
- Angelini P, Plantaz D, De Bernardi B, et al.: Late sequelae of symptomatic epidural compression in children with localized neuroblastoma. Pediatr Blood Cancer 57 (3): 473-80, 2011.[PUBMED Abstract]
- De Bernardi B, Quaglietta L, Haupt R, et al.: Neuroblastoma with symptomatic epidural compression in the infant: the AIEOP experience. Pediatr Blood Cancer 61 (8): 1369-75, 2014.[PUBMED Abstract]
- Papathanasiou ND, Gaze MN, Sullivan K, et al.: 18F-FDG PET/CT and 123I-metaiodobenzylguanidine imaging in high-risk neuroblastoma: diagnostic comparison and survival analysis. J Nucl Med 52 (4): 519-25, 2011.[PUBMED Abstract]
- Kushner BH, Kramer K, Modak S, et al.: Sensitivity of surveillance studies for detecting asymptomatic and unsuspected relapse of high-risk neuroblastoma. J Clin Oncol 27 (7): 1041-6, 2009.[PUBMED Abstract]
- Owens C, Li BK, Thomas KE, et al.: Surveillance imaging and radiation exposure in the detection of relapsed neuroblastoma. Pediatr Blood Cancer 63 (10): 1786-93, 2016.[PUBMED Abstract]
- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- Corrigan JJ, Feig SA; American Academy of Pediatrics: Guidelines for pediatric cancer centers. Pediatrics 113 (6): 1833-5, 2004.[PUBMED Abstract]
- 低リスク神経芽腫の治療
-
低リスク神経芽腫は新たに神経芽腫を診断されるすべての患者のうち半数近くを占める。以前の小児腫瘍学グループ(COG)の臨床試験の成功により、特定の神経芽腫患者に対する治療は減少し続けている。
以前に用いられたCOGの神経芽腫低リスク群への割り付け基準が表7に記述されている。
表7.小児腫瘍学グループ(COG)研究に用いられたCOGによる神経芽腫の低リスク群分類スキームa INSS病期 年齢 の状態 INPCの組織型 DNA倍数性 その他 DI = DNA指数;INPC = 国際神経芽腫病理学分類;INSS = 神経芽腫国際病期分類システム。 aCOG-P9641(NCT00003119)(低リスク)およびCOG-A3961(NCT00003093)(中リスク)試験により、リスクグループの割り付けおよび治療戦略について神経芽腫患者に対する現在の標準治療が確立された。 bDNA倍数性:DI > 1は悪性度が低い;DI = 1は悪性度が高い;低二倍体腫瘍(DI < 1)はDI > 1の腫瘍として扱う(DI < 1[低二倍体]は悪性度の低い倍数性であると考えられる)。 cINSS 2A/2B期で脊髄圧迫、神経学的欠損、または他の症状がある患者には、即時化学療法が4サイクル実施される。 d2A/2B腫瘍は、低リスクに分類するために50%以上切除する必要がある。切除が50%未満の腫瘍は中リスクに分類される。 eINSS 4S期で生物学的には良好で、臨床症状がある乳児には、症状がみられなくなるまで即時化学療法(2~4サイクル)が実施される。臨床症状には次のものが含まれる:肝腫大を伴うまたは伴わない呼吸困難、脊髄圧迫と神経学的欠損、下大静脈圧迫と腎虚血;または尿路生殖管閉塞;または消化管閉塞と嘔吐;または代償療法に反応しない臨床的に重大な出血を伴う凝固障害。 1 不問 不問 不問 不問 2A/2Bc、d 不問 増幅なし 不問 不問 50%以上の切除、症状なし 4Se 1歳未満 増幅なし 予後良好 DI > 1 症状なし 表8は、低リスクおよび中リスク患者に対するANBL1232(NCT02176967)研究など、現在のCOGの研究に用いられている、非常に低リスクまたは低リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の分類スキームを示している。
表8.非常に低リスクまたは低リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の治療前分類スキームa INRG病期 組織学的分類 腫瘍分化度 11qの異常 倍数性 治療前リスクグループ GN = 神経節腫;GNB = 神経節芽腫;NA = 増幅なし。 a許可を得て転載。©(2015)米国臨床腫瘍学会。All rights reserved.Pinto N et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma, J Clin Oncol 33 (27), 2015: 3008-3017.[ 1 ] L1/L2 GN、成熟途中型、GNB、混在型 A(非常に低リスク) L1 すべて、GN、成熟途中型またはGNB、混在型を除く NA B(非常に低リスク) L2 生後18ヵ月未満 すべて、GN、成熟途中型またはGNB、混在型を除く NA なし D(低リスク) 生後18ヵ月以上 GNB、結節型神経芽腫 高分化型 NA なし E(低リスク) M 生後18ヵ月未満 NA 高二倍体 F(低リスク) MS 生後18ヵ月未満 NA なし C(非常に低リスク) (4S期神経芽腫患者の治療に関する詳しい情報については、本要約の4S期神経芽腫の治療のセクションを参照のこと。)
低リスク神経芽腫に対する治療法の選択肢
(画像で明らかにされた危険因子[L1]がみられないことまたは外科医の専門知識のいずれかに基づいて)切除可能と思われる限局性疾患の患者では、経験を積んだ外科医により腫瘍を切除すべきである。生物学が予後良好であると確定すれば、手術後の残存病変は再燃の危険因子とは考えられず、化学療法は適応とされない。数件の研究により、生物学的特性が予後良好で残存病変を有する患者は、イベントフリー生存(EFS)率が90%超、全生存(OS)率が99~100%という非常に優れた治療成績を有することが示されている。[ 2 ][ 3 ]神経芽腫が疑われる一部の患者が生検なしで観察されている;この戦略はCOGのANBL1232(NCT02176967)試験でさらに研究されている。[ 4 ][ 5 ]
低リスク神経芽腫に対する治療法の選択肢には以下のものがある:
- 手術とその後の観察。
- 手術を併用するまたは併用しない化学療法(手術後に症状のある疾患または切除不能の進行性疾患に対して)。
- 生検なしの観察(小さい副腎腫瘍を伴う周産期の神経芽腫に対して)。診断的生検なしに明らかな神経芽腫を観察したCOGの経験は限られており、研究段階にある。
- 放射線療法(緊急治療の場合のみ)。
手術を併用するまたは併用しない化学療法
手術を併用するまたは併用しない化学療法は以下の治療に用いられる:
- 症状のある疾患。化学療法はまた、症状(例、脊髄圧迫)のある低リスク患者(例、INSS 1期またはL1期)にも使用される。化学療法にはカルボプラチン、シクロホスファミド、ドキソルビシン、およびエトポシドを用いる。長期的影響を最小限にとどめるため、各薬物の累積投与量を低く抑える。[ 3 ]2A期/2B期または4S期疾患の症状のある患者は中リスクに分類され、化学療法を受ける。
- 手術後に切除不能の進行性疾患。
証拠(化学療法):
-
COG-P9641研究は、コンセンサスから導き出された因子に基づくリスク層別化を検証するための初期のCOG研究の1つであった。この第III相非ランダム化試験では、915人の患者が診断および生物学的検査のために組織を採取し、原発腫瘍を安全に最大限切除する初回手術を受けた。化学療法は、症状のある疾患を有するか、またはそのリスクのある患者、診断時に切除された腫瘍が50%未満または手術単独後に切除不能の進行性疾患を有した患者にのみ用いられた。[
3
]
- 1期:1期疾患の患者は、93%の5年EFS率および99%の5年OS率を達成した。
-
2A期および2B期:初回手術後に観察された2A期および2B期疾患の無症状の患者(n = 306)では、87%の5年EFS率および96%の5年OS率が得られた。2A期神経芽腫患者の方が2B期神経芽腫患者よりもEFSが有意に良好であったが(92% vs 85%;P = 0.0321)、OSにおける有意差は認められなかった(98% vs 96%;P = 0.2867)。(2A期および2B期疾患の無症状の患者で95%の3年OS率を達成するという)研究の主要目的は達成された。
2B期神経芽腫患者のうち、予後不良な組織像の患者(EFS、72%;OS、86%)または二倍体腫瘍の患者(EFS、75%;OS、84%)、または生後18ヵ月を超える患者ではEFS率およびOS率が低かった。2B期、二倍体腫瘍、および予後不良な組織像を有する患者の転帰は特に不良で(EFS、54%;OS、70%)、さらに1pのヘテロ接合性の消失を示す少数の患者で生存者はなく、死亡はすべて生後18ヵ月を超える小児にみられた。
-
診断時に無症状で初回手術後に観察された患者:最初の915人の患者のうち、800人が診断時に無症状で、初回手術後は観察された。この集団における患者の11%が疾患の再発または進行を経験した。即時化学療法(中央値、4サイクル;範囲1~8サイクル)を受けた患者115人中、81%が非常に良好な部分奏効以上の反応を示した。化学療法後、10%の患者で疾患の再発または進行がみられた。
手術単独で治療された患者に対する5年EFS率は89%でOS率の推定値は97%であった一方、手術と即時化学療法で治療された患者に対する5年EFS率は91%でOS率の推定値は98%であった。
- MYCN増幅:MYCN増幅が認められる腫瘍の影響が1期神経芽腫患者において解析された。MYCNの増幅が認められない患者に対する5年EFS率は93%でOS率は99%であった一方、MYCN増幅が認められた腫瘍に対する5年EFS率は70%(P = 0.0042)でOS率は80%(P < 0.001)であった。
生検なしの観察
生検なしの観察が小さい副腎腫瘍を伴う周産期の神経芽腫の治療に用いられている。
COGの研究で、スクリーニングまたは偶然に行った超音波検査により生後6ヵ月未満の乳児に発見された神経芽腫が疑われる選択された小さいINSS 1期または2期の副腎腫瘤は、組織診断の確定と外科的介入をしなくとも安全に経過観察でき、そうすれば、新生児に手術によって起こりうる合併症を回避できることが確認された。[ 4 ]患者は、介入の必要を示す腫瘍の増殖、または転移を発見するために頻繁に観察される。手術なしの観察を許可する基準の拡大を含めた追加の研究がCOG ANBL1232(NCT02176967)研究で進行中である(表9を参照のこと)。
証拠(生検なしの観察):
-
COG-ANBL00P2研究により、3.1cm未満の固形性の副腎腫瘍(または5cm未満の嚢胞性腫瘍)でINSS 1期疾患を有する生後6ヵ月未満の患者において待機観察は安全であることが報告された。[
4
]
- 81%の患者が自然退縮を示し、外科的介入が回避された。
- 適格患者87人中83人が生検または切除なしに観察され、最終的に手術を受けた患者はわずか16人(19%)であった。
- (神経芽腫のイベントに対する)3年EFS率は97.7%、OS率は100%であった。
見たところ2B期および3期でMYCNの増幅は認められず、生物学的特性が予後良好な神経芽腫の生後12ヵ月以下の無症状の乳児において、切除を試みる必要性、診断時かまたはそれより遅らせるかについては議論がある。ドイツの1件の臨床試験において、これらの患者の一部が生検または部分切除後に化学療法または放射線療法なしに観察され、多くの患者は局所進行を認めず、追加の切除は実施されなかった。[ 5 ]このコホートはまた、COG ANBL1232(NCT02176967)研究でも評価されている(詳しい情報については、本要約の臨床評価段階にある治療法の選択肢のセクションを参照のこと)。L2腫瘍を有し、生物学的特性が予後良好な生後18ヵ月未満の乳児が、腫瘍生検後に観察されている。
臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
ANBL1232(NCT02176967)(高リスク以外の神経芽腫を有する若年患者の治療における反応および生物学的特性に基づく危険因子を指針にした治療):この第III相試験では、高リスク以外の神経芽腫を有する若年患者の治療において、反応および生物学的特性に基づく危険因子を指針にした治療がどの程度良好に機能するかが研究されている。表9ではANBL1232試験における低リスク神経芽腫患者に対する治療割り付けについて記述している。低リスクおよび中リスクの神経芽腫を有する患者の多くはCOG試験で研究されていないが、治療成績の推移を把握するため、神経芽腫の生物学的研究であるANBL00B1(NCT00904241)に登録されている。
表9.低リスク神経芽腫に対するANBL1232の治療割り付け INRG病期 生物学的特性(組織像およびゲノム情報 年齢 その他 治療 INRG = 国際神経芽腫リスクグループ。 aゲノムの特徴としては、MYCN遺伝子の増幅、染色体断片異常(1p、3p、4p、11qにおける体細胞コピー数の減少または1p、2p、17qにおける体細胞コピー数の増加)、DNA指数が挙げられる。 b予後良好なゲノムの特徴とは、上で定義した染色体断片異常が認められず、染色体全体の増加が1つ以上または高二倍体の腫瘍(DNA指数 > 1)と定義される。 c症状なしとは、命を脅かす症状が認められず、差し迫った神経学的後遺症などの続発症(例、神経学的障害が存在するか差し迫った硬膜外または髄腔内腫瘍、眼窩周囲または頭蓋冠を拠点とする病変で脳神経障害が存在するか差し迫っている、腫瘍により重要臓器の機能が解剖学的または機械的に障害を受けている[腹部コンパートメント症候群、尿路閉塞など])が認められないことと定義される。 L1 生後12ヵ月未満 直径5cm未満;非副腎性であれば確認検査 研究での生検なしの観察 L2 予後良好な組織像およびゲノム情報b 生後18ヵ月未満 症状なしc 研究での観察 MS すべての組織像およびゲノム情報 生後3ヵ月未満 肝腫大が存在するか、進展している、あるいは症状が認められる 即時治療、反応に基づく化学療法、プロトコルに従う 予後良好な組織像およびゲノム情報b 生後3ヵ月未満 症状なしcで、肝腫大は存在も進展もしていない 臨床的スコアリングシステムに従って観察 予後良好な組織像およびゲノム情報b 生後3~18ヵ月 症状なしc 臨床的スコアリングシステムに従って観察 症状が認められる 反応に基づく化学療法、プロトコルに従う
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Matthay KK, Perez C, Seeger RC, et al.: Successful treatment of stage III neuroblastoma based on prospective biologic staging: a Children's Cancer Group study. J Clin Oncol 16 (4): 1256-64, 1998.[PUBMED Abstract]
- Strother DR, London WB, Schmidt ML, et al.: Outcome after surgery alone or with restricted use of chemotherapy for patients with low-risk neuroblastoma: results of Children's Oncology Group study P9641. J Clin Oncol 30 (15): 1842-8, 2012.[PUBMED Abstract]
- Nuchtern JG, London WB, Barnewolt CE, et al.: A prospective study of expectant observation as primary therapy for neuroblastoma in young infants: a Children's Oncology Group study. Ann Surg 256 (4): 573-80, 2012.[PUBMED Abstract]
- Hero B, Simon T, Spitz R, et al.: Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol 26 (9): 1504-10, 2008.[PUBMED Abstract]
- Iehara T, Hamazaki M, Tajiri T, et al.: Successful treatment of infants with localized neuroblastoma based on their MYCN status. Int J Clin Oncol 18 (3): 389-95, 2013.[PUBMED Abstract]
- 中リスク神経芽腫の治療
-
以前に用いられた小児腫瘍学グループ(COG)の神経芽腫中リスク群への割り付け基準が表10に記述されている。これらの基準はほとんどがCOG-A3961(NCT00003093)研究から得られたものであり、COG ANBL0531(NCT00499616)研究で用いられた。
表10.COG-A3961研究に用いられた小児腫瘍学グループ(COG)による神経芽腫の中リスク群分類スキームa INSS病期 年齢 の状態 INPCの組織型 DNA倍数性 その他 2A/2B 不問 増幅なし 不問 不問 50%以上の切除、症状あり 不問 増幅なし 不問 不問 50%未満の切除 不問 増幅なし 不問 不問 生検のみ 3c 1歳半未満 増幅なし 不問 不問 1歳半以上 増幅なし 予後良好 不問 4c 1歳未満 増幅なし 不問 不問 1歳-1歳半未満 増幅なし 予後良好 DI > 1 4Sd 1歳未満 増幅なし 不問 DI = 1 症状なしまたは症状あり 1歳未満 欠落 欠落 欠落 生検を行うには状態が悪すぎる 1歳未満 増幅なし 不問 不問 症状が認められる 1歳未満 増幅なし 予後不良 不問 症状なしまたは症状あり COG-A3961(NCT00003093)中リスク研究の結果[ 1 ]は、ヨーロッパの研究からの結果と関連しており、ANBL0531(NCT00499616)試験において用いられた中リスク分類の再定義に用いられた。[ 2 ]進行中のANBL00B1(NCT00904241)生物学的研究向けのANBL0531リスク分類の修正が表10に示されている。
表11は進行中のCOG研究に用いられている、中リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の分類を示している。
表11.中リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の治療前分類スキームa INRG病期 組織学的分類 腫瘍分化度 11qの異常 倍数性 治療前リスクグループ GN = 神経節腫;GNB = 神経節芽腫;NA = 増幅なし。 a許可を得て転載。©(2015)米国臨床腫瘍学会。All rights reserved.Pinto N et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma, J Clin Oncol 33 (27), 2015: 3008-3017.[ 3 ] L2 生後18ヵ月未満 すべて、GN、成熟途中型またはGNB、混在型を除く NA あり G(中リスク) 生後18ヵ月以上 GNB、結節型神経芽腫 低分化型または未分化型 NA あり H(中リスク) NA なし H(中リスク) M 生後12ヵ月未満 NA 二倍体 I(中リスク) 生後12ヵ月~18ヵ月未満 NA 二倍体 J(中リスク) (4S期神経芽腫患者の治療に関する詳しい情報については、本要約の4S期神経芽腫の治療のセクションを参照のこと。)
中リスク神経芽腫に対する治療法の選択肢
中リスク神経芽腫に対する治療法の選択肢には以下のものがある:
- 手術を併用するまたは併用しない化学療法。
- 手術と観察(乳児に対して)。
- 放射線療法(必要な場合)。
手術を併用するまたは併用しない化学療法
中リスクに分類された患者は手術と4~8サイクルの術前補助化学療法(カルボプラチン、シクロホスファミド、ドキソルビシン、およびエトポシド;化学療法レジメンによる長期的影響を最小限にとどめるため、各薬物の累積投与量は低く抑えられる)による治療が成功している (COG-A3961、ANBL0531[NCT00499616])。一般に、腫瘍の生物学的特性が予後不良な患者が8サイクルの化学療法を受けるのに対し、生物学特性が予後良好な患者は4サイクルの化学療法を受ける。 COG-A3961第III相試験で、中リスク神経芽腫患者に対しては、優れた生存を維持しながら治療を大幅に弱められることが実証された。[ 1 ]日本における非ランダム化臨床試験でも、MYCN遺伝子の増幅が認められない3期神経芽腫の乳児に対してきわめて優れた治療成績が報告された。[ 4 ]COG ANBL0531(NCT00499616)研究では、中リスク腫瘍を有する小児の複数サブセットに対して化学療法の期間および強度のさらなる縮小に成功した。
腹部神経芽腫が腎臓に及んでいると考えられる症例では、化学療法のコースが実施される前に腎摘出術は施行されない。[ 5 ]
初回化学療法が限局性神経芽腫を有するすべての中リスク乳児に適応とされるかどうかについては、さらなる研究が必要である。
証拠(手術を併用するまたは併用しない化学療法):
- 北米では、COG-A3961研究によりリスクに基づいた神経芽腫治療計画の研究が進められ、この治療計画では、年齢、神経芽腫国際病期分類システム(INSS)の病期、および腫瘍の生物学的特性(すなわち、MYCN遺伝子増幅、国際神経芽腫病理学分類システム、およびDNA倍数性)に基づいて、全患者を低リスク群、中リスク群、または高リスク群に割り付けた。その後COG ANBL0531(NCT00499616)試験において、中リスク群が研究された。
A3961研究では、切除不能な限局性のMYCN増幅が認められない腫瘍を有する患者およびMYCN増幅が認められない4期腫瘍を有する乳児において、以前の治療計画と比較して治療の全体的な縮小について調査された。中リスク群は4~8サイクルの中用量の術前補助化学療法(カルボプラチン、シクロホスファミド、ドキソルビシン、およびエトポシド)と、場合によっては追加の手術を受け、放射線療法は回避された。中リスク腫瘍(3期、4期、および4S期)の患者464人のうち、69.6%が高二倍体および予後良好な組織像として定義される予後良好な特性を有し、4サイクルの化学療法を受ける群に割り付けられた。[ 1 ]
ANBL0531(NCT00499616)研究では、同様にMYCN増幅が認められず、年齢および病期で定められた404人の小児グループが治療され、いくつかの患者サブセットで化学療法の期間および強度が縮小された。この研究では、生物学的特性が予後不良な生後12~18ヵ月の4期の患者が追加された。[ 2 ]
- A3961研究では、術前補助化学療法の実施により、以前は切除不能であった腫瘍の99.6%で少なくとも部分切除が可能になった。いずれの研究でも、実施された切除の程度(完全切除 vs 不完全切除)による全生存(OS)の有意差は示されなかった。
- A3961およびANBL0531研究において、局所放射線療法を受けた患者は3%未満であり、後者の研究では進行性の肝腫大または脊髄圧迫が認められる患者のみが放射線療法を受けた。A3961研究における3年イベントフリー生存(EFS)率は88%、OS率は95%であった。その後のANBL0531研究において、3年EFS率は83%、OS率は95%であった。[ 2 ]
- 3年EFS率は、予後良好な病理組織型の3期疾患の患者(n = 269)で92%、4S期疾患で、二倍体または予後不良な組織型などの予後不良な生物学的特性を持つ患者(n = 31)で90%、4期疾患の乳児(n = 176)で81%であった(3期および4S期 vs 4期についてP < 0.001)。
- 乳児のみが倍数性により層別化され、二倍体腫瘍を持つ乳児が4サイクル vs 8サイクルの化学療法を受けた。3年OS率の推定値は3期疾患で98%、4S期疾患で97%、4期疾患で93%であった(3期および4S期 vs 4期についてP = 0.002)。二倍体を有する乳児は、転帰が不良であり(P = 0.03)、研究対象の二倍体を有する全患児を合併した場合も同様であった(P = 0.03)。
- 予後良好な生物学的特性を有する患者のOS率について、持続性病変に対し8サイクルの化学療法を受けた患者(100%)と4サイクルの化学療法を受けた患者(96%)間で差はみられなかった。
- 予期しない毒性作用はみられなかった。
- ドイツの1件のプロスペクティブ臨床試験では、1歳以下で1期、2期、または3期腫瘍を有し、組織型が確認され、MYCNの増幅が認められない乳児340人が登録された。腫瘍による臓器不全症状を有する57人の乳児には、診断時に化学療法が実施された。低リスク手術を受けた乳児190人では腫瘍が完全にまたはほぼ完全に切除された。年齢または臓器転移のために高リスク手術を用いることなく腫瘍を切除できなかった乳児、計93人は化学療法を用いずに観察された。[
6
]
- 化学療法を受けた乳児に対する3年OS率はきわめて優れていた(95%)。
- 33人の乳児では追加の手術が回避され、72人の乳児では化学療法が回避された。
- 治療を行わずに観察された乳児に対する3年OS率は99%であった。腫瘍切除術未施行の乳児における無転移生存率は94%で、手術または化学療法で治療された乳児に対する割合との差は認められなかった(追跡期間中央値、58ヵ月)。
- 腫瘍切除術未施行の乳児93人中44人では自然退縮が認められ(17人では完全退縮が認められた)、39人では進行が認められた。
- 研究者らは、限局性神経芽腫の乳児には、生後1年を過ぎてから退縮が観察されているため、経過観察戦略が適切であると提唱した。
- プロスペクティブなInfant Neuroblastoma European Study(EURO-INF-NB-STUDY-1999-99.1)では、中用量の化学療法が有効であると示された;切除不能で非転移性の神経芽腫を有し、MYCNの増幅が認められない乳児の約半数では安全な外科的切除を受け、長期の有害作用は回避された。[
7
][証拠レベル:3iiA]
- 5年OS率は99%およびEFS率は90%であった(追跡期間中央値、6年)。
- この研究で、外科的切除を受けた乳児のEFSは、手術を受けなかった乳児よりも良好であった。
- プロスペクティブなInternational Society of Paediatric Oncology Europe Neuroblastoma(SIOPEN)試験では、MYCNの増幅が認められない2期または3期の切除不能神経芽腫の乳児のほか、国際神経芽腫病理学分類で予後良好な生後12~18ヵ月の小児の治療を行った。[
8
][証拠レベル:3iiD]
- 従来の化学療法を用いたEFS率は98%であった。
- こうした結果はCOG-A3961試験の結果とほぼ同じである。
- 播種性神経芽腫でMYCN遺伝子の増幅は認められない乳児を対象にしたヨーロッパの2件のプロスペクティブ試験において、INSS 3期原発腫瘍または骨格シンチグラフィ陽性であるが放射線学的骨転移は認められない(ほとんどはメタヨードベンジルグアニジンスキャンで確認されたが、少数はテクネチウム99mTc骨スキャンで確認された)乳児は致死的症状または臓器不全の危険性がある症状がみられない限り、化学療法による治療を開始されなかった。実施された場合、化学療法は短期用量および標準用量の化学療法で投与された。[
9
]
- INSS 4S期疾患が認めらない41人の患者におけるOS率は、初回化学療法の実施に関係なく100%であった。
- 骨格、肺、および中枢神経系への明らかな(放射性核種スキャンにより確認されるが、単純X線またはコンピュータ断層撮影[CT]スキャンでは確認されない)転移を有する乳児の2年OS率は96%であった(n = 45)。
- いずれのプロトコルでも手術または化学療法に関連した合併症で死亡した患者はいなかった。
手術と観察(乳児に対して)
3期または4期神経芽腫の無症状の乳児については、手術と観察で良好な治療成績を示すヨーロッパの研究があるため、これらの乳児全員に化学療法を実施する必要があるかどうかについては、議論の余地がある。[ 9 ]
証拠(乳児における手術と観察):
- フランスの1件の研究において、原発腫瘍が正中線を越えて浸潤している(原発腫瘍がINSS 3期で転移が4S期カテゴリーに限定される)か、単純X線撮影および/またはCTで明らかとなる皮質骨の変化は伴わず骨シンチグラフィが陽性であるために4期に分類された乳児は、それほど積極的ではない化学療法で、他の4期の乳児よりも転帰が良好であると報告された(EFS、90% vs 27%)。[ 10 ]しかしながら、皮質骨病変が放射線学的に示された乳児のかなり多くが、MYCN増幅も示す腫瘍を有した。[ 10 ]
- フランスでの研究を基に、SIOPENにより、播種性神経芽腫でMYCNの増幅が認められない乳児125人(INSS 3期原発腫瘍または骨格シンチグラフィ陽性の乳児、n = 41)を対象にして、症状がみられない場合にこれらの患児を観察で管理できるかどうかを判断するためプロスペクティブ試験が実施された。ただし、治療担当医師は常に経過観察戦略に従ったわけではない。[
9
]
- 2年OS率について、切除不能原発腫瘍を有した患者と原発腫瘍を切除された患者(97% vs 100%)間および放射線学的異常がみられない骨格シンチグラフィ陰性の患者と陽性の患者(100% vs 97%)間で有意差は認められなかった。
- ドイツの1件のプロスペクティブ臨床試験では、1歳以下で1期、2期、または3期腫瘍を有し、組織型が確認され、MYCNの増幅が認められない乳児340人が登録された。切除を受けた乳児190人中、3期神経芽腫を有していた乳児は8人であった。年齢または臓器転移のために高リスク手術を用いることなく腫瘍を切除できなかった乳児、計93人は化学療法を用いずに観察され、このうち21人が3期の患者であった。3期の患者41人を含む57人の乳児が脅迫的な症状をコントロールするために化学療法で治療された。[
6
]
- 3年OS率は、腫瘍切除術未施行の乳児(99%)、化学療法を受けた乳児(95%)、および腫瘍を切除された乳児(98%)の集団全体で非常に優れていた(P = 0.45)。
放射線療法
中リスク疾患を有する小児に対する放射線療法は、化学療法による治療中に疾患が進行したか、化学療法による治療後に切除不能な進行疾患が認められた患者にのみ使用される。
中リスク神経芽腫を有する患者に対する強度縮小化学療法を検証した1件のプロスペクティブ・ランダム化COG試験では、患者479人中12人(2.5%)のみが局所放射線療法(21Gy)を受けた。1人の患者が4S期疾患を有し、5人の患者が3期疾患を有し、6人の患者が4期疾患を有した。初回治療にもかかわらず臨床的な悪化(8人の患者)、肉眼的残存病変および不良な生物学的特性(3人の患者)、または治療後の再燃(1人の患者)に対して放射線療法が実施された。[ 1 ][ 11 ][ 12 ]
臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
ANBL1232(NCT02176967)(高リスク以外の神経芽腫を有する若年患者の治療における反応および生物学的特性に基づく危険因子を指針にした治療):この第III相試験では、高リスク以外の神経芽腫を有する若年患者の治療において、反応および生物学的特性に基づく危険因子を指針にした治療がどの程度良好に機能するかが研究されている。表12ではANBL1232試験における中リスク神経芽腫患者に対する治療割り付けについて記述している。中リスク患者の多くはこの研究に適格ではない;これらの患者はCOGの生物学的研究、ANBL00B1(NCT00904241)に登録され、追跡可能である。
表12.中リスク神経芽腫に対するANBL1232の治療割り付け INRG病期 生物学的特性(組織像およびゲノム情報 年齢 その他 治療 aゲノムの特徴としては、MYCN遺伝子の増幅、染色体断片異常(1p、3p、4p、11qにおける体細胞コピー数の減少または1p、2p、17qにおける体細胞コピー数の増加)、DNA指数が挙げられる。 b予後良好なゲノムの特徴とは、上で定義した染色体断片異常が認められず、染色体全体の増加が1つ以上または高二倍体の腫瘍(DNA指数 > 1)と定義される。 c症状なしとは、命を脅かす症状が認められず、差し迫った神経学的後遺症などの続発症(例、神経学的障害が存在するか差し迫った硬膜外または髄腔内腫瘍、眼窩周囲または頭蓋冠を拠点とする病変で脳神経障害が存在するか差し迫っている、腫瘍により重要臓器の機能が解剖学的または機械的に障害を受けている[腹部コンパートメント症候群、尿路閉塞など])が認められないことと定義される。 d予後不良なゲノムの特徴は、染色体断片異常(1p、3p、4p、11qにおける体細胞コピー数の減少または1p、2p、17qにおける体細胞コピー数の増加)の存在、または二倍体腫瘍(DNA指数 = 1)によって定義される。これには、コピーニュートラル(コピー数の変化を伴わない)ヘテロ接合性の消失が含まれる。 eANBL1232研究は、MYCNが増幅していない腫瘍を有する患者のみ適格である。 L2 予後良好な組織像およびゲノム情報b 生後18ヵ月未満 症状なしc 研究での観察 MS 予後良好な組織像およびゲノム情報b 生後3~18ヵ月 症状なしc 臨床的スコアリングシステムに従って観察 症状が認められる 反応に基づく化学療法、プロトコルに従う 予後不良d/組織像およびゲノム情報が不明e 生後18ヵ月未満 反応に基づく化学療法、プロトコルに従う INRG = 国際神経芽腫リスクグループ。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Baker DL, Schmidt ML, Cohn SL, et al.: Outcome after reduced chemotherapy for intermediate-risk neuroblastoma. N Engl J Med 363 (14): 1313-23, 2010.[PUBMED Abstract]
- Twist CJ, Schmidt ML, Naranjo A, et al.: Maintaining Outstanding Outcomes Using Response- and Biology-Based Therapy for Intermediate-Risk Neuroblastoma: A Report From the Children's Oncology Group Study ANBL0531. J Clin Oncol 37 (34): 3243-3255, 2019.[PUBMED Abstract]
- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Iehara T, Hamazaki M, Tajiri T, et al.: Successful treatment of infants with localized neuroblastoma based on their MYCN status. Int J Clin Oncol 18 (3): 389-95, 2013.[PUBMED Abstract]
- Shamberger RC, Smith EI, Joshi VV, et al.: The risk of nephrectomy during local control in abdominal neuroblastoma. J Pediatr Surg 33 (2): 161-4, 1998.[PUBMED Abstract]
- Hero B, Simon T, Spitz R, et al.: Localized infant neuroblastomas often show spontaneous regression: results of the prospective trials NB95-S and NB97. J Clin Oncol 26 (9): 1504-10, 2008.[PUBMED Abstract]
- Rubie H, De Bernardi B, Gerrard M, et al.: Excellent outcome with reduced treatment in infants with nonmetastatic and unresectable neuroblastoma without MYCN amplification: results of the prospective INES 99.1. J Clin Oncol 29 (4): 449-55, 2011.[PUBMED Abstract]
- Kohler JA, Rubie H, Castel V, et al.: Treatment of children over the age of one year with unresectable localised neuroblastoma without MYCN amplification: results of the SIOPEN study. Eur J Cancer 49 (17): 3671-9, 2013.[PUBMED Abstract]
- De Bernardi B, Gerrard M, Boni L, et al.: Excellent outcome with reduced treatment for infants with disseminated neuroblastoma without MYCN gene amplification. J Clin Oncol 27 (7): 1034-40, 2009.[PUBMED Abstract]
- Minard V, Hartmann O, Peyroulet MC, et al.: Adverse outcome of infants with metastatic neuroblastoma, MYCN amplification and/or bone lesions: results of the French society of pediatric oncology. Br J Cancer 83 (8): 973-9, 2000.[PUBMED Abstract]
- Matthay KK, Perez C, Seeger RC, et al.: Successful treatment of stage III neuroblastoma based on prospective biologic staging: a Children's Cancer Group study. J Clin Oncol 16 (4): 1256-64, 1998.[PUBMED Abstract]
- Kim C, Choi YB, Lee JW, et al.: Excellent treatment outcomes in children younger than 18 months with stage 4 MYCN nonamplified neuroblastoma. Korean J Pediatr 61 (2): 53-58, 2018.[PUBMED Abstract]
- 高リスク神経芽腫の治療
-
以前に用いられた小児腫瘍学グループ(COG)の神経芽腫高リスク群への割り付け基準が表13に記述されている。
表13.小児腫瘍学グループ(COG)神経芽腫の高リスク群分類スキーム INSS病期 年齢 の状態 INPCの組織型 DNA倍数性 その他 2A/2Bb 不問 増幅あり 不問 不問 切除の程度は不問 3c 1歳半以上 増幅なし 予後不良 不問 不問 増幅あり 不問 不問 4c 1歳未満 増幅あり 不問 不問 1歳-1歳半未満 増幅あり 不問 不問 1歳-1歳半未満 不問 不問 DI = 1 1歳-1歳半未満 不問 予後不良 不問 1歳半以上 不問 不問 不問 4S 1歳未満 増幅あり 不問 不問 症状なしまたは症状あり 表14は、ANBL1531(NCT03126916)など、進行中のCOG研究に用いられている、高リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の分類を示している。
表14.高リスクの神経芽腫についての国際神経芽腫リスクグループ(INRG)の治療前分類スキームa INRG病期 組織学的分類 腫瘍分化度 11qの異常 倍数性 治療前リスクグループ GN = 神経節腫;GNB = 神経節芽腫;NA = 増幅なし。 a許可を得て転載。©(2015)米国臨床腫瘍学会。All rights reserved.Pinto N et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma, J Clin Oncol 33 (27), 2015: 3008-3017.[ 1 ] L1 すべて、GN、成熟途中型またはGNB、混在型を除く 増幅あり K(高リスク) L2 生後18ヵ月以上 GNB、結節型神経芽腫 低分化型または未分化型 増幅あり N(高リスク) M 生後18ヵ月未満 増幅あり O(高リスク) 生後18ヵ月以上 P(高リスク) 生後18ヵ月未満 NA あり Q(高リスク) 増幅あり R(高リスク) 4S期神経芽腫の乳児の約8~10%がMYCNの増幅が認められる腫瘍を有し、通常は高リスクプロトコルで治療される。ヨーロッパの1件の研究において、4期および4S期疾患でMYCNの増幅が認められる乳児に対する全体的なイベントフリー生存(EFS)率および全生存(OS)率は治療後2~5年経過時でわずか30%であった。[ 2 ]
高リスク神経芽腫の患児について、現在の治療による5年OS率は2005年から2010年の間に診断された患者で約50%である。[ 1 ][ 3 ]積極的に治療しても、高リスク神経芽腫はのちに再発する場合があり、治療終了後5年以上経過してから再発することもある。[ 4 ][ 5 ]
INRGのデータベースからの研究で、リンパ節にのみ遠隔転移が認められ(4N期と呼ばれる)、腫瘍の生物学的特性が良好で、治療成績の良い(5年OS率、85%)傾向がある患者146人が明らかにされ、高リスク4期患者のこの特殊なサブグループにはそれほど強力ではない治療法を検討できることが示唆されている。[ 6 ]
高リスク神経芽腫に対する治療法の選択肢
高リスク神経芽腫患者の治療成績は、ランダム化試験で生存率が最近改善しているにもかかわらず依然として不良のままである。
高リスク神経芽腫に対する治療法の選択肢には典型的に以下のものがある:
化学療法、手術、SCTと併用するタンデムサイクルの骨髄除去的治療、放射線療法、およびジヌツキシマブとIL-2/GM-CSFおよびイソトレチノインとの併用
高リスク神経芽腫患者に対する治療は一般的に以下の3段階に分けられる:
寛解導入期
最も一般的に用いられる寛解導入療法の基本骨格として、シスプラチンおよびエトポシドとビンクリスチン、シクロホスファミド、およびドキソルビシンとの交替療法のサイクルが用量を強化して実施される。[ 7 ]再燃患者では抗神経芽腫活性が示されたことから、このレジメンにトポテカンおよびシクロホスファミドが追加された。[ 8 ]4サイクルの化学療法後または寛解導入化学療法終了時の治療への反応は高リスク療法完了時のEFSと相関している。[ 9 ][ 10 ][ 11 ]4件の連続したCOG高リスク試験の患者407人の多変量解析では、11qのヘテロ接合性の消失は疾患進行の有意な予測因子であることが示され、11qのヘテロ接合性の消失が認められない場合は寛解導入療法終了時の完全奏効率と部分奏効率の両方が高くなった。[ 11 ][証拠レベル:3iii]
化学療法への反応がみられれば、通常はその後に原発腫瘍の切除が試みられる。寛解導入化学療法前または後のいずれに実施する肉眼的完全切除が有益かについては、見解が一致していない。[ 12 ]
証拠(化学療法前または後の原発腫瘍の切除):
- COG A3973(NCT00004188)研究では、寛解導入化学療法後に肉眼的完全切除が試みられた患者220人の手術が中央審査された。切除の程度は外科医の推定により、90%以上 vs 90%未満と判定されたが、画像検査による中央審査との一致はわずか63%であったことが明らかにされた。[
13
][証拠レベル:3iiA]
- にもかかわらず、外科医の評価による90%以上 vs 90%未満の切除は、それぞれ46% vs 38%のEFS率(P = 0.01)およびそれぞれ8.5% vs 20%の累積局所再燃率を予測した。
- OSにおける有意差は認められなかった(57% vs 49%、P = 0.3)。
- 著者の結論によると、局所再発を低下させるために90%以上の切除を達成する努力の継続が支持された。
- 高リスク神経芽腫の小児87人を対象にした1件の単一施設のレトロスペクティブ研究により、ほぼ完全な(90%を超える)切除と比較して、肉眼的完全切除の有意な有益性は実証されなかった。[
14
][証拠レベル:3iiD]
- しかしながら、結果から、90%を超える切除は90%未満の切除と比較してOSが改善されることが示唆されている。
転移性疾患を有する高リスク患者において診断時または化学療法実施後に腫瘍を完全切除する積極的な外科的アプローチの潜在的有益性は、明確には示されていない。数件の研究が、診断時の原発腫瘍完全摘出による生存率の改善を報告している;しかしながら、このような患者の治療成績は、外科的な切除範囲よりも腫瘍の生物学的特性の方に左右されており、腫瘍の生物学的特性そのものによって切除可能かどうかが決まるであろう。[ 15 ][ 16 ][ 17 ]生後18ヵ月を超える4期患者において化学療法後に原発腫瘍塊を肉眼的に完全切除することに利点があるかどうかについては、見解が分かれている。[ 13 ][ 16 ][ 17 ][ 18 ]
地固め療法期
高リスクレジメンの地固め療法期には、骨髄除去的化学療法およびSCTが実施され、(寛解導入化学療法中に集められる)自家幹細胞で救助しなければ致死量の骨髄除去的化学療法による微小残存腫瘍(MRD)の根絶および骨髄への植え付けが図られる。数件の大規模ランダム化比較研究により、3年EFS率は従来の化学療法(22~31%)よりもSCT治療(31~47%)により改善することが示されている。[ 19 ][ 20 ][ 21 ]以前は、SCT前処置レジメンにおいて全身放射線照射が用いられていた。最新のプロトコルでは、SCTと併用するタンデム化学療法またはSCTの前処置レジメンとしてカルボプラチン/エトポシド/メルファランまたはブスルファン/メルファランが用いられる。[ 22 ][証拠レベル:3iA]
証拠(骨髄除去的化学療法および幹細胞救助):
- 地固め療法についてのヨーロッパの1件の大規模多施設試験で、多剤併用寛解導入レジメン(シスプラチン、カルボプラチン、シクロホスファミド、ビンクリスチン、およびエトポシド±トポテカン、ビンクリスチン、およびドキソルビシン)を完了し、十分な奏効を得た患者を、ブスルファン/メルファランまたはカルボプラチン/エトポシド/メルファランのいずれかを受けるようにランダムに割り付けた。[
23
][証拠レベル:1iiA]
- シスプラチン、カルボプラチン、シクロホスファミド、ビンクリスチン、およびエトポシドによる寛解導入療法、ならびにブスルファン/メルファランによるSCT用の地固め療法によりEFSの改善が得られたが、OSまたは重度の有害事象に対する効果はみられなかった。
- 2サイクルの逐次的骨髄除去的化学療法および幹細胞救助のタンデム実施は、高リスク神経芽腫の患者に実施可能であることが示された。[ 24 ]
- 1件のランダム化臨床研究(COG-ANBL0532)で幹細胞救助を併用する2サイクル vs 1サイクルの骨髄除去的化学療法の効力が検証された。[
25
][証拠レベル:1iiA]4期神経芽腫で6サイクルの寛解導入化学療法を受けた生後18ヵ月を超える小児が続いて、カルボプラチン/エトポシド/メルファランを併用する単回の(シングル)自家SCTまたはシクロホスファミド/チオテパと併用するタンデム移植とその後の用量を抑えたカルボプラチン/エトポシド/メルファラン投与にランダムに割り付けられた。2つ目の別個の試験では、腫瘍床への放射線照射後、ほとんどの患者はイソトレチノイン単独またはイソトレチノインとジヌツキシマブおよび免疫増強の併用を受けるようにランダムに割り付けられた。
- ランダム化時からの3年EFS率はタンデム移植群で62%およびシングルSCT群で48%であった(P = 0.006)。3年OS率はタンデム自家SCT群で74%およびシングル自家SCT群で69%であった(P = 0.25)。
- ランダム化後にジヌツキシマブおよび免疫強化療法を受けた患者の3年EFS率は、タンデムSCT群が73%およびシングルSCT群が55%であり(P = 0.004)、OS率はそれぞれ84%および74%であった。[ 25 ][証拠レベル:1iiDi]
- これらの研究結果には重大な制限がある:この研究に登録されたかなり多くの患者が(患者および医療提供者の好みのために)治療にランダムに割り付けられておらず、選択バイアスを招いた可能性がある。
(移植に関する詳しい情報については、小児の造血細胞移植に関するPDQ要約の自家造血細胞移植のセクションを参照のこと。)
骨髄除去的治療後は、(完全切除が実施されたかどうかによらず)、原発腫瘍部位への放射線照射が適応とされる。寛解導入療法後にメタヨードベンジルグアニジン(MIBG)陽性が持続する転移部位の治療は、しばしば骨髄除去的治療後に実施される。放射線療法の至適線量については明らかにされていないが、複数の非ランダム化レトロスペクティブ研究により、SCT前に肉眼的残存病変が認められる場合は原発部位への30~36Gyの線量で局所制御が改善することが示唆されている。[ 26 ]
転移性病変部位への照射は、個々の場合に基づいて、または研究に登録された患者に対するプロトコルガイドラインに従って決定される。骨転移した神経芽腫の再燃は、しばしば前疾患の解剖学的部位に生じる。診断時に特定された転移部位で第一選択療法時に放射線を照射されなかった場所は、以前に照射を受けた転移部位に比べて、最初の再燃時の浸潤リスクが高いようであった。[ 27 ]これらの観察は、高リスク患者で寛解導入化学療法後もMIBG取り込みにより持続する転移巣に対する現在の照射パラダイムを裏付けている。[ 28 ]寛解導入化学療法後にびまん性骨転移が残存する症例では、大量化学療法を実施した後、地固め的放射線療法前に再評価される。骨髄の50%を超える照射は勧められない。
高リスク神経芽腫の原発腫瘍を治療するための陽子線治療の予備的結果が発表されており、効力および毒性が受け入れられるものであることが実証されている。[ 29 ]
地固め後療法期
地固め後療法はSCT後に存在しうるMRDを治療するためにデザインされている。[ 30 ]放射線療法は原発部位およびときに完全に消失していない転移領域を治療するために用いられている。SCT後の寛解期にある高リスク患者について、ジヌツキシマブをGM-CSFおよびIL-2と併用し、イソトレチノインとともに投与すると、EFSが改善することが示された。[ 31 ][ 32 ]
証拠(すべての治療):
- 1件のランダム化研究では、大量化学療法およびパージした自家骨髄移植(ABMT)の併用と、3サイクルの集中的な地固め化学療法とが比較された。さらに、化学療法またはABMTの完了後、この研究の患者はその後、継続治療を実施しない群とイソトレチノインを6ヵ月間投与する群とにランダムに割り付けられた。以下に示すEFSおよびOSの結果は各ランダム化の時期からの転帰を反映している。[
19
];[
30
][証拠レベル:1iiA]
- 5年EFS率は、ABMT群(30%)の方が地固め化学療法群(19%;P = 0.04)よりも有意に高かった。2群間で5年OSにおける有意差は認められなかった(39% vs 30%;P = 0.08)。
- イソトレチノインを投与された患者の5年EFSは、維持療法を受けなかった患者よりも高かった(42% vs 31%)が、有意差は認められなかった(P = 0.12)。イソトレチノイン投与にランダムに割り付けられた患者のOS(50%)は、継続治療を実施しなかった患者(39%)よりも高かったが、この差は有意ではなかった(P = 0.10)。
- 更新されたCochraneレビューはABMTを標準化学療法と比較した3件のランダム化臨床試験を評価した。[
19
][
20
][
21
][
30
][
33
]
- EFSはABMTの方が有意に優れていたが、OSにおける統計的有意差は認められなかった。
- 1件の単一施設のレトロスペクティブ非ランダム化試験で、自家SCTまたは従来の化学療法を受けた後にGM-CSFおよび3F8抗GD2抗体療法を受けた患者が比較された。[
34
]患者は、初回治療と追加療法に紹介された患者が混ざっており、不応性または再燃患者が含まれ、その一部は紹介施設において自家SCTを受けていた。自家SCT群では、最初の化学療法または自家SCTから、GM-CSFおよび3F8抗GD2抗体療法の開始までの期間が有意に長かった。自家SCT群ではまた、超高リスク患者が有意に多かった。
- GM-CSFおよび3F8抗GD2抗体療法と自家SCTの併用群ではEFSが良好な傾向が観察された(65% vs 51%、P = 0.128)が、化学療法単独で治療された患者と自家SCTで治療された患者間でOSにおける統計的有意差は認められなかった。
- 別のプロスペクティブ・ランダム化研究では、移植前に採取された幹細胞から神経芽腫細胞をパージしても優位性は示されなかった。[ 35 ]
- Center for International Blood and Marrow Transplant Researchに提出された同種移植症例147例のレビューにより、同種移植レシピエントが以前に自家移植を受けていた場合でも、自家移植を上回る同種移植の優位性は示されなかった。[ 36 ]
- COGの第III相試験では、SCT後に患者がイソトレチノインと組み合わせてGM-CSFおよびIL-2を併用するジヌツキシマブの投与 vs イソトレチノイン単独にランダムに割り付けられた。[
31
]
- イソトレチノインと免疫療法を併用する方(EFS、66%)が、標準のイソトレチノインによる維持療法(EFS、46%)よりも優れていた。結果として、SCT後の免疫療法はCOG試験において高リスク神経芽腫に対する標準治療と考えられている。
- COG研究の結果として、ジヌツキシマブは米国食品医薬品局により承認されている。
- ヨーロッパの1件の研究で、大量化学療法と自家SCT併用後の維持療法として投与する、dinutuximab-beta(マウス細胞の代わりにハムスターの細胞で製造されたジヌツキシマブ)とdinutuximab-beta + 皮下(SQ)IL-2が比較された。すべての患者が追加でイソトレチノインを投与された。[
37
]
- SQ IL-2の追加は治療成績を改善しなかった;3年EFS率は、dinutuximab-betaで治療された患者で56%およびdinutuximab-betaおよびSQ IL-2で治療された患者で60%(P = 0.76)であった。
原発腫瘍の外科的切除後の局所制御を強化するため、放射線療法(完全切除が得られたかどうかにかかわらず)および骨髄破壊的治療がしばしば実施される。[ 38 ][ 39 ];[ 40 ][証拠レベル:3iiA]放射線療法の至適線量については、明らかにされていない。[ 26 ]SCTに先行する外科的切除の程度に関係のない、広範囲にわたるリンパ節照射は、局所進行またはOSに関して患者に有益性をもたらさなかった。[ 41 ][証拠レベル:3iii]
骨転移病変の治療もまた、原発腫瘍床への照射時に実施すると疾患制御を最大化すると考えられる。転移性病変部位への放射線療法は、個々の場合に基づいて、または研究に登録された患者に対するプロトコルガイドラインに従って決定される。多くの小児が広範な骨転移を呈する。最初の骨転移部位すべてへの照射は実施不可能であるため、現在の医療の現場では、SCT前にMIBGで評価して反応していない部位が治療される。[ 27 ][ 42 ][ 43 ]診断時に特定された転移部位で第一選択療法時に放射線を照射されなかった場所は、以前に照射を受けた転移部位に比べて、最初の再燃時の浸潤リスクが高いようであった。[ 27 ]これらの観察は、高リスク患者で寛解導入化学療法後もMIBG取り込みにより持続する転移巣に対する現在の照射パラダイムを裏付けている。骨髄の50%を超える照射は勧められない。
寛解導入化学療法後にびまん性骨転移が残存する症例では、大量化学療法を実施した後、地固め的放射線療法の実施を決定する前に再評価される。
高リスク神経芽腫の原発腫瘍患者を治療するための陽子線治療の予備的結果が発表されており、効力および毒性が受け入れられるものであることが実証されている。[ 29 ]
高リスク神経芽腫の小児を対象にした1件の多施設第II相臨床試験で、オルニチン脱炭酸酵素阻害剤であるジフルオロメチルオルニチン(DFMO)を使用する維持療法が探索された。[ 44 ]この研究では、ANBL0032(NCT00026312)試験において以前に治療された患者のサブセットと比較して生存が改善されたと主張されたが、歴史的比較および患者選択でのバイアスの可能性のために、この知見の妥当性に制限がある。ランダム化試験のデータがない状況では、神経芽腫を有する小児の集学的治療にDFMOを追加する価値は確認できない。神経芽腫を有する患者に対するDFMO療法に関するさらなる研究が計画されており、一部の試験が進行中である。
臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
ANBL1531(NCT03126916)(高リスク神経芽腫を新たに診断された小児に対する強力な治療に追加する131I-MIBGまたはクリゾチニブの第III相研究):COGの現在の標準治療については上に述べている;標準治療は、寛解導入化学療法、手術とタンデムSCTによる地固め療法、およびイソトレチノインとジヌツキシマブの免疫増強免疫療法と併用する地固め後放射線療法からなる。最初の4週間の寛解導入化学療法サイクル中に、患者はALK遺伝子の異常(高リスク患者の約10~15%に発生する)についてスクリーニングを受ける。2サイクル目の寛解導入化学療法前に、治療群への割り付けが行われる。登録された患者のほとんどではMIBGの集積が認められ、ALKの異常は認められず、以下の3つの治療群の1つにランダムに割り付けられる:
- 治療群Aの治療は、上述のようにCOGの標準治療で構成される。
- 治療群Bの治療もCOGの標準治療で構成されるが、3サイクル目の寛解導入化学療法後に1回のMIBGサイクルが追加される。
- 治療群Cは治療群Bと同じ治療で構成されるが、SCTのための骨髄除去的地固め療法は、COG標準のタンデム移植よりもむしろ、ブスルファン/メルファランを併用する1回移植となる。
ALK遺伝子変異またはALKの増幅が認められる患者は、COGの現在標準の寛解導入化学療法を非ランダムに受け、ALK阻害薬のクリゾチニブが追加された後、標準のCOG治療計画でさらなる治療が実施される。
MIBGの集積が認められず、ALKに異常が認められない腫瘍を有する患者は、上述の治療群Aと同じ現在標準の化学療法を受ける。
ANBL1531試験での分類はINRGの病期分類システムに基づいている。
この試験でブースト放射線は、歴史的対照を上回る明確な有益性がみられなかったため、中止された。
-
ANBL17P1(NCT03786783)(新たに診断されSCTを受けた高リスク神経芽腫患者を治療するためのジヌツキシマブ、サルグラモスチム、および多剤併用化学療法):高リスク神経芽腫を有する多くの小児が、寛解導入療法中に疾患進行を経験し、持続性の転移性疾患を有し、または治療完了後に再燃するため、高リスク神経芽腫を有する小児に対する革新的な治療法が依然としてきわめて必要とされている。再発または不応性の神経芽腫患者に実施された最近の研究により、抗GD2モノクローナル抗体 + 化学療法およびGM-CSFを併用する治療後に客観的な臨床反応が実証されている。この限られた施設でのプロトコルでは、新たに診断された神経芽腫患者に対する3~5サイクルの標準寛解導入化学療法中の抗GD2モノクローナル抗体のジヌツキシマブおよびGM-CSFの追加が安全で忍容性があるかどうかが評価される。
この試験でブースト放射線は、歴史的対照を上回る明確な有益性がみられなかったため、中止された。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Canete A, Gerrard M, Rubie H, et al.: Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Paediatric Oncology European Neuroblastoma Experience. J Clin Oncol 27 (7): 1014-9, 2009.[PUBMED Abstract]
- Maris JM: Recent advances in neuroblastoma. N Engl J Med 362 (23): 2202-11, 2010.[PUBMED Abstract]
- Cotterill SJ, Pearson AD, Pritchard J, et al.: Late relapse and prognosis for neuroblastoma patients surviving 5 years or more: a report from the European Neuroblastoma Study Group "Survey". Med Pediatr Oncol 36 (1): 235-8, 2001.[PUBMED Abstract]
- Mertens AC, Yasui Y, Neglia JP, et al.: Late mortality experience in five-year survivors of childhood and adolescent cancer: the Childhood Cancer Survivor Study. J Clin Oncol 19 (13): 3163-72, 2001.[PUBMED Abstract]
- Morgenstern DA, London WB, Stephens D, et al.: Metastatic neuroblastoma confined to distant lymph nodes (stage 4N) predicts outcome in patients with stage 4 disease: A study from the International Neuroblastoma Risk Group Database. J Clin Oncol 32 (12): 1228-35, 2014.[PUBMED Abstract]
- Kushner BH, LaQuaglia MP, Bonilla MA, et al.: Highly effective induction therapy for stage 4 neuroblastoma in children over 1 year of age. J Clin Oncol 12 (12): 2607-13, 1994.[PUBMED Abstract]
- Park JR, Scott JR, Stewart CF, et al.: Pilot induction regimen incorporating pharmacokinetically guided topotecan for treatment of newly diagnosed high-risk neuroblastoma: a Children's Oncology Group study. J Clin Oncol 29 (33): 4351-7, 2011.[PUBMED Abstract]
- Decarolis B, Schneider C, Hero B, et al.: Iodine-123 metaiodobenzylguanidine scintigraphy scoring allows prediction of outcome in patients with stage 4 neuroblastoma: results of the Cologne interscore comparison study. J Clin Oncol 31 (7): 944-51, 2013.[PUBMED Abstract]
- Yanik GA, Parisi MT, Shulkin BL, et al.: Semiquantitative mIBG scoring as a prognostic indicator in patients with stage 4 neuroblastoma: a report from the Children's oncology group. J Nucl Med 54 (4): 541-8, 2013.[PUBMED Abstract]
- Pinto N, Naranjo A, Hibbitts E, et al.: Predictors of differential response to induction therapy in high-risk neuroblastoma: A report from the Children's Oncology Group (COG). Eur J Cancer 112: 66-79, 2019.[PUBMED Abstract]
- De Ioris MA, Crocoli A, Contoli B, et al.: Local control in metastatic neuroblastoma in children over 1 year of age. BMC Cancer 15: 79, 2015.[PUBMED Abstract]
- von Allmen D, Davidoff AM, London WB, et al.: Impact of Extent of Resection on Local Control and Survival in Patients From the COG A3973 Study With High-Risk Neuroblastoma. J Clin Oncol 35 (2): 208-216, 2017.[PUBMED Abstract]
- Englum BR, Rialon KL, Speicher PJ, et al.: Value of surgical resection in children with high-risk neuroblastoma. Pediatr Blood Cancer 62 (9): 1529-35, 2015.[PUBMED Abstract]
- DeCou JM, Bowman LC, Rao BN, et al.: Infants with metastatic neuroblastoma have improved survival with resection of the primary tumor. J Pediatr Surg 30 (7): 937-40; discussion 940-1, 1995.[PUBMED Abstract]
- Castel V, Tovar JA, Costa E, et al.: The role of surgery in stage IV neuroblastoma. J Pediatr Surg 37 (11): 1574-8, 2002.[PUBMED Abstract]
- Simon T, Häberle B, Hero B, et al.: Role of surgery in the treatment of patients with stage 4 neuroblastoma age 18 months or older at diagnosis. J Clin Oncol 31 (6): 752-8, 2013.[PUBMED Abstract]
- Adkins ES, Sawin R, Gerbing RB, et al.: Efficacy of complete resection for high-risk neuroblastoma: a Children's Cancer Group study. J Pediatr Surg 39 (6): 931-6, 2004.[PUBMED Abstract]
- Matthay KK, Villablanca JG, Seeger RC, et al.: Treatment of high-risk neuroblastoma with intensive chemotherapy, radiotherapy, autologous bone marrow transplantation, and 13-cis-retinoic acid. Children's Cancer Group. N Engl J Med 341 (16): 1165-73, 1999.[PUBMED Abstract]
- Berthold F, Boos J, Burdach S, et al.: Myeloablative megatherapy with autologous stem-cell rescue versus oral maintenance chemotherapy as consolidation treatment in patients with high-risk neuroblastoma: a randomised controlled trial. Lancet Oncol 6 (9): 649-58, 2005.[PUBMED Abstract]
- Pritchard J, Cotterill SJ, Germond SM, et al.: High dose melphalan in the treatment of advanced neuroblastoma: results of a randomised trial (ENSG-1) by the European Neuroblastoma Study Group. Pediatr Blood Cancer 44 (4): 348-57, 2005.[PUBMED Abstract]
- Elborai Y, Hafez H, Moussa EA, et al.: Comparison of toxicity following different conditioning regimens (busulfan/melphalan and carboplatin/etoposide/melphalan) for advanced stage neuroblastoma: Experience of two transplant centers. Pediatr Transplant 20 (2): 284-9, 2016.[PUBMED Abstract]
- Ladenstein R, Pötschger U, Pearson ADJ, et al.: Busulfan and melphalan versus carboplatin, etoposide, and melphalan as high-dose chemotherapy for high-risk neuroblastoma (HR-NBL1/SIOPEN): an international, randomised, multi-arm, open-label, phase 3 trial. Lancet Oncol 18 (4): 500-514, 2017.[PUBMED Abstract]
- Seif AE, Naranjo A, Baker DL, et al.: A pilot study of tandem high-dose chemotherapy with stem cell rescue as consolidation for high-risk neuroblastoma: Children's Oncology Group study ANBL00P1. Bone Marrow Transplant 48 (7): 947-52, 2013.[PUBMED Abstract]
- Park JR, Kreissman SG, London WB, et al.: Effect of Tandem Autologous Stem Cell Transplant vs Single Transplant on Event-Free Survival in Patients With High-Risk Neuroblastoma: A Randomized Clinical Trial. JAMA 322 (8): 746-755, 2019.[PUBMED Abstract]
- Casey DL, Kushner BH, Cheung NV, et al.: Dose-escalation is needed for gross disease in high-risk neuroblastoma. Pediatr Blood Cancer 65 (7): e27009, 2018.[PUBMED Abstract]
- Polishchuk AL, Li R, Hill-Kayser C, et al.: Likelihood of bone recurrence in prior sites of metastasis in patients with high-risk neuroblastoma. Int J Radiat Oncol Biol Phys 89 (4): 839-45, 2014.[PUBMED Abstract]
- Casey DL, Pitter KL, Kushner BH, et al.: Radiation Therapy to Sites of Metastatic Disease as Part of Consolidation in High-Risk Neuroblastoma: Can Long-term Control Be Achieved? Int J Radiat Oncol Biol Phys 100 (5): 1204-1209, 2018.[PUBMED Abstract]
- Hattangadi JA, Rombi B, Yock TI, et al.: Proton radiotherapy for high-risk pediatric neuroblastoma: early outcomes and dose comparison. Int J Radiat Oncol Biol Phys 83 (3): 1015-22, 2012.[PUBMED Abstract]
- Matthay KK, Reynolds CP, Seeger RC, et al.: Long-term results for children with high-risk neuroblastoma treated on a randomized trial of myeloablative therapy followed by 13-cis-retinoic acid: a children's oncology group study. J Clin Oncol 27 (7): 1007-13, 2009.[PUBMED Abstract]
- Yu AL, Gilman AL, Ozkaynak MF, et al.: Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma. N Engl J Med 363 (14): 1324-34, 2010.[PUBMED Abstract]
- Cheung NK, Cheung IY, Kushner BH, et al.: Murine anti-GD2 monoclonal antibody 3F8 combined with granulocyte-macrophage colony-stimulating factor and 13-cis-retinoic acid in high-risk patients with stage 4 neuroblastoma in first remission. J Clin Oncol 30 (26): 3264-70, 2012.[PUBMED Abstract]
- Yalçin B, Kremer LC, Caron HN, et al.: High-dose chemotherapy and autologous haematopoietic stem cell rescue for children with high-risk neuroblastoma. Cochrane Database Syst Rev 8: CD006301, 2013.[PUBMED Abstract]
- Kushner BH, Ostrovnaya I, Cheung IY, et al.: Lack of survival advantage with autologous stem-cell transplantation in high-risk neuroblastoma consolidated by anti-GD2 immunotherapy and isotretinoin. Oncotarget 7 (4): 4155-66, 2016.[PUBMED Abstract]
- Kreissman SG, Seeger RC, Matthay KK, et al.: Purged versus non-purged peripheral blood stem-cell transplantation for high-risk neuroblastoma (COG A3973): a randomised phase 3 trial. Lancet Oncol 14 (10): 999-1008, 2013.[PUBMED Abstract]
- Hale GA, Arora M, Ahn KW, et al.: Allogeneic hematopoietic cell transplantation for neuroblastoma: the CIBMTR experience. Bone Marrow Transplant 48 (8): 1056-64, 2013.[PUBMED Abstract]
- Ladenstein R, Pötschger U, Valteau-Couanet D, et al.: Interleukin 2 with anti-GD2 antibody ch14.18/CHO (dinutuximab beta) in patients with high-risk neuroblastoma (HR-NBL1/SIOPEN): a multicentre, randomised, phase 3 trial. Lancet Oncol 19 (12): 1617-1629, 2018.[PUBMED Abstract]
- Haas-Kogan DA, Swift PS, Selch M, et al.: Impact of radiotherapy for high-risk neuroblastoma: a Children's Cancer Group study. Int J Radiat Oncol Biol Phys 56 (1): 28-39, 2003.[PUBMED Abstract]
- Casey DL, Kushner BH, Cheung NK, et al.: Local Control With 21-Gy Radiation Therapy for High-Risk Neuroblastoma. Int J Radiat Oncol Biol Phys 96 (2): 393-400, 2016.[PUBMED Abstract]
- Gatcombe HG, Marcus RB, Katzenstein HM, et al.: Excellent local control from radiation therapy for high-risk neuroblastoma. Int J Radiat Oncol Biol Phys 74 (5): 1549-54, 2009.[PUBMED Abstract]
- Braunstein SE, London WB, Kreissman SG, et al.: Role of the extent of prophylactic regional lymph node radiotherapy on survival in high-risk neuroblastoma: A report from the COG A3973 study. Pediatr Blood Cancer 66 (7): e27736, 2019.[PUBMED Abstract]
- Li R, Polishchuk A, DuBois S, et al.: Patterns of Relapse in High-Risk Neuroblastoma Patients Treated With and Without Total Body Irradiation. Int J Radiat Oncol Biol Phys 97 (2): 270-277, 2017.[PUBMED Abstract]
- Mazloom A, Louis CU, Nuchtern J, et al.: Radiation therapy to the primary and postinduction chemotherapy MIBG-avid sites in high-risk neuroblastoma. Int J Radiat Oncol Biol Phys 90 (4): 858-62, 2014.[PUBMED Abstract]
- Sholler GLS, Ferguson W, Bergendahl G, et al.: Maintenance DFMO Increases Survival in High Risk Neuroblastoma. Sci Rep 8 (1): 14445, 2018.[PUBMED Abstract]
- COG A3973(NCT00004188)研究では、寛解導入化学療法後に肉眼的完全切除が試みられた患者220人の手術が中央審査された。切除の程度は外科医の推定により、90%以上 vs 90%未満と判定されたが、画像検査による中央審査との一致はわずか63%であったことが明らかにされた。[
13
][証拠レベル:3iiA]
- INSS 4S期およびINRG MS期神経芽腫の治療
-
神経芽腫国際病期分類システム(INSS) 4S期患者は、生後12ヵ月未満で、INSS 1期または2期の原発腫瘍を有する一方、国際神経芽腫リスクグループ(INRG) MS期患者は原発腫瘍の病期に関係なく生後18ヵ月未満である。どちらの病期分類システムも、転移に関する限られたパターンの定義は同じである。
INRG Task Forceによる4S疾患カテゴリーを新たなMS定義のカテゴリーに置き換える決定は、L2原発腫瘍および4S転移パターンを有する少数の乳児(生後12~18ヵ月の患者を含む)は良好な転帰を有するという報告に基づいていた。[ 1 ][ 2 ]その後、実際のINRGデータの研究により、多くの生物学的特性からMS期疾患で生後12~18ヵ月の患者の不良な転帰が予測されること、および予後良好な生物学的特性を有する乳児のみが従来の4S診断を受けた小児と同等の長期の転帰を有することが明らかにされた。[ 2 ]
4S/MS期神経芽腫患者の多くが治療を必要としない。しかしながら、予後不良な生物学的特性を示す腫瘍または進行中の肝腫大と臓器障害による症状を有する患者は死亡のリスクが高く、低用量~中用量の化学療法で治療される。これらの患者の8~10%でMYCN増幅が認められるため、高リスクプロトコルで治療される。[ 3 ]
以前に用いられた小児腫瘍学グループ(COG)の神経芽腫4S期群への割り付け基準が表15に記述されている。
表15.COG-P9641、COG-A3961、およびCOG-A3973研究に用いられた小児腫瘍学グループ(COG)による神経芽腫の4S期群分類スキームa INSS病期 年齢 の状態 INPC分類 DNA倍数性 その他 リスクグループ 4Sc 1歳未満 増幅なし 予後良好 DI > 1 症状なし 低リスク 1歳未満 増幅なし 不問 DI = 1 症状なしまたは症状あり 中リスク 1歳未満 増幅なし 予後不良 不問 症状なしまたは症状あり 中リスク 1歳未満 欠落 欠落 欠落 生検を行うには状態が悪すぎる 中リスク 1歳未満 増幅なし 不問 不問 症状が認められる 中リスク 1歳未満 増幅あり 不問 不問 症状なしまたは症状あり 高リスク 表16は、MS期神経芽腫についてのINRGの分類を示しており、進行中のCOG研究に用いられている。
表16.MS期の神経芽腫についての国際神経芽腫リスクグループ(INRG)の治療前分類スキームa INRG病期 組織学的分類 腫瘍分化度 11qの異常 倍数性 治療前リスクグループ NA = 増幅なし。 a許可を得て転載。©(2015)米国臨床腫瘍学会。All rights reserved.Pinto N et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma, J Clin Oncol 33 (27), 2015: 3008-3017.[ 4 ] MS 生後18ヵ月未満 NA なし C(非常に低リスク) あり Q(高リスク) 増幅あり R(高リスク) 4S期/MS期神経芽腫に対する治療法の選択肢
4S/MS期神経芽腫の治療に標準的アプローチは存在しない。
4S/MS期神経芽腫に対する治療法の選択肢には以下のものがある:
- 支持療法と併用する観察(腫瘍の生物学的特性が予後良好な無症状の患者に対して)。
- 化学療法(症状のある患者、非常に年齢の低い乳児、または生物学的特性が予後不良な患者に対して)。
- 放射線療法(まれに、転移性疾患による肝腫大に関係した症状を有する患者に対して)。
原発巣の切除は治療成績の改善とは関係していない。[ 5 ][ 6 ][ 7 ]まれに、肝に巨大な4S/MS期神経芽腫を有する乳児は、疾患の制御に用いられる化学療法および/または放射線療法により肝硬変を発症するが、同所性肝移植から利益が得られる可能性がある。[ 8 ]
支持療法と併用する観察
支持療法と併用する観察は腫瘍の生物学的特性が予後良好な無症状の患者の治療に用いられる。
4S/MS期の小児の治療は、臨床像に依存する。[ 5 ][ 6 ]巨大腫瘤が臓器障害や死亡リスクの原因となっている場合を除いて、ほとんどの患者は治療を必要としない。
化学療法
化学療法は症状のある患者、非常に年齢の低い乳児(生後2ヵ月までに診断される)、または生物学的特性が予後不良な患者の治療に用いられる。生後数週間で急速な腫瘍増殖の証拠が得られた患者は、不可逆性の可能性のある腹部コンパートメント症候群と肝不全および/または腎不全を回避するために、化学療法による即時介入を必要とする。[ 9 ]
INSS病期が4S/MS期の神経芽腫と診断された乳児は、特に肝腫大を認める場合または生後3ヵ月未満の場合、臨床的に急速に悪化する可能性があり、早期の治療開始により利益が得られる場合がある。[ 9 ]化学療法が有益な4S期疾患の乳児を同定することは困難である。
4S期の患者集団の評価を改善するために、悪化または障害の徴候および症状を測定するスコアリングシステムが開発された。[ 10 ]このスコアリングシステムがレトロスペクティブに評価され、臨床経過を予測したことで、INSS 4S期神経芽腫の患者を管理する指針とするためにプロスペクティブに適用されている。[ 10 ][ 11 ]このスコアリングシステムは、上で考察した最も年齢の低い乳児におけるANBL0531(NCT00499616)の結果に基づいて、4S/MS期乳児に対する化学療法による介入の指針とすべく修正されている。[ 9 ]
症状のある患者の治療には、さまざまな化学療法レジメン(シクロホスファミド単独、カルボプラチン/エトポシド、シクロホスファミド/ドキソルビシン/ビンクリスチン)が用いられている。治療アプローチでは、不良な生存率の一因となる毒性作用を回避するために化学療法の実施は症状が持続している場合に限られる。また、非常に年齢の低いまたは低体重の乳児に対しては、各化学療法サイクル後に顆粒球コロニー刺激因子を併用する比較的低用量の化学療法がしばしば推奨される。
証拠(4S/MS期の腫瘍に対する化学療法):
- COG ANBL0531(NCT00499616)試験では、腫瘍にMYCN増幅が認められず、臓器障害または切迫性の臓器機能不全を来しているか、生物学的特性が予後不良な(予後不良な組織像および/または二倍体のDNA指数)4S期患者のサブセットがプロスペクティブに研究された。49人の患者が登録され、このうち41人に症状があり、28人は生物学的特性が予後不良であった。腫瘍の生物学的特性、患者の年齢、および症状に基づいて、患者は2、4、または8サイクルの化学療法を受けるように割り付けられた。[
9
][証拠レベル:3iiiA]
- 3年全生存(OS)率は81.4%であった。死亡例の9人中8人は診断時に生後2ヵ月未満の患者であった。5例の死亡は、急速に進行する肝腫大の急性合併症(すなわち、腹部コンパートメント症候群、腎不全、呼吸不全、凝固障害、および感染症)に関係していた。診断時に生後40日未満の患者は、生後47日を超える患者と比較して死亡リスクが13倍以上高かった。5例が死亡した後、この研究は診断時に生後2ヵ月未満で肝腫大が進展している4S期神経芽腫患者に対して即時化学療法を指示するように修正された。その後に登録された乳児では、生後2ヵ月未満の乳児18人を含めて肝腫大の合併症に関係した死亡は発生しなかった。
- この研究により、生物学的特性が予後不良な患者の治療成績は生物学的特性が予後良好な症状のある患者と比較して劣っていたことが確認された。晩期に死亡した2人の患者は転移性疾患の結果として死亡し、予後不良な生物学的特性を有した。
- この研究では、原発腫瘍の切除は指示されず、原発腫瘍の50%超が切除された患者は16人のみであった。生検を受けずに症状のある患者は、迅速な治療を促し、リスクのある手技を避ける試験への登録に適格とされた。その試験では、症状のある4S期神経芽腫患者の状態が改善し、生検が安全であると考えられるようになるまで、患者は生検およびしたがって、生物学的な特徴付けを回避でき、これにより研究の対象となった。
-
COG-P9641試験に4S期患者80人が登録された。[
14
]
- 全体で、5年イベントフリー生存(EFS)率は77%、OS率は91%であった。
- 症状のない4S期神経芽腫について手術または生検単独による治療を受けた患者41人に対する5年EFS率は63%、OS率は84%であったのに対し、手術と化学療法による治療を受けた患者39人に対する5年EFS率は95%、OS率は97%であった(EFS、P = 0.0016;OS、P = 0.1302)。
以前は、4S期神経芽腫患者における生存率が低いのは化学療法の毒性が原因であると考えられていた;しかしながら、COG-P9641試験での化学療法の使用は特定の臨床状況で推奨されるサイクル数に制限されていた。
- また、COG-P9641試験では、生物学的に良好な(MYCN増幅が認められない)INSS 4S期神経芽腫で無症状の乳児は、疾患が進行するか、臨床症状が現れるまで化学療法を受けなかった。[
14
]
- 症状が現れた乳児には疾患に関係した臓器不全および感染性合併症がみられ、その結果、即時化学療法(4~8サイクル)を受けた乳児と比較してOSが劣った。化学療法を受けなかった乳児に対する3年OS率は84%であったのに対し、化学療法を受けた乳児では97%であった(P = 0.1321)。
- COG-ANBL0531試験では、INSS 4S期患者に対する2年OS率は81%で、これはCOG-P9641など、他の共同試験で報告されたものより低い。[ 9 ]ANBL0531研究に登録された患者の多くが、以前の試験に登録された患者よりも健康状態が悪かったが、これは一部には症状のある乳児において腫瘍生検が必要とされなかったためである。以前の試験では主に無症状の患者が含まれ、ほとんどは生物学的特性が予後良好であった。ANBL0531での治療は、症状、年齢、および腫瘍の生物学的特性に基づいて割り付けられた。
- 4S期でMYCNの増幅が認められない腫瘍を有するか、INSS 3期原発腫瘍および/または単純X線撮影および/またはコンピュータ断層撮影で明らかとなる皮質骨の変化は伴わず骨シンチグラフィが陽性の乳児125人を対象に1件のプロスペクティブ研究が実施された。[
11
]初期治療の決定には治療前の症状スコアが用いられた;症状スコアが低い乳児(n = 86)には観察が推奨され、症状スコアが高い乳児(n = 37)には化学療法が推奨された。
症状スコアが高い患者に対する化学療法としては、カルボプラチンおよびエトポシドの3日間のコースを2~4回があり、症状が持続するか、進行性疾患が発症した場合にはシクロホスファミド、ドキソルビシン、およびビンクリスチンの5日間のコースが最大4回実施された。患者の半数が原発腫瘍の完全切除または部分切除を受けた。
- 症状のない患者と症状のある患者とで2年EFS率およびOS率における差はみられなかったが(EFS、87% vs 88%;OS、98% vs 97%)、研究者の多くが、症状スコアが低い場合に化学療法の実施を好んだ。
- 症状スコアが低い乳児について、初回治療未実施の乳児(n = 56;OS、93%)と治療が実施された乳児(n = 30;OS、86%)とで治療成績に差は認められなかった。
- 症状スコアが高い乳児に対するOS率は90%であった。
- 2年OS率について、切除不能原発腫瘍を有した患者と原発腫瘍を切除された患者(97% vs 100%)間および放射線学的異常がみられない骨格シンチグラフィ陰性の患者と陽性の患者(100% vs 97%)間で有意差は認められなかった。
放射線療法(転移性疾患による肝腫大に関係した症状を有する患者に対して)。
化学療法に反応しなかった症状のあるMS(4S)期神経芽腫の乳児において顕著な肝腫大が認められるまれな症例では、非常に低線量の放射線療法が用いられている。MS期神経芽腫の症状のある乳児41人を対象にした1件のシリーズでは、放射線療法が5人の乳児に実施されたが、そのうち3人が死亡した。[ 9 ]
臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
-
ANBL1232(NCT02176967)(高リスク以外の神経芽腫を有する若年患者の治療における反応および生物学的特性に基づく危険因子を指針にした治療):
- 生後18ヵ月未満の新たに診断されたすべてのINRG MS期患児に対しては、以下が実施される:
- 生後3ヵ月未満で、肝腫大が存在するか、進展している、あるいは症状が認められる患者は試験に登録され、即時に化学療法が開始される。1ヵ月以内に完全な病期分類を完了する必要がある;患者の状態が安定するまで、腫瘍生検は実施されない。
- 生後3~12ヵ月で、症状が認められる患者は試験に登録され、即時に化学療法が開始される。腫瘍生検は、患者の状態が安定した後に実施される。
- 生後12~18ヵ月で、症状が認められる患者には化学療法開始前に、腫瘍生検が実施される。
- 生後3~18ヵ月で、症状が認められない患者および生後3ヵ月未満で、症状が認められず、肝腫大も進展していない患者は、腫瘍生検が実施された後、最初は注意深く観察し、3年間継続する。
INRG MS期腫瘍で、症状の有無に関係なく予後不良な組織型または予後不良なゲノムの特徴を有する患者は、反応に基づくアルゴリズムに従って治療され、治療期間が決定される。化学療法を行わずに観察されているINRG MS期患者に対しては、臨床的変化がないかモニタリングし、治療を開始するために客観的スコアリングシステムが用いられる。症状が完全に解消し、原発腫瘍容積の少なくとも50%が減少(部分奏効)した患者に対しては、化学療法を中止し、治療完了後3年間、観察を継続する。疾患が進行する場合、その患者はこの研究から外れる。
- 生後18ヵ月未満の新たに診断されたすべてのINRG MS期患児に対しては、以下が実施される:
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Monclair T, Brodeur GM, Ambros PF, et al.: The International Neuroblastoma Risk Group (INRG) staging system: an INRG Task Force report. J Clin Oncol 27 (2): 298-303, 2009.[PUBMED Abstract]
- Taggart DR, London WB, Schmidt ML, et al.: Prognostic value of the stage 4S metastatic pattern and tumor biology in patients with metastatic neuroblastoma diagnosed between birth and 18 months of age. J Clin Oncol 29 (33): 4358-64, 2011.[PUBMED Abstract]
- Canete A, Gerrard M, Rubie H, et al.: Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Paediatric Oncology European Neuroblastoma Experience. J Clin Oncol 27 (7): 1014-9, 2009.[PUBMED Abstract]
- Pinto NR, Applebaum MA, Volchenboum SL, et al.: Advances in Risk Classification and Treatment Strategies for Neuroblastoma. J Clin Oncol 33 (27): 3008-17, 2015.[PUBMED Abstract]
- Guglielmi M, De Bernardi B, Rizzo A, et al.: Resection of primary tumor at diagnosis in stage IV-S neuroblastoma: does it affect the clinical course? J Clin Oncol 14 (5): 1537-44, 1996.[PUBMED Abstract]
- Katzenstein HM, Bowman LC, Brodeur GM, et al.: Prognostic significance of age, MYCN oncogene amplification, tumor cell ploidy, and histology in 110 infants with stage D(S) neuroblastoma: the pediatric oncology group experience--a pediatric oncology group study. J Clin Oncol 16 (6): 2007-17, 1998.[PUBMED Abstract]
- Nickerson HJ, Matthay KK, Seeger RC, et al.: Favorable biology and outcome of stage IV-S neuroblastoma with supportive care or minimal therapy: a Children's Cancer Group study. J Clin Oncol 18 (3): 477-86, 2000.[PUBMED Abstract]
- Steele M, Jones NL, Ng V, et al.: Successful liver transplantation in an infant with stage 4S(M) neuroblastoma. Pediatr Blood Cancer 60 (3): 515-7, 2013.[PUBMED Abstract]
- Twist CJ, Naranjo A, Schmidt ML, et al.: Defining Risk Factors for Chemotherapeutic Intervention in Infants With Stage 4S Neuroblastoma: A Report From Children's Oncology Group Study ANBL0531. J Clin Oncol 37 (2): 115-124, 2019.[PUBMED Abstract]
- Hsu LL, Evans AE, D'Angio GJ: Hepatomegaly in neuroblastoma stage 4s: criteria for treatment of the vulnerable neonate. Med Pediatr Oncol 27 (6): 521-8, 1996.[PUBMED Abstract]
- De Bernardi B, Gerrard M, Boni L, et al.: Excellent outcome with reduced treatment for infants with disseminated neuroblastoma without MYCN gene amplification. J Clin Oncol 27 (7): 1034-40, 2009.[PUBMED Abstract]
- Keene DJ, Minford J, Craigie RJ, et al.: Laparostomy closure in stage 4S neuroblastoma. J Pediatr Surg 46 (1): e1-4, 2011.[PUBMED Abstract]
- Harper L, Perel Y, Lavrand F, et al.: Surgical management of neuroblastoma-related hepatomegaly: do material and method really count? Pediatr Hematol Oncol 25 (4): 313-7, 2008.[PUBMED Abstract]
- Strother DR, London WB, Schmidt ML, et al.: Outcome after surgery alone or with restricted use of chemotherapy for patients with low-risk neuroblastoma: results of Children's Oncology Group study P9641. J Clin Oncol 30 (15): 1842-8, 2012.[PUBMED Abstract]
- 再発神経芽腫の治療
-
成熟による腫瘍の成長は、生検の実施および組織像のレビューによって腫瘍の進行とは鑑別すべきである。患者にメタヨードベンジルグアニジン(MIBG)の取り込みを示す成熟中の病変が持続して認められることがあるが、これは特に低リスクおよび中リスク疾患の患者では治療成績に影響しない。[ 1 ]ヨウ素131-MIBG(131I-MIBG)による治療を受けた不応性または再発性の高リスク神経芽腫患者14人を対象とした23組のMIBGおよびポジトロン放射断層撮影(PET)スキャンの解析から、MIBGスキャンは転移性骨病変の発見においてフッ素18-フルデオキシグルコース(18F-FDG)PETよりも感度が高いことが明らかにされたが、軟部組織病変については18F-FDG PETの方が感度が高い傾向が認められた。[ 2 ]
サブクローン性のALK変異または他のMAPK経路病変が診断時に認められ、その後の再燃時にクローン性増殖を来すことがある。したがって、進行している腫瘍の連続サンプリングにより、潜在的にアクション可能な変異が同定される場合がある。[ 3 ][ 4 ]同じ患者の原発および再燃神経芽腫を比較した現代的な包括的分子解析から、広範なクローン濃縮およびいくつかの新たに発見された変異が明らかとなり、多くの腫瘍がRAS-MAPK経路に新しいまたはクローン性に濃縮された変異を示した。これは診断時に高リスクおよび低リスクの両方の腫瘍の患者に該当した。[ 5 ][ 6 ](詳しい情報については、本要約の神経芽腫のゲノムおよび生物学的特性のセクションを参照のこと)。
最初に高リスク疾患と診断された小児において神経芽腫が再発した場合、さらなる集中療法を実施しても通常、予後不良である。[ 7 ][ 8 ][ 9 ][ 10 ]しかしながら、これらの患者が別の化学療法レジメンにより、しばしば何ヵ月にもわたって生存が得られる可能性がある。[ 11 ][ 12 ]これらの患者には臨床試験が適しており、提案してもよい。現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
再発神経芽腫の予後因子
International Neuroblastoma Risk Group Projectでは、世界中の十分に確立された臨床試験グループにおける大規模臨床試験に登録した神経芽腫患者2,266人の再燃後の生存に関連する(診断時に定義される)臨床的および生物学的特性のサバイバルツリー解析が実施された。[ 7 ]サバイバルツリー解析から以下が明らかになった:
- 再燃を来した集団全体の全生存(OS)率は20%であった。
- 疾患診断時のすべての病期の患者で、5年OSで測定したところMYCN増幅はより不良な予後を予測した。
- 増幅の認められない神経芽腫国際病期分類システム(INSS)4期の神経芽腫を診断された患者では、生後18ヵ月を超える年齢および乳酸脱水素酵素(LDH)高値は不良な予後を予測した。
- MYCN増幅が認められる患者では、1期および2期の診断を受けた患者の方が3期および4期の診断を受けた患者よりも予後良好である。
- 腫瘍にMYCNの増幅が認められず4期ではない患者のうち、生後18ヵ月未満の患児では高二倍体の患児の方が二倍体の患児よりも予後良好であったのに対し、生後18ヵ月を超える患児では分化型腫瘍を有する患児の方が未分化型および低分化型腫瘍を有する患児よりもはるかに予後良好であった。
診断時に定められる、再燃後の生存に対する重要な予後因子としては以下のものがある:[ 7 ]
- 年齢。
- INSS病期。
- MYCNの状態。
- 診断から最初の再燃までの期間。
- LDH値、倍数性、および腫瘍分化の組織学的悪性度(程度は低い)。
小児腫瘍学グループ(COG)の低リスクおよび中リスク神経芽腫患者における再発の経験によれば、大半の患者は救助可能であると示された。COGの報告によれば、中リスク患者における3年イベントフリー生存(EFS)率は88%およびOS率は96%で、低リスク患者における5年EFS率は89%およびOS率は97%であった。[ 13 ][ 14 ]さらに、初発時に低リスクまたは中リスク疾患と診断されたほとんどの患者における局所再発または4S期のパターンでの再発は、骨髄除去的治療および幹細胞移植を併用せずに、観察のみ、手術単独、または中用量の化学療法の併用を用いた治療が成功しうる。
高リスク神経芽腫を呈する小児における再発後のOSは一般的にきわめて不良であるが、1件の単一施設研究において、再燃が単一部位の軟部組織腫瘤(2~3人の小児ではまた再燃時に骨髄または骨病変がみられた)であり、完全寛解または微小残存病変(MRD)後の最初の再燃であった高リスク神経芽腫患者では35%の5年OS率が得られた。すべての患者が軟部組織病変の外科的切除を受けた。MYCN増幅および多病巣性軟部組織病変は、増悪後のより不良な生存に関連した。[ 15 ]
初発時に低リスクに分類された患者の再発神経芽腫
局所領域での再発
初発時に低リスクに分類され局所領域で再発を来した神経芽腫に対する治療法の選択肢には以下のものがある:
- 手術とその後の観察または化学療法。
- 化学療法と場合によりその後の手術。
局所または領域再発がんは、可能であれば切除する。
腫瘍の生物学的特性が良好で、治療計画の完了後3ヵ月以上後に領域内に再発した患児は、再発腫瘍が完全ないしほぼ完全(切除が90%以上)に切除されていれば、経過観察とする。腫瘍の生物学的特性が良好でも、ほぼ完全には切除されていない患児には、化学療法を実施する。[ 13 ][ 14 ]
局所領域再発時の年齢が1歳未満の乳児で、腫瘍の何らかの生物学的特性が不良であっても、腫瘍が完全ないしほぼ完全に切除されていれば、経過観察とする。同様の乳児で、ほぼ完全には切除されていない場合には、化学療法を実施する。化学療法は中用量で用いるカルボプラチン、シクロホスファミド、ドキソルビシン、およびエトポシド、またはシクロホスファミドおよびトポテカンで構成される。以前のCOG試験(COG-P9641およびCOG-A3961)で使用されているように、化学療法レジメンによる長期的影響を最小限にとどめるため、各薬物の累積投与量は低く抑えられる。[ 13 ][ 14 ]
診断時の国際神経芽腫病理学分類が不良であるか、MYCN遺伝子の増幅が認められ、局所再発を来した比較的年長の小児は予後不良であり、手術、積極的な多剤併用化学療法で治療されるか、または臨床試験への登録を提案される場合がある。
証拠(手術とその後の観察または化学療法):
- 1期、2A期、2B期、および4S期神経芽腫の低リスク患者に関するCOGの研究では915人の患者が登録され、このうち800人が無症状で手術単独での治療後、経過が観察された。残りの患者は、手術を併用するまたは併用しない化学療法を受けた。[
14
]
- 患者の約10%に腫瘍の進行または再発がみられた。研究では再発のほとんどが手術単独または手術を併用するまたは併用しない中用量の化学療法で治療され、5年EFS率(89%)およびOS率(97%)で示されているように、ほとんどの患者が救助された。
転移性再発または標準治療に不応性の神経芽腫
初発時に低リスクに分類され転移性再発を来した神経芽腫に対する治療法の選択肢には以下のものがある:
- 観察。
- 化学療法。
- 手術とその後の化学療法。
- 高リスク療法。
初発時に低リスクに分類されており、再発時の年齢が1歳未満である乳児の転移性再発または進行性神経芽腫は、以前のCOG試験(COG-P9641およびCOG-A3961)で定義されているように腫瘍の生物学的特性に応じて以下のように治療される:
- 生物学的特性が完全に良好で、転移が4S期のパターンであり、診断後3ヵ月以内に再発ないし進行している場合には、患者を系統的観察下に置く。
- 転移性進行巣または転移性再発巣が、診断後3ヵ月以上経過してから発生しているか、または4S期のパターンでない場合には、可能であれば原発腫瘍を摘出し、化学療法を実施する。
化学療法は中用量で用いるカルボプラチン、シクロホスファミド、ドキソルビシン、およびエトポシドで構成される。以前のCOG試験(COG-P9641およびCOG-A3961)で使用されているように、化学療法レジメンによる長期的影響を最小限にとどめるため、各薬物の累積投与量を低く抑える。
初発時に低リスクに分類されており、転移性再発または進行時に年齢が1歳を超え、4S期以外の再発パターンの小児は通常、予後不良であり、以下のような治療を受ける:
- 高リスク療法。
転移性再発を来した神経芽腫患者は、高リスク神経芽腫を新たに診断された患者と同様の治療を受ける。(詳しい情報については、本要約の高リスク神経芽腫に対する治療法の選択肢のセクションを参照のこと。)
初発時に中リスクに分類された患者の再発神経芽腫
COG ANBL0531(NCT00499616)研究では、新たに診断された中リスク神経芽腫を有する患者がカルボプラチン、エトポシド、シクロホスファミド、およびドキソルビシンで構成された化学療法で治療された。研究登録後3年以内に非転移性進行疾患を発症した患者には、修復療法がプロトコルに含まれていた。最大6サイクルのシクロホスファミドおよびトポテカンが患者に投与可能であった。シクロホスファミドおよびトポテカンの投与を受けた患者27人中、18人の患者がイベントフリー状態を維持し、9人の患者が再燃し、2人の患者が死亡した。8サイクルの化学療法に対する初期反応が不十分であった20人の患者がシクロホスファミドおよびトポテカンで治療された。これら20人の患者のうち、9人の患者が非常に良好な部分奏効以上を達成した;しかしながら、6人の患者では疾患が進行または再燃し、1人の患者が死亡した。このことから、8サイクルの化学療法後に一定の治療エンドポイントを達成できない患者には、より積極的な治療が必要であると示唆される。[ 16 ]
COG-A3961臨床試験で治療された中リスク神経芽腫患者479人のうち、42人の患者で疾患が進行した。進行した割合は、生物学的特性が良好な患者で10%および生物学的特性が不良な患者で17%であった。30人の患者が局所領域での再発、11人の患者が転移性再発、および1人の患者が両方の再発を来した。患者42人中6人が疾患により死亡した一方、36人の患者が治療に反応した。したがって、中リスク神経芽腫で疾患が進行した患者のほとんどが救助可能である。[ 13 ]
局所領域での再発
初発時に中リスクに分類され局所領域で再発を来した神経芽腫に対する治療法の選択肢には以下のものがある:
- 手術(完全切除)。
- 手術(不完全切除)とその後の化学療法。
- 放射線療法。放射線療法は、化学療法およびセカンドルック手術後に疾患進行がみられる患者に対してのみ検討される。[ 13 ]
生物学的特性が良好な神経芽腫の局所領域再発で、化学療法終了後3ヵ月以上経過してから発生したものは、外科的に治療できる場合がある。ほぼ完全には切除できなかった場合には、追加の化学療法を実施できる。化学療法は、以前に受けた化学療法に基づいて選択すべきである。[ 13 ]
転移性再発
初発時に中リスクに分類され転移性再発を来した神経芽腫に対する治療法の選択肢には以下のものがある:
- 高リスク療法。
転移性再発を来した神経芽腫患者は、高リスク神経芽腫を新たに診断された患者と同様の治療を受ける。(詳しい情報については、本要約の高リスク神経芽腫に対する治療法の選択肢のセクションを参照のこと。)
初発時に高リスクに分類された患者の再発神経芽腫
初発時に高リスクに分類された患者の再発はいずれも非常に予後不良である。[ 7 ]臨床試験を検討してもよい。患者の治療計画の一部として緩和ケアも考慮すべきである。
数件の試験の解析には、COGによる最近の初期相の試験で腫瘍が再発または進行した神経芽腫患者383人が含まれた。1年無増悪生存(PFS)率は21%で、4年PFS率は6%であった一方、OS率は1年経過時に57%および4年経過時に20%であった。その後に再発または進行を経験しなかった患者は10%に満たない。MYCNの増幅はより不良なPFS率およびOS率を予測した。[ 17 ]高リスク神経芽腫を呈する小児における再発後のOSは一般的にきわめて不良であるが、1件の単一施設研究において、再燃が単一部位の軟部組織腫瘤(2~3人の小児ではまた再燃時に骨髄または骨病変がみられた)であり、完全寛解またはMRD後の最初の再燃であった高リスク神経芽腫患者では35%の5年OS率が得られた。[ 15 ]
初発時に高リスクに分類された患者において再発または不応性の神経芽腫に対する治療法の選択肢には以下のものがある:
- 免疫療法を併用する化学療法。
- テモゾロミド、イリノテカン、およびジヌツキシマブ。[ 18 ]
- 131I-MIBG。131I-MIBG単独、他の治療との併用、またはその後の幹細胞救助。
- ALK阻害薬。ALK変異を有する患者に対する、クリゾチニブ、または他のALK阻害薬。[ 19 ]
- 化学療法。
- シクロホスファミドまたはエトポシドと併用するトポテカン。[ 20 ]
- イリノテカンと併用するテモゾロミド。
免疫療法を併用する化学療法により、疾患進行を来した高リスク患者に対して最も良好な奏効率および奏効期間が得られる。
証拠(免疫療法を併用する化学療法):
- ANBL1221(NCT01767194)試験では、最初の再燃または進行を来した患者が、テモゾロミド/イリノテカン/ジヌツキシマブまたはテモゾロミド/イリノテカン/テムシロリムスのいずれかを受けるようにランダムに割り付けられた。[
18
]
- ジヌツキシマブを含む併用で治療された患者17人中、9人の患者(53%)で客観的奏効が得られたのに対し、テムシロリムスを含むレジメンで治療された患者18人で客観的奏効が得られたのは1人であった。
証拠(131I-MIBG):
- 再発または不応性の神経芽腫の小児に対しては、131I-MIBGが有効な症状緩和薬であり、臨床研究において単独投与または化学療法(幹細胞救助を併用する)との併用が検討される。[ 21 ][ 22 ][ 23 ][ 24 ][ 25 ][ 26 ];[ 27 ][ 28 ][証拠レベル:3iiiA]
- 131I-MIBG療法による治療を受けた200人を超える患者を対象とした北米の1件のレトロスペクティブ研究で、疾患の再発または進行を来した小児が、診断以降病勢が安定しているか持続性病変であった小児と比較された。[
29
]
- 病勢が安定している持続性病変の患者では、131I-MIBG療法後にすぐ進行する率が低く、2年OS率はより良好であった(65% vs 39%)。
- 8人の患者における131I-MIBG、ビンクリスチン、およびイリノテカンと自家幹細胞移植(SCT)に続いてブスルファン/メルファランと自家SCTを用いるタンデム地固め療法がレトロスペクティブに報告され、3人で完全奏効、2人で部分奏効、および1人で小さな反応が得られた。[ 28 ]
- シングル自家SCTと漸増用量の131I-MIBGおよびカルボプラチン/エトポシド/メルファランが追加の患者で研究された。[
30
]
- 寛解導入化学療法後、不応性の患者27人と進行性の患者15人が治療され、4人で反応が得られた。導入療法に部分奏効を示した8人の患者が治療され、3人で反応が得られた。
- 類洞閉塞症候群の12%の発生率により用量が制限される。
証拠(化学療法):
- イリノテカンとテモゾロミドの併用療法は、1件の研究で奏効率が15%であった。[ 31 ][証拠レベル:2A]
- 1件のレトロスペクティブ研究では、92サイクルのイホスファミド、カルボプラチン、およびエトポシドを投与された74人の患者について報告された;この研究はこの薬物の併用が奏効した場合には末梢血幹細胞救助を受けた患者37人を含んでいた。[
32
]
- 病変の縮小(大きな反応および小さな反応)は、新たに再燃が認められた患者17人中14人(82%)、不応性神経芽腫患者26人中13人(50%)、および化学療法中に疾患が進行して治療を受けた患者34人中12人(35%)で達成された(P = 0.005)。
- 悪性度3の毒性作用はまれであった。
- シクロホスファミドまたはエトポシドと併用するトポテカンが、最初にトポテカン治療を受けていない再発患者に使用されている。[ 33 ][ 34 ];[ 20 ][証拠レベル:1A]
- 大量のカルボプラチン、イリノテカン、および/またはテモゾロミドが、トポテカンを含むレジメンに抵抗性または不応性の再燃患者に使用されている。[ 34 ]
再発または進行性神経芽腫における同種移植は歴史的に成功率が低い。1件のレトロスペクティブ登録研究では、以前の自家SCT後の同種SCTは利益をもたらさないようであった。疾患の再発が、依然として最も一般的な治療失敗の原因となっている。[ 35 ]
静注されるモノクローナル抗体の抗腫瘍活性を再現することのできる宿主抗ガングリオシド抗体を誘発するようにデザインされたワクチンなどの新たな治療アプローチの臨床試験が現在研究されている。患者はまた、広範な免疫賦活性作用を持ち、抗GD2/GD3モノクローナル抗体と相乗作用を生じるベータグルカン治療を受ける。高リスク神経芽腫の小児15人を対象とした第I相研究で、この療法はいかなる用量制限毒性を示すこともなく耐容性を示した。[ 36 ]2回目以降の完全または非常に良好な部分寛解を得た後に抗GD2免疫療法およびイソトレチノインによる地固め療法を行い、維持療法を併用した、または併用しなかった患者において長期PFSが報告されている。これには以前に抗GD2免疫療法およびイソトレチノインの投与を受けていた患者が含まれている。[ 37 ]
中枢神経系での再発神経芽腫
初発時の提示ではまれであるが、中枢神経系(CNS)転移は再発神経芽腫患者の5~10%に起こる。新たに診断された患者に対する初期治療では、CNSの治療が十分できないため、CNSが再燃につながる聖域部位として浮上している。[ 38 ][ 39 ]CNS再燃は、ほとんどすべての場合致命的で、死亡までの期間中央値は6ヵ月である。
CNSにおける再発神経芽腫に対する治療法の選択肢には以下のものがある:
- 手術および放射線療法。
- 新たな治療アプローチ。
一般に、現状の治療アプローチには、CNSにおける巨大なおよび顕微鏡的残存病変およびその後の再燃を予兆しうる全身の微小残存病変の根絶が挙げられる。神経外科的介入は、浮腫の軽減、出血の抑制、および治療開始前の巨大腫瘍の切除のために行われる。
放射性ヨウ素標識モノクローナル抗体を髄腔内投与するコンパートメント放射免疫療法が、手術、頭蓋脊髄放射線療法、および化学療法の後に再発した転移性CNS神経芽腫の患者を対象に試験されている。[ 12 ]
再発または不応性の神経芽腫に対して臨床評価段階にある治療法の選択肢
米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
- ANBL1821(NCT03794349)(再燃または不応性神経芽腫患者の治療においてeflornithine[DFMO]を併用するまたは併用しない塩酸イリノテカン、テモゾロミド、およびジヌツキシマブ):本試験では、化学免疫療法の基本骨格へのDFMOの追加が検討されており、再発神経芽腫患者において有望な結果を示している。DFMOは、MYCNの下流の転写標的で、ポリアミン合成経路において鍵となる酵素であるODC1に対する不可逆的阻害薬である。DFMOは、腫瘍の生存に必要な必須ポリアミンを枯渇させる。
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再燃または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的なvariant(多様体ないしバリアント)が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
- ADVL1312(NCT02095132)(再燃または難治性固形腫瘍の小児、青年、および若年成人において経口イリノテカンと併用するAZD1775[MK-1775]の第I相/II相研究):Wee1はDNA損傷に応答して活性化し、化学療法抵抗性および発がん遺伝子により誘発された細胞ストレスに対する耐容性において役割を果たすチロシンキナーゼである。Wee1阻害薬のAZD1775(MK-1775)は、このチェックポイントを克服し、化学療法に対する細胞の感受性を高めるために開発されており、MYCまたはMYCN発がん遺伝子の値が高い腫瘍では有効性が高まる可能性がある。
- ADVL1621(NCT02332668)(進行黒色腫もしくは進行、再燃、または難治性PD-L1陽性固形腫瘍またはリンパ腫の小児におけるペムブロリズマブ[MK-3475]の第I相/II相研究):この研究の1部では、ペムブロリズマブ療法の最大耐容量を見出し、その用量を確認し、第II相試験の推奨用量を見出す。この研究の2部では、小児における第II相試験の推奨用量の安全性および効力をさらに評価する。
- ENCIT-01(NCT02311621)(再発/不応性神経芽腫に対してCD171特異的キメラ抗原受容体[CAR]を発現するようにレンチウイルスを用いて形質導入された自家T細胞を使用する細胞免疫療法の第I相の実施可能性および安全性研究):再発または不応性神経芽腫患者は、従来の化学療法に抵抗性を示す。このため、研究者らは患者から直接採取したT細胞(遺伝学的にCARを発現するように修正できる)を使用する試みを行っている。CARは、神経芽腫細胞表面に発現する蛋白であるCD171の認識を介してT細胞が神経芽腫細胞を認識して殺すことができるようにする。これは、CAR T細胞の最大耐容量を明らかにするようにデザインされた第I相研究である。
- NANT2015-02(NCT03107988)(ALKにより再燃したまたは不応性の神経芽腫患者に対するALK/ROS1の経口低分子阻害薬、ロルラチニブ[PF-06463922]の第I相研究):これは、第三世代ALK阻害薬の小児における用量を見出す研究である。ロルラチニブはクリゾチニブに抵抗性を示す一部のALK変異に対して感受性を示す。より多くの小児を含める拡大研究も計画されている。
- N2011-01(NCT02035137)(抵抗性/再燃神経芽腫について131I-MIBG、131I-MIBGとビンクリスチンおよびイリノテカンの併用、または131I-MIBGおよびボリノスタットの併用に関するランダム化第II相Pick-the-Winner[成績が優れた治療を選択する]研究):この研究では、再燃または持続性の神経芽腫を診断された患者を対象に、ある治療が他の治療よりも優れているかを判定するためMIBGを含む3つの治療レジメンが腫瘍反応に対する効果および関連する副作用も含めて比較される。
- NANT2017-01(NCT03332667)(ジヌツキシマブと併用するMIBG):この小児の第I相試験では、不応性または再発神経芽腫患児に対し131I-MIBGがジヌツキシマブ(キメラ14.18モノクローナル抗体)との併用で投与される。この研究では第II相試験での小児への推奨投与量を決定するために従来の第I相用量漸増3+3デザインを使用する。その後に追加の6人の患児の拡大コホートが登録される可能性がある。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Marachelian A, Shimada H, Sano H, et al.: The significance of serial histopathology in a residual mass for outcome of intermediate risk stage 3 neuroblastoma. Pediatr Blood Cancer 58 (5): 675-81, 2012.[PUBMED Abstract]
- Taggart DR, Han MM, Quach A, et al.: Comparison of iodine-123 metaiodobenzylguanidine (MIBG) scan and [18F]fluorodeoxyglucose positron emission tomography to evaluate response after iodine-131 MIBG therapy for relapsed neuroblastoma. J Clin Oncol 27 (32): 5343-9, 2009.[PUBMED Abstract]
- Schleiermacher G, Javanmardi N, Bernard V, et al.: Emergence of new ALK mutations at relapse of neuroblastoma. J Clin Oncol 32 (25): 2727-34, 2014.[PUBMED Abstract]
- Padovan-Merhar OM, Raman P, Ostrovnaya I, et al.: Enrichment of Targetable Mutations in the Relapsed Neuroblastoma Genome. PLoS Genet 12 (12): e1006501, 2016.[PUBMED Abstract]
- Eleveld TF, Oldridge DA, Bernard V, et al.: Relapsed neuroblastomas show frequent RAS-MAPK pathway mutations. Nat Genet 47 (8): 864-71, 2015.[PUBMED Abstract]
- Schramm A, Köster J, Assenov Y, et al.: Mutational dynamics between primary and relapse neuroblastomas. Nat Genet 47 (8): 872-7, 2015.[PUBMED Abstract]
- London WB, Castel V, Monclair T, et al.: Clinical and biologic features predictive of survival after relapse of neuroblastoma: a report from the International Neuroblastoma Risk Group project. J Clin Oncol 29 (24): 3286-92, 2011.[PUBMED Abstract]
- Pole JG, Casper J, Elfenbein G, et al.: High-dose chemoradiotherapy supported by marrow infusions for advanced neuroblastoma: a Pediatric Oncology Group study. J Clin Oncol 9 (1): 152-8, 1991.[PUBMED Abstract]
- Castel V, Cañete A, Melero C, et al.: Results of the cooperative protocol (N-III-95) for metastatic relapses and refractory neuroblastoma. Med Pediatr Oncol 35 (6): 724-6, 2000.[PUBMED Abstract]
- Lau L, Tai D, Weitzman S, et al.: Factors influencing survival in children with recurrent neuroblastoma. J Pediatr Hematol Oncol 26 (4): 227-32, 2004.[PUBMED Abstract]
- Saylors RL, Stine KC, Sullivan J, et al.: Cyclophosphamide plus topotecan in children with recurrent or refractory solid tumors: a Pediatric Oncology Group phase II study. J Clin Oncol 19 (15): 3463-9, 2001.[PUBMED Abstract]
- Kramer K, Kushner BH, Modak S, et al.: Compartmental intrathecal radioimmunotherapy: results for treatment for metastatic CNS neuroblastoma. J Neurooncol 97 (3): 409-18, 2010.[PUBMED Abstract]
- Baker DL, Schmidt ML, Cohn SL, et al.: Outcome after reduced chemotherapy for intermediate-risk neuroblastoma. N Engl J Med 363 (14): 1313-23, 2010.[PUBMED Abstract]
- Strother DR, London WB, Schmidt ML, et al.: Outcome after surgery alone or with restricted use of chemotherapy for patients with low-risk neuroblastoma: results of Children's Oncology Group study P9641. J Clin Oncol 30 (15): 1842-8, 2012.[PUBMED Abstract]
- Murphy JM, Lim II, Farber BA, et al.: Salvage rates after progression of high-risk neuroblastoma with a soft tissue mass. J Pediatr Surg 51 (2): 285-8, 2016.[PUBMED Abstract]
- Twist CJ, Schmidt ML, Naranjo A, et al.: Maintaining Outstanding Outcomes Using Response- and Biology-Based Therapy for Intermediate-Risk Neuroblastoma: A Report From the Children's Oncology Group Study ANBL0531. J Clin Oncol 37 (34): 3243-3255, 2019.[PUBMED Abstract]
- London WB, Bagatell R, Weigel BJ, et al.: Historical time to disease progression and progression-free survival in patients with recurrent/refractory neuroblastoma treated in the modern era on Children's Oncology Group early-phase trials. Cancer 123 (24): 4914-4923, 2017.[PUBMED Abstract]
- Mody R, Naranjo A, Van Ryn C, et al.: Irinotecan-temozolomide with temsirolimus or dinutuximab in children with refractory or relapsed neuroblastoma (COG ANBL1221): an open-label, randomised, phase 2 trial. Lancet Oncol 18 (7): 946-957, 2017.[PUBMED Abstract]
- Mossé YP, Lim MS, Voss SD, et al.: Safety and activity of crizotinib for paediatric patients with refractory solid tumours or anaplastic large-cell lymphoma: a Children's Oncology Group phase 1 consortium study. Lancet Oncol 14 (6): 472-80, 2013.[PUBMED Abstract]
- London WB, Frantz CN, Campbell LA, et al.: Phase II randomized comparison of topotecan plus cyclophosphamide versus topotecan alone in children with recurrent or refractory neuroblastoma: a Children's Oncology Group study. J Clin Oncol 28 (24): 3808-15, 2010.[PUBMED Abstract]
- DuBois SG, Groshen S, Park JR, et al.: Phase I Study of Vorinostat as a Radiation Sensitizer with 131I-Metaiodobenzylguanidine (131I-MIBG) for Patients with Relapsed or Refractory Neuroblastoma. Clin Cancer Res 21 (12): 2715-21, 2015.[PUBMED Abstract]
- Polishchuk AL, Dubois SG, Haas-Kogan D, et al.: Response, survival, and toxicity after iodine-131-metaiodobenzylguanidine therapy for neuroblastoma in preadolescents, adolescents, and adults. Cancer 117 (18): 4286-93, 2011.[PUBMED Abstract]
- Matthay KK, Yanik G, Messina J, et al.: Phase II study on the effect of disease sites, age, and prior therapy on response to iodine-131-metaiodobenzylguanidine therapy in refractory neuroblastoma. J Clin Oncol 25 (9): 1054-60, 2007.[PUBMED Abstract]
- Matthay KK, Tan JC, Villablanca JG, et al.: Phase I dose escalation of iodine-131-metaiodobenzylguanidine with myeloablative chemotherapy and autologous stem-cell transplantation in refractory neuroblastoma: a new approaches to Neuroblastoma Therapy Consortium Study. J Clin Oncol 24 (3): 500-6, 2006.[PUBMED Abstract]
- Matthay KK, Quach A, Huberty J, et al.: Iodine-131--metaiodobenzylguanidine double infusion with autologous stem-cell rescue for neuroblastoma: a new approaches to neuroblastoma therapy phase I study. J Clin Oncol 27 (7): 1020-5, 2009.[PUBMED Abstract]
- DuBois SG, Chesler L, Groshen S, et al.: Phase I study of vincristine, irinotecan, and ¹³¹I-metaiodobenzylguanidine for patients with relapsed or refractory neuroblastoma: a new approaches to neuroblastoma therapy trial. Clin Cancer Res 18 (9): 2679-86, 2012.[PUBMED Abstract]
- Johnson K, McGlynn B, Saggio J, et al.: Safety and efficacy of tandem 131I-metaiodobenzylguanidine infusions in relapsed/refractory neuroblastoma. Pediatr Blood Cancer 57 (7): 1124-9, 2011.[PUBMED Abstract]
- French S, DuBois SG, Horn B, et al.: 131I-MIBG followed by consolidation with busulfan, melphalan and autologous stem cell transplantation for refractory neuroblastoma. Pediatr Blood Cancer 60 (5): 879-84, 2013.[PUBMED Abstract]
- Zhou MJ, Doral MY, DuBois SG, et al.: Different outcomes for relapsed versus refractory neuroblastoma after therapy with (131)I-metaiodobenzylguanidine ((131)I-MIBG). Eur J Cancer 51 (16): 2465-72, 2015.[PUBMED Abstract]
- Yanik GA, Villablanca JG, Maris JM, et al.: 131I-metaiodobenzylguanidine with intensive chemotherapy and autologous stem cell transplantation for high-risk neuroblastoma. A new approaches to neuroblastoma therapy (NANT) phase II study. Biol Blood Marrow Transplant 21 (4): 673-81, 2015.[PUBMED Abstract]
- Bagatell R, London WB, Wagner LM, et al.: Phase II study of irinotecan and temozolomide in children with relapsed or refractory neuroblastoma: a Children's Oncology Group study. J Clin Oncol 29 (2): 208-13, 2011.[PUBMED Abstract]
- Kushner BH, Modak S, Kramer K, et al.: Ifosfamide, carboplatin, and etoposide for neuroblastoma: a high-dose salvage regimen and review of the literature. Cancer 119 (3): 665-71, 2013.[PUBMED Abstract]
- Simon T, Längler A, Harnischmacher U, et al.: Topotecan, cyclophosphamide, and etoposide (TCE) in the treatment of high-risk neuroblastoma. Results of a phase-II trial. J Cancer Res Clin Oncol 133 (9): 653-61, 2007.[PUBMED Abstract]
- Kushner BH, Kramer K, Modak S, et al.: Differential impact of high-dose cyclophosphamide, topotecan, and vincristine in clinical subsets of patients with chemoresistant neuroblastoma. Cancer 116 (12): 3054-60, 2010.[PUBMED Abstract]
- Hale GA, Arora M, Ahn KW, et al.: Allogeneic hematopoietic cell transplantation for neuroblastoma: the CIBMTR experience. Bone Marrow Transplant 48 (8): 1056-64, 2013.[PUBMED Abstract]
- Kushner BH, Cheung IY, Modak S, et al.: Phase I trial of a bivalent gangliosides vaccine in combination with β-glucan for high-risk neuroblastoma in second or later remission. Clin Cancer Res 20 (5): 1375-82, 2014.[PUBMED Abstract]
- Kushner BH, Ostrovnaya I, Cheung IY, et al.: Prolonged progression-free survival after consolidating second or later remissions of neuroblastoma with Anti-GD2 immunotherapy and isotretinoin: a prospective Phase II study. Oncoimmunology 4 (7): e1016704, 2015.[PUBMED Abstract]
- Kramer K, Kushner B, Heller G, et al.: Neuroblastoma metastatic to the central nervous system. The Memorial Sloan-kettering Cancer Center Experience and A Literature Review. Cancer 91 (8): 1510-9, 2001.[PUBMED Abstract]
- Matthay KK, Brisse H, Couanet D, et al.: Central nervous system metastases in neuroblastoma: radiologic, clinical, and biologic features in 23 patients. Cancer 98 (1): 155-65, 2003.[PUBMED Abstract]
- 本要約の変更点(06/08/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
神経芽腫の病期情報
本文が改訂され、小児腫瘍学グループの画像で明らかにされた危険因子の記述が更新された(証拠レベル:3iiiCが追加された)。
神経芽腫に対する治療法選択肢の概要
証拠レベル:3iiiCが追加された。
高リスク神経芽腫の治療
参考文献28としてCasey et al.が追加された。
本文に、高リスク神経芽腫の小児を対象にして、オルニチン脱炭酸酵素阻害剤であるジフルオロメチルオルニチンを使用する維持療法について探索した1件の多施設第II相臨床試験の結果に関する記述が追加された(引用、参考文献44としてSholler et al.)。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、神経芽腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Christopher N. Frantz, MD (Alfred I. duPont Hospital for Children)
- Andrea A. Hayes-Jordan, MD, FACS, FAAP (University of North Carolina - Chapel Hill School of Medicine)
- Karen J. Marcus, MD, FACR (Dana-Farber Cancer Institute/Boston Children's Hospital)
- Nita Louise Seibel, MD (National Cancer Institute)
- Stephen J. Shochat, MD (St. Jude Children's Research Hospital)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Neuroblastoma Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/neuroblastoma/hp/neuroblastoma-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389190]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。


 画像を拡大する
画像を拡大する