ご利用について
医療専門家向けの本PDQがん情報要約では、成人膵がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 膵がんに関する一般情報
-
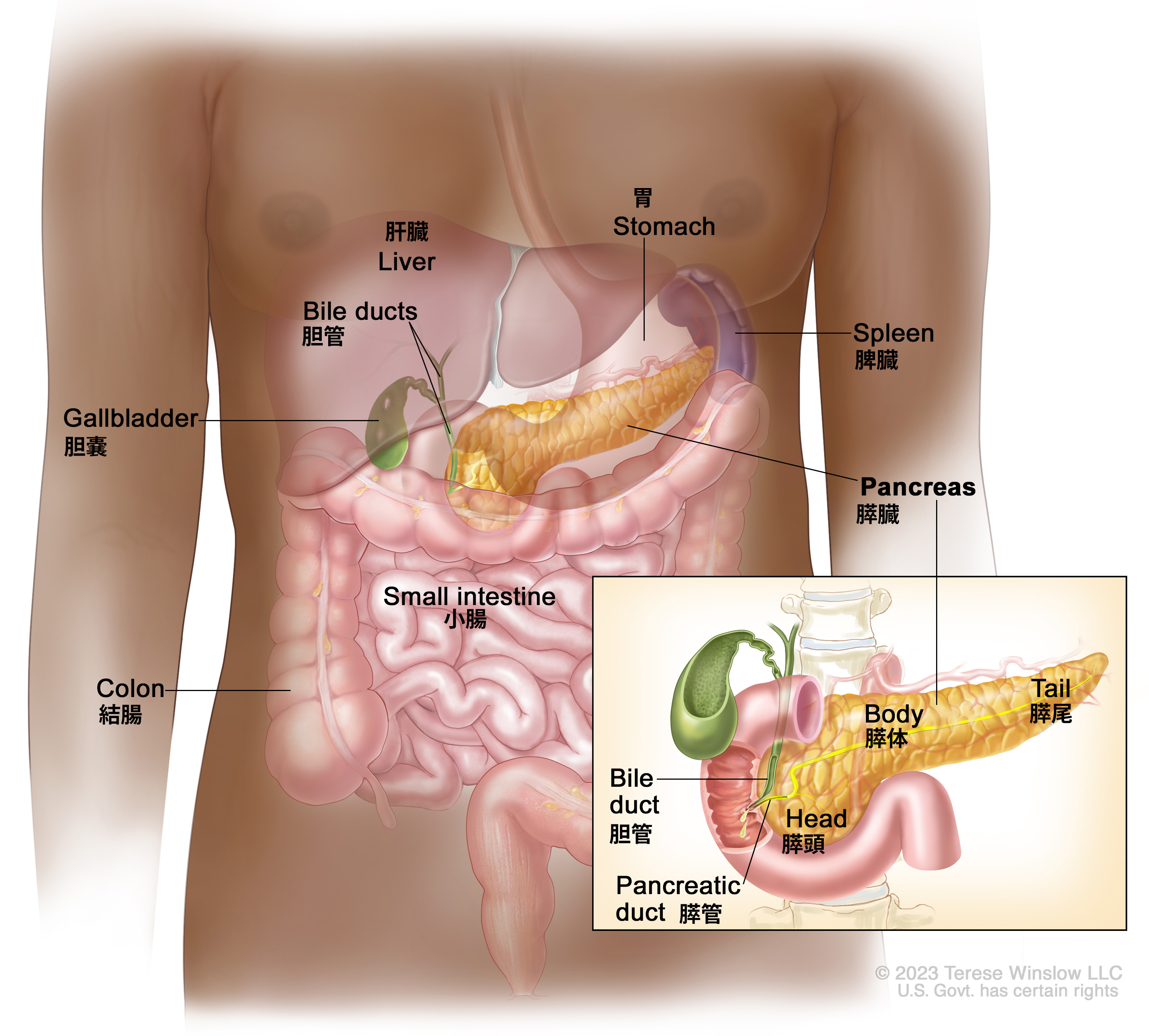
本要約では膵外分泌がんの治療に関する情報を提供する。膵がんに関する情報を含む他のPDQ要約には以下のものがある:
発生率および死亡率
米国において、2020年に推定される膵がんの新規症例数および死亡数:[ 1 ]
この数十年にわたり膵がんの発生率は著明に増大しており、米国ではがん死の主要原因の第4位となっている。膵がんに関連する死亡率は高いものの、その病因はほとんど明らかにされていない。[ 2 ]
臨床的特徴
膵がんの症状は、膵臓内の腫瘍部位および浸潤の程度によって異なる。
初期の膵がんでは、注目すべき症状は多く見られない。がんが増殖するにつれて、以下の症状が見られる可能性がある:
診断的評価および病期評価
膵がんは以下の理由から発見と診断が困難である:
膵がんを適切に治療するには、がんが切除可能かどうかを評価することがきわめて重要である。
画像法
画像技術を用いることで、膵がんの診断および切除不能な病変を有する患者の特定に役立つ場合がある。用いられる画像検査には以下のものがある:[ 5 ]
腹膜細胞診
228人の患者のケースシリーズでは、腹膜細胞診陽性を切除不能性の決定に用いた場合、陽性反応適中度が94%、特異度が98%、感度が25%であった。[ 8 ]
腫瘍マーカー
膵がんに特異的な腫瘍マーカーはみられず、血清がん抗原(CA)19-9などのマーカーは特異度が低い。診断時には、膵がん患者のほとんどにCA19-9増大が認められる。根治治療の実施期間内または実施後、CA19-9値増大を認めれば、腫瘍増大が進行しているとみなせる。[ 9 ][証拠レベル:3iDiii]しかしながら、CA19-9が正常値でも、再発が除外されるわけではない。
予後および生存
予後に影響する主な因子は以下の通りである:
膵外分泌がんが根治可能となるのはまれであり、全生存率(OS)は6%を下回っている。[ 10 ]膵がんに伴う罹病および死亡が甚大で、治療決定が複雑なため、包括的な集学的チームによる管理を考慮すべきである。
腫瘍が間違いなく膵臓に限局している場合に治癒率は最も高率となるが、この病期は症例の20%に満たない。限局性膵がんおよび小膵がん(2cm未満)で、リンパ節転移も膵被膜を越える進展も認められない患者には、外科的完全切除により、18~24%の生命表法を用いた5年生存率が得られうる。[ 11 ][証拠レベル:3iA]
外科的切除は根治的治療の基本戦略であり、限局性小膵腫瘍患者に生存利益が得られるが、必ず全身療法と一緒に検討すべきである。切除不能、転移性、または再発膵がん患者では、外科的切除により利益が得られる可能性は低い。
いずれの病期の膵がん患者も従来の化学療法、放射線療法、および外科手術に対する反応が悪いため、臨床試験の対象とするのが適切であろう。
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Silverman DT, Schiffman M, Everhart J, et al.: Diabetes mellitus, other medical conditions and familial history of cancer as risk factors for pancreatic cancer. Br J Cancer 80 (11): 1830-7, 1999.[PUBMED Abstract]
- Tersmette AC, Petersen GM, Offerhaus GJ, et al.: Increased risk of incident pancreatic cancer among first-degree relatives of patients with familial pancreatic cancer. Clin Cancer Res 7 (3): 738-44, 2001.[PUBMED Abstract]
- Nöthlings U, Wilkens LR, Murphy SP, et al.: Meat and fat intake as risk factors for pancreatic cancer: the multiethnic cohort study. J Natl Cancer Inst 97 (19): 1458-65, 2005.[PUBMED Abstract]
- Riker A, Libutti SK, Bartlett DL: Advances in the early detection, diagnosis, and staging of pancreatic cancer. Surg Oncol 6 (3): 157-69, 1997.[PUBMED Abstract]
- John TG, Greig JD, Carter DC, et al.: Carcinoma of the pancreatic head and periampullary region. Tumor staging with laparoscopy and laparoscopic ultrasonography. Ann Surg 221 (2): 156-64, 1995.[PUBMED Abstract]
- Minnard EA, Conlon KC, Hoos A, et al.: Laparoscopic ultrasound enhances standard laparoscopy in the staging of pancreatic cancer. Ann Surg 228 (2): 182-7, 1998.[PUBMED Abstract]
- Merchant NB, Conlon KC, Saigo P, et al.: Positive peritoneal cytology predicts unresectability of pancreatic adenocarcinoma. J Am Coll Surg 188 (4): 421-6, 1999.[PUBMED Abstract]
- Willett CG, Daly WJ, Warshaw AL: CA 19-9 is an index of response to neoadjunctive chemoradiation therapy in pancreatic cancer. Am J Surg 172 (4): 350-2, 1996.[PUBMED Abstract]
- Siegel R, Naishadham D, Jemal A: Cancer statistics, 2013. CA Cancer J Clin 63 (1): 11-30, 2013.[PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997.[PUBMED Abstract]
- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999.[PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001.[PUBMED Abstract]
- Passik SD, Breitbart WS: Depression in patients with pancreatic carcinoma. Diagnostic and treatment issues. Cancer 78 (3 Suppl): 615-26, 1996.[PUBMED Abstract]
- 膵がんの細胞分類
-
膵がんは以下のがん腫を含む:
参考文献- Sanchez JA, Newman KD, Eichelberger MR, et al.: The papillary-cystic neoplasm of the pancreas. An increasingly recognized clinicopathologic entity. Arch Surg 125 (11): 1502-5, 1990.[PUBMED Abstract]
- Warshaw AL, Compton CC, Lewandrowski K, et al.: Cystic tumors of the pancreas. New clinical, radiologic, and pathologic observations in 67 patients. Ann Surg 212 (4): 432-43; discussion 444-5, 1990.[PUBMED Abstract]
- Sohn TA, Yeo CJ, Cameron JL, et al.: Intraductal papillary mucinous neoplasms of the pancreas: an increasingly recognized clinicopathologic entity. Ann Surg 234 (3): 313-21; discussion 321-2, 2001.[PUBMED Abstract]
- 膵がんの病期情報
-
膵外分泌がんの病期分類システムには絶えず進展がみられる。臨床病期分類は、外科的判断が強く影響する切除可能性に従って決定される。外科的切除可能性に対するコンセンサスガイドライン(例、National Comprehensive Cancer Network、MD Anderson Cancer Center、American Hepato-Pancreato-Biliary Association、およびInternational Hepato-Pancreato-Biliary Association)は、洗練され続けているが、従来から以下に層別化されている:
米国がん合同委員会(AJCC)はTNM(腫瘍、リンパ節、転移)分類による病期判定を指定している。[ 1 ]
AJCC病期分類とTNMの定義
参考文献- Kakar S, Pawlik TM, Allen PJ: Exocrine Pancreas. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 337–47.[PUBMED Abstract]
- 膵がんの治療法選択肢の概要
-
実施可能である場合には依然として外科的切除術が第一治療法である;ときに外科的切除術により、長期生存がもたらされ、有効な緩和が得られることがある。[ 1 ][ 2 ][ 3 ][証拠レベル:3iA]治療はしばしば切除可能性に従って決定されるが、この決定は外科的判断と経験によってさまざまである。患者数の多い施設への紹介を検討すべきである。[ 4 ]
術後化学療法の追加は全生存を改善するが、化学放射線療法の役割については、依然として議論が続いている。
膵がんの合併症には以下のものがある:
いずれの病期の膵外分泌がん患者も生存率は低い。いずれの病期の患者にも臨床試験中の治療が代替療法として適しており、症状緩和目的のアプローチを選択する前に検討すべきである。
膵がんに対して現在実施中の臨床試験に関する情報は、NCIウェブサイトから入手することができる。
表6.膵がんの治療法選択肢 治療法選択肢 切除可能またはぎりぎり切除可能な膵がん 術前補助療法 手術 術後化学療法 術後化学放射線療法 局所進行膵がん 標的療法を併用するまたは併用しない化学療法 化学放射線療法 手術 症状緩和目的の手術 転移または再発膵がん 標的療法を併用するまたは併用しない化学療法 病期にかかわらず、緩和療法が考慮できる。詳しい情報については、本要約の緩和療法のセクションを参照のこと。
参考文献- Yeo CJ, Cameron JL, Lillemoe KD, et al.: Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients. Ann Surg 221 (6): 721-31; discussion 731-3, 1995.[PUBMED Abstract]
- Conlon KC, Klimstra DS, Brennan MF: Long-term survival after curative resection for pancreatic ductal adenocarcinoma. Clinicopathologic analysis of 5-year survivors. Ann Surg 223 (3): 273-9, 1996.[PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997.[PUBMED Abstract]
- Lidsky ME, Sun Z, Nussbaum DP, et al.: Going the Extra Mile: Improved Survival for Pancreatic Cancer Patients Traveling to High-volume Centers. Ann Surg 266 (2): 333-338, 2017.[PUBMED Abstract]
- 切除可能またはぎりぎり切除可能な膵がんの治療
-
切除可能またはぎりぎり切除可能な膵がんに対する治療法選択肢
切除可能またはぎりぎり切除可能な膵がんに対する治療法選択肢には以下のものがある:
- 術前補助療法:根治的膵切除術前の放射線療法併用/非併用による化学療法。
- 手術:根治的膵切除術は以下の通り:
- 術後化学療法:根治的膵切除術とその後に実施する化学療法。[ 3 ]
- 術後化学放射線療法:根治的膵切除術とその後に実施するフルオロウラシル(5-FU)化学療法および放射線療法。[ 4 ][ 5 ][ 6 ][ 7 ][ 8 ]
病期にかかわらず、緩和療法が考慮できる。詳しい情報については、本要約の緩和療法のセクションを参照のこと。
術前補助療法
術前補助療法は、手術前に施行する化学放射線療法併用/非併用による化学療法である。術前補助療法の役割は、レトロスペクティブ研究(Surveillance, Epidemiology, and End Results [SEER]データベースおよびNational Cancer Database)で評価されており、ぎりぎり切除可能な膵がん患者の管理に対して、多くのコンセンサスガイドラインにより推奨されている。切除可能な膵がんで評価中であるが、大規模なランダム化臨床試験がまだ完了していない。[ 9 ][ 10 ][ 11 ]
手術
完全切除術を施行すれば18~24%の5年生存率が得られるが、局所、遠隔ともに腫瘍再発率が高いため、依然として最終コントロールは不良である。したがって、治療には全身療法も推奨される。[ 12 ][ 13 ][ 14 ][証拠レベル:3iA]
外科的局所切除術を実施できる膵がん患者は約20%であり、手術死亡率は約1~16%である。[ 15 ][ 16 ][ 17 ][ 18 ][ 19 ]メディケア請求書データベースの情報を用いた、1992年から1995年に膵頭十二指腸切除術を施行した7,000人を超える患者に関する全国コホート研究では、膵頭十二指腸切除術実施例の少ない病院(膵頭十二指腸切除術が1例未満/年)が多い病院(膵頭十二指腸切除術が6例以上/年)よりも院内死亡率が高いことが明らかにされた(それぞれ16% vs 4%;P < 0.01)。[ 15 ]
術後化学療法
歴史的に、複数のランダム化試験で、補助ゲムシタビン単剤療法[ 20 ]または補助5-FU単剤療法[ 3 ]の方が手術単独よりも外科的切除後の6ヵ月全生存(OS)率が改善することが確立されている。より最近の研究では、外科的切除後の治療成績をさらに改善する可能性のある新たな併用レジメンが調査されている。
パフォーマンスステータスが良好な患者については、補助FOLFIRINOX(オキサリプラチン、ロイコボリン、イリノテカン、および5-FU)化学療法またはゲムシタビンとカペシタビンの併用を検討すべきである。しかしながら、高齢の患者またはパフォーマンスステータスが境界域の患者に対しては、補助ゲムシタビンまたは5-FU単剤療法を検討できる。アジアでは、S-1(テガフール、ギメラシル、およびオテラシルカリウム)がゲムシタビンベースの治療法に対する適切な代替療法である。
証拠(術後化学療法):
- FOLFIRINOX:PRODIGE-24試験(NCT01526135)は、ランダム化オープンラベル第III相試験で、R0/R1切除を受けた493人の患者が1:1の比率で、6サイクルのゲムシタビン(28日サイクルの1日目、8日目、および15日目に1,000mg/m2)または12サイクルのFOLFIRINOX(2週間ごとにオキサリプラチン、85mg/m2、ロイコボリン、400mg/m2、イリノテカン、150mg/m2、および5-FU、2,400mg/m2を46時間持続注入)を投与される群にランダムに割り付けられた。[ 21 ][証拠レベル:1iiA]
- ゲムシタビンとカペシタビン:European Study for Pancreatic Cancer(ESPAC-4[NCT00058201])試験では、膵がんを切除された患者732人を、6サイクルのゲムシタビン単独(4週間ごとの3週間に週1回1,000mg/m2を投与)または経口カペシタビン(1,660mg/m2を21日間投与後7日間の休薬[1サイクル])を併用のいずれかにランダムに割り付けた。[ 22 ][証拠レベル:1iiA]
- S-1:Japan Adjuvant Study Group of Pancreatic Cancer(膵がん補助化学療法研究グループ)(JASPAC-01)研究は日本で実施された第III相多施設非劣性試験であり、385人の患者が6サイクルのゲムシタビン(4週間ごとの3週間に週1回1,000mg/m2を投与)またはS-1(テガフール、ギメラシル、およびオテラシルカリウム)(4週間の1日2回経口投与に続いて2週間の休薬)のいずれかを受けるようにランダムに割り付けられた。[ 23 ][証拠レベル:1iiA]
- ゲムシタビン:Charité Onkologie(CONKO)-001は、膵がんを切除し補助ゲムシタビン6サイクル vs 観察にランダムに割り付けられた患者368人を対象にした多施設第III相試験であった。[ 20 ][証拠レベル:1iiDii]以前の試験とは対照的に、主要エンドポイントはDFSであった。
- ゲムシタビンまたは5-FU:ESPAC-3(NCT00058201)試験では、肉眼的完全切除を受けた患者1,088人を、6ヵ月にわたって28日ごとの1~5日目に5-FU(425mg/m2)およびロイコボリン(20mg/m2)を投与する群、または6ヵ月にわたって28日ごとの1日目、8日目、および15日目にゲムシタビン(1,000mg/m2)を投与する群のいずれかにランダムに割り付けた。[ 3 ][証拠レベル:1iiA]
術後化学放射線療法
利用可能なランダム化臨床試験のデータの多くは統計的検出力が低く、結果が矛盾しているため、この疾患の管理における術後療法(化学放射線療法を伴うまたは伴わない化学療法)の役割については見解の一致をみていない。[ 4 ][ 5 ][ 6 ][ 7 ][ 8 ]
証拠(術後化学放射線療法):
数件の第III相試験で、術後補助5-FUをベースにした化学放射線療法のOSに関する潜在的利益が調査された:
- Gastrointestinal Study Group(GITSG):1985年にGITSGにより実施された小規模ランダム化試験では、手術単独と、手術とその後に実施する化学放射線療法とが比較された。[ 4 ][証拠レベル:1iiA];[ 5 ][証拠レベル:2A]
- European Organization for the Research and Treatment of Cancer(EORTC):EORTCがこのGITSG試験の結果を再現しようと試みたが、補助化学放射線療法が切除術単独より有意に有益であることを確認するに至らなかった[ 6 ][証拠レベル:1iiA];ただし、この試験では、膵がん患者のほか(予後が良好である可能性のある)十二指腸乳頭部領域がん患者も対象とされていた。
- その後のESPAC-1試験で更新された解析では、膵切除術後に厳格なランダム化を受けた患者のみ調査された。患者は4群(観察群、5-FUボーラス投与化学療法群、5-FUボーラス投与化学放射線療法群、または化学放射線療法後の追加化学療法群)の1つに割り付けられた。[ 7 ][ 8 ][ 25 ][証拠レベル:1iiA]
- 米国のGastrointestinal Intergroup:米国のGastrointestinal Intergroupにより、膵がんを切除され、術後5-FU注入 + 5-FU注入と同時に実施する放射線、または補助ゲムシタビン + 5-FU注入と同時に実施する放射線のいずれかを受ける群に割り付けられた451人の患者を対象とした1件の第III相ランダム化試験(Radiation Therapy Oncology Group[RTOG]-9704)の結果が報告されている。[ 26 ][証拠レベル:1iiA]すべての患者および膵頭部腫瘍患者の主要エンドポイントはOSであった。
エルロチニブを併用するまたは併用しないフルコースのゲムシタビン完了後の化学放射線療法の影響を評価するためのEORTC/U.S. Gastrointestinal IntergroupのRTOG-0848第III相補助試験は終了し、結果が待たれている。
この疾患に対するより有効な全身療法を決定するために、追加試験の実施が依然として妥当である。
切除可能またはぎりぎり切除可能な膵がんに対して臨床評価段階にある治療法の選択肢
臨床評価段階にある治療法の選択肢には以下のものがある:
- 術前化学療法および/または放射線療法。
- 代替の放射線技術。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Dalton RR, Sarr MG, van Heerden JA, et al.: Carcinoma of the body and tail of the pancreas: is curative resection justified? Surgery 111 (5): 489-94, 1992.[PUBMED Abstract]
- Brennan MF, Moccia RD, Klimstra D: Management of adenocarcinoma of the body and tail of the pancreas. Ann Surg 223 (5): 506-11; discussion 511-2, 1996.[PUBMED Abstract]
- Neoptolemos JP, Stocken DD, Bassi C, et al.: Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 304 (10): 1073-81, 2010.[PUBMED Abstract]
- Further evidence of effective adjuvant combined radiation and chemotherapy following curative resection of pancreatic cancer. Gastrointestinal Tumor Study Group. Cancer 59 (12): 2006-10, 1987.[PUBMED Abstract]
- Kalser MH, Ellenberg SS: Pancreatic cancer. Adjuvant combined radiation and chemotherapy following curative resection. Arch Surg 120 (8): 899-903, 1985.[PUBMED Abstract]
- Klinkenbijl JH, Jeekel J, Sahmoud T, et al.: Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg 230 (6): 776-82; discussion 782-4, 1999.[PUBMED Abstract]
- Neoptolemos JP, Dunn JA, Stocken DD, et al.: Adjuvant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. Lancet 358 (9293): 1576-85, 2001.[PUBMED Abstract]
- Neoptolemos JP, Stocken DD, Friess H, et al.: A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer. N Engl J Med 350 (12): 1200-10, 2004.[PUBMED Abstract]
- Stessin AM, Meyer JE, Sherr DL: Neoadjuvant radiation is associated with improved survival in patients with resectable pancreatic cancer: an analysis of data from the surveillance, epidemiology, and end results (SEER) registry. Int J Radiat Oncol Biol Phys 72 (4): 1128-33, 2008.[PUBMED Abstract]
- Versteijne E, Vogel JA, Besselink MG, et al.: Meta-analysis comparing upfront surgery with neoadjuvant treatment in patients with resectable or borderline resectable pancreatic cancer. Br J Surg 105 (8): 946-958, 2018.[PUBMED Abstract]
- Mokdad AA, Minter RM, Zhu H, et al.: Neoadjuvant Therapy Followed by Resection Versus Upfront Resection for Resectable Pancreatic Cancer: A Propensity Score Matched Analysis. J Clin Oncol 35 (5): 515-522, 2017.[PUBMED Abstract]
- Cameron JL, Crist DW, Sitzmann JV, et al.: Factors influencing survival after pancreaticoduodenectomy for pancreatic cancer. Am J Surg 161 (1): 120-4; discussion 124-5, 1991.[PUBMED Abstract]
- Yeo CJ, Cameron JL, Lillemoe KD, et al.: Pancreaticoduodenectomy for cancer of the head of the pancreas. 201 patients. Ann Surg 221 (6): 721-31; discussion 731-3, 1995.[PUBMED Abstract]
- Yeo CJ, Abrams RA, Grochow LB, et al.: Pancreaticoduodenectomy for pancreatic adenocarcinoma: postoperative adjuvant chemoradiation improves survival. A prospective, single-institution experience. Ann Surg 225 (5): 621-33; discussion 633-6, 1997.[PUBMED Abstract]
- Birkmeyer JD, Finlayson SR, Tosteson AN, et al.: Effect of hospital volume on in-hospital mortality with pancreaticoduodenectomy. Surgery 125 (3): 250-6, 1999.[PUBMED Abstract]
- Cameron JL, Pitt HA, Yeo CJ, et al.: One hundred and forty-five consecutive pancreaticoduodenectomies without mortality. Ann Surg 217 (5): 430-5; discussion 435-8, 1993.[PUBMED Abstract]
- Spanknebel K, Conlon KC: Advances in the surgical management of pancreatic cancer. Cancer J 7 (4): 312-23, 2001 Jul-Aug.[PUBMED Abstract]
- Balcom JH, Rattner DW, Warshaw AL, et al.: Ten-year experience with 733 pancreatic resections: changing indications, older patients, and decreasing length of hospitalization. Arch Surg 136 (4): 391-8, 2001.[PUBMED Abstract]
- Sohn TA, Yeo CJ, Cameron JL, et al.: Resected adenocarcinoma of the pancreas-616 patients: results, outcomes, and prognostic indicators. J Gastrointest Surg 4 (6): 567-79, 2000 Nov-Dec.[PUBMED Abstract]
- Oettle H, Post S, Neuhaus P, et al.: Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 297 (3): 267-77, 2007.[PUBMED Abstract]
- Conroy T, Hammel P, Hebbar M, et al.: FOLFIRINOX or Gemcitabine as Adjuvant Therapy for Pancreatic Cancer. N Engl J Med 379 (25): 2395-2406, 2018.[PUBMED Abstract]
- Neoptolemos JP, Palmer DH, Ghaneh P, et al.: Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC-4): a multicentre, open-label, randomised, phase 3 trial. Lancet 389 (10073): 1011-1024, 2017.[PUBMED Abstract]
- Uesaka K, Boku N, Fukutomi A, et al.: Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3, open-label, randomised, non-inferiority trial (JASPAC 01). Lancet 388 (10041): 248-57, 2016.[PUBMED Abstract]
- Oettle H, Neuhaus P, Hochhaus A, et al.: Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial. JAMA 310 (14): 1473-81, 2013.[PUBMED Abstract]
- Choti MA: Adjuvant therapy for pancreatic cancer--the debate continues. N Engl J Med 350 (12): 1249-51, 2004.[PUBMED Abstract]
- Regine WF, Winter KA, Abrams RA, et al.: Fluorouracil vs gemcitabine chemotherapy before and after fluorouracil-based chemoradiation following resection of pancreatic adenocarcinoma: a randomized controlled trial. JAMA 299 (9): 1019-26, 2008.[PUBMED Abstract]
- Regine WF, Winter KA, Abrams R, et al.: Fluorouracil-based chemoradiation with either gemcitabine or fluorouracil chemotherapy after resection of pancreatic adenocarcinoma: 5-year analysis of the U.S. Intergroup/RTOG 9704 phase III trial. Ann Surg Oncol 18 (5): 1319-26, 2011.[PUBMED Abstract]
- 局所進行膵がんの治療
-
局所進行膵がんに対する治療法選択肢
局所進行および転移膵がんはいずれも治癒可能ではないが、局所進行病変の自然経過は転移病変の場合と異なる可能性がある。剖検シリーズで、死亡した局所進行病変を有する患者の30%には遠隔転移の証拠が得られなかったことが実証された。[ 1 ][証拠レベル:1iiA]そのため、局所進行病変を有する患者に対する化学放射線療法が必要であるかという課題に研究者らは取り組んでいる。
局所進行膵がんに対する治療法選択肢には以下のものがある:
- 標的療法を併用するまたは併用しない化学療法。
- 化学放射線療法:転移病変がみられない患者に対する化学療法とその後の化学放射線療法。
- 手術:根治的膵切除術。
- 症状緩和目的の手術:症状緩和目的の外科胆道および/または胃バイパス術、経皮的放射線学的胆管ステント留置、または内視鏡的胆管ステント留置。[ 2 ][ 3 ]
病期にかかわらず、緩和療法が考慮できる。詳しい情報については、本要約の緩和療法のセクションを参照のこと。
標的療法を併用するまたは併用しない化学療法
化学療法は局所進行膵がん患者に対する一次治療法であり、転移性疾患を有する患者の治療に用いられるものと同じレジメンが用いられる。
証拠(化学療法):
- FOLFIRINOX vs ゲムシタビン:1件の多施設第II/III相試験には、転移性膵腺がんでEastern Cooperative Oncology Group(ECOG)のパフォーマンスステータススコアが0または1の患者342人が含められた。[ 4 ][証拠レベル:1iiA]患者は、FOLFIRINOX(オキサリプラチン[85mg/m2]、イリノテカン[180mg/m2]、ロイコボリン[400mg/m2]、およびフルオロウラシル[5-FU;400mg/m2]をボーラスで投与後、2週間ごとに2,400mg/m2を46時間持続注入)またはゲムシタビン(8週間中7週間、週1回、その後は4週間中3週間、週1回1,000mg/m2)を投与される群にランダムに割り付けられた。
- ゲムシタビンとナブパクリタキセル vs ゲムシタビン:1件の多施設国際第III相試験(NCT00844649)には、転移性膵腺がん(カルノフスキーのパフォーマンスステータスが70以上)を有し、転移性疾患に対して以前に化学療法を受けていない患者861人が含められた。[ 5 ][証拠レベル:1iiA]補助療法でゲムシタビンまたは他の何らかの化学療法を受けたことのある患者は除外された。患者はゲムシタビン(1,000 mg/m2)とナブパクリタキセル(体表面積1m2当たり125mg)、週1回を4週間中3週実施、またはゲムシタビン単剤療法(1,000 mg/m2、週1回を8週間中7週実施に続いて、週1回を4週間中3週実施)にランダムに割り付けられた。
- ゲムシタビン vs 5-FU:ゲムシタビンは膵がん患者に活性を示しており、有用な症状緩和薬剤である。[ 6 ][ 7 ][ 8 ]膵腺がんの進行患者および転移患者を対象に第一選択肢の治療としてゲムシタビンと5-FUを比較した第III相試験では、ゲムシタビン投与患者に有意な生存率の改善をみたことが報告された(5-FUでは1年生存率が2%であったのに対して、ゲムシタビンでは18%であった;P = 0.003)。[ 7 ][証拠レベル:1iiA]
- ゲムシタビン単独 vs ゲムシタビンとエルロチニブ:カナダ国立がん研究所(NCIカナダ)が実施した第III相試験(CAN-NCIC-PA3[NCT00026338])では、膵がんが進行または転移した患者を対象にゲムシタビン単独とゲムシタビンとエルロチニブ(100mg/日)の併用とが比較された。[ 9 ][証拠レベル:1iiA]
- 白金アナログまたはフルオロピリミジンのいずれかとの併用 vs ゲムシタビン単剤:多くの第III相研究が白金アナログ(シスプラチンまたはオキサリプラチン)またはフルオロピリミジンのいずれかとの併用レジメン vs ゲムシタビン単剤を評価している。[ 10 ][ 11 ]
- 5-FU、ロイコボリン、およびオキサリプラチン(OFFレジメン) vs 最適な支持療法(BSC):ゲムシタビンをベースとしたレジメンで進行した後には、第二選択化学療法が有益な場合がある。Charité Onkologie(CONKO)-003の研究者らは、第二選択化学療法を受ける患者をOFFレジメンまたはBSCのいずれかにランダムに割り付けた。[ 12 ][ 13 ][証拠レベル:3iA]OFFレジメンはロイコボリン(200mg/m2)投与後、5-FU(1日目、8日目、15日目、および22日目に2,000mg/m2[24時間持続注入])およびオキサリプラチン(8日目および22日目に85mg/m2)で構成された。3週間の休薬後、43日目に次のサイクルが開始された。試験は登録数が少なかったため早期に終了され、わずか46人の患者がOFFレジメンまたはBSCにランダムに割り付けられた。
化学放射線療法
局所進行膵がんにおける化学放射線療法の役割については、依然として議論が続いている。表7に局所進行膵がんに対する化学放射線療法について検討した第III相ランダム化研究が要約されている。
表7.局所進行膵がんを対象としたランダム化研究:生存期間中央値 試験 レジメン 化学放射線療法 放射線療法単独 化学療法単独 値 5-FU = フルオロウラシル;ECOG = Eastern Cooperative Oncology Group;FFCD = Fédération Francophone de Cancérologie Digestive;GEM = ゲムシタビン;GITSG = Gastrointestinal Tumor Study Group;Gy = グレイ(電離放射線の吸収線量の単位);P値 = 確率値;XRT = X線または放射線療法。 2000年より前 GITSG[ 14 ] 放射線療法単独 vs 5-FU/60Gy XRT 40週 20週 <.01 ECOG[ 15 ] 放射線療法 vs 5-FU、マイトマイシンC/59Gy XRT 8.4ヵ月 7.1ヵ月 .16 2000年以降 FFCD[ 16 ] GEM vs GEM、シスプラチン、60Gy XRT 8.6ヵ月 13ヵ月 .03 ECOG[ 17 ] GEM vs GEM/50.4Gy XRT 11.1ヵ月 9.2ヵ月 .017 証拠(化学放射線療法):
3件の試験で、集学的治療 vs 放射線療法単独の調査が試みられた。[ 14 ][ 15 ][ 16 ]試験にはデザインや分析方法にかなりの欠陥が認められた。当初、標準の実践は、最初の2件の研究のデータに基づく化学放射線療法の実施であった;しかしながら、3番目の研究の発表では、標準の実践は転移が認められない場合に化学療法とその後の化学放射線療法に変更された。
-
LAP07(NCT00634725):LAP07研究は、Groupe Coopérateur Multidiciplinaire en Oncologie(GERCOR)研究の結果に基づいて実施された国際ランダム化第III相研究であった。計449人の患者が2008年から2011年の間に登録され、2段階のランダム化プロセスを介してランダムに割り付けられた。第一段階では、患者はゲムシタビンによる導入療法(n = 223)またはゲムシタビン + エルロチニブ(n = 219) × 4サイクルにランダムに割り付けられた。第二段階で、対照となる腫瘍を有する患者(n = 269)は化学療法(n = 136)または化学放射線療法(n = 133)を受けるように2回目のランダム化を実施された。総線量54Gyを30分割で1日1回照射が、放射線療法実施日に同時カペシタビン、800mg/m2、1日2回の用量とともに処方された。[
18
][証拠レベル:1iiA]
LAP07研究は、ゲムシタビンをベースにした導入化学療法の設定で化学放射線療法の役割について最も強固なプロスペクティブ・ランダム化第III相研究のデータを提示しているが、OSの有益性は実証されていない。しかしながら、この研究は、局所進行がんの設定において広く採用されているFOLFIRINOX化学療法の出現前に開始されていた。ゲムシタビン/パクリタキセルやFOLFIRINOXなど、より活性の高い化学療法レジメンの設定における化学放射線療法の役割については、まだ評価されていない。
- Gastrointestinal Tumor Study Group(GITSG)のGITSG-9273試験:2000年より前に実施された数件の第III相試験で、集学的治療 vs 放射線療法単独が評価された。局所進行性または転移性膵がんの患者に対するゲムシタビン使用前に、GITSGの研究者らは局所進行性膵腺がん患者106人を、外照射療法(EBRT)(60Gy)単独群またはEBRT(40Gyまたは60Gyのいずれか) + 5-FUボーラス投与の同時実施群にランダムに割り付けた。[ 14 ][証拠レベル:1iiA]
- ECOG E-8282試験:ECOGの研究者らは114人の患者を、放射線療法(59.4Gy)単独または同時の5-FU注入(1,000mg/m2/日、2日目~5日目および28日目~31日目に投与) + マイトマイシン(10mg/m2、2日目に投与)との併用にランダムに割り付けた。[ 15 ]
- Fédération Francophone de Cancérologie Digestive-Société Française de Radiothérapie Oncologie(FFCD-SFRO)試験:放射線療法単独では治療として不十分であることが明らかになったため、研究者らは集学的治療 vs 化学療法単独を評価した。FFCD-SFROの研究者らは、患者119人を化学放射線療法(2Gy分割で60Gyの照射と、5-FUの300mg/m2/日を6週間の1~5日目に持続注入およびシスプラチンの20mg/m2/日を1週目および5週目の1~5日目に持続注入)による導入療法、またはゲムシタビン(1,000mg/m2を7週間で週1回投与)による導入療法にランダムに割り付けた。ゲムシタビンによる維持療法が、病勢進行または毒性を原因とする治療中止によって停止されるまで両群に適用された。[ 20 ][証拠レベル1iiA]
- ECOG:FFCD-SFRO研究の結果は、研究者らが患者74人をゲムシタビン単独群、またはゲムシタビンと放射線療法の併用後にゲムシタビンを継続する群のいずれかにランダムに割り付けたECOGによる研究の結果と対照をなしている。[ 17 ]注目すべきことに、この研究は登録数が少なかったため、早期に閉鎖された。
- GERCOR:化学放射線療法の毒性が高いこと、および局所進行膵がん患者に高い割合で転移の早期発生がみられることを考慮して、研究者らは化学放射線療法にふさわしい限局性病変を有する患者を選別する戦略を検討している。この戦略で選択された患者では、化学療法の数ヵ月後に限局性または全身性の進行性病変はみられない。[ 21 ][証拠レベル:3iiiA]
手術
局所進行膵がん患者は、腫瘍による局所血管の侵害ないし浸潤が認められるため、技術的に切除不能な腫瘍を有する。しかしながら、化学療法と化学放射線療法の併用により、一部の患者は根治的膵切除術の候補となりうる。
症状緩和目的の手術
かなりの割合(約3分の1)の膵がん患者が局所進行性の病変を呈するようになる。患者は、内視鏡的、外科的、または放射線学的手段による、胆道閉塞の症状緩和が有益な場合がある。[ 22 ]
局所進行膵がんに対して臨床評価段階にある治療法の選択肢
臨床評価段階にある治療法の選択肢には以下のものがある:
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Iacobuzio-Donahue CA, Fu B, Yachida S, et al.: DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer. J Clin Oncol 27 (11): 1806-13, 2009.[PUBMED Abstract]
- van den Bosch RP, van der Schelling GP, Klinkenbijl JH, et al.: Guidelines for the application of surgery and endoprostheses in the palliation of obstructive jaundice in advanced cancer of the pancreas. Ann Surg 219 (1): 18-24, 1994.[PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001.[PUBMED Abstract]
- Conroy T, Desseigne F, Ychou M, et al.: FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 364 (19): 1817-25, 2011.[PUBMED Abstract]
- Von Hoff DD, Ervin T, Arena FP, et al.: Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med 369 (18): 1691-703, 2013.[PUBMED Abstract]
- Rothenberg ML, Moore MJ, Cripps MC, et al.: A phase II trial of gemcitabine in patients with 5-FU-refractory pancreas cancer. Ann Oncol 7 (4): 347-53, 1996.[PUBMED Abstract]
- Burris HA, Moore MJ, Andersen J, et al.: Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 15 (6): 2403-13, 1997.[PUBMED Abstract]
- Storniolo AM, Enas NH, Brown CA, et al.: An investigational new drug treatment program for patients with gemcitabine: results for over 3000 patients with pancreatic carcinoma. Cancer 85 (6): 1261-8, 1999.[PUBMED Abstract]
- Moore MJ, Goldstein D, Hamm J, et al.: Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 25 (15): 1960-6, 2007.[PUBMED Abstract]
- Poplin E, Feng Y, Berlin J, et al.: Phase III, randomized study of gemcitabine and oxaliplatin versus gemcitabine (fixed-dose rate infusion) compared with gemcitabine (30-minute infusion) in patients with pancreatic carcinoma E6201: a trial of the Eastern Cooperative Oncology Group. J Clin Oncol 27 (23): 3778-85, 2009.[PUBMED Abstract]
- Colucci G, Labianca R, Di Costanzo F, et al.: Randomized phase III trial of gemcitabine plus cisplatin compared with single-agent gemcitabine as first-line treatment of patients with advanced pancreatic cancer: the GIP-1 study. J Clin Oncol 28 (10): 1645-51, 2010.[PUBMED Abstract]
- Pelzer U, Kubica K, Stieler J, et al.: A randomized trial in patients with gemcitabine refractory pancreatic cancer. Final results of the CONKO 003 study. [Abstract] J Clin Oncol 26 (Suppl 15): A-4508, 2008.[PUBMED Abstract]
- Pelzer U, Schwaner I, Stieler J, et al.: Best supportive care (BSC) versus oxaliplatin, folinic acid and 5-fluorouracil (OFF) plus BSC in patients for second-line advanced pancreatic cancer: a phase III-study from the German CONKO-study group. Eur J Cancer 47 (11): 1676-81, 2011.[PUBMED Abstract]
- A multi-institutional comparative trial of radiation therapy alone and in combination with 5-fluorouracil for locally unresectable pancreatic carcinoma. The Gastrointestinal Tumor Study Group. Ann Surg 189 (2): 205-8, 1979.[PUBMED Abstract]
- Cohen SJ, Dobelbower R, Lipsitz S, et al.: A randomized phase III study of radiotherapy alone or with 5-fluorouracil and mitomycin-C in patients with locally advanced adenocarcinoma of the pancreas: Eastern Cooperative Oncology Group study E8282. Int J Radiat Oncol Biol Phys 62 (5): 1345-50, 2005.[PUBMED Abstract]
- Chauffert B, Mornex F, Bonnetain F, et al.: Phase III trial comparing initial chemoradiotherapy (intermittent cisplatin and infusional 5-FU) followed by gemcitabine vs. gemcitabine alone in patients with locally advanced non metastatic pancreatic cancer: a FFCD-SFRO study. [Abstract] J Clin Oncol 24 (Suppl 18): A-4008, 180s, 2006.[PUBMED Abstract]
- Loehrer PJ, Feng Y, Cardenes H, et al.: Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial. J Clin Oncol 29 (31): 4105-12, 2011.[PUBMED Abstract]
- Hammel P, Huguet F, van Laethem JL, et al.: Effect of Chemoradiotherapy vs Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial. JAMA 315 (17): 1844-53, 2016.[PUBMED Abstract]
- Moertel CG, Frytak S, Hahn RG, et al.: Therapy of locally unresectable pancreatic carcinoma: a randomized comparison of high dose (6000 rads) radiation alone, moderate dose radiation (4000 rads + 5-fluorouracil), and high dose radiation + 5-fluorouracil: The Gastrointestinal Tumor Study Group. Cancer 48 (8): 1705-10, 1981.[PUBMED Abstract]
- Chauffert B, Mornex F, Bonnetain F, et al.: Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5-FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer. Definitive results of the 2000-01 FFCD/SFRO study. Ann Oncol 19 (9): 1592-9, 2008.[PUBMED Abstract]
- Huguet F, André T, Hammel P, et al.: Impact of chemoradiotherapy after disease control with chemotherapy in locally advanced pancreatic adenocarcinoma in GERCOR phase II and III studies. J Clin Oncol 25 (3): 326-31, 2007.[PUBMED Abstract]
- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999.[PUBMED Abstract]
- Tepper JE, Noyes D, Krall JM, et al.: Intraoperative radiation therapy of pancreatic carcinoma: a report of RTOG-8505. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys 21 (5): 1145-9, 1991.[PUBMED Abstract]
- Reni M, Panucci MG, Ferreri AJ, et al.: Effect on local control and survival of electron beam intraoperative irradiation for resectable pancreatic adenocarcinoma. Int J Radiat Oncol Biol Phys 50 (3): 651-8, 2001.[PUBMED Abstract]
- 転移または再発膵がんの治療
-
転移または再発膵がんに対する治療法選択肢
転移または再発膵がんに対する治療法選択肢には以下のものがある:
病期にかかわらず、緩和療法が考慮できる。詳しい情報については、本要約の緩和療法のセクションを参照のこと。
標的療法を併用するまたは併用しない化学療法
症状緩和目的の化学療法レジメンは客観的奏効率が低く、効力が限定的であるため、新たに診断された患者はいずれも臨床試験への登録を検討すべきである。多剤併用化学療法は単剤のゲムシタビンと比較して生存期間を延長することが示されている。[ 1 ][ 2 ][ 3 ]
証拠(単剤の化学療法):
- ゲムシタビン vs フルオロウラシル(5-FU):膵腺がんの進行患者および転移患者を対象に第一選択の治療としてゲムシタビンと5-FUを比較した第III相試験では、ゲムシタビン投与患者に有意な生存率の改善をみたことが報告された(5-FUでは1年生存率が2%であったのに対して、ゲムシタビンでは18%であった;P = 0.003)。[ 1 ][証拠レベル:1iiA]
証拠(多剤化学療法):
- FOLFIRINOX(ロイコボリン・カルシウム、5-FU、塩酸イリノテカン、およびオキサリプラチン) vs ゲムシタビン:1件の多施設第II/III相試験には、転移性膵腺がんでEastern Cooperative Oncology Groupのパフォーマンスステータススコアが0または1の患者342人が含められた。[ 4 ][証拠レベル:1iiA]患者は、FOLFIRINOX(オキサリプラチン[85mg/m2]、イリノテカン[180mg/m2]、ロイコボリン[400mg/m2]、および5-FU[400mg/m2]をボーラスで投与後、2週間ごとに2,400mg/m2を46時間持続注入)またはゲムシタビン(8週間中7週間、週1回、その後は4週間中3週間、週1回1,000mg/m2)を投与される群にランダムに割り付けられた。
- ゲムシタビンとナブパクリタキセル vs ゲムシタビン:1件の多施設国際第III相試験(NCT00844649)には、転移性膵腺がん(カルノフスキーのパフォーマンスステータスが70以上)を有し、転移性疾患に対して以前に化学療法を受けていない患者861人が含められた。[ 5 ][証拠レベル:1iiA]補助療法でゲムシタビンまたは他の何らかの化学療法を受けたことのある患者は除外された。患者はゲムシタビン(1,000 mg/m2)とナブパクリタキセル(体表面積1m2当たり125mg)、週1回を4週間中3週実施、またはゲムシタビン単剤療法(1,000 mg/m2、週1回を8週間中7週実施に続いて、週1回を4週間中3週実施)にランダムに割り付けられた。
- ゲムシタビン単独 vs ゲムシタビンとエルロチニブ:カナダ国立がん研究所(NCIカナダ)が実施した第III相試験(CAN-NCIC-PA3[NCT00026338])では、膵がんが進行または転移した患者を対象にゲムシタビン単独とゲムシタビンとエルロチニブ(100mg/日)の併用とが比較された。[ 6 ][証拠レベル:1iiA]
証拠(第二選択化学療法):
- 5-FUおよびフォリン酸を併用するまたは併用しないナノリポソーム型イリノテカン:NAPOLI-1試験(NCT01494506)では、以前にゲムシタビンベースの治療法で治療された転移性膵がん患者におけるナノリポソーム型イリノテカンの役割が評価された。[ 7 ]ナノリポソーム型イリノテカンは、イリノテカンおよびその活性代謝物の腫瘍内での濃度を増すようにデザインされたイリノテカンの封入剤である。この研究では、計417人の患者が、ナノリポソーム型イリノテカン単剤療法(3週間ごとに120mg/m2;n = 151)、5-FUおよびフォリン酸(n = 149)、またはナノリポソーム型イリノテカン(2週間ごとに80mg/m2 + 5-FU)およびフォリン酸(n = 117)のいずれかにランダムに割り付けられた。[ 7 ][証拠レベル:1iiD]
- 5-FU、ロイコボリン、およびオキサリプラチン(OFFレジメン) vs 最適な支持療法(BSC):ゲムシタビンをベースとしたレジメンで進行した後には、第二選択化学療法が有益な場合がある。Charité Onkologie(CONKO)-003の研究者らは、第二選択化学療法を受ける患者をOFFレジメンまたはBSCのいずれかにランダムに割り付けた。[ 2 ];[ 3 ][証拠レベル:3iA]OFFレジメンはロイコボリン(200mg/m2)投与後、5-FU(1日目、8日目、15日目、および22日目に2,000mg/m2[24時間持続注入])およびオキサリプラチン(8日目および22日目に85mg/m2)で構成された。3週間の休薬後、43日目に次のサイクルが開始された。試験は登録数が少なかったため早期に終了され、わずか46人の患者がOFFレジメンまたはBSCにランダムに割り付けられた。
- ゲムシタビン化学療法後のFOLFOX(ロイコボリン カルシウム[フォリン酸]、5-FU、およびオキサリプラチン) vs 5-FU/ロイコボリン:プロスペクティブ多施設試験であるPANCREOX研究では、第一選択治療のゲムシタビンをベースにした化学療法を以前に受けた進行性膵がん患者108人が、修正FOLFOX-6(mFOLFOX-6)として投与するオキサリプラチンを併用する(n = 54)または併用しない(n = 54)5-FU/ロイコボリンを受けるようにランダムに割り付けられた。[ 8 ][証拠レベル:3iA]目標の登録患者数128人であったが、登録が伸び悩んだためこの研究は早期に中止された。
BRCA1/BRCA2生殖細胞変異を有する患者に関する特別な考慮事項
膵腺がん患者の4~8%が、BRCA1またはBRCA2遺伝子に生殖細胞変異を有する。[ 9 ][ 10 ]BRCA1/BRCA2は相同的修復経路およびDNA二本鎖切断の修復における蛋白をコードし、そのため、さらなるDNA損傷に対して感受性が高い可能性がある。BRCA1/BRCA2に変異が認められる膵腫瘍では、白金製剤をベースにした治療に対して反応が改善することが実証されている。[ 11 ]ポリ(ADPリボース)ポリメラーゼ(PARP)阻害は、一本鎖切断の修復を阻害することでBRCA1/BRCA2変異と相乗的に作用すると仮定されている。BRCA1/BRCA2が変異した進行期卵巣がんおよび乳がん患者に対する治療として、いくつかのPARP阻害剤が承認されており、BRCA1/BRCA2が変異した膵腺がん患者を管理する目的で盛んに研究されている。
オラパリブ
第一選択の白金製剤をベースにした治療に対して4ヵ月以上反応していたBRCA1/BRCA2生殖細胞変異を有する転移性膵腺がん患者には、オラパリブ(PARP阻害剤の1つ)維持療法を検討できる。
証拠(オラパリブ):
- POLO Trial[NCT02184195]:BRCA1またはBRCA2遺伝子に生殖細胞変異を有する転移性膵腺がんで、第一選択の白金製剤をベースにした16週間の化学療法後に疾患が進行しなかった患者154人を対象にした1件の多施設第III相ランダム化二重盲検プラセボ対照試験。[ 12 ][証拠レベル:1iDiii]患者は3:2の比率で、オラパリブ(300mg、1日2回)またはプラセボの投与に割り付けられ、PFSについて評価された。
転移または再発膵がんに対して臨床評価段階にある治療法の選択肢
臨床評価段階にある治療法の選択肢には以下のものがある:
- 新しい抗がん剤単独または化学療法との併用を評価する臨床試験。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Burris HA, Moore MJ, Andersen J, et al.: Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 15 (6): 2403-13, 1997.[PUBMED Abstract]
- Pelzer U, Kubica K, Stieler J, et al.: A randomized trial in patients with gemcitabine refractory pancreatic cancer. Final results of the CONKO 003 study. [Abstract] J Clin Oncol 26 (Suppl 15): A-4508, 2008.[PUBMED Abstract]
- Pelzer U, Schwaner I, Stieler J, et al.: Best supportive care (BSC) versus oxaliplatin, folinic acid and 5-fluorouracil (OFF) plus BSC in patients for second-line advanced pancreatic cancer: a phase III-study from the German CONKO-study group. Eur J Cancer 47 (11): 1676-81, 2011.[PUBMED Abstract]
- Conroy T, Desseigne F, Ychou M, et al.: FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 364 (19): 1817-25, 2011.[PUBMED Abstract]
- Von Hoff DD, Ervin T, Arena FP, et al.: Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med 369 (18): 1691-703, 2013.[PUBMED Abstract]
- Moore MJ, Goldstein D, Hamm J, et al.: Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 25 (15): 1960-6, 2007.[PUBMED Abstract]
- Wang-Gillam A, Li CP, Bodoky G, et al.: Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial. Lancet 387 (10018): 545-57, 2016.[PUBMED Abstract]
- Gill S, Ko YJ, Cripps C, et al.: PANCREOX: A Randomized Phase III Study of Fluorouracil/Leucovorin With or Without Oxaliplatin for Second-Line Advanced Pancreatic Cancer in Patients Who Have Received Gemcitabine-Based Chemotherapy. J Clin Oncol 34 (32): 3914-3920, 2016.[PUBMED Abstract]
- Holter S, Borgida A, Dodd A, et al.: Germline BRCA Mutations in a Large Clinic-Based Cohort of Patients With Pancreatic Adenocarcinoma. J Clin Oncol 33 (28): 3124-9, 2015.[PUBMED Abstract]
- Cancer Genome Atlas Research Network. Electronic address: andrew_aguirre@dfci.harvard.edu, Cancer Genome Atlas Research Network: Integrated Genomic Characterization of Pancreatic Ductal Adenocarcinoma. Cancer Cell 32 (2): 185-203.e13, 2017.[PUBMED Abstract]
- Golan T, Kanji ZS, Epelbaum R, et al.: Overall survival and clinical characteristics of pancreatic cancer in BRCA mutation carriers. Br J Cancer 111 (6): 1132-8, 2014.[PUBMED Abstract]
- Golan T, Hammel P, Reni M, et al.: Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med 381 (4): 317-327, 2019.[PUBMED Abstract]
- 緩和療法
-
膵がん患者に対する緩和療法選択肢には以下のものがある:
- 内視鏡的または放射線学的ステント留置法などの症状緩和目的の外科的バイパス手技。[ 1 ][ 2 ]
- 症状緩和目的の放射線的手技。
- (経皮的)腹腔神経ブロックまたは胸膜腔内神経ブロックによる疼痛緩和。[ 3 ]
- この他の症状緩和目的治療単独。
参考文献- Sohn TA, Lillemoe KD, Cameron JL, et al.: Surgical palliation of unresectable periampullary adenocarcinoma in the 1990s. J Am Coll Surg 188 (6): 658-66; discussion 666-9, 1999.[PUBMED Abstract]
- Baron TH: Expandable metal stents for the treatment of cancerous obstruction of the gastrointestinal tract. N Engl J Med 344 (22): 1681-7, 2001.[PUBMED Abstract]
- Polati E, Finco G, Gottin L, et al.: Prospective randomized double-blind trial of neurolytic coeliac plexus block in patients with pancreatic cancer. Br J Surg 85 (2): 199-201, 1998.[PUBMED Abstract]
- 本要約の変更点(05/15/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、成人膵がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Pancreatic Cancer Treatment (Adult).Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/pancreatic/hp/pancreatic-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389394]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する





