ご利用について
医療専門家向けの本PDQがん情報要約では、成人中咽頭がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 中咽頭がんに関する一般情報
-
発生率および死亡率
米国において、2020年に推定される中咽頭がん(口腔がんとともに含まれる)の新規症例数および死亡数[ 1 ]:
中咽頭がんはヒトパピローマウイルス(HPV)関連中咽頭がんの高まりに起因して発生率が増加しつつある;男性が中咽頭がんに罹患する可能性は女性よりも2倍以上高い。[ 1 ][ 2 ][ 3 ]
解剖学
解剖学的に、中咽頭部は上方の軟口蓋と下方の舌骨の間に位置する;前方は口腔と連続し、上方は上咽頭と、下方は声門上部および下咽頭と交通する。
中咽頭は以下の部分に分けられる[ 4 ]:
頭頸部における所属リンパ節の解剖学
頭頸部の所属リンパ節には頸静脈、副神経、および顔面動脈と平行に走行し、顎下三角に至るリンパ節を含む。こうした局所の解剖学および所属リンパ節の状態の理解は、頭頸部がん患者のケアにきわめて重要である。[ 3 ][ 5 ][ 6 ]頸部の領域はリンパ節の解剖学的構造に関する情報交換を容易にするため、以下のようにレベルI~Vおよび咽頭後リンパ節と記述されている:
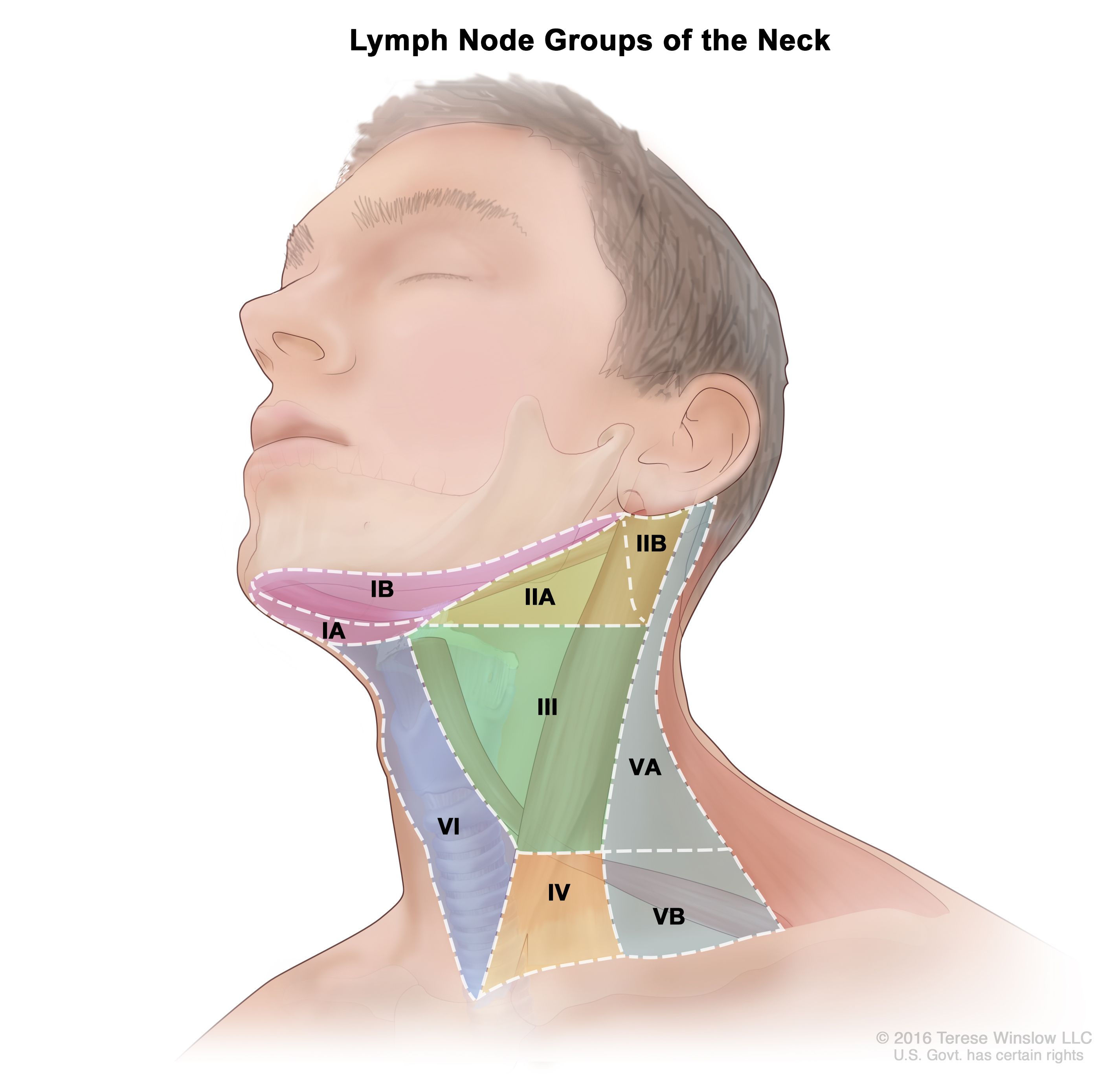
咽頭後リンパ節は中咽頭がんにおいてリンパ節に転移しうる部位である。MD Anderson Cancer Centerからの1件の大規模レトロスペクティブ・コホートにおいて、初回治療として放射線を受けた中咽頭がん患者981人の臨床所見が報告された。[ 7 ][証拠レベル:3iiA][証拠レベル:3iiDii]
危険因子
中咽頭扁平上皮がん(SCC)の危険因子として、以下が含まれる:[ 8 ]
詳しい情報については、口腔がん、咽頭がんおよび喉頭がんの予防に関するPDQ要約を参照のこと。
HPV感染
米国における喫煙率は低下しているため、HPV陰性のタバコ関連中咽頭がんが減少している;しかしながら、HPV陽性の中咽頭がんが増加している。Surveillance, Epidemiology, and End Results(SEER)プログラムからの組織のリポジトリデータによると、1988年から2004年までのHPV陰性がんの有病率は50%減少し、HPV陽性中咽頭がんは225%増加した。[ 14 ][証拠レベル:3iii]
HPV陽性中咽頭がんはHPV感染と因果関係があり、また予後良好な別個の疾病であろう。数件の研究により、HPV陽性腫瘍患者は有意に高い生存率を有することが示されている。[ 12 ][ 15 ][ 16 ][ 17 ]中咽頭がんではHPVへの感染状態が予後に影響するため、米国がん合同委員会(AJCC)の第8版の病期分類では現在、HPV感染状態で中咽頭がんの病期判定を分けている。[ 5 ][ 6 ]新たに診断された、または再発頭頸部SCCの患者253人を含むプロスペクティブ研究では、患者の25%にHPVが検出された。腫瘍悪性度が低いことと中咽頭の部位は、それぞれがHPVの存在の可能性を増加させた。[ 12 ]中咽頭腫瘍は、HPV陽性である可能性(57%)が口腔(12%)の腫瘍部位および中咽頭以外(14%)の部位と比較して高い。HPV陽性中咽頭がんは主として、口蓋扁桃または舌扁桃に発生する。扁桃または舌根部では腫瘍の62%がHPV陽性であったのに対し、中咽頭の他の部位では25%がHPV陽性であった。
頭頸部がんの個人歴
上部気道消化管のがんを有する患者において、二次原発がんが発生するリスクは年間3~7%であると推定されている。[ 18 ][ 19 ]このリスクのために、患者には生涯にわたる監視が必要である。治療後の喫煙および飲酒は気道消化管の二次原発腫瘍発現と関連している。[ 20 ][ 21 ][ 22 ]患者は、喫煙と飲酒をやめるためにカウンセリングが必要となることがある。
中咽頭がんにおいて喫煙歴に関連して発生する多発同時性原発SCCは、一部は広域発がんの過程のためである。広域発がんの概念は、当初は1953年に記述され、発がん物質に長期間曝露された組織の領域内で腫瘍が多病巣性に発生するというものである。[ 23 ]高リスクの個人から採取された組織学的に正常な組織における遺伝子変化を検出する分子研究は、広域発がんの概念を強力に支持している。[ 24 ][ 25 ][ 26 ][ 27 ][ 28 ]
二次原発悪性腫瘍を発症する可能性を明らかにするため、指標となる中咽頭SCC患者と中咽頭部以外(すなわち、口腔、喉頭、および下咽頭)の指標となるSCC患者(N = 2,230)が比較された。二次原発悪性腫瘍の発生率は、指標となる中咽頭SCC患者の方が指標となる中咽頭以外のがん患者よりも低かった(P < 0.001)。中咽頭SCC患者では、非喫煙者と比較して前喫煙者では二次原発悪性腫瘍のリスクが50%高く、現在喫煙者では非喫煙者と比較してリスクが100%高かった(傾向性のP = 0.008)。これらのデータから、典型的なHPV表現型に適合する患者は二次原発悪性腫瘍のリスクが非常に低いことが示唆されている。[ 29 ]
ベテル
ベテル(噛みタバコ:アジアの一部地域で一般に使用される刺激性の製剤)チューイングは中咽頭がんのリスクを増大させる。[ 30 ]
臨床像
中咽頭がんの臨床像は中咽頭における腫瘍の位置によって異なる。中咽頭がんは以下の位置に発生しうる:
扁桃
前口蓋弓および扁桃は、中咽頭原発腫瘍の最も一般的な位置である。[ 4 ]前口蓋弓に浸潤する病変は、形成異常、炎症、または表層に拡がる病変の領域として現れることがある。これらのがんは、外側の軟口蓋、臼後三角および頬粘膜、および扁桃窩を含む広範な領域に拡がることがある。[ 3 ][ 4 ]リンパ液は主にレベルIIのリンパ節へと流れている。
後口蓋弓の腫瘍は、下方に進展して咽頭喉頭蓋ヒダおよび甲状軟骨後面に浸潤することがある。これらの病変はより頻繁にレベルVのリンパ節に転移する。
扁桃窩の病変は、外方増殖性か潰瘍性であり、前口蓋弓の病変に類似した進展パターンを有することがある。これらの腫瘍は、口蓋弓のがんに比べしばしば進行期疾患として現れる。患者の約75%は、III期またはIV期の疾患を呈する。[ 3 ][ 4 ]リンパ液は主にレベルVのリンパ節へと流れている。後口蓋弓の腫瘍は、下方に進展して咽頭喉頭蓋ヒダおよび甲状軟骨後面に浸潤することがある。これらの病変はより頻繁にレベルVのリンパ節に転移する。
舌根部
臨床的に、舌根部のがんは潜伏性である。これらのがんは、浸潤性または外方増殖性に成長することがある。舌根部には痛覚線維がないため、これらの腫瘍はかなり進行するまでしばしば症状がない。[ 4 ]
舌根部の進行がんの徴候および症状には以下のものがある:[ 3 ][ 4 ]
舌根部には豊富なリンパ流があるため、リンパ節転移が一般的である。舌根部の進行がん患者の約70%以上は、同側頸部リンパ節転移を有する;両側頸部リンパ節転移を有するのはこうした患者の30%以下である。[ 4 ][ 35 ]転移した頸部リンパ節には一般にレベルII、III、IV、Vのリンパ節のほか、咽頭後リンパ節が含まれる。
咽頭壁
咽頭壁の病変は上方の上咽頭、後方の頸筋膜椎前葉、および下方の梨状陥凹および下咽頭壁に浸潤して拡がることがある。主なリンパ液は咽頭後リンパ節およびレベルIIおよびIIIのリンパ節へと流れている。ほとんどの咽頭がんは正中線を越えて進展するため、両側頸部への転移が一般的である。
早期腫瘍はしばしば無症状である。咽頭壁の腫瘍は一般的に進行期に診断される。[ 3 ][ 4 ]
咽頭壁の進行期腫瘍の徴候および症状には以下のものがある:
白斑症
白斑症は、擦っても除去できない白い斑点を認めることを意味する臨床記述用語としてのみ使用され、その重要性は組織学的所見によって決まる。[ 8 ]白斑症は、過角化から実際の早期浸潤がんまでの範囲に及び、真菌症、扁平苔癬をはじめとする良性の口腔疾患の場合もある。
診断的評価
原発腫瘍は、可能であれば視診および触診に基づいて評価するほか、間接鏡検査によって評価する。考えられるリンパ流領域は、注意深く触診する。腫瘍の存在は組織学的に確定する必要がある。診断では、生検によって得られたあらゆる病理学的データと追加の放射線検査も考慮される。
原発腫瘍の評価には、以下の手技が実施されることがある:
PET-CTスキャンでは、原発腫瘍、リンパ節病変、および遠隔転移病変の発見を評価するための形態学的データおよび代謝に関するデータが得られる;また放射線療法の計画立案の指針とするためにも使用できる。レトロスペクティブ・データにより、形態学的パラメータおよびPET-解糖系パラメータ(フッ化デオキシグルコースPET-CTで測定される)は、中咽頭がんの原発腫瘍ではHPV陽性疾患よりもHPV陰性疾患で有意に大きい(Response Evaluation Criteria In Solid Tumors [RECIST]の最長径で測定した場合);不均一であるほか;最大標準摂取率(SUV:standardized uptake value)(SUVmax)、平均SUV、および腫瘍の活動性部分の体積が高いことが実証されている。しかしながら、HPV陽性疾患を有する患者の所属リンパ節病変では、同じPETパラメータが比較的大きいことが多い。[ 36 ][証拠レベル:3iiDiv]
予後因子および生存
中咽頭がんに対する予後因子として以下が含まれる:
患者の中咽頭がんが低リスク、中リスク、または高リスクであるかどうかの決定には、表1に記述する基準が用いられる;この基準は化学放射線療法で治療されたIII期およびIV期中咽頭SCC患者を対象にした1件のランダム化試験のレトロスペクティブ解析において再帰分割分析を用いて定義されている。[ 17 ]
表1.中咽頭がんのリスクに関連した特徴a リスクの程度 特徴 3年OS率 CI = 信頼区間;HPV = ヒトパピローマウイルス;OS = 全生存;+ = 陽性;- = 陰性。(詳しい情報については、本要約のAJCC病期分類とTNMの定義のセクションを参照のこと。) aAng KK, Harris J, Wheeler R, et al.: Human papillomavirus and survival of patients with oropharyngeal cancer.N Engl J Med 363 (1): 24-35, 2010. 低リスク HPV+、10パック-年以下の喫煙歴、およびN0-N2aのリンパ節病変 93%(95%CI、88.3-97.7) 中リスク HPV+、10パック-年を超える喫煙歴、およびN2b-N3のリンパ節病変;または 70.8%(95%CI、60.7-80.8) HPV-、10パック-年以下の喫煙歴、およびN2b-N3のリンパ節病変またはT2-T3の腫瘍 高リスク HPV-および10パック-年を超える喫煙歴;または 46.2%(95%CI、34.7-57.7) HPV-、10パック-年以下の喫煙歴、およびT4の腫瘍 治療後の追跡
治療後最初の1年は6~12週間ごとに、治療後2年目は3ヵ月ごとに、治療後3年目は3~4ヵ月ごとに、それ以降は6ヵ月ごとに、頭頸部の綿密な検査を患者に実施することで、医師は再発がないか調べることができる。
関連する要約
中咽頭がんに関する情報を含む他のPDQ要約には以下のものがある:
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Parkin DM, Bray F, Ferlay J, et al.: Estimating the world cancer burden: Globocan 2000. Int J Cancer 94 (2): 153-6, 2001.[PUBMED Abstract]
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 729-80.[PUBMED Abstract]
- Choi WH, Hu KS, Culliney B, et al.: Cancer of the oropharynx. In: Harrison LB, Sessions RB, Hong WK, eds.: Head and Neck Cancer: A Multidisciplinary Approach. 3rd ed. Philadelphia, PA: Lippincott, William & Wilkins, 2009, pp 285-335.[PUBMED Abstract]
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 113-21.[PUBMED Abstract]
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123-35.[PUBMED Abstract]
- Gunn GB, Debnam JM, Fuller CD, et al.: The impact of radiographic retropharyngeal adenopathy in oropharyngeal cancer. Cancer 119 (17): 3162-9, 2013.[PUBMED Abstract]
- Neville BW, Day TA: Oral cancer and precancerous lesions. CA Cancer J Clin 52 (4): 195-215, 2002 Jul-Aug.[PUBMED Abstract]
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 729-80.[PUBMED Abstract]
- Licitra L, Bernier J, Grandi C, et al.: Cancer of the oropharynx. Crit Rev Oncol Hematol 41 (1): 107-22, 2002.[PUBMED Abstract]
- Mork J, Lie AK, Glattre E, et al.: Human papillomavirus infection as a risk factor for squamous-cell carcinoma of the head and neck. N Engl J Med 344 (15): 1125-31, 2001.[PUBMED Abstract]
- Gillison ML, Koch WM, Capone RB, et al.: Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 92 (9): 709-20, 2000.[PUBMED Abstract]
- D'Souza G, Kreimer AR, Viscidi R, et al.: Case-control study of human papillomavirus and oropharyngeal cancer. N Engl J Med 356 (19): 1944-56, 2007.[PUBMED Abstract]
- Chaturvedi AK, Engels EA, Pfeiffer RM, et al.: Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 29 (32): 4294-301, 2011.[PUBMED Abstract]
- Ringström E, Peters E, Hasegawa M, et al.: Human papillomavirus type 16 and squamous cell carcinoma of the head and neck. Clin Cancer Res 8 (10): 3187-92, 2002.[PUBMED Abstract]
- Schwartz SR, Yueh B, McDougall JK, et al.: Human papillomavirus infection and survival in oral squamous cell cancer: a population-based study. Otolaryngol Head Neck Surg 125 (1): 1-9, 2001.[PUBMED Abstract]
- Ang KK, Harris J, Wheeler R, et al.: Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 363 (1): 24-35, 2010.[PUBMED Abstract]
- Khuri FR, Lippman SM, Spitz MR, et al.: Molecular epidemiology and retinoid chemoprevention of head and neck cancer. J Natl Cancer Inst 89 (3): 199-211, 1997.[PUBMED Abstract]
- León X, Quer M, Diez S, et al.: Second neoplasm in patients with head and neck cancer. Head Neck 21 (3): 204-10, 1999.[PUBMED Abstract]
- Do KA, Johnson MM, Doherty DA, et al.: Second primary tumors in patients with upper aerodigestive tract cancers: joint effects of smoking and alcohol (United States). Cancer Causes Control 14 (2): 131-8, 2003.[PUBMED Abstract]
- Khuri FR, Kim ES, Lee JJ, et al.: The impact of smoking status, disease stage, and index tumor site on second primary tumor incidence and tumor recurrence in the head and neck retinoid chemoprevention trial. Cancer Epidemiol Biomarkers Prev 10 (8): 823-9, 2001.[PUBMED Abstract]
- Day GL, Blot WJ, Shore RE, et al.: Second cancers following oral and pharyngeal cancers: role of tobacco and alcohol. J Natl Cancer Inst 86 (2): 131-7, 1994.[PUBMED Abstract]
- Slaughter DP, Southwick HW, Smejkal W: Field cancerization in oral stratified squamous epithelium: clinical implications of multicentric origin. Cancer 6 (5): 963-8, 1953.[PUBMED Abstract]
- Braakhuis BJ, Tabor MP, Leemans CR, et al.: Second primary tumors and field cancerization in oral and oropharyngeal cancer: molecular techniques provide new insights and definitions. Head Neck 24 (2): 198-206, 2002.[PUBMED Abstract]
- Braakhuis BJ, Tabor MP, Kummer JA, et al.: A genetic explanation of Slaughter's concept of field cancerization: evidence and clinical implications. Cancer Res 63 (8): 1727-30, 2003.[PUBMED Abstract]
- Tabor MP, Brakenhoff RH, van Houten VM, et al.: Persistence of genetically altered fields in head and neck cancer patients: biological and clinical implications. Clin Cancer Res 7 (6): 1523-32, 2001.[PUBMED Abstract]
- Tabor MP, Brakenhoff RH, Ruijter-Schippers HJ, et al.: Multiple head and neck tumors frequently originate from a single preneoplastic lesion. Am J Pathol 161 (3): 1051-60, 2002.[PUBMED Abstract]
- Ha PK, Califano JA: The molecular biology of mucosal field cancerization of the head and neck. Crit Rev Oral Biol Med 14 (5): 363-9, 2003.[PUBMED Abstract]
- Gan SJ, Dahlstrom KR, Peck BW, et al.: Incidence and pattern of second primary malignancies in patients with index oropharyngeal cancers versus index nonoropharyngeal head and neck cancers. Cancer 119 (14): 2593-601, 2013.[PUBMED Abstract]
- Ho PS, Ko YC, Yang YH, et al.: The incidence of oropharyngeal cancer in Taiwan: an endemic betel quid chewing area. J Oral Pathol Med 31 (4): 213-9, 2002.[PUBMED Abstract]
- Yokoyama A, Watanabe H, Fukuda H, et al.: Multiple cancers associated with esophageal and oropharyngolaryngeal squamous cell carcinoma and the aldehyde dehydrogenase-2 genotype in male Japanese drinkers. Cancer Epidemiol Biomarkers Prev 11 (9): 895-900, 2002.[PUBMED Abstract]
- Tremmel SC, Götte K, Popp S, et al.: Intratumoral genomic heterogeneity in advanced head and neck cancer detected by comparative genomic hybridization. Cancer Genet Cytogenet 144 (2): 165-74, 2003.[PUBMED Abstract]
- Brieger J, Jacob R, Riazimand HS, et al.: Chromosomal aberrations in premalignant and malignant squamous epithelium. Cancer Genet Cytogenet 144 (2): 148-55, 2003.[PUBMED Abstract]
- Forastiere A, Koch W, Trotti A, et al.: Head and neck cancer. N Engl J Med 345 (26): 1890-900, 2001.[PUBMED Abstract]
- Lindberg R: Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and digestive tracts. Cancer 29 (6): 1446-9, 1972.[PUBMED Abstract]
- Tahari AK, Alluri KC, Quon H, et al.: FDG PET/CT imaging of oropharyngeal squamous cell carcinoma: characteristics of human papillomavirus-positive and -negative tumors. Clin Nucl Med 39 (3): 225-31, 2014.[PUBMED Abstract]
- 中咽頭がんの細胞分類
-
ほとんどの中咽頭がんは扁平上皮がん(SCC)である。[ 1 ][ 2 ][ 3 ]SCCは非浸潤性の場合もあれば、浸潤性の場合もある。非浸潤性のSCCには、上皮内がんという用語が使用される。組織学的に浸潤がんは、高分化、中分化、低分化、または未分化のいずれかに分類される。SCCは通常、中分化または低分化である。[ 4 ]SCCの深部浸潤縁(すなわち、浸潤先端)での悪性度分類は、腫瘍全体の悪性度分類よりも優れた予後に関する情報を提供しうる。[ 5 ]舌扁桃および口蓋扁桃から発生するヒトパピローマウイルス(HPV)陽性中咽頭がんは、HPV、特にHPV16感染に関連した分子病理学的に異なる疾患実体である。HPV陰性腫瘍と比較して、HPV陽性腫瘍は低分化および非角化型である頻度が高く、類基底細胞型の形態と強く関連し、TP53変異を有する可能性は低い。[ 6 ]
増殖抗原の生物マーカーKi-67の発現に対する組織の免疫組織化学的評価は、組織学的悪性度分類を補完するであろう。中咽頭における上皮形成異常の分子指標として、Ki-67の発現は腫瘍細胞におけるヘテロ接合性の消失(LOH)とよく相関しているようである。25人の患者からの43の組織標本を含むレトロスペクティブ研究において、Ki-67を用いた増殖の評価は、組織学的悪性度分類よりも優れたLOHの代替であることが明らかにされた。[ 7 ]
中咽頭がんの他のタイプとして以下が含まれる:
詳しい情報については、唾液腺がんの治療(成人)、成人ホジキンリンパ腫の治療、および成人非ホジキンリンパ腫の治療に関するPDQ要約を参照のこと。
参考文献- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 729-80.[PUBMED Abstract]
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 113-21.[PUBMED Abstract]
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123-35.[PUBMED Abstract]
- Oral cavity and oropharynx. In: Rosai J, ed.: Rosai and Ackerman's Surgical Pathology. Vol. 1. 10th ed. New York, NY: Mosby Elsevier, 2011, pp. 237-264.[PUBMED Abstract]
- Bryne M, Boysen M, Alfsen CG, et al.: The invasive front of carcinomas. The most important area for tumour prognosis? Anticancer Res 18 (6B): 4757-64, 1998 Nov-Dec.[PUBMED Abstract]
- Gillison ML, Koch WM, Capone RB, et al.: Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst 92 (9): 709-20, 2000.[PUBMED Abstract]
- Tabor MP, Braakhuis BJ, van der Wal JE, et al.: Comparative molecular and histological grading of epithelial dysplasia of the oral cavity and the oropharynx. J Pathol 199 (3): 354-60, 2003.[PUBMED Abstract]
- 中咽頭がんの病期情報
-
中咽頭がんに対する病期分類システムは、病理学的というよりもむしろ臨床的である。病期分類システムは、治療前に疾患の進展度を最も良好に評価したものに基づいている。
中咽頭がんの解剖学的な臨床病期分類には、以下の臨床評価と画像技術が含まれる:
PETが、再発中咽頭がんに対する画像法として研究されている。[ 3 ]
米国がん合同委員会(AJCC)病期分類とTNMの定義
AJCCは、中咽頭がんを定義するためにTNM(腫瘍、リンパ節、転移)分類による病期判定を指定している。[ 2 ][ 4 ]リンパ組織、軟組織、骨、および軟骨由来などの非上皮性腫瘍は、ここには収載していない。
AJCCでは、ヒトパピローマウイルス(HPV)関連中咽頭扁平上皮がん[ 4 ]およびp16陰性中咽頭扁平上皮がん[ 2 ]に対して別個の病期分類システムを使用している。
HPV媒介(p16陽性)中咽頭がんに対するAJCC予後的病期グループ
表2.TNM分類におけるI期の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:HPV-Mediated (p16+) Oropharyngeal Cancer.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 113-21. I T0、T1、またはT2;N0またはN1;M0 T0、T1、またはT2 = 下記の表5におけるIV期を参照のこと。 N0またはN1 = 下記の表5におけるIV期を参照のこと。 M0 = 遠隔転移を認めない。 表3.TNM分類におけるII期の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:HPV-Mediated (p16+) Oropharyngeal Cancer.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 113-21. II T0、T1、またはT2;N2;M0 T0、T1、またはT2 = 下記の表5におけるIV期を参照のこと。 N2 = 対側あるいは両側リンパ節転移で6cm以下。 M0 = 遠隔転移を認めない。 T3;N0、N1、またはN2;M0 T3 = 最大径が4cmを超えるか、または喉頭蓋の舌面への進展を認める腫瘍。 N0、N1、またはN2 = 下記の表5におけるIV期を参照のこと。 M0 = 遠隔転移を認めない。 表4.TNM分類におけるIII期の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:HPV-Mediated (p16+) Oropharyngeal Cancer.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 113-21. b舌根部および喉頭蓋谷の原発腫瘍から喉頭蓋の舌面への粘膜進展は喉頭浸潤を意味しない。 III T0、T1、T2、T3、またはT4;N3;M0 T0、T1、T2、T3、またはT4 = 下記の表5におけるIV期を参照のこと。 N3 = 6cmを超えるリンパ節。 M0 = 遠隔転移を認めない。 T4;N0、N1、N2、またはN3;M0 T4 = 中等度に進行した局所病変。喉頭、外舌筋、内側翼突筋、硬口蓋、または下顎骨に浸潤あるいは下顎骨を越えて浸潤する腫瘍。b N0、N1、N2、またはN3 = 下記の表5におけるIV期を参照のこと。 M0 = 遠隔転移を認めない。 表5.TNM分類におけるIV期の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:HPV-Mediated (p16+) Oropharyngeal Cancer.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 113-21. b舌根部および喉頭蓋谷の原発腫瘍から喉頭蓋の舌面への粘膜進展は喉頭浸潤を意味しない。 IV すべてのT、すべてのN、M1 T0 = 原発腫瘍を認めない。 T1 = 最大径が2cm以下の腫瘍。 T2 = 最大径が2cmを超えるが4cm以下の腫瘍。 T3 = 最大径が4cmを超えるか、または喉頭蓋の舌面への進展を認める腫瘍。 T4 = 中等度に進行した局所病変。喉頭、外舌筋、内側翼突筋、硬口蓋、または下顎骨に浸潤あるいは下顎骨を越えて浸潤する腫瘍。b NX = 所属リンパ節の評価が不可能。 N0 = 所属リンパ節に転移を認めない。 N1 = 同側の1つ以上のリンパ節転移で6cm以下。 N2 = 対側あるいは両側リンパ節転移で6cm以下。 N3 = 6cmを超えるリンパ節。 M1 = 遠隔転移を認める。 p16陰性中咽頭扁平上皮がんに対するAJCC予後的病期グループ
表6.TNM分類における0期の定義a 病期 TN 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:Oropharynx (p16−) and Hypopharynx.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 123-35. 上付き文字bの説明は表10の終わりに示す。 0 Tis、N0、M0 Tis = 上皮内(in situ)がん。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表7.TNM分類におけるI期の定義a 病期 TN 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:Oropharynx (p16−) and Hypopharynx.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 123-35. 上付き文字bの説明は表10の終わりに示す。 I T1、N0、M0 T1 = 最大径が2cm以下の腫瘍。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表8.TNM分類におけるII期の定義a 病期 TN 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移。 aAJCCから許諾を得て転載:Oropharynx (p16−) and Hypopharynx.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 123-35. 上付き文字bの説明は表10の終わりに示す。 II T2、N0、M0 T2 = 最大径が2cmを超えるが4cm以下の腫瘍。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 表9.TNM分類におけるIII期の定義a 病期 TN 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;ENE = 節外への進展。 aAJCCから許諾を得て転載:Oropharynx (p16−) and Hypopharynx.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 123-35. 上付き文字bの説明は表10の終わりに示す。 III T3、N0、M0 T3 = 最大径が4cmを超えるか、または喉頭蓋の舌面への進展を認める腫瘍。 N0 = 所属リンパ節に転移を認めない。 M0 = 遠隔転移を認めない。 T1、T2、T3;N1;M0 T1、T2、T3 = 下記の表10におけるIVC期を参照のこと。 N1 = 同側の単発性リンパ節転移で最大径が3cm以下およびENE(-)。 M0 = 遠隔転移を認めない。 表10.TNM分類におけるIVA期、IVB期、およびIVC期の定義a 病期 TNM 記述 T = 原発腫瘍;N = 所属リンパ節;M = 遠隔転移;ENE = 節外への進展。 aAJCCから許諾を得て転載:Oropharynx (p16−) and Hypopharynx.In: Edge SB, Byrd DR, Compton CC, et al., eds.: AJCC Cancer Staging Manual.8th ed. New York, NY: Springer, 2017, pp 123-35. bUまたはLの指定は、すべてのN分類に使用されることがあり、輪状軟骨下縁上方の転移(U)または輪状軟骨下縁下方の転移(L)を指す。同様に、臨床的および病理学的ENEはENE(-)またはENE(+)と記録すべきである。 c舌根部および喉頭蓋谷の原発腫瘍から喉頭蓋の舌面への粘膜進展は喉頭浸潤を意味しない。 IVA T4a;N0、N1;M0 T4a = 中等度に進行した局所病変。喉頭、外舌筋、内側翼突筋、硬口蓋、または下顎骨に浸潤する腫瘍。c N0、1 = 本表における下記のIVC期を参照のこと。 M0 = 遠隔転移を認めない。 T1、T2、T3、T4a;N2;M0 T1、T2、T3、T4a = 本表における下記のIVC期を参照のこと。 N2 = 同側の単発性リンパ節転移で最大径が3cmを超えるが6cm以下およびENE(-);または同側の多発リンパ節転移で最大径が6cm以下およびENE(-);または両側あるいは対側のリンパ節転移で最大径が6cm以下およびENE(-)。 M0 = 遠隔転移を認めない。 IVB すべてのT、N3、M0 すべてのT = 本表における下記のIVC期を参照のこと。 N3 = 最大径が6cmを超えるリンパ節転移およびENE(-);または数を問わないリンパ節転移で、臨床的に明らかなENE(+)。 M0 = 遠隔転移を認めない。 T4b、すべてのN、M0 T4b = かなり進行した局所病変。外側翼突筋、翼状突起骨板、外側上咽頭、または頭蓋底に浸潤する腫瘍または頸動脈を包み込む腫瘍。 すべてのN = 本表における下記のIVC期を参照のこと。 M0 = 遠隔転移を認めない。 IVC すべてのT、すべてのN、M1 TX = 原発腫瘍の評価が不可能。 Tis = 上皮内(in situ)がん。 T1 = 最大径が2cm以下の腫瘍。 T2 = 最大径が2cmを超えるが4cm以下の腫瘍。 T3 = 最大径が4cmを超えるか、または喉頭蓋の舌面への進展を認める腫瘍。 T4 = 中等度に進行したまたはかなり進行した局所病変。 -T4a = 中等度に進行した局所病変。喉頭、外舌筋、内側翼突筋、硬口蓋、または下顎骨に浸潤する腫瘍。c -T4b = かなり進行した局所病変。外側翼突筋、翼状突起骨板、外側上咽頭、または頭蓋底に浸潤する腫瘍または頸動脈を包み込む腫瘍。 NX = 所属リンパ節の評価が不可能。 N0 = 所属リンパ節に転移を認めない。 N1 = 同側の単発性リンパ節転移で最大径が3cm以下およびENE(-)。 N2 = 同側の単発性リンパ節転移で最大径が3cmを超えるが6cm以下およびENE(-);または同側の多発リンパ節転移で最大径が6cm以下およびENE(-);または両側あるいは対側のリンパ節転移で最大径が6cm以下およびENE(-)。 -N2a = 同側の単発性リンパ節転移で最大径が3cmを超えるが6cm以下およびENE(-)。 -N2b = 同側の多発リンパ節転移で最大径が6cm以下およびENE(-)。 -N2c = 両側あるいは対側リンパ節転移で最大径が6cm以下およびENE(-)。 N3 = 最大径が6cmを超えるリンパ節転移およびENE(-);または数を問わないリンパ節転移で、臨床的に明らかなENE(+)。 -N3a = 最大径が6cmを超えるリンパ節転移およびENE(-)。 -N3b = 数を問わないリンパ節転移で、臨床的に明らかなENE(+)。 M1 = 遠隔転移を認める。 参考文献- Weber AL, Romo L, Hashmi S: Malignant tumors of the oral cavity and oropharynx: clinical, pathologic, and radiologic evaluation. Neuroimaging Clin N Am 13 (3): 443-64, 2003.[PUBMED Abstract]
- Oropharynx (p16-) and Hypopharynx. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 123-35.[PUBMED Abstract]
- Wong RJ, Lin DT, Schöder H, et al.: Diagnostic and prognostic value of [(18)F]fluorodeoxyglucose positron emission tomography for recurrent head and neck squamous cell carcinoma. J Clin Oncol 20 (20): 4199-208, 2002.[PUBMED Abstract]
- HPV-Mediated (p16+) Oropharyngeal Cancer. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 113-21.[PUBMED Abstract]
- 中咽頭がんに対する治療法選択肢の概要
-
中咽頭がんを治療するための至適アプローチを容易に明らかにすることはできないが、それは生存率が明らかに優れた単一の治療レジメンが存在しないためである。文献では、さまざまな治療法選択肢が報告されているが、これらの選択肢について説得力のある比較研究を示している報告はない。治療法の検討では、発声および嚥下の転帰を含めた機能状態とパフォーマンスステータスを明らかにすべきである。
表11.中咽頭がんに対する治療法選択肢 病期( 治療法の選択肢 I期およびII期の中咽頭がん 標準分割照射法を用いる放射線療法 手術 III期およびIV期の中咽頭がん 局所進行疾患を有する患者に対する手術とその後の同時化学療法を併用する、または併用しない術後放射線療法(PORT) 分割方法を変更した放射線療法 同時化学放射線療法 術前補助化学療法とその後の同時化学放射線療法 転移性および再発中咽頭がん 腫瘍が放射線療法に反応せず、技術的に施行可能である場合は、外科的切除 手術で腫瘍を完全切除できず、以前に治癒線量を照射していなければ、放射線療法 腫瘍が最初に完全切除できておらず、技術的に施行可能である場合は、再度の手術 切除不能な局所領域で再発した疾患に対する化学療法 従来の分割照射法、または多分割照射法と同時化学療法の併用を用いる追加の放射線療法 セツキシマブ同時投与を併用する体幹部定位放射線治療 免疫療法 手術および/または放射線療法
中咽頭がんの治療には、手術と放射線療法が標準となっている;しかしながら、ランダム化試験からの治療成績のデータは限られている。複数の研究で手術または放射線を用いるべきかどうかという問題を扱う試みがなされているが、こうした研究の検出力は低い。[ 1 ]
証拠(手術および/または放射線療法):
- 1件のプロスペクティブ・ランダム化試験において、N2またはN3病変を有する頭頸部がん患者564人が予定されていた頸部リンパ節郭清術またはポジトロン放射断層撮影-コンピュータ断層撮影(PET-CT)スキャンによるサーベイランスのいずれかにランダムに割り付けられた。[ 2 ]
- 1970年から2000年までに報告された51件のシリーズで、舌根部中咽頭がん患者6,400人を対象にしたプール解析で、以下が示された:[
3
]
歴史的には、舌根部に原発腫瘍が発生した患者の治療後のパフォーマンスステータスおよび機能状態は、放射線療法後の方が手術後よりも良好であったようである。局所制御率および生存率はどちらの治療法の選択肢でもほぼ同じである。[ 4 ][ 5 ]
- 同じ研究で、扁桃部に扁平上皮がん(SCC)を有し、放射線療法を併用するまたは併用しない手術 vs 頸部リンパ節郭清術を併用するまたは併用しない放射線療法を受けた患者の結果は以下の通りであった:[ 3 ]
早期疾患の患者では、単一手段による治療が好まれる。歴史的には、放射線単独が好まれているが、経口的手術および経口的ロボット手術など、新たに出現した外科技術の使用が増加している。経口的手術 vs 初回放射線療法の非ランダム化比較により、侵襲性を最低限に抑えた外科技術での優れた生活の質(QOL)が示唆されている。[ 6 ]歴史的には、侵襲性の比較的高い外科技術はQOLが劣り、罹病率が高かった。
ヒトパピローマウイルス陽性中咽頭がんにおいて経口的手術アプローチと術後放射線療法における線量の段階的縮小の併用を評価する1件の多施設プロスペクティブ試験、ECOG-3311(NCT01898494)が現在進行中である。
局所進行疾患を有する患者に対する手術とその後の同時化学療法を併用する、または併用しない術後放射線療法(PORT)
切除および再建の新しい手術法が到達手段とともに機能温存をもたらしたことで、III期およびIV期中咽頭がんを有する患者に対する手術選択肢の範囲が拡がった。さまざまな外科的アプローチがあり、頸部リンパ節郭清術変法の役割に関する意見には開きがあり、同じ結果に至る多数の再建法があるため、特定の手術法およびその変法は、ここでは記述していない。このグループの患者は、利用可能な多数の方法に熟達し、積極的かつ頻繁にこうした患者のケアに関わる頭頸部外科医が管理する。
初回手術後の病理所見に応じて、以下に示す組織学的所見に対する補助療法の設定で化学療法を併用するまたは併用しないPORTが用いられる:
EORTC-22931(NCT00002555)およびRTOG-9501(NCT00002670)研究のプール解析に基づいて、高リスクの病理学的危険因子、リンパ節の被膜外進展(ECE)、または切除断端陽性が認められる中咽頭扁平上皮がん患者におけるPORTへの化学療法の追加は、放射線療法単独と比較して局所領域制御および全生存(OS)の利益をもたらすことを示している。[ 7 ][ 8 ][ 9 ][ 10 ][証拠レベル:1iiA]
中等度の病理学的危険因子を有する患者に対してPORTと同時に実施するシスプラチン化学療法の追加については不明である。中等度の病理学的危険因子として以下が含まれる:
1件のランダム化試験(RTOG-0920[NCT00956007])で、これらの中等度の病理学的危険因子について術後の設定で放射線療法へのセツキシマブの追加が検証されている。
放射線療法
頭頸部がんに対する放射線療法の公表された臨床結果のレビューにより、放射線療法が長期にわたれば重大な局所制御不能に陥ることが示唆されている;したがって、標準治療計画を長引かせるのは好ましくない。[ 11 ][ 12 ]
放射線療法期間に喫煙する患者は、喫煙しない患者より奏効率が低く、生存期間が短くなるようである。[ 13 ]放射線療法を開始する前に禁煙するように患者に忠告することは有益である。
強度変調放射線療法(IMRT)は過去10年間で発展し、頭頸部放射線療法の標準技術となっている。IMRTは、1分割当たりわずかに2Gyを超える線量で標的体積内同時ブースト法(SIB)としても知られる線量ペインティング技術の使用を可能にし、これにより、全治療期間のわずかな短縮と腫瘍に対する生物学的等価線量の増加が可能となる。
証拠(根治的放射線療法):
- T1-2期、N0-1、M0の中咽頭がんで、化学療法を併用しない初回放射線療法で治療された患者69人を対象にした第II相試験(RTOG-0022[NCT00006360])でIMRTが検討された。[
14
]追跡期間中央値は2.8年であった。原発腫瘍および転移リンパ節に対して規定された計画標的体積(PTV)線量は、6週間で1分割当たり2.2Gyの66Gyであった。無症状のPTVに対して、SIB技術を用いて1分割当たり1.8~2.0Gyで54~60Gyが同時に照射された。以下の結果が観察された:
RTOG-0022研究により、複数施設での高い制御率およびIMRTの実施可能性が示された;この研究ではまた、以前のRadiation Therapy Oncology Group(RTOG)研究と比較して腫瘍制御率が高くなっていることおよび唾液関連毒性が減少していることが示された。しかしながら、標的線量が過少に大きく逸脱した場合は、所属領域制御失敗率が高くなった。
- 同様の非ランダム化多施設研究で、IMRTにより分割線量を2.3~2.5Gyの範囲で増加させる放射線療法が用いられた。これらの線量は咽喉頭のT2N0、T2N1、または喉頭のT3N0扁平上皮がんに対して同時化学療法と併用せずに実施する場合に安全である。[ 15 ][ 16 ][ 17 ][ 18 ][ 19 ]
- 英国で実施された1件のランダム化試験(PARSPORT[NCT00081029])では、従来の三次元原体照射療法とIMRTが比較された。以下の結果が観察された:[ 20 ][証拠レベル:1iiA]
分割方法の変更 vs 標準分割照射法
化学療法の候補とならない局所進行中咽頭がん患者には、分割方法を変更した放射線療法単独が用いられる場合がある。III期またはIV期の中咽頭がん患者には、分割方法を変更した放射線療法により、標準分割照射法と比較して高い局所領域制御率を得ることができる。
証拠(分割方法の変更 vs 標準分割照射法):
放射線療法による追加の晩期合併症(晩期障害)は、全甲状腺に外照射療法を受けたことのある患者の30~40%に発生する甲状腺機能低下症である。治療開始前、および治療後追跡の一環として、患者の甲状腺機能検査が検討される。[ 24 ][ 25 ]
2件のランダム化比較試験のプロスペクティブなデータにより、甲状腺機能低下症の発生率が報告された。[ 26 ]
口蓋または舌根部への進展が限定的で、被膜外浸潤を伴わず同側のリンパ節転移が限定的な扁桃のT1またはT2原発腫瘍など、明らかに一側性の中咽頭がん患者について、同側リンパ節への選択的治療により、対側頸部への転移のリスクがごくわずかになる。[ 27 ]正中線上または正中線近くのT3およびT4腫瘍に対しては、両側リンパ節の治療が検討される。咽頭後リンパ節もまた、頸部リンパ節鎖に加えて選択的リンパ節治療に包含される場合がある。
同時化学放射線療法
同時化学放射線療法は局所進行(III期およびIV期)中咽頭がん患者に対する標準治療法の選択肢であり、放射線療法単独よりも優れている。[ 28 ]この治療アプローチでは器官の温存および機能性が強調されている。[ 29 ][ 30 ]
証拠(同時化学放射線療法):
- 1965年から2000年にかけて発表された93件の頭頸部がんに関するランダム化プロスペクティブ試験のメタアナリシスにより、以下が示された:[ 31 ][証拠レベル:2A]
- 局所進行頭頸部がん患者を対象にした1件のランダム化試験において、治癒目的の放射線療法単独(213人の患者)が放射線療法 + 週1回のセツキシマブ(211人の患者)と比較された。[ 32 ]セツキシマブの初回用量は放射線療法開始1週間前に体表面積1m2当たり400mgで、その後、放射線療法期間中は体表面積1m2当たり週1回250mgであった。この研究では、両群で分割方法変更レジメンが使用できた。[ 32 ][ 33 ][証拠レベル:1iiA]
ヒトパピローマウイルス(HPV)陽性中咽頭がん患者におけるセツキシマブ vs シスプラチン
線量を抑えた放射線療法を用いる治療の脱強化を評価する研究(NRG-HN002[NCT02254278]およびECOG-3311[NCT01898494])が、低リスクHPV陽性中咽頭がん患者において進行中である。2件のランダム化試験で、シスプラチンをベースにした治療の毒性を低下させるために提案されている脱強化戦略として、上皮成長因子受容体阻害薬のセツキシマブが評価されている。
証拠(HPV陽性中咽頭がん患者におけるセツキシマブ vs シスプラチン):
- RTOG-1016(NCT01302834)ランダム化試験において、HPV陽性(p16免疫組織化学の中央診断による確認で決定された)中咽頭がん患者が、1:1の比率でセツキシマブと併用する放射線療法またはシスプラチンと併用する放射線療法のいずれかを受けるようにランダムに割り付けられた。この試験の目的は、放射線療法とシスプラチンを用いた治療と比較して、放射線療法とセツキシマブによる治療で生存の非劣性が得られるかどうかを明らかにすることであった。登録された987人の患者のうち、849人が放射線療法 + セツキシマブ(n = 425)または放射線療法 + シスプラチン(n = 424)を受けるようにランダムに割り付けられた。その後、セツキシマブを受けるように割り付けられた患者では399人およびシスプラチンを受けるように割り付けられた患者では406人が適格であると判断された。患者は、3週間ごとに2サイクルのシスプラチン(100mg/m2)または週1回のセツキシマブのいずれかと併用する6週間で70Gyの加速分割放射線療法(6分割/週)を受けた。[ 34 ][証拠レベル:1iiA]
-
De-ESCALaTE HPV[NCT01874171]は、アイルランド、オランダ、および英国においてHPV陽性低リスク中咽頭がんの18歳以上の患者(非喫煙者または喫煙歴が10パック-年未満の生涯喫煙者)を対象に、32の頭頸部治療施設で実施されたオープンラベルの第III相ランダム化比較試験であった。[
36
]患者は放射線療法(35分割で70Gy)に加えて、1:1の比率でシスプラチンの静脈内投与(100mg/m2、放射線療法の1日目、22日目、および43日目)またはセツキシマブの静脈内投与(400mg/m2負荷用量後、250mg/m2、週1回注入を7回)のいずれかを受けるようにランダムに割り付けられた。
主要アウトカムは治療終了から24ヵ月経過時の重度(グレード3~5)の全毒性イベントであった。主要アウトカムはintention-to-treat解析およびプロトコルに基づく解析で評価された。2012年11月12日から2016年10月1日までの間に、334人の患者が登録された(シスプラチン群が166人およびセツキシマブ群が168人)。
これらの知見から、局所領域進行HPV関連中咽頭がん患者のOS率および局所再発率についてシスプラチンと比較したセツキシマブの劣性が示され、またシスプラチンと比較したセツキシマブと放射線療法による治療の毒性低下は実証されなかった。放射線療法とセツキシマブの併用による治療は、放射線療法とシスプラチンを用いた治療と比較して、OSとPFSが劣っていた;したがって、放射線療法とシスプラチンによる治療が依然として標準治療である。
口腔毒性に関する詳しい情報については、化学療法と頭頸部放射線療法の口腔合併症に関するPDQ要約を参照のこと。
術前補助化学療法とその後の同時化学放射線療法
5件のランダム化試験のメタアナリシスにおいて、計1,022人の局所進行頭頸部扁平上皮がん患者がTPF(ドセタキセル、シスプラチン、およびフルオロウラシル)による術前補助化学療法とその後の同時化学放射線療法または同時化学放射線療法単独のいずれかを受けるようにランダムに割り付けられた。この解析では、TPFレジメンを用いた術前補助化学療法について同時化学放射線療法単独を上回るOS(HR、1.01;95%信頼限界[CL]、0.84、1.21;P = 0.92)またはPFS(HR、0.91;95%CL、0.75、1.1;P = 0.32)の優位性を示すことができなかった。[ 37 ][証拠レベル:1iA]
証拠(術前補助化学療法とその後の同時化学放射線療法):
- HPV関連中咽頭SCC患者を対象にシスプラチン、パクリタキセル、およびセツキシマブを使用した術前補助化学療法の第II相研究(ECOG 1308[NCT01084083])において、3サイクルの術前補助化学療法で臨床的完全奏効を達成した患者が週1回のセツキシマブと併用する線量を抑えた54GyのIMRTを受けた;臨床的完全奏効に至らなかった患者は、原発腫瘍部位またはリンパ節に対する69.3Gyの放射線とセツキシマブを受けた。[ 38 ]
全体として、中咽頭がん患者に対する術前補助化学療法の役割は依然として不明である。しかしながら、HPVで定義されるサブセットでは、この第II相研究により、この設定で術前補助化学療法は化学放射線療法をより少なくして使用できることが示唆されているため、さらなる情報が必要である。[ 37 ][ 39 ][ 40 ][ 41 ][ 42 ][証拠レベル:1iA]
参考文献- Iyer NG, Tan DS, Tan VK, et al.: Randomized trial comparing surgery and adjuvant radiotherapy versus concurrent chemoradiotherapy in patients with advanced, nonmetastatic squamous cell carcinoma of the head and neck: 10-year update and subset analysis. Cancer 121 (10): 1599-607, 2015.[PUBMED Abstract]
- Mehanna H, Wong WL, McConkey CC, et al.: PET-CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med 374 (15): 1444-54, 2016.[PUBMED Abstract]
- Parsons JT, Mendenhall WM, Stringer SP, et al.: Squamous cell carcinoma of the oropharynx: surgery, radiation therapy, or both. Cancer 94 (11): 2967-80, 2002.[PUBMED Abstract]
- Harrison LB, Zelefsky MJ, Armstrong JG, et al.: Performance status after treatment for squamous cell cancer of the base of tongue--a comparison of primary radiation therapy versus primary surgery. Int J Radiat Oncol Biol Phys 30 (4): 953-7, 1994.[PUBMED Abstract]
- Mendenhall WM, Morris CG, Amdur RJ, et al.: Definitive radiotherapy for squamous cell carcinoma of the base of tongue. Am J Clin Oncol 29 (1): 32-9, 2006.[PUBMED Abstract]
- Chen AM, Daly ME, Luu Q, et al.: Comparison of functional outcomes and quality of life between transoral surgery and definitive chemoradiotherapy for oropharyngeal cancer. Head Neck 37 (3): 381-5, 2015.[PUBMED Abstract]
- Cooper JS, Pajak TF, Forastiere AA, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 350 (19): 1937-44, 2004.[PUBMED Abstract]
- Bernier J, Domenge C, Ozsahin M, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 350 (19): 1945-52, 2004.[PUBMED Abstract]
- Bernier J, Cooper JS, Pajak TF, et al.: Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 27 (10): 843-50, 2005.[PUBMED Abstract]
- Cooper JS, Zhang Q, Pajak TF, et al.: Long-term follow-up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 84 (5): 1198-205, 2012.[PUBMED Abstract]
- Fowler JF, Lindstrom MJ: Loss of local control with prolongation in radiotherapy. Int J Radiat Oncol Biol Phys 23 (2): 457-67, 1992.[PUBMED Abstract]
- Allal AS, de Pree C, Dulguerov P, et al.: Avoidance of treatment interruption: an unrecognized benefit of accelerated radiotherapy in oropharyngeal carcinomas? Int J Radiat Oncol Biol Phys 45 (1): 41-5, 1999.[PUBMED Abstract]
- Browman GP, Wong G, Hodson I, et al.: Influence of cigarette smoking on the efficacy of radiation therapy in head and neck cancer. N Engl J Med 328 (3): 159-63, 1993.[PUBMED Abstract]
- Eisbruch A, Harris J, Garden AS, et al.: Multi-institutional trial of accelerated hypofractionated intensity-modulated radiation therapy for early-stage oropharyngeal cancer (RTOG 00-22). Int J Radiat Oncol Biol Phys 76 (5): 1333-8, 2010.[PUBMED Abstract]
- Leclerc M, Maingon P, Hamoir M, et al.: A dose escalation study with intensity modulated radiation therapy (IMRT) in T2N0, T2N1, T3N0 squamous cell carcinomas (SCC) of the oropharynx, larynx and hypopharynx using a simultaneous integrated boost (SIB) approach. Radiother Oncol 106 (3): 333-40, 2013.[PUBMED Abstract]
- Buettner F, Miah AB, Gulliford SL, et al.: Novel approaches to improve the therapeutic index of head and neck radiotherapy: an analysis of data from the PARSPORT randomised phase III trial. Radiother Oncol 103 (1): 82-7, 2012.[PUBMED Abstract]
- Gulliford SL, Miah AB, Brennan S, et al.: Dosimetric explanations of fatigue in head and neck radiotherapy: an analysis from the PARSPORT Phase III trial. Radiother Oncol 104 (2): 205-12, 2012.[PUBMED Abstract]
- Kohler RE, Sheets NC, Wheeler SB, et al.: Two-year and lifetime cost-effectiveness of intensity modulated radiation therapy versus 3-dimensional conformal radiation therapy for head-and-neck cancer. Int J Radiat Oncol Biol Phys 87 (4): 683-9, 2013.[PUBMED Abstract]
- Gupta T, Agarwal J, Jain S, et al.: Three-dimensional conformal radiotherapy (3D-CRT) versus intensity modulated radiation therapy (IMRT) in squamous cell carcinoma of the head and neck: a randomized controlled trial. Radiother Oncol 104 (3): 343-8, 2012.[PUBMED Abstract]
- Nutting CM, Morden JP, Harrington KJ, et al.: Parotid-sparing intensity modulated versus conventional radiotherapy in head and neck cancer (PARSPORT): a phase 3 multicentre randomised controlled trial. Lancet Oncol 12 (2): 127-36, 2011.[PUBMED Abstract]
- Fu KK, Pajak TF, Trotti A, et al.: A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int J Radiat Oncol Biol Phys 48 (1): 7-16, 2000.[PUBMED Abstract]
- Beitler JJ, Zhang Q, Fu KK, et al.: Final results of local-regional control and late toxicity of RTOG 9003: a randomized trial of altered fractionation radiation for locally advanced head and neck cancer. Int J Radiat Oncol Biol Phys 89 (1): 13-20, 2014.[PUBMED Abstract]
- Baujat B, Bourhis J, Blanchard P, et al.: Hyperfractionated or accelerated radiotherapy for head and neck cancer. Cochrane Database Syst Rev (12): CD002026, 2010.[PUBMED Abstract]
- Turner SL, Tiver KW, Boyages SC: Thyroid dysfunction following radiotherapy for head and neck cancer. Int J Radiat Oncol Biol Phys 31 (2): 279-83, 1995.[PUBMED Abstract]
- Constine LS: What else don't we know about the late effects of radiation in patients treated for head and neck cancer? Int J Radiat Oncol Biol Phys 31 (2): 427-9, 1995.[PUBMED Abstract]
- Murthy V, Narang K, Ghosh-Laskar S, et al.: Hypothyroidism after 3-dimensional conformal radiotherapy and intensity-modulated radiotherapy for head and neck cancers: prospective data from 2 randomized controlled trials. Head Neck 36 (11): 1573-80, 2014.[PUBMED Abstract]
- O'Sullivan B, Warde P, Grice B, et al.: The benefits and pitfalls of ipsilateral radiotherapy in carcinoma of the tonsillar region. Int J Radiat Oncol Biol Phys 51 (2): 332-43, 2001.[PUBMED Abstract]
- Denis F, Garaud P, Bardet E, et al.: Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 22 (1): 69-76, 2004.[PUBMED Abstract]
- Mendenhall WM, Werning JW, Pfister DG: Treatment of head and neck cancer. In: DeVita VT Jr, Lawrence TS, Rosenberg SA: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2011, pp 729-80.[PUBMED Abstract]
- Adelstein DJ: Oropharyngeal cancer: the role of chemotherapy. Curr Treat Options Oncol 4 (1): 3-13, 2003.[PUBMED Abstract]
- Pignon JP, le Maître A, Maillard E, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 92 (1): 4-14, 2009.[PUBMED Abstract]
- Bonner JA, Harari PM, Giralt J, et al.: Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 354 (6): 567-78, 2006.[PUBMED Abstract]
- Curran D, Giralt J, Harari PM, et al.: Quality of life in head and neck cancer patients after treatment with high-dose radiotherapy alone or in combination with cetuximab. J Clin Oncol 25 (16): 2191-7, 2007.[PUBMED Abstract]
- Trotti A, Harris J, Gillison M, et al.: NRG-RTOG 1016: phase III trial comparing radiation/cetuximab to radiation/cisplatin in HPV-related cancer of the oropharynx. [Abstract] Int J Radiat Oncol Biol Phys 102 (5): A-LBA4, 1604-5, 2018. Also available online. Last accessed April 7, 2020.[PUBMED Abstract]
- Gillison ML, Trotti AM, Harris J, et al.: Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial. Lancet 393 (10166): 40-50, 2019.[PUBMED Abstract]
- Mehanna H, Robinson M, Hartley A, et al.: Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial. Lancet 393 (10166): 51-60, 2019.[PUBMED Abstract]
- Budach W, Bölke E, Kammers K, et al.: Induction chemotherapy followed by concurrent radio-chemotherapy versus concurrent radio-chemotherapy alone as treatment of locally advanced squamous cell carcinoma of the head and neck (HNSCC): A meta-analysis of randomized trials. Radiother Oncol 118 (2): 238-43, 2016.[PUBMED Abstract]
- Marur S, Li S, Cmelak AJ, et al.: E1308: Phase II Trial of Induction Chemotherapy Followed by Reduced-Dose Radiation and Weekly Cetuximab in Patients With HPV-Associated Resectable Squamous Cell Carcinoma of the Oropharynx- ECOG-ACRIN Cancer Research Group. J Clin Oncol 35 (5): 490-497, 2017.[PUBMED Abstract]
- Haddad R, O'Neill A, Rabinowits G, et al.: Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomised phase 3 trial. Lancet Oncol 14 (3): 257-64, 2013.[PUBMED Abstract]
- Cohen EE, Karrison TG, Kocherginsky M, et al.: Phase III randomized trial of induction chemotherapy in patients with N2 or N3 locally advanced head and neck cancer. J Clin Oncol 32 (25): 2735-43, 2014.[PUBMED Abstract]
- Hitt R, Grau JJ, López-Pousa A, et al.: A randomized phase III trial comparing induction chemotherapy followed by chemoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer. Ann Oncol 25 (1): 216-25, 2014.[PUBMED Abstract]
- Driessen CM, de Boer JP, Gelderblom H, et al.: Induction chemotherapy with docetaxel/cisplatin/5-fluorouracil followed by randomization to two cisplatin-based concomitant chemoradiotherapy schedules in patients with locally advanced head and neck cancer (CONDOR study) (Dutch Head and Neck Society 08-01): A randomized phase II study. Eur J Cancer 52: 77-84, 2016.[PUBMED Abstract]
- I期およびII期の中咽頭がんの治療
-
I期およびII期の中咽頭がんに対する治療法の選択肢
I期およびII期の中咽頭がんの管理では、至適治療を確立するために集学的データが必要である。I期およびII期の中咽頭がんを制御する成功率は、放射線療法または手術で同等である。(詳しい情報については、本要約の中咽頭がんに対する治療法選択肢の概要のセクションを参照のこと。)
治療の選択は、治療法の選択肢から予測される機能的な発声と嚥下および審美的結果のほか、外科医および放射線腫瘍医が対応可能な専門技術により決定される。治療はそれぞれの患者に個別化される。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
- III期およびIV期の中咽頭がんの治療
-
III期およびIV期の中咽頭がんの管理は複雑で、至適治療の確立には集学的データが必要である。(詳しい情報については、本要約の中咽頭がんに対する治療法選択肢の概要のセクションを参照のこと。)
III期およびIV期の中咽頭がんに対する治療法の選択肢
III期およびIV期の中咽頭がんに対して臨床評価段階にある治療法の選択肢
III期およびIV期の中咽頭がんに対して臨床評価段階にある治療法の選択肢には以下のものがある:
- 臨床試験で投与されているような術前補助化学療法は、腫瘍を縮小させるために用いられており、手術または放射線療法のいずれかを用いる腫瘍の治療をさらに確実なものにする。化学療法は他の治療法に先んじて実施される;このため、ネオアジュバントという名称により、放射線を用いた根治治療後、根治治療中または術後に実施される標準アジュバント療法と区別される。術前補助化学療法では多剤併用が用いられている。[ 16 ][ 17 ][ 18 ][ 19 ][ 20 ]
- 免疫療法と併用する化学放射線療法。RTOG 3504(NCT02764593)では、中リスク~高リスクの頭頸部がん患者においてニボルマブと併用する同時化学放射線療法が評価されている。
- 放射線療法における線量の段階的縮小を用いる治療の脱強化がNRG-HN002(NCT02254278)において研究されている。
- 経口的手術とその後の放射線療法における線量の段階的縮小を用いる治療の脱強化がECOG -3311(NCT01898494)において研究されている。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Bernier J, Cooper JS, Pajak TF, et al.: Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 27 (10): 843-50, 2005.[PUBMED Abstract]
- Cooper JS, Zhang Q, Pajak TF, et al.: Long-term follow-up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 84 (5): 1198-205, 2012.[PUBMED Abstract]
- Cooper JS, Pajak TF, Forastiere AA, et al.: Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 350 (19): 1937-44, 2004.[PUBMED Abstract]
- Bernier J, Domenge C, Ozsahin M, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 350 (19): 1945-52, 2004.[PUBMED Abstract]
- Horiot JC, Le Fur R, N'Guyen T, et al.: Hyperfractionation versus conventional fractionation in oropharyngeal carcinoma: final analysis of a randomized trial of the EORTC cooperative group of radiotherapy. Radiother Oncol 25 (4): 231-41, 1992.[PUBMED Abstract]
- Bourhis J, Lapeyre M, Tortochaux J, et al.: Phase III randomized trial of very accelerated radiation therapy compared with conventional radiation therapy in squamous cell head and neck cancer: a GORTEC trial. J Clin Oncol 24 (18): 2873-8, 2006.[PUBMED Abstract]
- Overgaard J, Hansen HS, Specht L, et al.: Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA 6 and 7 randomised controlled trial. Lancet 362 (9388): 933-40, 2003.[PUBMED Abstract]
- Overgaard J, Mohanti BK, Begum N, et al.: Five versus six fractions of radiotherapy per week for squamous-cell carcinoma of the head and neck (IAEA-ACC study): a randomised, multicentre trial. Lancet Oncol 11 (6): 553-60, 2010.[PUBMED Abstract]
- Fu KK, Pajak TF, Trotti A, et al.: A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int J Radiat Oncol Biol Phys 48 (1): 7-16, 2000.[PUBMED Abstract]
- Bonner JA, Harari PM, Giralt J, et al.: Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med 354 (6): 567-78, 2006.[PUBMED Abstract]
- Curran D, Giralt J, Harari PM, et al.: Quality of life in head and neck cancer patients after treatment with high-dose radiotherapy alone or in combination with cetuximab. J Clin Oncol 25 (16): 2191-7, 2007.[PUBMED Abstract]
- Denis F, Garaud P, Bardet E, et al.: Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 22 (1): 69-76, 2004.[PUBMED Abstract]
- Olmi P, Crispino S, Fallai C, et al.: Locoregionally advanced carcinoma of the oropharynx: conventional radiotherapy vs. accelerated hyperfractionated radiotherapy vs. concomitant radiotherapy and chemotherapy--a multicenter randomized trial. Int J Radiat Oncol Biol Phys 55 (1): 78-92, 2003.[PUBMED Abstract]
- Semrau R, Mueller RP, Stuetzer H, et al.: Efficacy of intensified hyperfractionated and accelerated radiotherapy and concurrent chemotherapy with carboplatin and 5-fluorouracil: updated results of a randomized multicentric trial in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 64 (5): 1308-16, 2006.[PUBMED Abstract]
- Pignon JP, le Maître A, Maillard E, et al.: Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol 92 (1): 4-14, 2009.[PUBMED Abstract]
- Al-Kourainy K, Kish J, Ensley J, et al.: Achievement of superior survival for histologically negative versus histologically positive clinically complete responders to cisplatin combination in patients with locally advanced head and neck cancer. Cancer 59 (2): 233-8, 1987.[PUBMED Abstract]
- Stupp R, Weichselbaum RR, Vokes EE: Combined modality therapy of head and neck cancer. Semin Oncol 21 (3): 349-58, 1994.[PUBMED Abstract]
- Ensley J, Crissman J, Kish J, et al.: The impact of conventional morphologic analysis on response rates and survival in patients with advanced head and neck cancers treated initially with cisplatin-containing combination chemotherapy. Cancer 57 (4): 711-7, 1986.[PUBMED Abstract]
- Pfister DG, Harrison LB, Strong EW, et al.: Organ-function preservation in advanced oropharynx cancer: results with induction chemotherapy and radiation. J Clin Oncol 13 (3): 671-80, 1995.[PUBMED Abstract]
- Dimery IW, Hong WK: Overview of combined modality therapies for head and neck cancer. J Natl Cancer Inst 85 (2): 95-111, 1993.[PUBMED Abstract]
- 転移性および再発中咽頭がんの治療
-
転移性および再発中咽頭がんに対する治療法の選択肢
転移性および再発中咽頭がんの管理は複雑で、至適治療の確立には集学的データが必要である。(詳しい情報については、本要約の中咽頭がんに対する治療法選択肢の概要のセクションを参照のこと。)
転移性および再発中咽頭がんに対する治療法の選択肢には以下のものがある:
- 腫瘍が放射線療法に反応せず、技術的に施行可能である場合は、外科的切除。[ 1 ]
- 手術で腫瘍を完全切除できず、以前に治癒線量を照射していなければ、放射線療法。[ 2 ]
- 腫瘍が最初に完全切除できておらず、技術的に施行可能である場合は、再度の手術。[ 1 ]
- 切除不能な局所領域で再発した疾患に対する化学療法。
- 従来の分割照射法、または多分割照射法(HFX)と同時化学療法の併用を用いる追加の放射線療法。[ 3 ]
- セツキシマブ同時投与を併用する体幹部定位放射線治療。[ 4 ]
- 局所の転移性または再発がんの設定では、プラチナ製剤をベースにした化学療法の失敗後に免疫療法(プログラム死リガンド1[PD-L1]経路の阻害剤)が使用できる。[ 5 ][ 6 ]
化学療法
頭頸部の転移性または再発扁平上皮がん(SCC)を有する患者に対する第一選択治療として、プラチナ製剤をベースにした化学療法がしばしば用いられる。
証拠(化学療法):
- 頭頸部の未治療の転移性または再発SCCを有する患者442人を対象にした1件の第III相ランダム化試験において、プラチナ製剤 + フルオロウラシルへのセツキシマブの追加は、プラチナ製剤 + フルオロウラシル単独と比較して、全生存(OS)を改善し、生存期間中央値は10.1ヵ月 vs 7.4ヵ月(死亡に対するハザード比[HR][HR死亡]、0.80;95%信頼区間[CI]、0.64-0.99;P = 0.04)であった。[
7
]
腫瘍のEGFR遺伝子コピー数は、頭頸部の転移性または再発SCCを有する患者に対する第一選択治療としてセツキシマブ + プラチナ製剤およびフルオロウラシルの効力を判断する予測バイオマーカーであることは示されなかった。[ 9 ][証拠レベル:1iiA]
- 1件のオープンラベル第III相ランダム化試験により、メトトレキサートを投与された患者と比較して、アファチニブを投与された患者における無増悪生存(PFS)の改善が実証された。[
10
]
- 追跡期間中央値6.7ヵ月後、PFS期間中央値はアファチニブ群で2.6ヵ月(95%CI、2.0-2.7)およびメトトレキサート群で1.7ヵ月(95%CI、1.5-2.4)(HR、0.80[95%CI、0.65-0.98];P = 0.030)であった。
- アファチニブまたはメトトレキサートで治療された患者に対する最も頻度の高いグレード3またはグレード4の薬物関連の有害事象には以下のものがあった:
- 全体での重篤な有害事象は、アファチニブで治療された患者の14%およびメトトレキサートで治療された患者の11%に発生した。
免疫療法
ペムブロリズマブ
ペムブロリズマブはモノクローナル抗体であり、プログラム死(PD-1)経路の阻害剤である。2件の研究で、頭頸部の治癒不能な転移性または再発扁平上皮がんを有する患者におけるペムブロリズマブが評価されている。
証拠(第一選択治療としてのペムブロリズマブ):
- 37ヵ国の200箇所で実施されたKEYNOTE-048[NCT02358031]は、頭頸部の局所の治癒不能な未治療の転移性または再発扁平上皮がんを有する参加者を対象にした第III相ランダム化非盲検研究であった。[
11
]患者は1:1:1の比率で、ペムブロリズマブ単独、ペムブロリズマブ + プラチナ製剤およびフルオロウラシル(化学療法と併用するペムブロリズマブ)、またはセツキシマブ + プラチナ製剤およびフルオロウラシル(化学療法と併用するセツキシマブ)を受けるようにランダムに割り付けられた。研究者、参加者、およびスポンサーの代表にはPD-L1複合陽性スコア(CPS)の結果が隠されていた;PD-L1陽性は研究への登録に必要とされなかった。
主要エンドポイントはOSおよびPFSであった。進行は、intention-to-treat解析で、X線像で確認される疾患進行またはすべての原因による死亡(いずれか早い方)と定義された。試験では、882人の参加者がペムブロリズマブ単独(n = 301)、化学療法と併用するペムブロリズマブ(n = 281)、または化学療法と併用するセツキシマブ(n = 300)を受けるように割り付けられた;このうち、754人(85%)ではCPSが1以上で、381人(43%)ではCPSが20以上であった。
頭頸部の転移性または再発扁平上皮がん(SCC)を有する患者には、ペムブロリズマブ + プラチナ製剤およびフルオロウラシルが適切な第一選択治療である。頭頸部のPD-L1陽性の転移性または再発扁平上皮がんを有する患者には、ペムブロリズマブ単剤療法が適切な第一選択治療である。
証拠(プラチナ製剤をベースにした治療で進行した後のペムブロリズマブ):
- ランダム化第III相試験のKEYNOTE-040[NCT02252042]では、3~6ヵ月以内にプラチナ製剤をベースにした化学療法を受けた治癒不能な転移性または再発頭頸部SCC患者が含められた。[ 5 ]患者はペムブロリズマブ群(3週間ごとに200mg[247人の患者])または研究者の選択による標準治療群(メトトレキサート、ドセタキセル、またはセツキシマブ[248人の患者])にランダムに割り付けられた。患者は進行するか毒性が発現するまで治療を受けた。ペムブロリズマブの最長投与期間は24ヵ月であった。主要エンドポイントはintention-to-treat集団でのOSであった。
ニボルマブ
ニボルマブは完全ヒト化免疫グロブリンG4(IgG4)抗PD-1モノクローナル抗体である。
証拠(ニボルマブ):
- 1件のオープンラベル第III相試験では、再発頭頸部SCCでプラチナ製剤をベースにした化学療法後6ヵ月以内に進行した患者361人が、ニボルマブ(3mg/kg体重の用量)を2週間ごとの投与、または標準の単剤全身療法(メトトレキサート、ドセタキセル、またはセツキシマブ)の投与に2:1の比率でランダム化され、主要エンドポイントはOS期間とされた。[ 6 ]
転移性および再発中咽頭がんに対して臨床評価段階にある治療法の選択肢
転移性および再発中咽頭がんに対して臨床評価段階にある治療法の選択肢には以下のものがある:
- HFXと同時化学療法、標的療法、体幹部定位放射線治療、または免疫療法とを併用する追加の放射線療法を評価する臨床試験。[ 12 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も入手することができる。
参考文献- Wong LY, Wei WI, Lam LK, et al.: Salvage of recurrent head and neck squamous cell carcinoma after primary curative surgery. Head Neck 25 (11): 953-9, 2003.[PUBMED Abstract]
- Vikram B, Strong EW, Shah JP, et al.: Intraoperative radiotherapy in patients with recurrent head and neck cancer. Am J Surg 150 (4): 485-7, 1985.[PUBMED Abstract]
- Spencer SA, Harris J, Wheeler RH, et al.: RTOG 96-10: reirradiation with concurrent hydroxyurea and 5-fluorouracil in patients with squamous cell cancer of the head and neck. Int J Radiat Oncol Biol Phys 51 (5): 1299-304, 2001.[PUBMED Abstract]
- Vargo JA, Ferris RL, Ohr J, et al.: A prospective phase 2 trial of reirradiation with stereotactic body radiation therapy plus cetuximab in patients with previously irradiated recurrent squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 91 (3): 480-8, 2015.[PUBMED Abstract]
- Cohen EEW, Soulières D, Le Tourneau C, et al.: Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-and-neck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label, phase 3 study. Lancet 393 (10167): 156-167, 2019.[PUBMED Abstract]
- Ferris RL, Blumenschein G, Fayette J, et al.: Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 375 (19): 1856-1867, 2016.[PUBMED Abstract]
- Vermorken JB, Mesia R, Rivera F, et al.: Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 359 (11): 1116-27, 2008.[PUBMED Abstract]
- Mesía R, Rivera F, Kawecki A, et al.: Quality of life of patients receiving platinum-based chemotherapy plus cetuximab first line for recurrent and/or metastatic squamous cell carcinoma of the head and neck. Ann Oncol 21 (10): 1967-73, 2010.[PUBMED Abstract]
- Licitra L, Mesia R, Rivera F, et al.: Evaluation of EGFR gene copy number as a predictive biomarker for the efficacy of cetuximab in combination with chemotherapy in the first-line treatment of recurrent and/or metastatic squamous cell carcinoma of the head and neck: EXTREME study. Ann Oncol 22 (5): 1078-87, 2011.[PUBMED Abstract]
- Machiels JP, Haddad RI, Fayette J, et al.: Afatinib versus methotrexate as second-line treatment in patients with recurrent or metastatic squamous-cell carcinoma of the head and neck progressing on or after platinum-based therapy (LUX-Head & Neck 1): an open-label, randomised phase 3 trial. Lancet Oncol 16 (5): 583-94, 2015.[PUBMED Abstract]
- Burtness B, Harrington KJ, Greil R, et al.: Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 394 (10212): 1915-1928, 2019.[PUBMED Abstract]
- Tortochaux J, Tao Y, Tournay E, et al.: Randomized phase III trial (GORTEC 98-03) comparing re-irradiation plus chemotherapy versus methotrexate in patients with recurrent or a second primary head and neck squamous cell carcinoma, treated with a palliative intent. Radiother Oncol 100 (1): 70-5, 2011.[PUBMED Abstract]
- 本要約の変更点(05/08/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
本要約には編集上の変更がなされた。
本要約はPDQ Adult Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、成人中咽頭がんの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Adult Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、ウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Adult Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Adult Treatment Editorial Board.PDQ Oropharyngeal Cancer Treatment (Adult).Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/head-and-neck/hp/adult/oropharyngeal-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389168 ]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する