ご利用について
医療専門家向けの本PDQがん情報要約では、小児上衣腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 小児上衣腫に関する一般情報
-
上衣腫を含む原発性脳腫瘍は、小児の最も一般的な充実性腫瘍をともに構成する多様な疾病からなる1つのグループである。腫瘍の診断と分類には、免疫組織化学的分析、細胞遺伝学的ならびに分子遺伝学的所見、および細胞分裂能の測定が用いられることが多くなっている。脳腫瘍はその組織像によって分類されるが、腫瘍存在部位、その拡がり、分子的特徴、および年齢は治療および予後を左右する重要な因子である。
中枢神経系腫瘍に関する世界保健機関(WHO)分類の2016年の改訂版によれば、上衣腫瘍は以下の5つの主要な亜型に分類される:[ 1 ]
PDQ小児脳腫瘍の治療要約は主に、神経系腫瘍に関するWHO分類に従って構成されている。[ 1 ]神経系腫瘍の分類の詳しい説明と各種の脳腫瘍に対応する治療要約へのリンクについては、小児脳腫瘍および脊髄腫瘍の治療の概要に関するPDQ要約を参照のこと。
解剖学
上衣腫は脳室と脳内の通路、および脊髄中心部を覆う上衣細胞から発生する(図1を参照のこと)。上衣細胞は脳脊髄液(CSF)を産生する。この種の腫瘍はテント上、テント下、または脊髄に分類される。小児の場合、ほとんどの上衣腫がテント下腫瘍であり、第四脳室内またはその周辺から発生し、テント上での発生頻度は低い。脊髄上衣腫は小児期ではまれである。
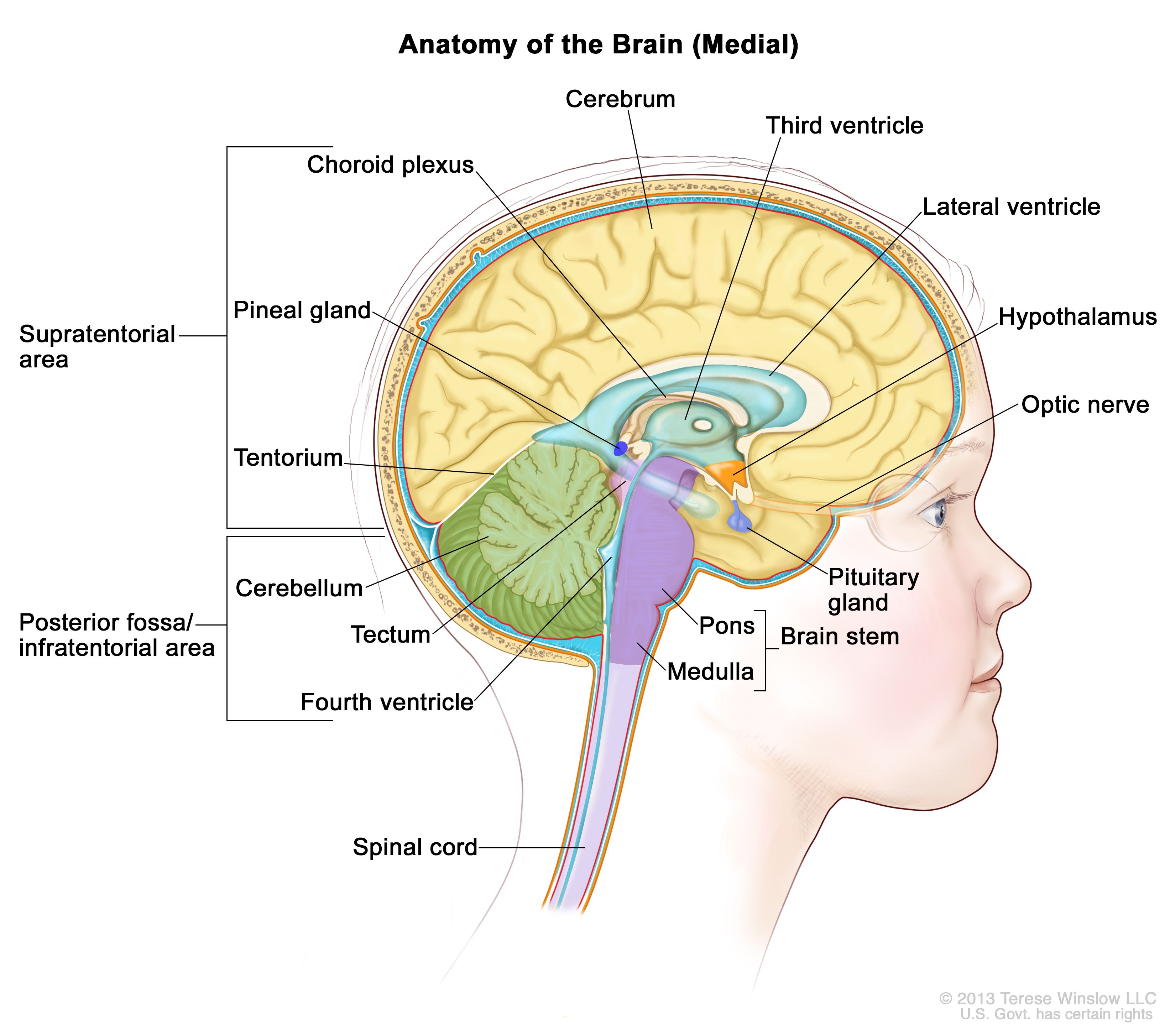
図1.松果体、下垂体、視神経、脳室(青色の部分が脳脊髄液)などを示す脳内の解剖図。小脳テントは大脳と小脳を区切っている。テント下(後頭蓋窩)は小脳テントの下部に位置する領域で、脳幹、小脳、第四脳室が含まれている。テント上は小脳テント上部の大脳が含まれる領域を指す。 臨床的特徴
上衣腫の臨床像は腫瘍の位置によって異なる。
診断的評価
上衣腫が疑われる患者はすべて、脳全体および脊髄の画像診断によって評価を行う。脊髄のくも膜下転移を評価するために利用可能な最も感度が高い方法は、ガドリニウムを用いた脊髄の磁気共鳴画像法(MRI)である。画像診断は術後の出血との混同を避けるため、手術前に実施するのが理想的である。MRIを使用する場合は一般的に、ガドリニウム増強後、連続するMRIスライスを用い少なくとも2平面画像上で、脊髄全体が映し出される。
可能であれば、CSFの細胞学的評価を実施する。[ 5 ]
予後因子
治療成績に影響を及ぼす不良因子には(上述のものを除いて)以下のものがある:
治療後の経過観察
上衣腫の治療後には神経画像検査によるサーベイランスと臨床評価をともに実施することが、一般的に推奨される。大半の医師は以下の間隔で脳および/または脊髄のMRI画像を撮影している:[ 30 ][証拠レベル:2A]
- 治療後最初の2~3年間:3~4ヵ月ごと。
- 治療後4~5年目:6ヵ月ごと。
- 治療後5年目以降:晩期再発率が高く、再燃した上衣腫がサーベイランスのためのMRIで確認された場合(5年OS率、37%)の方が、症状が発現したために確認された症例(5年OS率、8%)よりも治療成績が良好であることを示す証拠があるため、年1回。
参考文献- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. Lyon, France: IARC Press, 2016.[PUBMED Abstract]
- Gurney JG, Smith MA, Bunin GR: CNS and miscellaneous intracranial and intraspinal neoplasms. In: Ries LA, Smith MA, Gurney JG, et al., eds.: Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. Bethesda, Md: National Cancer Institute, SEER Program, 1999. NIH Pub.No. 99-4649, Chapter 3, pp 51-63. Also available online. Last accessed March 20, 2020.[PUBMED Abstract]
- Central Brain Tumor Registry of the United States: Statistical Report: Primary Brain Tumors in the United States, 1997-2001. Hinsdale, Ill: Central Brain Tumor Registry of the United States, 2004..[PUBMED Abstract]
- Andreiuolo F, Puget S, Peyre M, et al.: Neuronal differentiation distinguishes supratentorial and infratentorial childhood ependymomas. Neuro Oncol 12 (11): 1126-34, 2010.[PUBMED Abstract]
- Moreno L, Pollack IF, Duffner PK, et al.: Utility of cerebrospinal fluid cytology in newly diagnosed childhood ependymoma. J Pediatr Hematol Oncol 32 (6): 515-8, 2010.[PUBMED Abstract]
- Wani K, Armstrong TS, Vera-Bolanos E, et al.: A prognostic gene expression signature in infratentorial ependymoma. Acta Neuropathol 123 (5): 727-38, 2012.[PUBMED Abstract]
- Witt H, Mack SC, Ryzhova M, et al.: Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell 20 (2): 143-57, 2011.[PUBMED Abstract]
- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015.[PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016.[PUBMED Abstract]
- Mendrzyk F, Korshunov A, Benner A, et al.: Identification of gains on 1q and epidermal growth factor receptor overexpression as independent prognostic markers in intracranial ependymoma. Clin Cancer Res 12 (7 Pt 1): 2070-9, 2006.[PUBMED Abstract]
- Korshunov A, Witt H, Hielscher T, et al.: Molecular staging of intracranial ependymoma in children and adults. J Clin Oncol 28 (19): 3182-90, 2010.[PUBMED Abstract]
- Kilday JP, Mitra B, Domerg C, et al.: Copy number gain of 1q25 predicts poor progression-free survival for pediatric intracranial ependymomas and enables patient risk stratification: a prospective European clinical trial cohort analysis on behalf of the Children's Cancer Leukaemia Group (CCLG), Societe Francaise d'Oncologie Pediatrique (SFOP), and International Society for Pediatric Oncology (SIOP). Clin Cancer Res 18 (7): 2001-11, 2012.[PUBMED Abstract]
- Godfraind C, Kaczmarska JM, Kocak M, et al.: Distinct disease-risk groups in pediatric supratentorial and posterior fossa ependymomas. Acta Neuropathol 124 (2): 247-57, 2012.[PUBMED Abstract]
- Korshunov A, Golanov A, Timirgaz V: Immunohistochemical markers for intracranial ependymoma recurrence. An analysis of 88 cases. J Neurol Sci 177 (1): 72-82, 2000.[PUBMED Abstract]
- Andreiuolo F, Le Teuff G, Bayar MA, et al.: Integrating Tenascin-C protein expression and 1q25 copy number status in pediatric intracranial ependymoma prognostication: A new model for risk stratification. PLoS One 12 (6): e0178351, 2017.[PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019.[PUBMED Abstract]
- Upadhyaya SA, Robinson GW, Onar-Thomas A, et al.: Molecular grouping and outcomes of young children with newly diagnosed ependymoma treated on the multi-institutional SJYC07 trial. Neuro Oncol 21 (10): 1319-1330, 2019.[PUBMED Abstract]
- Cavalli FMG, Hübner JM, Sharma T, et al.: Heterogeneity within the PF-EPN-B ependymoma subgroup. Acta Neuropathol 136 (2): 227-237, 2018.[PUBMED Abstract]
- Fukuoka K, Kanemura Y, Shofuda T, et al.: Significance of molecular classification of ependymomas: C11orf95-RELA fusion-negative supratentorial ependymomas are a heterogeneous group of tumors. Acta Neuropathol Commun 6 (1): 134, 2018.[PUBMED Abstract]
- Andreiuolo F, Varlet P, Tauziède-Espariat A, et al.: Childhood supratentorial ependymomas with YAP1-MAMLD1 fusion: an entity with characteristic clinical, radiological, cytogenetic and histopathological features. Brain Pathol 29 (2): 205-216, 2019.[PUBMED Abstract]
- Massimino M, Miceli R, Giangaspero F, et al.: Final results of the second prospective AIEOP protocol for pediatric intracranial ependymoma. Neuro Oncol 18 (10): 1451-60, 2016.[PUBMED Abstract]
- Merchant TE, Jenkins JJ, Burger PC, et al.: Influence of tumor grade on time to progression after irradiation for localized ependymoma in children. Int J Radiat Oncol Biol Phys 53 (1): 52-7, 2002.[PUBMED Abstract]
- Korshunov A, Golanov A, Sycheva R, et al.: The histologic grade is a main prognostic factor for patients with intracranial ependymomas treated in the microneurosurgical era: an analysis of 258 patients. Cancer 100 (6): 1230-7, 2004.[PUBMED Abstract]
- Tamburrini G, D'Ercole M, Pettorini BL, et al.: Survival following treatment for intracranial ependymoma: a review. Childs Nerv Syst 25 (10): 1303-12, 2009.[PUBMED Abstract]
- Amirian ES, Armstrong TS, Aldape KD, et al.: Predictors of survival among pediatric and adult ependymoma cases: a study using Surveillance, Epidemiology, and End Results data from 1973 to 2007. Neuroepidemiology 39 (2): 116-24, 2012.[PUBMED Abstract]
- Tihan T, Zhou T, Holmes E, et al.: The prognostic value of histological grading of posterior fossa ependymomas in children: a Children's Oncology Group study and a review of prognostic factors. Mod Pathol 21 (2): 165-77, 2008.[PUBMED Abstract]
- Ellison DW, Kocak M, Figarella-Branger D, et al.: Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed 10: 7, 2011.[PUBMED Abstract]
- Vaidya K, Smee R, Williams JR: Prognostic factors and treatment options for paediatric ependymomas. J Clin Neurosci 19 (9): 1228-35, 2012.[PUBMED Abstract]
- Zapotocky M, Beera K, Adamski J, et al.: Survival and functional outcomes of molecularly defined childhood posterior fossa ependymoma: Cure at a cost. Cancer 125 (11): 1867-1876, 2019.[PUBMED Abstract]
- Massimino M, Barretta F, Modena P, et al.: Pediatric intracranial ependymoma: correlating signs and symptoms at recurrence with outcome in the second prospective AIEOP protocol follow-up. J Neurooncol 140 (2): 457-465, 2018.[PUBMED Abstract]
- 小児上衣腫の分子的特徴
-
上衣腫の分子的亜型
分子的特性化研究から、上衣腫について9つの分子的亜型が同定されており、小児ではそのうち6つが圧倒的に多い。これらの亜型は、特有なDNAメチル化および遺伝子発現プロファイルに加え、独特な広範囲のゲノム変化により決定される(図2を参照のこと)。[ 1 ][ 2 ][ 3 ][ 4 ]
- テント下腫瘍。
- 後頭蓋窩A(PF-EPN-A)、H3 K27のトリメチル化基準の消失。
- 後頭蓋窩B(PF-EPN-B)、H3 K27のトリメチル化基準の保持。
- テント上腫瘍。
- C11orf95-RELA陽性上衣腫(ST-EPN-RELA)。
- YAP1融合陽性上衣腫(ST-EPN-YAP1)。
- 脊髄腫瘍。
- 粘液乳頭状上衣腫(SP-EPN-MPE)。
- 古典的組織型(SP-EPN)。
上衣下腫は-テント上、テント下、または脊髄のいずれでも-残りの3つの分子遺伝学的な多様体の原因となっており、小児でみられることは、あったとしてもまれである。
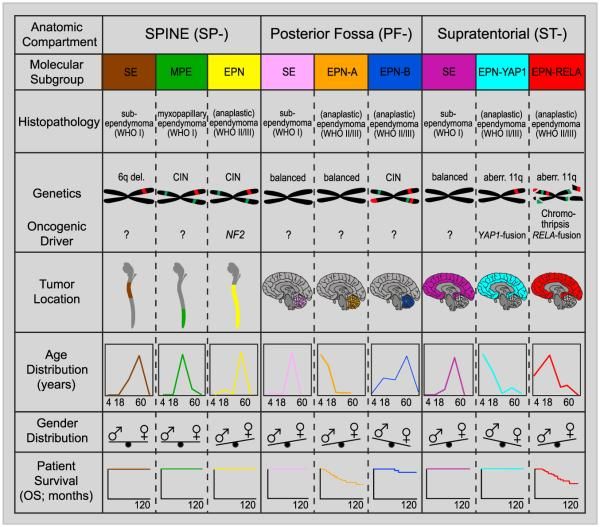
図2.上衣腫瘍の亜型の主要な分子的および臨床的特徴をグラフの形で示した要約。メチル化プロファイリングにより同定された上衣腫瘍の9つの分子的亜型の主要な遺伝子的所見およびエピジェネティックな所見の略図。CIN、染色体不安定性。Elsevierから許諾を得て転載:Cancer Cell, Volume 27, Kristian W. Pajtler, Hendrik Witt, Martin Sill, David T.W. Jones, Volker Hovestadt, Fabian Kratochwil, Khalida Wani, Ruth Tatevossian, Chandanamali Punchihewa, Pascal Johann, Juri Reimand, Hans-Jorg Warnatz, Marina Ryzhova, Steve Mack, Vijay Ramaswamy, David Capper, Leonille Schweizer, Laura Sieber, Andrea Wittmann, Zhiqin Huang, Peter van Sluis, Richard Volckmann, Jan Koster, Rogier Versteeg, Daniel Fults, Helen Toledano, Smadar Avigad, Lindsey M. Hoffman, Andrew M. Donson, Nicholas Foreman, Ekkehard Hewer, Karel Zitterbart, Mark Gilbert, Terri S. Armstrong, Nalin Gupta, Jeffrey C. Allen, Matthias A. Karajannis, David Zagzag, Martin Hasselblatt, Andreas E. Kulozik, Olaf Witt, V. Peter Collins, Katja von Hoff, Stefan Rutkowski, Torsten Pietsch, Gary Bader, Marie-Laure Yaspo, Andreas von Deimling, Peter Lichter, Michael D. Taylor, Richard Gilbertson, David W. Ellison, Kenneth Aldape, Andrey Korshunov, Marcel Kool, and Stefan M. Pfister, Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups, Pages 728-743, Copyright (2015). テント下腫瘍
後頭蓋窩A上衣腫(PF-EPN-A)
後頭蓋窩上衣腫で最も多い亜型はPF-EPN-Aであり、その特徴は以下の通りである:
- 幼児での発症(年齢中央値、3歳)。[ 1 ][ 5 ]
- 蛋白の構造に影響を及ぼす変異率が低い(ゲノム当たり約5個)。[ 2 ]
- 症例の約25%での、上衣腫[ 6 ]の予後不良因子として知られている染色体1qの増加。[ 1 ][ 3 ][ 7 ]
- 染色体の増加や欠失がほとんどない均衡の取れた染色体プロファイル。[ 1 ][ 2 ]
- H3 K27のトリメチル化基準の消失およびゲノム全域にわたるDNAの低メチル化。[
8
]H3 K27のトリメチル化基準の消失は、以下の2つの機序の1つにより発生する:
- 症例の10%におけるCXorf67/EZHIPの反復性変異で、ほぼすべてのPF-EPN-AにおいてCXorf67/EZHIP mRNAの発現が多くみられる。[ 9 ][ 10 ](変異を伴うまたは伴わない)CXorf67/EZHIP発現により、メチルトランスフェラーゼEZH2が阻害され、H3 K27のトリメチル化基準の消失に至る。[ 10 ][ 11 ]
- 少数の症例でのヒストンH3多様体における反復性のK27M変異。[ 12 ][ 13 ]びまん性内在性橋グリオーマとは異なり、H3.1における変異(HIST1H3BおよびHIST1H3C)は、H3.3における変異(H3F3A)よりも一般的である。[ 9 ]ヒストン変異はCXorf67/EZHIPの高発現と相互排他的であり[ 9 ]、それらはまたEZH2阻害を介してH3 K27のトリメチル化基準の消失に至る。
PF-EPN-Aの600例を超える症例を対象にした1件の研究では、メチル化アレイプロファイリングを用いてこの集団をPFA-1およびPFA-2の2つの異なるサブグループに分けた。[ 9 ]遺伝子発現プロファイリングによって、これら2つの亜型は後脳の解剖学的に異なる位置に発生しうることが示唆された。PFA-1とPFA-2グループの双方で、より小さい異なる亜型が同定でき、異質性の存在が示唆された。これらの亜型の臨床的意義を明らかにするには、さらなる研究が必要である。
テント上腫瘍
RELA融合を伴うテント上上衣腫(ST-EPN-RELA)
ST-EPN-RELAは小児テント上上衣腫の最大のサブセットであり、NF-κB経路活性に重要な転写因子であるRELAが関与する遺伝子融合を特徴とする。[ 14 ][ 15 ]ST-EPN-RELAは、以下を特徴とする:
YAP1融合を伴うテント上上衣腫(ST-EPN-YAP1)
ST-EPN-YAP1は2番目のそれほど多くないテント上上衣腫のサブセットで、11番染色体上のYAP1が関わる融合を有する。ST-EPN-YAP1は以下を特徴とする:
RELAまたはYAP1融合(11番染色体上)を伴わないテント上上衣腫は未定義の疾患実体であり、これらのサンプルが何を意味するかは不明である。DNAメチル化解析により、これらのサンプルはしばしば、高悪性度グリオーマや胚芽腫といった他の疾患実体とクラスターを形成する;11番染色体が関わる融合が認められないテント上上衣腫を診断する際は注意すべきである。[ 16 ][ 17 ]
参考文献- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015.[PUBMED Abstract]
- Witt H, Mack SC, Ryzhova M, et al.: Delineation of two clinically and molecularly distinct subgroups of posterior fossa ependymoma. Cancer Cell 20 (2): 143-57, 2011.[PUBMED Abstract]
- Mack SC, Witt H, Piro RM, et al.: Epigenomic alterations define lethal CIMP-positive ependymomas of infancy. Nature 506 (7489): 445-50, 2014.[PUBMED Abstract]
- Pajtler KW, Mack SC, Ramaswamy V, et al.: The current consensus on the clinical management of intracranial ependymoma and its distinct molecular variants. Acta Neuropathol 133 (1): 5-12, 2017.[PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016.[PUBMED Abstract]
- Korshunov A, Witt H, Hielscher T, et al.: Molecular staging of intracranial ependymoma in children and adults. J Clin Oncol 28 (19): 3182-90, 2010.[PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019.[PUBMED Abstract]
- Panwalkar P, Clark J, Ramaswamy V, et al.: Immunohistochemical analysis of H3K27me3 demonstrates global reduction in group-A childhood posterior fossa ependymoma and is a powerful predictor of outcome. Acta Neuropathol 134 (5): 705-714, 2017.[PUBMED Abstract]
- Pajtler KW, Wen J, Sill M, et al.: Molecular heterogeneity and CXorf67 alterations in posterior fossa group A (PFA) ependymomas. Acta Neuropathol 136 (2): 211-226, 2018.[PUBMED Abstract]
- Hübner JM, Müller T, Papageorgiou DN, et al.: EZHIP/CXorf67 mimics K27M mutated oncohistones and functions as an intrinsic inhibitor of PRC2 function in aggressive posterior fossa ependymoma. Neuro Oncol 21 (7): 878-889, 2019.[PUBMED Abstract]
- Jain SU, Do TJ, Lund PJ, et al.: PFA ependymoma-associated protein EZHIP inhibits PRC2 activity through a H3 K27M-like mechanism. Nat Commun 10 (1): 2146, 2019.[PUBMED Abstract]
- Gessi M, Capper D, Sahm F, et al.: Evidence of H3 K27M mutations in posterior fossa ependymomas. Acta Neuropathol 132 (4): 635-7, 2016.[PUBMED Abstract]
- Ryall S, Guzman M, Elbabaa SK, et al.: H3 K27M mutations are extremely rare in posterior fossa group A ependymoma. Childs Nerv Syst 33 (7): 1047-1051, 2017.[PUBMED Abstract]
- Parker M, Mohankumar KM, Punchihewa C, et al.: C11orf95-RELA fusions drive oncogenic NF-κB signalling in ependymoma. Nature 506 (7489): 451-5, 2014.[PUBMED Abstract]
- Pietsch T, Wohlers I, Goschzik T, et al.: Supratentorial ependymomas of childhood carry C11orf95-RELA fusions leading to pathological activation of the NF-κB signaling pathway. Acta Neuropathol 127 (4): 609-11, 2014.[PUBMED Abstract]
- Sturm D, Orr BA, Toprak UH, et al.: New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell 164 (5): 1060-72, 2016.[PUBMED Abstract]
- Fukuoka K, Kanemura Y, Shofuda T, et al.: Significance of molecular classification of ependymomas: C11orf95-RELA fusion-negative supratentorial ependymomas are a heterogeneous group of tumors. Acta Neuropathol Commun 6 (1): 134, 2018.[PUBMED Abstract]
- テント下腫瘍。
- 小児上衣腫瘍の病理組織学的分類
-
初めて、2016年版の世界保健機関(WHO)の中枢神経系(CNS)腫瘍の分類は選択されたCNS腫瘍の分類に遺伝子型所見の追加を組み入れた。統合されたこの分類は、より均質な疾患を定義して診断の正確さを向上させ、予後判定を洗練させ、より高い信頼性で治療戦略に関する結論に到達させることを意図している。
上衣腫瘍は現在以下の5つの主要な亜型に分類される:[ 1 ]
-
上衣下腫(WHO分類の悪性度I):上衣下腫は増殖速度が緩徐な新生物であり、典型的には脳室壁に付着する。上衣下腫は線維性基質に埋没したグリア系腫瘍細胞集塊で構成されている。
上衣下腫(WHO分類の悪性度I)の真の発生率を明らかにするのは困難である。これらの腫瘍は無症状であることが多く、剖検時に偶発的に発見されることもある。上衣下腫はすべての上衣腫瘍の5%未満を占めると考えられる。
小児における上衣下腫の診断は疑わしく、さらなるレビューまたは分子解析を検討すべきである。[ 2 ]
- 粘液乳頭状上衣腫(WHO分類の悪性度I):粘液乳頭状上衣腫のほとんどは主に脊髄円錐、馬尾、および脊髄終糸領域に発生し、血管化した粘液状の間質コア周囲に乳頭状に配列した腫瘍細胞が組織学的特徴である。
-
上衣腫(WHO分類の悪性度II):上衣腫は、脳室壁または脊柱管から生じる悪性度IIの新生物と考えられ、腫瘍性の上衣細胞で構成される。2016年版のWHOの改訂では、細胞性上衣腫という用語は、標準的な上衣腫と同義であると考えられたために、亜型として削除された。上衣腫のWHO分類の悪性度II腫瘍の他の亜型には以下のものがある:
- 乳頭状上衣腫-脳脊髄液曝露に伴い直線的な上皮様の表面を形成する。
- 明細胞性上衣腫-核周囲明庭を伴う乏突起膠腫様の外見を呈する。この多様体は脳のテント上部に優先的に位置する。
- タン細胞性上衣腫-悪性度II上衣腫の中で最もまれな型。この亜型は最も一般的には脊髄で発見される。腫瘍細胞はさまざまな幅および細胞密度の束で配列されており、絡み合わせは不完全である。
- 上衣腫、RELA融合陽性(WHO分類の悪性度IIまたはIII):この統合診断は小児の大半のテント上上衣腫瘍で認められる。表現型として、これは上衣腫(WHO分類の悪性度II)または退形成性上衣腫(WHO分類の悪性度III)と類似している。これらの腫瘍はC11orf95-RELA融合を特徴とし、L1CAM免疫組織化学がこの亜型の代替指標の役割を果たす可能性がある。[ 3 ]
- 退形成性上衣腫(WHO分類の悪性度III):この亜型は悪性上衣腫としても知られている。退形成性上衣腫は上衣系分化を示す悪性グリオーマと考えられており、悪性度IIの上衣腫と比較して、高い細胞密度および有糸分裂活動増加を示し、これはしばしば微小血管増生および壊死と関連する。悪性度IIと悪性度IIIの差は明らかに観察者間でばらつきがあり、共同グループ研究間で一貫性を欠いている。[ 4 ]
上衣下腫および粘液乳頭状上衣腫は通常、悪性度IIおよび悪性度IIIの上衣腫とは臨床的および病理学的に異なると考えられている。
テント上上衣腫とテント下上衣腫は、ともに放射状グリア細胞由来と考えられているが、ゲノム学的にも、ゲノムの全体像としても、遺伝子発現的にも、免疫組織化学的にも異なる特徴を有する。[ 5 ][ 6 ][ 7 ][ 8 ]テント上腫瘍の方が、多くの場合に神経細胞分化によって特徴付けられる。[ 6 ]テント上上衣腫とテント下上衣腫は生物学的に別個の疾患実体と考えるべきであることは明らかである。[ 5 ][ 8 ][ 9 ][ 10 ][ 11 ]
上衣芽腫はもはやWHO分類には含まれておらず、現在では多層性ロゼットを有する胚芽腫として分類されている(詳しい情報については、小児髄芽腫およびその他の中枢神経系胚芽腫の治療に関するPDQ要約を参照のこと)。
参考文献- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. Lyon, France: IARC Press, 2016.[PUBMED Abstract]
- Pajtler KW, Mack SC, Ramaswamy V, et al.: The current consensus on the clinical management of intracranial ependymoma and its distinct molecular variants. Acta Neuropathol 133 (1): 5-12, 2017.[PUBMED Abstract]
- Parker M, Mohankumar KM, Punchihewa C, et al.: C11orf95-RELA fusions drive oncogenic NF-κB signalling in ependymoma. Nature 506 (7489): 451-5, 2014.[PUBMED Abstract]
- Ellison DW, Kocak M, Figarella-Branger D, et al.: Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed 10: 7, 2011.[PUBMED Abstract]
- Taylor MD, Poppleton H, Fuller C, et al.: Radial glia cells are candidate stem cells of ependymoma. Cancer Cell 8 (4): 323-35, 2005.[PUBMED Abstract]
- Andreiuolo F, Puget S, Peyre M, et al.: Neuronal differentiation distinguishes supratentorial and infratentorial childhood ependymomas. Neuro Oncol 12 (11): 1126-34, 2010.[PUBMED Abstract]
- Grill J, Bergthold G, Ferreira C: Pediatric ependymomas: will molecular biology change patient management? Curr Opin Oncol 23 (6): 638-42, 2011.[PUBMED Abstract]
- Mack SC, Pajtler KW, Chavez L, et al.: Therapeutic targeting of ependymoma as informed by oncogenic enhancer profiling. Nature 553 (7686): 101-105, 2018.[PUBMED Abstract]
- Mack SC, Witt H, Piro RM, et al.: Epigenomic alterations define lethal CIMP-positive ependymomas of infancy. Nature 506 (7489): 445-50, 2014.[PUBMED Abstract]
- Pajtler KW, Witt H, Sill M, et al.: Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell 27 (5): 728-43, 2015.[PUBMED Abstract]
- Johnson RA, Wright KD, Poppleton H, et al.: Cross-species genomics matches driver mutations and cell compartments to model ependymoma. Nature 466 (7306): 632-6, 2010.[PUBMED Abstract]
-
上衣下腫(WHO分類の悪性度I):上衣下腫は増殖速度が緩徐な新生物であり、典型的には脳室壁に付着する。上衣下腫は線維性基質に埋没したグリア系腫瘍細胞集塊で構成されている。
- 小児上衣腫の病期情報
-
公式の病期分類システムはないが、上衣腫はテント上腫瘍、テント下腫瘍、および脊髄腫瘍に分けられる。小児上衣腫の約20%が脊椎に発生し、80%が脳(テント上領域で30%およびテント下領域で70%)に発生する。[ 1 ]
上衣腫は通常、脳室の上衣被膜または脊髄の中心管あるいは終室を起源とし、脳脊髄液に接している。そのため、これらの腫瘍は脳脊髄軸全体に拡がっている可能性があるが、播種が報告されるのは悪性度IIおよび悪性度IIIの上衣腫を有する患者の10%未満である。後頭蓋窩およびテント上上衣腫では播種性腫瘍がまれであることを考慮すると、脳脊髄軸の画像検査を術前に実施することがきわめて重要である;脊髄の画像検査を放射線療法開始前に繰り返して、(術後の血液/血管のうっ血とは違った)転移病変が存在しないか再評価すべきである。
粘液乳頭状上衣腫は疾患の経過の初期に神経系に播種する可能性があり[ 2 ][ 3 ]、脳の画像検査が推奨される。
参考文献- Villano JL, Parker CK, Dolecek TA: Descriptive epidemiology of ependymal tumours in the United States. Br J Cancer 108 (11): 2367-71, 2013.[PUBMED Abstract]
- Fassett DR, Pingree J, Kestle JR: The high incidence of tumor dissemination in myxopapillary ependymoma in pediatric patients. Report of five cases and review of the literature. J Neurosurg 102 (1 Suppl): 59-64, 2005.[PUBMED Abstract]
- Bandopadhayay P, Silvera VM, Ciarlini PDSC, et al.: Myxopapillary ependymomas in children: imaging, treatment and outcomes. J Neurooncol 126 (1): 165-174, 2016.[PUBMED Abstract]
- 小児上衣腫に関する治療法選択肢の概要
-
最も実用的で許容できる従来の治療法をさらに向上させるために、種々の臨床試験が実施され、その結果として、小児がん患者における生存率が幾度も改善されてきた。小児科での臨床試験は、新たな治療法と現在標準とされている治療法とを比較するようデザインされる。こうした比較は、二群ランダム化試験か、新たな単一治療法の成績を評価しその結果を従来の治療法で得られた以前の結果と比較することによって行われる。
小児のがんは比較的まれであるため、侵攻性脳腫瘍の患児はすべて臨床試験に組み入れることが検討されるべきである。至適治療法を決定しこれを実施するために、治療計画は小児脳腫瘍の治療経験があるがん専門医の集学的なチームが行う必要がある。小児脳腫瘍に対する放射線療法には、高度な技術が必要とされ、至適結果を確実に得るためにはその領域での経験を積んでいる施設で行うべきである。
小児上衣腫の治療は手術から開始する。2度目の手術、化学療法、または放射線療法など、補助療法の種類は以下の因子により異なる。
- 上衣腫の亜型。
- 腫瘍の位置。
- 初回手術時に腫瘍が完全に摘出されたかどうか。
- 腫瘍が中枢神経系の全域に播種しているかどうか。
- 患児の年齢。
表1では、新たに診断されたおよび再発小児上衣腫に対する標準治療法の選択肢が記述されている。
表1.小児上衣腫に対する標準治療法の選択肢 治療群 標準治療法の選択肢 新たに診断された小児粘液乳頭状上衣腫(WHO分類の悪性度I) 手術と場合により補助放射線療法 新たに診断された小児上衣腫(WHO分類の悪性度II)、退形成性上衣腫(WHO分類の悪性度III)、またはRELA融合陽性上衣腫: 手術 補助療法: 残存腫瘍も播種性腫瘍も認められない場合 —放射線療法 残存腫瘍があり、播種性腫瘍が認められない場合 —セカンドルック手術 —放射線療法 —照射前化学療法 中枢神経系に播種性腫瘍が認められる場合 —放射線療法(標準治療法とは考えられていない) —化学療法(標準治療法とは考えられていない) 1歳未満の小児の場合 —化学療法 —遅延放射線療法 再発小児上衣腫 手術 放射線療法および/または化学療法 小児および青年のがん患者の生存において、劇的な改善が達成されている。1975年から2010年の間に、小児がんの死亡率は50%以上低下している。[ 1 ]小児および青年がん生存者には、治療から数ヵ月または数年経過後もがん療法の副作用が持続または発現することがあるため、綿密なモニタリングが必要である。(小児および青年のがん生存者における晩期合併症(晩期障害)の発生率、種類、およびモニタリングに関する具体的な情報については、小児がん治療の晩期合併症(晩期障害)のPDQ要約を参照のこと。)
参考文献- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- 小児粘液乳頭状上衣腫の治療
-
上衣腫の良性の組織学的亜型と考えられている粘液乳頭状上衣腫でも、診断時および経過観察時の中枢神経系への腫瘍の播種率は比較的高い。診断時および経過観察中の全脳脊髄軸の画像検査が適応とされる。[ 1 ][ 2 ]
新たに診断された小児粘液乳頭状上衣腫(世界保健機関[WHO]分類の悪性度I)に対する標準治療法の選択肢には以下のものがある:
- 手術と場合により補助放射線療法。
歴史的に、粘液乳頭状上衣腫(WHO分類の悪性度I)の管理は腫瘍の一塊切除を試み、肉眼的全切除が行われた症例にはさらなる治療は行われてこなかった。[ 3 ];[ 4 ][証拠レベル:3iiiDi]しかしながら、これらの腫瘍が、特に完全切除が得られなかった場合に脳脊髄軸の他の部位に播種しうるという知見、および局所放射線療法により無増悪生存が改善しうるという証拠に基づき、多くの開業医が現在では、原発腫瘤の外科的切除後の放射線療法の使用を支持している。[ 1 ][ 3 ];[ 5 ][証拠レベル:3iiiDi];[ 6 ][ 7 ][証拠レベル:3iiiDiii]
参考文献- Fassett DR, Pingree J, Kestle JR: The high incidence of tumor dissemination in myxopapillary ependymoma in pediatric patients. Report of five cases and review of the literature. J Neurosurg 102 (1 Suppl): 59-64, 2005.[PUBMED Abstract]
- Bagley CA, Kothbauer KF, Wilson S, et al.: Resection of myxopapillary ependymomas in children. J Neurosurg 106 (4 Suppl): 261-7, 2007.[PUBMED Abstract]
- Akyurek S, Chang EL, Yu TK, et al.: Spinal myxopapillary ependymoma outcomes in patients treated with surgery and radiotherapy at M.D. Anderson Cancer Center. J Neurooncol 80 (2): 177-83, 2006.[PUBMED Abstract]
- Bagley CA, Wilson S, Kothbauer KF, et al.: Long term outcomes following surgical resection of myxopapillary ependymomas. Neurosurg Rev 32 (3): 321-34; discussion 334, 2009.[PUBMED Abstract]
- Pica A, Miller R, Villà S, et al.: The results of surgery, with or without radiotherapy, for primary spinal myxopapillary ependymoma: a retrospective study from the rare cancer network. Int J Radiat Oncol Biol Phys 74 (4): 1114-20, 2009.[PUBMED Abstract]
- Agbahiwe HC, Wharam M, Batra S, et al.: Management of pediatric myxopapillary ependymoma: the role of adjuvant radiation. Int J Radiat Oncol Biol Phys 85 (2): 421-7, 2013.[PUBMED Abstract]
- Jeibmann A, Egensperger R, Kuchelmeister K, et al.: Extent of surgical resection but not myxopapillary versus classical histopathological subtype affects prognosis in lumbo-sacral ependymomas. Histopathology 54 (2): 260-2, 2009.[PUBMED Abstract]
- 小児上衣腫、退形成性上衣腫、またはRELA融合陽性上衣腫の治療
-
新たに診断された小児上衣腫(世界保健機関[WHO]分類の悪性度II)、退形成性上衣腫(WHO分類の悪性度III)、またはRELA融合陽性上衣腫(WHO分類の悪性度IIまたは悪性度III)に対する標準治療法の選択肢には以下のものがある:
通常は、すべての患者が腫瘍の摘出手術を受ける。それに追加して治療が行われるかどうかは、腫瘍切除の程度と播種性腫瘍の有無によって異なる。
手術
手術を実施して最大限の腫瘍の切除を試みる。切除の程度が増すと生存率が改善することを示唆する証拠がある。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ];[ 6 ][ 7 ][証拠レベル:3iDii]手術後には、切除の程度を確認するために磁気共鳴画像法(MRI)を実施する。手術前にMRIを実施していない場合には、腫瘍の播種と脳脊髄液の細胞病理について評価するために脳脊髄軸全体のMRIを行う。
残存腫瘍または播種性腫瘍のあるすべての分子的亜型の患者は再燃リスクが高いと考えるべきであり、そのような患者のために特別にデザインされた臨床試験に基づいて治療できる。残存腫瘍の証拠がない患者も、術後放射線療法の実施にもかかわらず、再燃リスクは依然として約20~40%ある。[ 8 ][証拠レベル:2Di]
逸話的経験は、完全に切除されたテント上の退形成性以外の腫瘍、および硬膜内脊髄上衣腫(intradural spinal cord ependymomas)については手術単独が、症例を選択した場合に適切な治療アプローチとなりうることを示唆している。[ 9 ][ 10 ][証拠レベル:3iiiDi];[ 11 ][ 12 ][ 13 ][証拠レベル:3iiiDiii]
証拠(手術):
- 新たに頭蓋内上衣腫と診断された患者(N = 356)に関するプロスペクティブ多施設共同研究グループ試験(小児腫瘍学グループ[COG]ACNS0121 [NCT00027846])で、テント上、非退形成性、肉眼的完全切除の上衣腫(n = 11)の治療に手術単独が使用された。[
8
][証拠レベル:2Diおよび2A]
- 5年イベントフリー生存(EFS)率は61.4%で全生存(OS)率は100%であった。
- 4人の患者(36%)で局所制御失敗が発生し、局所および遠隔における制御失敗が1人の患者(9%)で発生した。
- この研究において、手術単独アプローチに適格な患者の数は非常に少数であった;追加の治療の回避に成功したのは、これらの患者のサブセットのみであった。
後頭蓋窩上衣腫患者の転帰についてのレトロスペクティブ解析から、これらの患者は肉眼的完全切除単独により十分な治療を行える可能性が示唆されているが[ 7 ]、このアプローチはプロスペクティブ・ランダム化臨床試験で検証されていない。
補助療法
残存腫瘍も播種性腫瘍も認められない場合の治療
放射線療法
これらの患者に対する標準の術後治療は、3歳以上の小児の腫瘍床に対する54Gy~59.4Gyの放射線療法となっている。[ 5 ][ 14 ]ACNS0121(NCT00027846)研究では、放射線療法(54Gy)の使用を1歳という若さの患者に拡大した結果、3歳以上の小児と比較して同等のEFS率およびOS率が得られた。[ 8 ][証拠レベル:2Di]これらの腫瘍は通常は、初期に局所に再発するため、CNS全体(全脳および全脊髄)に照射する必要はないが、後頭蓋窩上衣腫、特に1qの増加が認められる腫瘍では、再発時に播種することがある。[ 15 ];[ 16 ][証拠レベル:3iiiA]
可能であれば、患者は脳腫瘍の小児患者に対する高度な原体照射療法(強度変調放射線療法または荷電粒子線療法[例、陽子線治療]を含む)の実施経験がある施設で治療されるべきである。
証拠(放射線療法):
- 1件の単一施設研究で、1~21歳の患者74人が手術直後に原体照射療法による治療を受けた。[
17
]
- 3年無増悪生存(PFS)率は77.6%(±5.8%)であった。
- 上述のシリーズの拡大で、153人の患者のうち107人が先行する切除の直後に原体照射法を受けた。[
5
][証拠レベル:3iA]
- 7年EFS率は76.9%(±13.5%)であった。
- COGのプロスペクティブ研究(ACNS0121[NCT00027846])には、上衣腫を新たに診断された1~21歳の患者356人が登録され、4つの層に分類された。[
8
][証拠レベル:2Di]
- 1層:分化型の組織像を示すテント上上衣腫を完全切除され、放射線療法なしで治療された患者。
- 5年PFS率は61.4%(95%信頼区間[CI]、34.5%-89.6%)で、7年経過時に死亡は認められなかったが、この層に登録された患者は11人のみであった。
- 2層:上衣腫(テント上とテント下の両方)を亜全切除され、残存病変の大きさが5mmを超える患者。治療は2サイクルの化学療法とその後のセカンドルック手術および腫瘍床に対する原体照射法(標的となる臨床的容積に1cm追加)で構成された。放射線量は、生後12~18ヵ月の患者に対して54Gyおよび生後18ヵ月を超える患者に対して59.4Gyであった。
- 5年PFS率は、セカンドルック手術が実施不可能であった患者で25%、およびセカンドルック手術で肉眼的完全切除が得られた患者で50%であった。
- 3層および4層:ほぼ完全な切除が得られた患者(3層)および肉眼的完全切除が得られた患者(4層)。生後12~18ヵ月の患者は54Gyの術後放射線療法を受け、生後18ヵ月を超える患者は59.4Gyの線量(標的となる臨床的容積に1cm追加)を受けた。
- 5年PFS率は68.5%(範囲、62.8~74.2%)であった。
- 後頭蓋窩A上衣腫(PF-EPN-A)、均衡が取れた1q(1qの増加が認められない):5年PFS率は81.5%(範囲、71.5~91.5%)であった。
- PF-EPN-A、1qの増加:5年PFS率は35.7%(範囲、12.8~58.6%)であった。
- PF-EPN-Aの患者について、1qの増加が認められる患者では、均衡が取れた1q(1qの増加が認められない)の患者よりも遠隔での制御失敗が一般的にみられた。
- テント上上衣腫:C11orf95-RELA融合について検証されたテント上上衣腫患者39人中30人が陽性で、このうち23人が3層および4層であった。生存における有意差は認められなかった;5年OS率は80%を超えた。
- 1層:分化型の組織像を示すテント上上衣腫を完全切除され、放射線療法なしで治療された患者。
- 陽子線治療(荷電粒子線療法の一種)は、脳および神経内分泌の重大な正常組織を回避しながら、(テント上またはテント下の)腫瘍を標的にするための潜在的な長所を備えている。
非常に幼い小児(3歳未満)における後頭蓋窩に対する陽子線治療後の脳幹毒性についての懸念から、一部の施設ではこれらの小児においてより保存的な線量の使用が増えている。[ 18 ][ 20 ][ 21 ]
化学療法
骨髄除去的化学療法[ 22 ]の使用を含めた補助化学療法が非播種性上衣腫を全摘した患者の治療成績を改善するという証拠はない。そのため、現在行われている治療アプローチは、新たに診断され完全に切除される上衣腫を有する小児に対する初回治療の標準的な構成要素として化学療法を含まない。
残存腫瘍があり、播種性腫瘍が認められない場合の治療
セカンドルック手術
全摘とその後照射を受けた患者の方が腫瘍コントロールが良好であるため、セカンドルック手術が検討されるべきである。[ 23 ]症例によっては、小児脳外科医が別の手術法によって腫瘍の肉眼的全切除が達成できると判断した場合に、初回の切除試行後にさらなる手術が実施されることがある。また、それ以上の先行手術を実施しても肉眼的全切除が得られないと予測されている;そのため、将来のセカンドルック手術を想定に入れて補助療法が開始される場合もある。[ 8 ]
放射線療法
上記の残存腫瘍も播種性腫瘍も認められない場合の治療サブセクションで述べた放射線療法の根拠は、播種性ではない残存腫瘍が認められる上衣腫小児の治療にも関係する。亜全摘患者においては、放射線療法を用いた治療により、25%の5年PFS率が得られ、PF-EPN-A患者では特に転帰不良であるが[ 8 ]、脊柱管内に残存腫瘍を認める患者の治療成績がより良好となる場合がある。[ 24 ]
照射前化学療法
残存腫瘍が認められる患者において化学療法を使用する根拠は、化学療法単独に対して完全奏効(CR)を達成するか、または化学療法後のセカンドルック手術時に肉眼的完全切除の可能性を促進することで、患者が放射線療法を受ける前に病変の証拠がない状態を達成しようと試みるためである。先行手術後の残存腫瘍に対する化学療法の有益性は依然として研究されている。
証拠(手術を併用するまたは併用しない照射前化学療法):
- 1件の研究で、ほぼ完全な(90%超の)切除を受けた小児における照射前化学療法の有益性が示され、肉眼的完全切除が達成された後に放射線療法を受けた小児の治療成績と同等の治療成績が認められた。[ 25 ]
- COGのACNS0121(NCT00027846)試験では、先行手術後に残存病変が認められた小児(n = 64)に対して2サイクルの照射前化学療法が実施された。[
8
][証拠レベル:2Di]
- セカンドルック手術は39%の患者(n = 25)で実施された(肉眼的完全切除、56%;ほぼ完全な切除、20%;亜全摘、24%)。
- セカンドルック手術を受けた患者に対する5年EFS率が50.5%であったのに対し、セカンドルック手術を受けなかった患者に対するEFS率は28.5%であった。
- 3歳未満の小児に対する1件の多施設試験では、照射前化学療法に続いて、その小児が生後12ヵ月以上になったら原体照射法、さらにその後の維持化学療法が用いられた。[
26
][証拠レベル:2Diii]
- 54人の患者が登録され、患者の54%(n = 29)が診断時に肉眼的完全切除を受けた。
- 残りの25人の患者のうち、60%(n = 15)が化学療法後にセカンドルック手術を受け、80%の患者が肉眼的完全切除を達成した。
- 放射線療法時に、76%の患者が肉眼的完全切除を受け、13%の患者がほぼ完全な切除を受け、および11%の患者が亜全摘を受けた。
- PFS(ただしOSではない)は、亜全摘を受けた患者と比較して放射線療法前に肉眼的完全切除またはほぼ完全な切除を受けた患者で良好であった(4年PFS率、肉眼的完全切除/ほぼ完全な切除に対する79% vs 亜全摘に対する41.7%)。
CNSに腫瘍が播種している場合の治療
放射線療法
腫瘍切除の程度に関係なく、これらの患者には一般的に、全脳および全脊髄に対する放射線療法と、局所病変および播種性腫瘤病変へのブースト照射を実施する。こうした患者における術後の局所照射の従来量は54Gy~55.8Gyである。また、脳脊髄軸全体(すなわち、全脳および全脊髄)にも約36Gyの照射が行われるが、患者の年齢によっては照射量を調節する場合がある。[ 29 ]脊髄の腫瘍塊へは41.4Gy~50.4Gyのブースト照射が実施されるが、線量は患者の年齢および腫瘍の位置による。しかしながら、このアプローチを支持する最近の研究発表は存在しない。
化学療法
ある程度の化学療法感受性がみられるため、化学療法がしばしば使用されるが、EFSおよびOSの改善を実証する証拠は欠けている。[ 30 ]
1歳未満の小児に対する治療
化学療法
すべてではないが一部の化学療法は、新たに上衣腫と診断された3歳未満の小児に客観的奏効をもたらす。[ 31 ][ 32 ][ 33 ][ 34 ]化学療法の目標は、放射線療法を回避する、小児の年齢が高くなるまで放射線を延期する、または(化学療法に対するCR、あるいは化学療法後のセカンドルック手術時の肉眼的完全切除により)放射線療法を実施する前に病変の証拠がない状態を達成することである。上衣腫を全摘した乳児および幼児の最大25%が長期生存を達成する。これらの研究は分子的特徴が明らかにされておらず、どの患者が化学療法単独レジメンで利益が得られるかは不明である。化学療法単独プロトコルの生存者は最終的に救助放射線療法を受ける可能性がある。[ 35 ];[ 36 ][証拠レベル:2Di]
遅延放射線療法
歴史的に、上衣腫の3歳未満の小児に対しては術後放射線療法が省略されていた。2件のCOG研究(POG-9233とACNS0121[NCT00027846])および多くのその後の試験は、このように比較的幼い小児の転帰を改善するために、術後放射線療法の年齢制限を1歳に下げている。ACNS0121試験は、腫瘍を完全切除された小児における原体照射法により、化学療法単独を受けた患者と比較して治療成績の有意な改善が得られたことを示している。[ 8 ][証拠レベル:2Di]
放射線温存アプローチによってどの患者に利益があるかは不明である;しかしながら、POG-9233試験の結果とACNS0121(NCT00027846)試験の結果を比較すると、放射線療法で治療された患者に対して生存における50~60%の改善が示唆されている。[ 8 ][ 35 ]分子マーカーをプロスペクティブに評価すると、放射線温存アプローチで安全に治療できる乳児および/または化学療法から利益が得られる患者を同定しうる。
証拠(放射線療法):
- Surveillance, Epidemiology, and End Results Programの診断時に3歳未満の患児のデータに基づくレトロスペクティブ・レビューは50年という期間を対象としたものであった。[
37
]
- 局所放射線療法を受けた患者の方が、切除範囲および腫瘍の悪性度(WHO分類の悪性度II vs 悪性度III)による調整後でも、10年生存率が良好であったことが結果で示された。
- 大規模なレトロスペクティブ研究により、分子的に特徴づけられた後頭蓋窩上衣腫820例で、完全切除および上衣腫の後頭蓋窩Bサブグループと併せて、第一選択補助放射線療法に伴って予後が改善することが実証された。PF-EPN-A腫瘍の小児では、放射線療法温存アプローチに伴い転帰が不良であった。[ 7 ]
- 原体照射法または荷電粒子線(例、陽子線)療法は上衣腫の幼児における放射線誘発性の神経損傷を最小限に抑えるための代替アプローチである。化学療法が奏効し残存腫瘍がない小児では、放射線療法の必要性およびその時期は依然として確定されていない。
- COGのACNS0121(NCT00027846)研究により、肉眼的完全切除またはほぼ完全な切除とその後の即時術後放射線療法を受けた1~3歳未満の小児で以下の結果が得られたことが明らかにされたことが示された:[
8
][証拠レベル:2Diおよび証拠レベル:2A]
- 5年EFS率は62.9%およびOSは87.4%であった。
- これらの結果は、5年EFS率が70.5%でOS率が85.8%であった3~21歳の患者で示された結果と統計的に差がなかった。
- 上衣腫を新たに診断され4~6サイクルの化学療法とその後の放射線療法(いったん生後12ヵ月に到達したのち)を受けた3歳未満の小児(n = 54)を対象にした多施設試験で、以下の結果が得られた:[
26
][証拠レベル:2Diiiおよび証拠レベル:2A]
- 4年PFS率は75.1%で、OS率は92.6%であった。
- これらの結果は、3歳を超える小児を治療した研究で示された結果と同等であった。
- 興味深いことに、診断時年齢が1歳未満の乳児と1~3歳の小児間で治療成績における差は認められなかった。
正常な脳組織への損傷を最小限に抑える三次元原体照射療法などの原体照射法や、陽子線治療などの荷電粒子線療法は、上衣腫の乳児と小児を対象に評価段階にある。[ 17 ][ 40 ]上衣腫の幼児の治療後に神経学的結果を分析する場合、治療開始前に欠損が幼児に存在していることがあるため、長期欠損のすべてを放射線療法に帰することはできないという点を考慮することが重要である。[ 17 ]例えば、診断時の水頭症の存在は、外科的切除後および放射線療法の実施前に測定される知能指数の低下と関連がある。[ 41 ]
小児上衣腫または退形成性上衣腫に対する臨床評価段階にある治療法の選択肢
選択された患者では、初期相の臨床試験が利用できる場合がある。これらの試験は、COG、Pediatric Brain Tumor Consortium、または他の団体を通して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- van Veelen-Vincent ML, Pierre-Kahn A, Kalifa C, et al.: Ependymoma in childhood: prognostic factors, extent of surgery, and adjuvant therapy. J Neurosurg 97 (4): 827-35, 2002.[PUBMED Abstract]
- Abdel-Wahab M, Etuk B, Palermo J, et al.: Spinal cord gliomas: A multi-institutional retrospective analysis. Int J Radiat Oncol Biol Phys 64 (4): 1060-71, 2006.[PUBMED Abstract]
- Kothbauer KF: Neurosurgical management of intramedullary spinal cord tumors in children. Pediatr Neurosurg 43 (3): 222-35, 2007.[PUBMED Abstract]
- Zacharoulis S, Ji L, Pollack IF, et al.: Metastatic ependymoma: a multi-institutional retrospective analysis of prognostic factors. Pediatr Blood Cancer 50 (2): 231-5, 2008.[PUBMED Abstract]
- Merchant TE, Li C, Xiong X, et al.: Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol 10 (3): 258-66, 2009.[PUBMED Abstract]
- Cage TA, Clark AJ, Aranda D, et al.: A systematic review of treatment outcomes in pediatric patients with intracranial ependymomas. J Neurosurg Pediatr 11 (6): 673-81, 2013.[PUBMED Abstract]
- Ramaswamy V, Hielscher T, Mack SC, et al.: Therapeutic Impact of Cytoreductive Surgery and Irradiation of Posterior Fossa Ependymoma in the Molecular Era: A Retrospective Multicohort Analysis. J Clin Oncol 34 (21): 2468-77, 2016.[PUBMED Abstract]
- Merchant TE, Bendel AE, Sabin ND, et al.: Conformal Radiation Therapy for Pediatric Ependymoma, Chemotherapy for Incompletely Resected Ependymoma, and Observation for Completely Resected, Supratentorial Ependymoma. J Clin Oncol 37 (12): 974-983, 2019.[PUBMED Abstract]
- Volpp PB, Han K, Kagan AR, et al.: Outcomes in treatment for intradural spinal cord ependymomas. Int J Radiat Oncol Biol Phys 69 (4): 1199-204, 2007.[PUBMED Abstract]
- Hukin J, Epstein F, Lefton D, et al.: Treatment of intracranial ependymoma by surgery alone. Pediatr Neurosurg 29 (1): 40-5, 1998.[PUBMED Abstract]
- Little AS, Sheean T, Manoharan R, et al.: The management of completely resected childhood intracranial ependymoma: the argument for observation only. Childs Nerv Syst 25 (3): 281-4, 2009.[PUBMED Abstract]
- Venkatramani R, Dhall G, Patel M, et al.: Supratentorial ependymoma in children: to observe or to treat following gross total resection? Pediatr Blood Cancer 58 (3): 380-3, 2012.[PUBMED Abstract]
- Ghia AJ, Mahajan A, Allen PK, et al.: Supratentorial gross-totally resected non-anaplastic ependymoma: population based patterns of care and outcomes analysis. J Neurooncol 115 (3): 513-20, 2013.[PUBMED Abstract]
- Koshy M, Rich S, Merchant TE, et al.: Post-operative radiation improves survival in children younger than 3 years with intracranial ependymoma. J Neurooncol 105 (3): 583-90, 2011.[PUBMED Abstract]
- Combs SE, Kelter V, Welzel T, et al.: Influence of radiotherapy treatment concept on the outcome of patients with localized ependymomas. Int J Radiat Oncol Biol Phys 71 (4): 972-8, 2008.[PUBMED Abstract]
- Schroeder TM, Chintagumpala M, Okcu MF, et al.: Intensity-modulated radiation therapy in childhood ependymoma. Int J Radiat Oncol Biol Phys 71 (4): 987-93, 2008.[PUBMED Abstract]
- Merchant TE, Mulhern RK, Krasin MJ, et al.: Preliminary results from a phase II trial of conformal radiation therapy and evaluation of radiation-related CNS effects for pediatric patients with localized ependymoma. J Clin Oncol 22 (15): 3156-62, 2004.[PUBMED Abstract]
- Indelicato DJ, Bradley JA, Rotondo RL, et al.: Outcomes following proton therapy for pediatric ependymoma. Acta Oncol 57 (5): 644-648, 2018.[PUBMED Abstract]
- Macdonald SM, Sethi R, Lavally B, et al.: Proton radiotherapy for pediatric central nervous system ependymoma: clinical outcomes for 70 patients. Neuro Oncol 15 (11): 1552-9, 2013.[PUBMED Abstract]
- Sato M, Gunther JR, Mahajan A, et al.: Progression-free survival of children with localized ependymoma treated with intensity-modulated radiation therapy or proton-beam radiation therapy. Cancer 123 (13): 2570-2578, 2017.[PUBMED Abstract]
- Indelicato DJ, Flampouri S, Rotondo RL, et al.: Incidence and dosimetric parameters of pediatric brainstem toxicity following proton therapy. Acta Oncol 53 (10): 1298-304, 2014.[PUBMED Abstract]
- Zacharoulis S, Levy A, Chi SN, et al.: Outcome for young children newly diagnosed with ependymoma, treated with intensive induction chemotherapy followed by myeloablative chemotherapy and autologous stem cell rescue. Pediatr Blood Cancer 49 (1): 34-40, 2007.[PUBMED Abstract]
- Massimino M, Solero CL, Garrè ML, et al.: Second-look surgery for ependymoma: the Italian experience. J Neurosurg Pediatr 8 (3): 246-50, 2011.[PUBMED Abstract]
- Wahab SH, Simpson JR, Michalski JM, et al.: Long term outcome with post-operative radiation therapy for spinal canal ependymoma. J Neurooncol 83 (1): 85-9, 2007.[PUBMED Abstract]
- Garvin JH, Selch MT, Holmes E, et al.: Phase II study of pre-irradiation chemotherapy for childhood intracranial ependymoma. Children's Cancer Group protocol 9942: a report from the Children's Oncology Group. Pediatr Blood Cancer 59 (7): 1183-9, 2012.[PUBMED Abstract]
- Upadhyaya SA, Robinson GW, Onar-Thomas A, et al.: Molecular grouping and outcomes of young children with newly diagnosed ependymoma treated on the multi-institutional SJYC07 trial. Neuro Oncol 21 (10): 1319-1330, 2019.[PUBMED Abstract]
- Grill J, Kalifa C, Doz F, et al.: A high-dose busulfan-thiotepa combination followed by autologous bone marrow transplantation in childhood recurrent ependymoma. A phase-II study. Pediatr Neurosurg 25 (1): 7-12, 1996.[PUBMED Abstract]
- Venkatramani R, Ji L, Lasky J, et al.: Outcome of infants and young children with newly diagnosed ependymoma treated on the "Head Start" III prospective clinical trial. J Neurooncol 113 (2): 285-91, 2013.[PUBMED Abstract]
- Merchant TE, Boop FA, Kun LE, et al.: A retrospective study of surgery and reirradiation for recurrent ependymoma. Int J Radiat Oncol Biol Phys 71 (1): 87-97, 2008.[PUBMED Abstract]
- Bouffet E, Capra M, Bartels U: Salvage chemotherapy for metastatic and recurrent ependymoma of childhood. Childs Nerv Syst 25 (10): 1293-301, 2009.[PUBMED Abstract]
- Duffner PK, Horowitz ME, Krischer JP, et al.: The treatment of malignant brain tumors in infants and very young children: an update of the Pediatric Oncology Group experience. Neuro-oncol 1 (2): 152-61, 1999.[PUBMED Abstract]
- Duffner PK, Horowitz ME, Krischer JP, et al.: Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumors. N Engl J Med 328 (24): 1725-31, 1993.[PUBMED Abstract]
- Geyer JR, Sposto R, Jennings M, et al.: Multiagent chemotherapy and deferred radiotherapy in infants with malignant brain tumors: a report from the Children's Cancer Group. J Clin Oncol 23 (30): 7621-31, 2005.[PUBMED Abstract]
- Grill J, Le Deley MC, Gambarelli D, et al.: Postoperative chemotherapy without irradiation for ependymoma in children under 5 years of age: a multicenter trial of the French Society of Pediatric Oncology. J Clin Oncol 19 (5): 1288-96, 2001.[PUBMED Abstract]
- Strother DR, Lafay-Cousin L, Boyett JM, et al.: Benefit from prolonged dose-intensive chemotherapy for infants with malignant brain tumors is restricted to patients with ependymoma: a report of the Pediatric Oncology Group randomized controlled trial 9233/34. Neuro Oncol 16 (3): 457-65, 2014.[PUBMED Abstract]
- Grundy RG, Wilne SA, Weston CL, et al.: Primary postoperative chemotherapy without radiotherapy for intracranial ependymoma in children: the UKCCSG/SIOP prospective study. Lancet Oncol 8 (8): 696-705, 2007.[PUBMED Abstract]
- Snider CA, Yang K, Mack SC, et al.: Impact of radiation therapy and extent of resection for ependymoma in young children: A population-based study. Pediatr Blood Cancer 65 (3): , 2018.[PUBMED Abstract]
- Zapotocky M, Beera K, Adamski J, et al.: Survival and functional outcomes of molecularly defined childhood posterior fossa ependymoma: Cure at a cost. Cancer 125 (11): 1867-1876, 2019.[PUBMED Abstract]
- von Hoff K, Kieffer V, Habrand JL, et al.: Impairment of intellectual functions after surgery and posterior fossa irradiation in children with ependymoma is related to age and neurologic complications. BMC Cancer 8: 15, 2008.[PUBMED Abstract]
- MacDonald SM, Safai S, Trofimov A, et al.: Proton radiotherapy for childhood ependymoma: initial clinical outcomes and dose comparisons. Int J Radiat Oncol Biol Phys 71 (4): 979-86, 2008.[PUBMED Abstract]
- Merchant TE, Lee H, Zhu J, et al.: The effects of hydrocephalus on intelligence quotient in children with localized infratentorial ependymoma before and after focal radiation therapy. J Neurosurg 101 (2 Suppl): 159-68, 2004.[PUBMED Abstract]
- 新たに頭蓋内上衣腫と診断された患者(N = 356)に関するプロスペクティブ多施設共同研究グループ試験(小児腫瘍学グループ[COG]ACNS0121 [NCT00027846])で、テント上、非退形成性、肉眼的完全切除の上衣腫(n = 11)の治療に手術単独が使用された。[
8
][証拠レベル:2Diおよび2A]
- 再発小児上衣腫の治療
-
上衣腫は悪性度にかかわらず再発が珍しくなく、初期治療から何年も経過してから再発することがある。[ 1 ]10~15年以上経過してからの晩期再発が報告されている。[ 2 ]腫瘍は一般に原発部位に再発するが、同時に脳脊髄軸播種が認められる場合もある。全身に再燃をみることは、きわめてまれである。
再燃時にはすべての患者に、再発腫瘍範囲の十分な評価が適応とされる。
再発小児上衣腫に対する治療法の選択肢には以下のものがある:
手術
さらなる手術介入の有用性は、腫瘍の範囲および位置に基づいて個別に判断する。
症例によっては、手術可能な病変に対し、代わりに放射線療法を実施することもある。
放射線療法および/または化学療法
再発上衣腫患者には、以下の方法を用いた治療を検討すべきである:[ 3 ][証拠レベル:3iiiB]
-
定位放射線手術[
4
][
5
][証拠レベル:3iiiA];[
6
][
7
][証拠レベル:3iiiDi]、強度変調光子線治療、陽子線治療[
8
];[
9
][証拠レベル:3iiiB]など、さまざまな放射線の治療法による局所再治療。
局所および遠隔(脊髄)の両再発に対して、頭蓋脊髄照射を考慮すべきである。St. Jude Children's Research Hospitalで放射線再照射患者101人を対象に実施された研究では、全生存(OS)期間および無増悪期間の中央値がそれぞれ75.1ヵ月および27.3ヵ月であったことが示された。1年、2年、および5年OS率の推定値は、それぞれ95.5%、74.9%、および57.3%であった。[ 8 ][証拠レベル:3iiiDiii]
- 局所制御失敗で局所への放射線再照射を受けた患者46人のうち、局所制御失敗が13人、遠隔のみの制御失敗が11人であった。
- 局所制御失敗で頭蓋脊髄への放射線再照射を受けた患者10人のうち、局所制御失敗が6人で、遠隔のみの制御失敗はみられなかった。
- 遠隔のみの制御失敗で頭蓋脊髄への放射線再照射による治療を行った場合は、局所制御失敗で局所への放射線再照射による治療を受けた個人と比較して、OS改善と独立した関連性が認められた(ハザード比[HR]、0.37;95%信頼区間[CI]、0.16-0.87)。
- 放射線療法を繰り返した後のグレード3を超える放射線壊死の10年累積発生率は7.9%であった。
- 最初の放射線療法後の遠隔制御失敗(局所制御失敗ではない)の患者で、染色体1q増幅は、より不良なOS(HR、3.5;95%CI、1.1-10.6)との有害な関連がみられた。OSおよび無増悪期間の短縮と関連する他の変数としては、男性であること、再発時の退形成の組織型、および初回放射線療法から再発までの期間が短いことが挙げられる。
再発に対する3コースおよびさらに4コースの放射線療法により、生存期間が延長可能で、毒性は許容範囲である。[ 8 ][証拠レベル:3iiiDiii]
- 活性を示す抗がん剤には、シクロホスファミド、シスプラチン、カルボプラチン、ロムスチン、およびエトポシドがあり、再発の設定で使用されている。比較的古い単剤研究では、これらの薬剤を用いて化学療法感受性が実証されているが、奏効の持続はまれである。[ 10 ][ 11 ]
治療戦略に関係なく、再発した患者の予後は不良である。[ 1 ]新たな治療アプローチの臨床試験への参加を検討すべきである。
臨床評価段階にある再発小児上衣腫の治療法の選択肢
選択された患者では、初期相の臨床試験が利用できる場合がある。これらの試験は、小児腫瘍学グループ(COG)、Pediatric Brain Tumor Consortium、または他の団体を通して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は現在実施中の全米および/または施設の臨床試験の例である:
-
APEC1621(NCT03155620)(Pediatric MATCH試験:再発または難治性進行固形腫瘍、非ホジキンリンパ腫、または組織球性疾患を有する小児患者の治療において遺伝子検査の結果に基づいて行う分子標的療法):NCI-COG Pediatric Molecular Analysis for Therapeutic Choice(MATCH、Pediatric MATCH試験と呼ばれる)では、難治性および再発固形腫瘍における160以上の遺伝子の4,000以上の変異を標的として次世代シークエンシングで同定された特異的な分子遺伝学的変化と標的薬物が照合される。1~21歳の小児および青年が試験に適格である。
分子生物学的な検討のために、進行または再発した病変から腫瘍の組織を得る必要がある。この試験で治療の対象とされている分子遺伝学的なvariant(多様体ないしバリアント)が認められる腫瘍を有する患者には、Pediatric MATCHでの治療が提案される。NCIウェブサイトおよびClinicalTrials.govウェブサイトで追加の情報が入手できる。
- NCT02125786(Trial of Surgery and Fractionated Re-Irradiation for Recurrent Ependymoma):この研究の主要目的は、初期治療後に再発した上衣腫の治療に手術および放射線再照射が有用かどうかを検討することである。放射線照射の第1コースと第2コースを合わせた線量は、通常の標準医療の場合より高い。研究者らは、手術および放射線再照射の効果および副作用を検討する予定である。また、腫瘍組織および血液を評価し検討することで、腫瘍に関する知識を深め、治療への反応の程度または不応の程度を解明するとともに、磁気共鳴画像法およびポジトロン放射断層撮影スキャンを用いて腫瘍反応および腫瘍再発を予測できるかどうかを確認する予定である。
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Zacharoulis S, Ashley S, Moreno L, et al.: Treatment and outcome of children with relapsed ependymoma: a multi-institutional retrospective analysis. Childs Nerv Syst 26 (7): 905-11, 2010.[PUBMED Abstract]
- Wu J, Armstrong TS, Gilbert MR: Biology and management of ependymomas. Neuro Oncol 18 (7): 902-13, 2016.[PUBMED Abstract]
- Messahel B, Ashley S, Saran F, et al.: Relapsed intracranial ependymoma in children in the UK: patterns of relapse, survival and therapeutic outcome. Eur J Cancer 45 (10): 1815-23, 2009.[PUBMED Abstract]
- Kano H, Yang HC, Kondziolka D, et al.: Stereotactic radiosurgery for pediatric recurrent intracranial ependymomas. J Neurosurg Pediatr 6 (5): 417-23, 2010.[PUBMED Abstract]
- Bouffet E, Hawkins CE, Ballourah W, et al.: Survival benefit for pediatric patients with recurrent ependymoma treated with reirradiation. Int J Radiat Oncol Biol Phys 83 (5): 1541-8, 2012.[PUBMED Abstract]
- Merchant TE, Boop FA, Kun LE, et al.: A retrospective study of surgery and reirradiation for recurrent ependymoma. Int J Radiat Oncol Biol Phys 71 (1): 87-97, 2008.[PUBMED Abstract]
- Kano H, Niranjan A, Kondziolka D, et al.: Outcome predictors for intracranial ependymoma radiosurgery. Neurosurgery 64 (2): 279-87; discussion 287-8, 2009.[PUBMED Abstract]
- Tsang DS, Burghen E, Klimo P, et al.: Outcomes After Reirradiation for Recurrent Pediatric Intracranial Ependymoma. Int J Radiat Oncol Biol Phys 100 (2): 507-515, 2018.[PUBMED Abstract]
- Eaton BR, Chowdhry V, Weaver K, et al.: Use of proton therapy for re-irradiation in pediatric intracranial ependymoma. Radiother Oncol 116 (2): 301-8, 2015.[PUBMED Abstract]
- Bouffet E, Capra M, Bartels U: Salvage chemotherapy for metastatic and recurrent ependymoma of childhood. Childs Nerv Syst 25 (10): 1293-301, 2009.[PUBMED Abstract]
- Jakacki RI, Foley MA, Horan J, et al.: Single-agent erlotinib versus oral etoposide in patients with recurrent or refractory pediatric ependymoma: a randomized open-label study. J Neurooncol 129 (1): 131-8, 2016.[PUBMED Abstract]
-
定位放射線手術[
4
][
5
][証拠レベル:3iiiA];[
6
][
7
][証拠レベル:3iiiDi]、強度変調光子線治療、陽子線治療[
8
];[
9
][証拠レベル:3iiiB]など、さまざまな放射線の治療法による局所再治療。
- 本要約の変更点(03/20/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
小児上衣腫、退形成性上衣腫、またはRELA融合陽性上衣腫の治療
本文に以下の記述が追加された;ある程度の化学療法感受性がみられるため、化学療法がしばしば使用されるが、イベントフリー生存および全生存の改善を実証する証拠は欠けている。
本文に、分子的に特徴づけられた後頭蓋窩上衣腫820例で、完全切除および上衣腫の後頭蓋窩Bサブグループと併せて、第一選択補助放射線療法に伴って予後が改善することが実証された大規模なレトロスペクティブ研究に関する記述が追加された。
再発小児上衣腫の治療
放射線療法および/または化学療法のサブセクションは広範囲にわたって改訂された。
本文に、再発小児上衣腫に対する治療として手術および放射線再照射を現在検討している臨床試験Trial of Surgery and Fractionated Reirradiation for Recurrent Ependymomaに関する記述が追加された。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、小児上衣腫の治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
- Kenneth J. Cohen, MD (Sidney Kimmel Comprehensive Cancer Center at Johns Hopkins Hospital)
- Louis S. Constine, MD (James P. Wilmot Cancer Center at University of Rochester Medical Center)
- Roger J. Packer, MD (Children's National Health System)
- Malcolm A. Smith, MD, PhD (National Cancer Institute)
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.gov まで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Board は、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Childhood Ependymoma Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/brain/hp/child-ependymoma-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389373]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する