ご利用について
医療専門家向けの本PDQがん情報要約では、小児脳幹グリオーマの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 小児脳幹グリオーマに関する一般情報
-
脳幹グリオーマを含む原発性脳腫瘍は、小児の最も一般的な充実性腫瘍をともに構成する多様な疾病からなる1つのグループである。腫瘍の診断と分類には、免疫組織化学的分析、細胞遺伝学的ならびに分子遺伝学的所見、および細胞分裂能の測定が用いられることが多くなっている。脳腫瘍はその組織像によって分類されるが、腫瘍存在部位およびその拡がりは治療および予後を左右する重要な因子である。
PDQ小児脳腫瘍の治療要約は、主に神経系腫瘍に関する世界保健機関(WHO)の分類に従って構成されている。[ 1 ]神経系腫瘍の分類の詳しい説明と各種の脳腫瘍に対応する治療要約へのリンクについては、小児脳腫瘍および脊髄腫瘍の治療の概要に関するPDQ要約を参照のこと。
脳幹グリオーマという用語は、中脳、橋、延髄を含めた脳幹に発生する膠細胞起源の腫瘍を表す一般的名称である。他の組織型(例、神経節膠腫)は脳幹に発生する一方で、以下の2つの組織型が多数を占める:
発生率
米国では、毎年約300~400人の小児が脳幹腫瘍と診断される。DIPGは、小児脳幹腫瘍の約75~80%を占める。[ 2 ]ほとんどのDIPG患者は、5~10歳の間に診断される。脳幹における限局性毛様細胞性星細胞腫は発生頻度が低い。[ 3 ]
解剖学
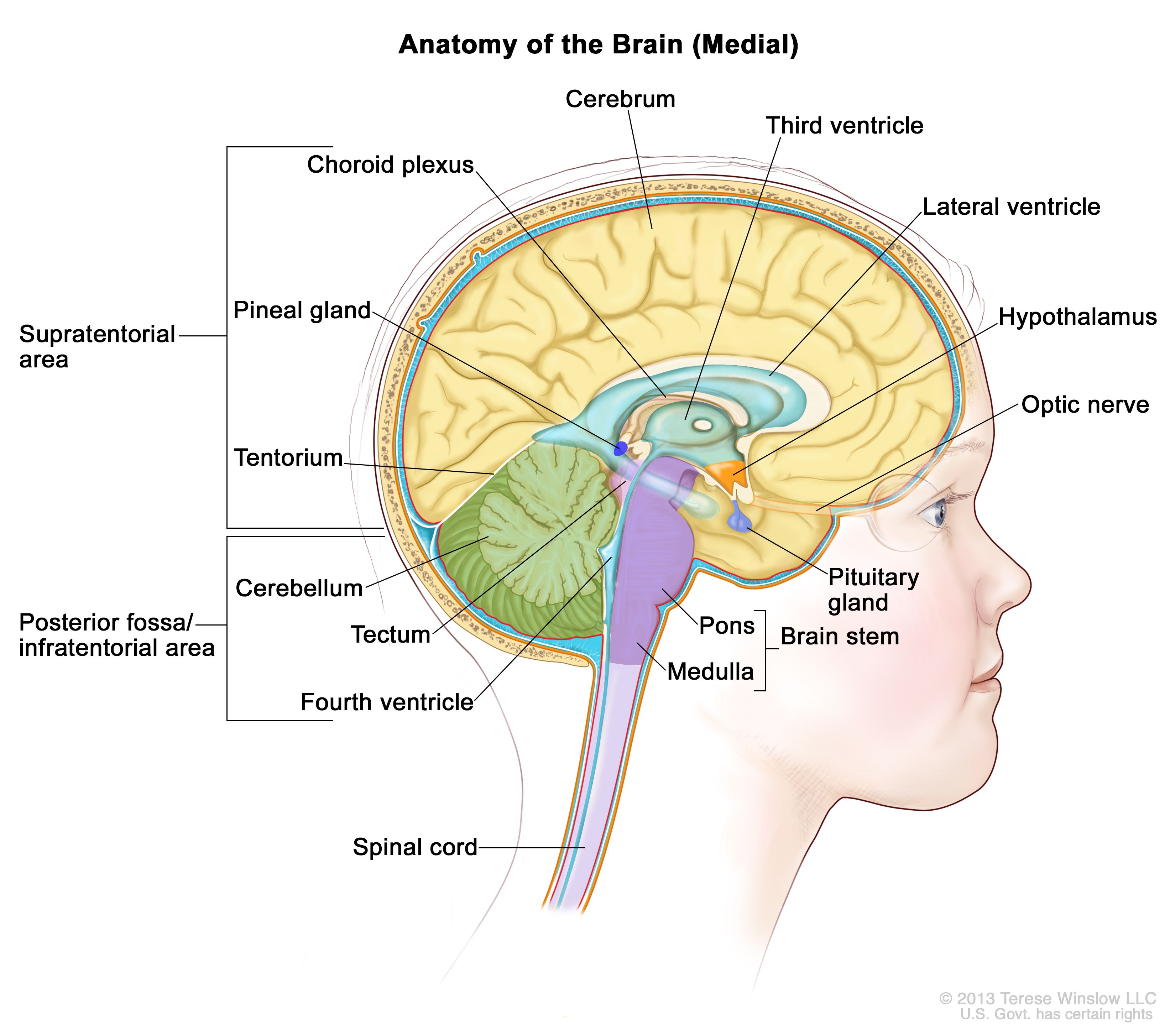
脳内部の解剖図で、松果体、下垂体、視神経、脳室(脳脊髄液を青色で示す)、およびその他の脳の部位を示している。後頭蓋窩はテント下の領域で、皮質と小脳を分けており、基本的に脳幹、小脳、および第4脳室を含む領域を示す。 臨床的特徴
DIPGの小児は、以下の症状の古典的三徴を呈する;しかしながら、小児は診断時にはこれらの症状の1つまたは2つしか呈さない場合がある:
橋の腫大による閉塞性水頭症が主症状となることもある。行動の変化および学業不振といった非特異的症状が認められる場合もある。
脳幹における限局性毛様細胞性星細胞腫の症状は、腫瘍の位置に応じて異なる。一般的に認められる症状には以下のものがある:[ 3 ]
診断
脳幹部の原発腫瘍は、臨床所見および磁気共鳴画像法(MRI)を用いた神経画像検査に基づいて以下のように診断されることが最も多い:[ 4 ]
神経線維腫症1型(NF1)の患児は、脳幹グリオーマ(しばしば毛様細胞性星細胞腫でDIPGではない)の発症リスクが高い。また、長い症状歴を示す場合、またはスクリーニング検査によって特定される場合がある。
予後および予後因子
DIPG患児の生存期間中央値は1年に満たないが、患児の約10%は2年以上生存する。[ 10 ][ 11 ]これに対して、限局性星細胞腫(例、毛様細胞性星細胞腫)の予後は著しく良好で、5年全生存率は90%を超えている。[ 3 ]
予後因子には以下のものがある:
治療後のフォローアップ
脳幹腫瘍で長期生存が予想される患児に対する標準的なフォローアップには、間欠的な臨床的評価およびMRIによる定期的な画像検査を含める傾向がある。MRIによるフォローアップが必要な期間はさまざまである:主として治療後における画像所見異常残存の有無、および最初の腫瘍組織型によって決まる。
参考文献- Louis DN, Ohgaki H, Wiestler OD: WHO Classification of Tumours of the Central Nervous System. 4th rev.ed. Lyon, France: IARC Press, 2016.[PUBMED Abstract]
- Warren KE: Diffuse intrinsic pontine glioma: poised for progress. Front Oncol 2: 205, 2012.[PUBMED Abstract]
- Klimo P, Pai Panandiker AS, Thompson CJ, et al.: Management and outcome of focal low-grade brainstem tumors in pediatric patients: the St. Jude experience. J Neurosurg Pediatr 11 (3): 274-81, 2013.[PUBMED Abstract]
- Liu AK, Brandon J, Foreman NK, et al.: Conventional MRI at presentation does not predict clinical response to radiation therapy in children with diffuse pontine glioma. Pediatr Radiol 39 (12): 1317-20, 2009.[PUBMED Abstract]
- Walker DA, Liu J, Kieran M, et al.: A multi-disciplinary consensus statement concerning surgical approaches to low-grade, high-grade astrocytomas and diffuse intrinsic pontine gliomas in childhood (CPN Paris 2011) using the Delphi method. Neuro Oncol 15 (4): 462-8, 2013.[PUBMED Abstract]
- Cage TA, Samagh SP, Mueller S, et al.: Feasibility, safety, and indications for surgical biopsy of intrinsic brainstem tumors in children. Childs Nerv Syst 29 (8): 1313-9, 2013.[PUBMED Abstract]
- Grill J, Puget S, Andreiuolo F, et al.: Critical oncogenic mutations in newly diagnosed pediatric diffuse intrinsic pontine glioma. Pediatr Blood Cancer 58 (4): 489-91, 2012.[PUBMED Abstract]
- Puget S, Beccaria K, Blauwblomme T, et al.: Biopsy in a series of 130 pediatric diffuse intrinsic Pontine gliomas. Childs Nerv Syst 31 (10): 1773-80, 2015.[PUBMED Abstract]
- Gupta N, Goumnerova LC, Manley P, et al.: Prospective feasibility and safety assessment of surgical biopsy for patients with newly diagnosed diffuse intrinsic pontine glioma. Neuro Oncol 20 (11): 1547-1555, 2018.[PUBMED Abstract]
- Hoffman LM, Veldhuijzen van Zanten SEM, Colditz N, et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of Diffuse Intrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. J Clin Oncol 36 (19): 1963-1972, 2018.[PUBMED Abstract]
- Cohen KJ, Pollack IF, Zhou T, et al.: Temozolomide in the treatment of high-grade gliomas in children: a report from the Children's Oncology Group. Neuro Oncol 13 (3): 317-23, 2011.[PUBMED Abstract]
- McAbee JH, Modica J, Thompson CJ, et al.: Cervicomedullary tumors in children. J Neurosurg Pediatr 16 (4): 357-66, 2015.[PUBMED Abstract]
- Ballester LY, Wang Z, Shandilya S, et al.: Morphologic characteristics and immunohistochemical profile of diffuse intrinsic pontine gliomas. Am J Surg Pathol 37 (9): 1357-64, 2013.[PUBMED Abstract]
- Wu G, Diaz AK, Paugh BS, et al.: The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat Genet 46 (5): 444-50, 2014.[PUBMED Abstract]
- Taylor KR, Mackay A, Truffaux N, et al.: Recurrent activating ACVR1 mutations in diffuse intrinsic pontine glioma. Nat Genet 46 (5): 457-61, 2014.[PUBMED Abstract]
- Buczkowicz P, Hoeman C, Rakopoulos P, et al.: Genomic analysis of diffuse intrinsic pontine gliomas identifies three molecular subgroups and recurrent activating ACVR1 mutations. Nat Genet 46 (5): 451-6, 2014.[PUBMED Abstract]
- Hoffman LM, DeWire M, Ryall S, et al.: Spatial genomic heterogeneity in diffuse intrinsic pontine and midline high-grade glioma: implications for diagnostic biopsy and targeted therapeutics. Acta Neuropathol Commun 4: 1, 2016.[PUBMED Abstract]
- Broniscer A, Laningham FH, Sanders RP, et al.: Young age may predict a better outcome for children with diffuse pontine glioma. Cancer 113 (3): 566-72, 2008.[PUBMED Abstract]
- Pascual-Castroviejo I, Pascual-Pascual SI, Viaño J, et al.: Posterior fossa tumors in children with neurofibromatosis type 1 (NF1). Childs Nerv Syst 26 (11): 1599-603, 2010.[PUBMED Abstract]
- Albers AC, Gutmann DH: Gliomas in patients with neurofibromatosis type 1. Expert Rev Neurother 9 (4): 535-9, 2009.[PUBMED Abstract]
- 小児脳幹グリオーマの分子的特性
-
びまん性内在性橋グリオーマ(DIPG)の細胞遺伝学的特徴
DIPGのゲノム情報
DIPGのゲノム的特徴は、他の多くの小児高悪性度大脳グリオーマの特徴、および成人高悪性度グリオーマの特徴と異なると考えられる。[ 1 ]DIPGの分子的および臨床的特徴は、ヒストンH3.3(H3F3A)またはH3.1(HIST1H3BおよびHIST1H3C)に特有なH3 K27M変異を伴う他の高悪性度正中グリオーマのものと一致しており、世界保健機関は、これらの腫瘍を、びまん性正中グリオーマ、H3 K27M変異型と呼ばれる単一の疾患群にまとめて分類するに至った。[ 2 ]
視床腫瘍を有する小児64人に関する1件の報告で、高悪性度グリオーマの50%(22例中11例)でH3 K27M変異がみられ、低悪性度の形態的特徴を示す腫瘍の約10%(42例中5例)でH3 K27M変異がみられた。5年全生存(OS)率はわずか6%(16例中1例)であった。[ 3 ]膠芽腫の患児202人を含む別の研究で、68腫瘍が正中線(主に視床)で、H3 K27M変異がみられた。この集団の5年OS率はわずか5%で、これはこの研究の残りの患者の生存率よりも有意に劣っていた。[ 4 ]
DIPGでは、多くの染色体およびゲノム異常が報告されており、以下のものがある:
DIPGの遺伝子発現プロファイルは、非脳幹性の小児高悪性度グリオーマと異なっており、この小児グリオーマのサブセットが生物学的に異なっていることをさらに裏付けている。[ 14 ]小児におけるH3 K27M変異腫瘍はまれにO6-メチルグアニン-DNA-メチルトランスフェラーゼ(MGMT)プロモーターメチル化を示し[ 4 ]、このことはDIPGの患者においてテモゾロミドが検証された場合に、その効力の不足を説明している。[ 16 ]
(低悪性度グリオーマの遺伝学に関する詳しい情報については、小児星細胞腫の治療に関するPDQ要約のゲノム変化のセクションを参照のこと。)
参考文献- Jones C, Karajannis MA, Jones DTW, et al.: Pediatric high-grade glioma: biologically and clinically in need of new thinking. Neuro Oncol 19 (2): 153-161, 2017.[PUBMED Abstract]
- Louis DN, Perry A, Reifenberger G, et al.: The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol 131 (6): 803-20, 2016.[PUBMED Abstract]
- Ryall S, Krishnatry R, Arnoldo A, et al.: Targeted detection of genetic alterations reveal the prognostic impact of H3K27M and MAPK pathway aberrations in paediatric thalamic glioma. Acta Neuropathol Commun 4 (1): 93, 2016.[PUBMED Abstract]
- Korshunov A, Ryzhova M, Hovestadt V, et al.: Integrated analysis of pediatric glioblastoma reveals a subset of biologically favorable tumors with associated molecular prognostic markers. Acta Neuropathol 129 (5): 669-78, 2015.[PUBMED Abstract]
- Wu G, Broniscer A, McEachron TA, et al.: Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and non-brainstem glioblastomas. Nat Genet 44 (3): 251-3, 2012.[PUBMED Abstract]
- Wu G, Diaz AK, Paugh BS, et al.: The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat Genet 46 (5): 444-50, 2014.[PUBMED Abstract]
- Fontebasso AM, Papillon-Cavanagh S, Schwartzentruber J, et al.: Recurrent somatic mutations in ACVR1 in pediatric midline high-grade astrocytoma. Nat Genet 46 (5): 462-6, 2014.[PUBMED Abstract]
- Taylor KR, Mackay A, Truffaux N, et al.: Recurrent activating ACVR1 mutations in diffuse intrinsic pontine glioma. Nat Genet 46 (5): 457-61, 2014.[PUBMED Abstract]
- Buczkowicz P, Hoeman C, Rakopoulos P, et al.: Genomic analysis of diffuse intrinsic pontine gliomas identifies three molecular subgroups and recurrent activating ACVR1 mutations. Nat Genet 46 (5): 451-6, 2014.[PUBMED Abstract]
- Schwartzentruber J, Korshunov A, Liu XY, et al.: Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature 482 (7384): 226-31, 2012.[PUBMED Abstract]
- Hoffman LM, DeWire M, Ryall S, et al.: Spatial genomic heterogeneity in diffuse intrinsic pontine and midline high-grade glioma: implications for diagnostic biopsy and targeted therapeutics. Acta Neuropathol Commun 4: 1, 2016.[PUBMED Abstract]
- Hoffman LM, Veldhuijzen van Zanten SEM, Colditz N, et al.: Clinical, Radiologic, Pathologic, and Molecular Characteristics of Long-Term Survivors of Diffuse Intrinsic Pontine Glioma (DIPG): A Collaborative Report From the International and European Society for Pediatric Oncology DIPG Registries. J Clin Oncol 36 (19): 1963-1972, 2018.[PUBMED Abstract]
- Zarghooni M, Bartels U, Lee E, et al.: Whole-genome profiling of pediatric diffuse intrinsic pontine gliomas highlights platelet-derived growth factor receptor alpha and poly (ADP-ribose) polymerase as potential therapeutic targets. J Clin Oncol 28 (8): 1337-44, 2010.[PUBMED Abstract]
- Paugh BS, Broniscer A, Qu C, et al.: Genome-wide analyses identify recurrent amplifications of receptor tyrosine kinases and cell-cycle regulatory genes in diffuse intrinsic pontine glioma. J Clin Oncol 29 (30): 3999-4006, 2011.[PUBMED Abstract]
- Khuong-Quang DA, Buczkowicz P, Rakopoulos P, et al.: K27M mutation in histone H3.3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas. Acta Neuropathol 124 (3): 439-47, 2012.[PUBMED Abstract]
- Cohen KJ, Heideman RL, Zhou T, et al.: Temozolomide in the treatment of children with newly diagnosed diffuse intrinsic pontine gliomas: a report from the Children's Oncology Group. Neuro Oncol 13 (4): 410-6, 2011.[PUBMED Abstract]
- 小児脳幹グリオーマの病期情報
-
小児脳幹グリオーマに対して一般的に適用される病期分類システムはない。
脳幹グリオーマは、以下の因子によって分類される:
脳幹グリオーマは、橋、中脳、視蓋、頸髄延髄接合部の後方の髄質をはじめとする脳幹部の多くの領域に発生する。腫瘍は近傍の小脳脚、小脳、頸髄、および/または視床にまで及ぶことがある。[ 1 ][ 2 ]
びまん性内在性橋グリオーマ(DIPG)の拡がりは臨床で示され、通常は周囲脳への浸潤で、クモ膜下腔を介した転移を伴う。こうした播種は、局所進行前に生じることもあるが、通常は原発病変の進行と同時か、進行後に発生する。[ 3 ]しかしながら、準臨床的には、脳幹、視床、大脳、およびテント上髄膜への進展を伴うより広範な播種が剖検時に示される。[ 4 ]
参考文献- Laigle-Donadey F, Doz F, Delattre JY: Brainstem gliomas in children and adults. Curr Opin Oncol 20 (6): 662-7, 2008.[PUBMED Abstract]
- Khatua S, Moore KR, Vats TS, et al.: Diffuse intrinsic pontine glioma-current status and future strategies. Childs Nerv Syst 27 (9): 1391-7, 2011.[PUBMED Abstract]
- Sethi R, Allen J, Donahue B, et al.: Prospective neuraxis MRI surveillance reveals a high risk of leptomeningeal dissemination in diffuse intrinsic pontine glioma. J Neurooncol 102 (1): 121-7, 2011.[PUBMED Abstract]
- Caretti V, Bugiani M, Freret M, et al.: Subventricular spread of diffuse intrinsic pontine glioma. Acta Neuropathol 128 (4): 605-7, 2014.[PUBMED Abstract]
- 小児脳幹グリオーマに対する治療法選択肢の概要
-
小児および青年のがん患者の生存において、劇的な改善が達成されている。1975年から2010年の間に、小児がんの死亡率は50%以上低下した。[ 1 ]最も実用的で許容できる従来の治療法をさらに向上させるために、種々の臨床試験が実施され、その結果として、小児がんにおける生存率が幾度も改善されてきた。小児科での臨床試験は、新たな療法と現在標準とされている治療法とを比較するようデザインされる。こうした比較は、二群ランダム化試験か、新たな単一治療法の成績を評価しその結果を従来の治療法で得られた以前の結果と比較することによって行われる。
小児のがんは比較的まれであるため、小児脳腫瘍の患児はすべて臨床試験に組み入れることが検討されるべきである。至適治療法を決定し、これを実施するためには、小児脳腫瘍の治療経験のあるがん専門医からなる集学的チームによる計画が必要である。小児脳腫瘍の放射線療法(三次元原体照射療法を含む)には、きわめて高度な技術が必要とされ、至適結果を確実に得るためにはその領域での経験を積んでいる施設で行うべきである。
表1に、新たに診断された進行性または再発小児脳幹グリオーマに対する標準治療法の選択肢を記述する。
表1.小児脳幹グリオーマに対する標準治療法の選択肢 治療群 標準治療法の選択肢 新規診断小児脳幹グリオーマ: びまん性内在性橋グリオーマ 放射線療法 限局性脳幹グリオーマ 外科的切除(化学療法および/または放射線療法を併用または非併用) 経過観察(脳脊髄液路変更術を実施または非実施) 切除不能な腫瘍に対する放射線療法、化学療法、または代替アプローチ 進行性/再発小児脳幹グリオーマ: びまん性内在性橋グリオーマ 標準治療法は存在しない 限局性脳幹グリオーマ 手術 放射線療法 化学療法 参考文献- Smith MA, Altekruse SF, Adamson PC, et al.: Declining childhood and adolescent cancer mortality. Cancer 120 (16): 2497-506, 2014.[PUBMED Abstract]
- 新規診断小児脳幹グリオーマの治療
-
新たに診断された小児びまん性内在性橋グリオーマ(DIPG)に対する標準治療法の選択肢
新たに診断された小児DIPGに対する標準治療法の選択肢には以下のものがある:
新たにDIPGと診断された患児に対しては、多数の臨床試験が利用可能であるが、新規診断DIPG患児の治療では、放射線療法を加えたいずれの治療法も有用性が証明されていない。[ 1 ][ 2 ][ 3 ][ 4 ][ 5 ][ 6 ];[ 7 ][ 8 ][証拠レベル:2A];[ 9 ][証拠レベル:3iiiA]
DIPG患児に対して放射線療法に追加した化学療法(術前補助、同時、放射線照射後の化学療法を含めて)または免疫療法戦略では長期生存につながったものはない。[ 10 ][ 11 ][ 12 ];[ 13 ][証拠レベル:2A]この中には、自家造血幹細胞救助を伴う高用量の骨髄破壊的化学療法を用いた治療も含まれており、この場合も生存延長効果は示されていない。[ 14 ]ただし、他の脳腫瘍の治療と同様に、DIPGの乳児に対しては一般的に放射線療法が省略され、化学療法単独のアプローチが用いられる。このアプローチの有用性を支持する公表データは不足している。
放射線療法
DIPGの小児に対する標準治療法は、腫瘍部位に対する放射線療法である。放射線療法の従来の線量は54~60Gyの範囲で、原発腫瘍部位に対して1日1回分割で局所的に照射する。このような治療法は大半の患者に一過性の利益をもたらすが、90%を超える患者が診断から18ヵ月以内に死亡する。[ 15 ]
放射線療法完了後2~3ヵ月経過して、放射線誘発性の変化が起こることがあり、腫瘍進行と酷似していることがある。追加の治療の効力を検討する場合は、放射線誘発性の変化と腫瘍進行とを区別するため、注意が必要である。[ 16 ]
多分割照射療法、少分割放射線療法、および放射線増感剤の効力を評価した調査研究では、これらの放射線療法技術を用いても転帰が改善しないことが明らかになっている。
- 多分割(1日2回)照射療法。より高線量の照射を実施するために、この技術が用いられており、計78Gyもの線量を用いる諸研究が完了している。これらの高線量放射線療法をDIPG患者に対して単独で使用しても[ 1 ][ 17 ]、化学療法と併用しても[ 3 ]、生存期間または生存率は改善しないことを示す証拠が得られている。
- 少分割放射線療法。この技術では、従来の分割放射線療法の技術と生存率は同程度であるが、治療負担が少ない可能性がある。[ 18 ][証拠レベル:1iiA];[ 15 ][ 19 ][証拠レベル:2A]
- 放射線増感剤。放射線療法の治療効果を高める手段として、種々の放射線増感剤の効力を評価する研究が完了しているが、転帰に有意な改善は示すことができていない。[ 1 ][ 3 ][ 4 ][ 5 ][ 20 ][ 21 ]
新たに診断された小児DIPGに対して臨床評価段階にある治療法の選択肢
選択された患者では、初期相の臨床試験が利用できる場合がある。これらの試験は、小児腫瘍学グループ(COG)、小児脳腫瘍コンソーシアム(Pediatric Brain Tumor Consortium:PBTC)、または他の団体を介して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
新たに診断された小児限局性脳幹グリオーマに対する標準治療法の選択肢
新たに診断された小児限局性脳幹グリオーマに対する標準治療法の選択肢には以下のものがある:
外科的切除(化学療法および/または放射線療法を併用または非併用)
一般に、最大限の外科的切除を試みる。[ 22 ]
腫瘍が残存する患者は、追加治療の対象となりうる。治療法の選択肢には、化学療法および/または放射線療法がある。
経過観察(脳脊髄液路変更術を実施または非実施)
視蓋に小さな病変および水頭症があるが他の神経脱落がない患者は、脳脊髄液路変更術のみによって治療し、進行性の病変である証拠が得られるまでは、神経放射線検査を継続するモニタリングを実施する。[ 23 ]
神経線維腫症1型の患者に対しては、何らかの治療を開始する前に、一定期間の経過観察を指示してもよい。[ 24 ]こうした小児の脳幹グリオーマは無痛性のこともあり、何年間も特別な治療を必要としない場合もある。[ 25 ]
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Mandell LR, Kadota R, Freeman C, et al.: There is no role for hyperfractionated radiotherapy in the management of children with newly diagnosed diffuse intrinsic brainstem tumors: results of a Pediatric Oncology Group phase III trial comparing conventional vs. hyperfractionated radiotherapy. Int J Radiat Oncol Biol Phys 43 (5): 959-64, 1999.[PUBMED Abstract]
- Jennings MT, Sposto R, Boyett JM, et al.: Preradiation chemotherapy in primary high-risk brainstem tumors: phase II study CCG-9941 of the Children's Cancer Group. J Clin Oncol 20 (16): 3431-7, 2002.[PUBMED Abstract]
- Allen J, Siffert J, Donahue B, et al.: A phase I/II study of carboplatin combined with hyperfractionated radiotherapy for brainstem gliomas. Cancer 86 (6): 1064-9, 1999.[PUBMED Abstract]
- Broniscer A, Leite CC, Lanchote VL, et al.: Radiation therapy and high-dose tamoxifen in the treatment of patients with diffuse brainstem gliomas: results of a Brazilian cooperative study. Brainstem Glioma Cooperative Group. J Clin Oncol 18 (6): 1246-53, 2000.[PUBMED Abstract]
- Doz F, Neuenschwander S, Bouffet E, et al.: Carboplatin before and during radiation therapy for the treatment of malignant brain stem tumours: a study by the Société Française d'Oncologie Pédiatrique. Eur J Cancer 38 (6): 815-9, 2002.[PUBMED Abstract]
- Wolff JE, Westphal S, Mölenkamp G, et al.: Treatment of paediatric pontine glioma with oral trophosphamide and etoposide. Br J Cancer 87 (9): 945-9, 2002.[PUBMED Abstract]
- Korones DN, Fisher PG, Kretschmar C, et al.: Treatment of children with diffuse intrinsic brain stem glioma with radiotherapy, vincristine and oral VP-16: a Children's Oncology Group phase II study. Pediatr Blood Cancer 50 (2): 227-30, 2008.[PUBMED Abstract]
- Cohen KJ, Heideman RL, Zhou T, et al.: Temozolomide in the treatment of children with newly diagnosed diffuse intrinsic pontine gliomas: a report from the Children's Oncology Group. Neuro Oncol 13 (4): 410-6, 2011.[PUBMED Abstract]
- Jalali R, Raut N, Arora B, et al.: Prospective evaluation of radiotherapy with concurrent and adjuvant temozolomide in children with newly diagnosed diffuse intrinsic pontine glioma. Int J Radiat Oncol Biol Phys 77 (1): 113-8, 2010.[PUBMED Abstract]
- Frappaz D, Schell M, Thiesse P, et al.: Preradiation chemotherapy may improve survival in pediatric diffuse intrinsic brainstem gliomas: final results of BSG 98 prospective trial. Neuro Oncol 10 (4): 599-607, 2008.[PUBMED Abstract]
- Frazier JL, Lee J, Thomale UW, et al.: Treatment of diffuse intrinsic brainstem gliomas: failed approaches and future strategies. J Neurosurg Pediatr 3 (4): 259-69, 2009.[PUBMED Abstract]
- Hargrave D, Bartels U, Bouffet E: Diffuse brainstem glioma in children: critical review of clinical trials. Lancet Oncol 7 (3): 241-8, 2006.[PUBMED Abstract]
- Warren K, Bent R, Wolters PL, et al.: A phase 2 study of pegylated interferon α-2b (PEG-Intron(®)) in children with diffuse intrinsic pontine glioma. Cancer 118 (14): 3607-13, 2012.[PUBMED Abstract]
- Bouffet E, Raquin M, Doz F, et al.: Radiotherapy followed by high dose busulfan and thiotepa: a prospective assessment of high dose chemotherapy in children with diffuse pontine gliomas. Cancer 88 (3): 685-92, 2000.[PUBMED Abstract]
- Janssens GO, Jansen MH, Lauwers SJ, et al.: Hypofractionation vs conventional radiation therapy for newly diagnosed diffuse intrinsic pontine glioma: a matched-cohort analysis. Int J Radiat Oncol Biol Phys 85 (2): 315-20, 2013.[PUBMED Abstract]
- Liu AK, Macy ME, Foreman NK: Bevacizumab as therapy for radiation necrosis in four children with pontine gliomas. Int J Radiat Oncol Biol Phys 75 (4): 1148-54, 2009.[PUBMED Abstract]
- Freeman CR, Krischer JP, Sanford RA, et al.: Final results of a study of escalating doses of hyperfractionated radiotherapy in brain stem tumors in children: a Pediatric Oncology Group study. Int J Radiat Oncol Biol Phys 27 (2): 197-206, 1993.[PUBMED Abstract]
- Zaghloul MS, Eldebawy E, Ahmed S, et al.: Hypofractionated conformal radiotherapy for pediatric diffuse intrinsic pontine glioma (DIPG): a randomized controlled trial. Radiother Oncol 111 (1): 35-40, 2014.[PUBMED Abstract]
- Negretti L, Bouchireb K, Levy-Piedbois C, et al.: Hypofractionated radiotherapy in the treatment of diffuse intrinsic pontine glioma in children: a single institution's experience. J Neurooncol 104 (3): 773-7, 2011.[PUBMED Abstract]
- Freeman CR, Kepner J, Kun LE, et al.: A detrimental effect of a combined chemotherapy-radiotherapy approach in children with diffuse intrinsic brain stem gliomas? Int J Radiat Oncol Biol Phys 47 (3): 561-4, 2000.[PUBMED Abstract]
- Bradley KA, Zhou T, McNall-Knapp RY, et al.: Motexafin-gadolinium and involved field radiation therapy for intrinsic pontine glioma of childhood: a children's oncology group phase 2 study. Int J Radiat Oncol Biol Phys 85 (1): e55-60, 2013.[PUBMED Abstract]
- Kestle J, Townsend JJ, Brockmeyer DL, et al.: Juvenile pilocytic astrocytoma of the brainstem in children. J Neurosurg 101 (1 Suppl): 1-6, 2004.[PUBMED Abstract]
- Igboechi C, Vaddiparti A, Sorenson EP, et al.: Tectal plate gliomas: a review. Childs Nerv Syst 29 (10): 1827-33, 2013.[PUBMED Abstract]
- Bilaniuk LT, Molloy PT, Zimmerman RA, et al.: Neurofibromatosis type 1: brain stem tumours. Neuroradiology 39 (9): 642-53, 1997.[PUBMED Abstract]
- Molloy PT, Bilaniuk LT, Vaughan SN, et al.: Brainstem tumors in patients with neurofibromatosis type 1: a distinct clinical entity. Neurology 45 (10): 1897-902, 1995.[PUBMED Abstract]
- Klimo P, Pai Panandiker AS, Thompson CJ, et al.: Management and outcome of focal low-grade brainstem tumors in pediatric patients: the St. Jude experience. J Neurosurg Pediatr 11 (3): 274-81, 2013.[PUBMED Abstract]
- Ronghe M, Hargrave D, Bartels U, et al.: Vincristine and carboplatin chemotherapy for unresectable and/or recurrent low-grade astrocytoma of the brainstem. Pediatr Blood Cancer 55 (3): 471-7, 2010.[PUBMED Abstract]
- Ruge MI, Kickingereder P, Simon T, et al.: Stereotactic iodine-125 brachytherapy for treatment of inoperable focal brainstem gliomas of WHO grades I and II: feasibility and long-term outcome. J Neurooncol 109 (2): 273-83, 2012.[PUBMED Abstract]
- 進行性/再発小児脳幹グリオーマの治療
-
進行性の小児びまん性内在性橋グリオーマ(DIPG)に対する治療法の選択肢
DIPG腫瘍の進行は一般的に放射線療法の完了後1年以内に予想される。放射線療法完了後2~3ヵ月経過して、放射線誘発性の変化が起こることがあり、腫瘍進行と酷似していることがある(偽性進行としても知られる)。
ほとんどの症例において、臨床上または放射線学上の進行時の生検は不要であるか、または推奨されない。鑑別診断の中に、臨床的に腫瘍再発と鑑別できない可能性のある治療に関連する脳幹損傷があれば、再燃の確認に生検を検討してもよい。以前に照射を受けたDIPG患者で壊死と腫瘍再発を区別する際におけるポジトロン放射断層撮影、磁気共鳴スペクトロスコピー、単一光子放出型コンピュータ断層撮影(single-photon emission CT)などの他の検査の信頼性は、まだ明らかにされていない。
追加の治療の効力を検討する場合は、放射線誘発性の変化と腫瘍進行とを区別するため、注意が必要である。
標準治療法は存在しない。進行性の小児DIPGに対する治療法の選択肢には以下のものがある:
- 放射線療法。
再照射療法によって生存期間が延長することが示されており、放射線療法に初期反応を示した小児における進行時に再照射療法の施行を考慮できる。[ 2 ][ 3 ]
- 新たな治療アプローチの臨床試験。
臨床的に顕著な活性を示す標準的な薬剤がないため、疾患に向けた追加の治療を希望する患者または家族は新たな治療アプローチの試験への参加を考慮すべきである。
進行時に疾患に向けた治療を行う決定がなされたかどうかに関係なく、緩和ケアは依然として管理の中心となっている。これにより、QOLを最大化しながら、末期疾患に関連する症状とストレスを緩和する試みが確保される。
進行性の小児DIPGに対して臨床評価段階にある治療法の選択肢
選択された患者では、初期相の臨床試験が利用できる場合がある。これらの試験は、小児腫瘍学グループ(COG)、小児脳腫瘍コンソーシアム(Pediatric Brain Tumor Consortium:PBTC)、または他の団体を介して利用できる場合がある。米国国立がん研究所(NCI)が支援している臨床試験に関する情報は、NCIウェブサイトに掲載されている。他の組織がスポンサーの臨床試験に関する情報については、ClinicalTrials.govウェブサイトを参照のこと。
以下は、現在実施されている全米および/または施設の臨床試験の例である:
再発性の小児限局性脳幹グリオーマに対する治療法の選択肢
腫瘍の再発時には、再燃の範囲を判定するための完全な評価が、選択された限局性病変に適応とされる。再発または進行時の治療の考慮事項は、先行治療により異なる。
再発性の小児限局性脳幹グリオーマに対する治療法の選択肢には以下のものがある:
最新の臨床試験
NCIが支援しているがん臨床試験で現在患者登録中の試験を検索するには、臨床試験アドバンスト・サーチを使用のこと(なお、このサイトは日本語検索に対応していない。)。このサーチでは、試験の場所、治療の種類、薬物名やその他の基準による絞り込みが可能である。臨床試験に関する一般情報も、入手することができる。
参考文献- Carceller F, Fowkes LA, Khabra K, et al.: Pseudoprogression in children, adolescents and young adults with non-brainstem high grade glioma and diffuse intrinsic pontine glioma. J Neurooncol 129 (1): 109-21, 2016.[PUBMED Abstract]
- Janssens GO, Gandola L, Bolle S, et al.: Survival benefit for patients with diffuse intrinsic pontine glioma (DIPG) undergoing re-irradiation at first progression: A matched-cohort analysis on behalf of the SIOP-E-HGG/DIPG working group. Eur J Cancer 73: 38-47, 2017.[PUBMED Abstract]
- Lassaletta A, Strother D, Laperriere N, et al.: Reirradiation in patients with diffuse intrinsic pontine gliomas: The Canadian experience. Pediatr Blood Cancer 65 (6): e26988, 2018.[PUBMED Abstract]
- Bowers DC, Krause TP, Aronson LJ, et al.: Second surgery for recurrent pilocytic astrocytoma in children. Pediatr Neurosurg 34 (5): 229-34, 2001.[PUBMED Abstract]
- Huynh-Le MP, Walker AJ, Burger PC, et al.: Management of pediatric intracranial low-grade gliomas: long-term follow-up after radiation therapy. Childs Nerv Syst 32 (8): 1425-30, 2016.[PUBMED Abstract]
- Ater JL, Zhou T, Holmes E, et al.: Randomized study of two chemotherapy regimens for treatment of low-grade glioma in young children: a report from the Children's Oncology Group. J Clin Oncol 30 (21): 2641-7, 2012.[PUBMED Abstract]
- 放射線療法。
- 本要約の変更点(06/08/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
小児脳幹グリオーマに関する一般情報
参考文献9として、Gupta et al.が追加された。
本要約はPDQ Pediatric Treatment Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、小児脳幹グリオーマの治療について、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Pediatric Treatment Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。PDQ Pediatric Treatment Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Pediatric Treatment Editorial Board.PDQ Childhood Brain Stem Glioma Treatment.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/brain/hp/child-glioma-treatment-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389253]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
入手可能な証拠の強さに基づき、治療選択肢は「標準」または「臨床評価段階にある」のいずれかで記載される場合がある。これらの分類は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する