ご利用について
医療専門家向けの本PDQがん情報要約では、乳がんのスクリーニングについて、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Screening and Prevention Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
CONTENTS
- 概要
-
注:乳がんの予防、乳がんの治療(成人)、男性の乳がんの治療、および妊娠中の乳がんの治療については、別のPDQ要約を参照できるようにしてある。
マンモグラフィは乳がん発見用に最も広く用いられているスクリーニング方法である。マンモグラフィが50~69歳の女性で乳がん死亡率を低下させ、生命を脅かすことのない臨床的に重要ではないがんの発見(過剰診断)を含む有害性と関連しているという証拠が存在する。40~49歳の女性に対するマンモグラフィの有益性は不明確である。[ 1 ][ 2 ]スクリーニング検査に乳房視触診(CBE)を使用する検討を行ったランダム化試験がインド、イラン、およびエジプトで実施されている。これらの研究の一部では、進行がんへの移行が示唆されている;しかしながら、死亡に対する有益性を結論するには、まだ証拠が不十分である。[ 3 ][ 4 ][ 5 ][ 6 ][ 7 ][ 8 ]乳房自己検査には死亡に対する有益性がないことが示されている。CBEについて発生率または死亡率の成績に関する結果は発表されていない。
超音波検査、磁気共鳴画像法、分子乳房画像法などの技術は通常、マンモグラフィの補助として評価されており、平均的集団における一次スクリーニングのツールではない。
説明を受けた上での医学的意思決定は、がんのスクリーニングを検討している患者に対して、ますます推奨されている。多種多様な意思決定支援が研究されている。(詳しい情報については、がんスクリーニングの概要に関するPDQ要約を参照のこと。)
マンモグラフィによるスクリーニング
有益性
50年前に開始されたランダム化比較試験(RCT)から、スクリーニングマンモグラフィが60~69歳の女性(固い証拠)および50~59歳の女性(中等度の証拠)で乳がん特異的死亡率を低下させるという証拠がもたらされている。より最近実施された集団ベース研究は、より長期間にわたりスクリーニングに参加するスクリーニング受診集団に対する有益性について疑問を提起している。
影響の大きさ:RCTのメタアナリシスに基づけば、乳がん死を1例防ぐためにスクリーニングに勧誘する必要のある女性数は女性の年齢によって異なる:39~49歳の女性では、1,904人が必要(95%信頼区間[CI]、929-6,378);50~59歳の女性では、1,339人が必要(95%CI、322-7,455);60~69歳の女性では、377人が必要(95%CI、230-1,050)。[ 9 ]
死亡率に関する有益性を実証するRCTのメタアナリシスの妥当性は、RCTの完了以降の数十年での医療用画像検査および治療法の改善により限定的となっている。2014年に完了したCanadian National Breast Screening Study(CNBSS)[ 10 ]の25年に及ぶ追跡では、スクリーニングマンモグラフィに関連する死亡率に関する有益性は示されなかった。
有害性
固い証拠によると、スクリーニングマンモグラフィは以下の悪影響をもたらすことがある。
スクリーニングマンモグラフィによる潜在的有害性に関するこのような結論のいずれについても、内部妥当性、一貫性および外部妥当性は良好である。
乳房視触診(CBE)
有益性
CNBSS試験ではスクリーニング受診なしに対するCBEの効力について調査されなかった。インドで2件、エジプトで1件が進行中のランダム化試験は、スクリーニングCBEの有効性を評価するようデザインされているが、まだ死亡率データを報告していない。[ 3 ][ 4 ][ 5 ][ 6 ][ 7 ][ 8 ]このため、スクリーニングCBEの有効性の評価はまだ不可能である。
有害性
CBEによるスクリーニングは以下の悪影響をもたらすことがある:
-
偽陽性による追加検査と不安。
- 影響の大きさ:50~59歳の女性における特異度は88~99%で、スクリーニングを受けた全女性について偽陽性率は1~12%であった。[ 23 ]
- 研究デザイン:記述的集団ベース。
- 内部妥当性、一貫性および外部妥当性:良好。
-
偽陰性による誤った安心感とがん診断の遅延の可能性。
- 影響の大きさ:がん患者女性の17~43%はCBE陰性であった。熟練した医師による検査時間が長くなるほど、また検査の質が高くなるほど、感度は高くなる。
- 研究デザイン:記述的集団ベース。
- 内部妥当性および外部妥当性:良好。
- 一貫性:普通。
乳房自己検査(BSE)
有益性
BSEがスクリーニングなしと比較されており、乳がん死亡率の低下に関する有益性がないことが示されている。
有害性
BSEを実施するために正式に指導および奨励を行うことで、より多くの胸部生検の実施につながるとともに、良性の乳房病変の診断が増加することを示す固い証拠が存在する。
- 健康上のアウトカムに対する影響の大きさ:研究集団における生検実施率は1.8%、対する対照群は1.0%であった。[ 24 ]
- 研究デザイン:2件のRCT、コホート研究。
- 内部妥当性:良好。
- 一貫性:普通。
- 外部妥当性:不良。
参考文献- Moss SM, Cuckle H, Evans A, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years' follow-up: a randomised controlled trial. Lancet 368 (9552): 2053-60, 2006.[PUBMED Abstract]
- Moss SM, Wale C, Smith R, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years' follow-up: a randomised controlled trial. Lancet Oncol 16 (9): 1123-32, 2015.[PUBMED Abstract]
- Hassan LM, Mahmoud N, Miller AB, et al.: Evaluation of effect of self-examination and physical examination on breast cancer. Breast 24 (4): 487-90, 2015.[PUBMED Abstract]
- Anderson BO, Bevers TB, Carlson RW: Clinical Breast Examination and Breast Cancer Screening Guideline. JAMA 315 (13): 1403-4, 2016.[PUBMED Abstract]
- Yen AM, Tsau HS, Fann JC, et al.: Population-Based Breast Cancer Screening With Risk-Based and Universal Mammography Screening Compared With Clinical Breast Examination: A Propensity Score Analysis of 1 429 890 Taiwanese Women. JAMA Oncol 2 (7): 915-21, 2016.[PUBMED Abstract]
- Myers ER, Moorman P, Gierisch JM, et al.: Benefits and Harms of Breast Cancer Screening: A Systematic Review. JAMA 314 (15): 1615-34, 2015.[PUBMED Abstract]
- Mittra I, Mishra GA, Singh S, et al.: A cluster randomized, controlled trial of breast and cervix cancer screening in Mumbai, India: methodology and interim results after three rounds of screening. Int J Cancer 126 (4): 976-84, 2010.[PUBMED Abstract]
- Sankaranarayanan R, Ramadas K, Thara S, et al.: Clinical breast examination: preliminary results from a cluster randomized controlled trial in India. J Natl Cancer Inst 103 (19): 1476-80, 2011.[PUBMED Abstract]
- Nelson HD, Tyne K, Naik A, et al.: Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med 151 (10): 727-37, W237-42, 2009.[PUBMED Abstract]
- Miller AB, Wall C, Baines CJ, et al.: Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ 348: g366, 2014.[PUBMED Abstract]
- Welch HG, Black WC: Overdiagnosis in cancer. J Natl Cancer Inst 102 (9): 605-13, 2010.[PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012.[PUBMED Abstract]
- Yen MF, Tabár L, Vitak B, et al.: Quantifying the potential problem of overdiagnosis of ductal carcinoma in situ in breast cancer screening. Eur J Cancer 39 (12): 1746-54, 2003.[PUBMED Abstract]
- Jørgensen KJ, Gøtzsche PC: Overdiagnosis in publicly organised mammography screening programmes: systematic review of incidence trends. BMJ 339: b2587, 2009.[PUBMED Abstract]
- Rosenberg RD, Yankaskas BC, Abraham LA, et al.: Performance benchmarks for screening mammography. Radiology 241 (1): 55-66, 2006.[PUBMED Abstract]
- Elmore JG, Barton MB, Moceri VM, et al.: Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med 338 (16): 1089-96, 1998.[PUBMED Abstract]
- Hubbard RA, Kerlikowske K, Flowers CI, et al.: Cumulative probability of false-positive recall or biopsy recommendation after 10 years of screening mammography: a cohort study. Ann Intern Med 155 (8): 481-92, 2011.[PUBMED Abstract]
- Rosenberg RD, Hunt WC, Williamson MR, et al.: Effects of age, breast density, ethnicity, and estrogen replacement therapy on screening mammographic sensitivity and cancer stage at diagnosis: review of 183,134 screening mammograms in Albuquerque, New Mexico. Radiology 209 (2): 511-8, 1998.[PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Likelihood ratios for modern screening mammography. Risk of breast cancer based on age and mammographic interpretation. JAMA 276 (1): 39-43, 1996.[PUBMED Abstract]
- Porter PL, El-Bastawissi AY, Mandelson MT, et al.: Breast tumor characteristics as predictors of mammographic detection: comparison of interval- and screen-detected cancers. J Natl Cancer Inst 91 (23): 2020-8, 1999.[PUBMED Abstract]
- Ronckers CM, Erdmann CA, Land CE: Radiation and breast cancer: a review of current evidence. Breast Cancer Res 7 (1): 21-32, 2005.[PUBMED Abstract]
- Goss PE, Sierra S: Current perspectives on radiation-induced breast cancer. J Clin Oncol 16 (1): 338-47, 1998.[PUBMED Abstract]
- Fenton JJ, Rolnick SJ, Harris EL, et al.: Specificity of clinical breast examination in community practice. J Gen Intern Med 22 (3): 332-7, 2007.[PUBMED Abstract]
- Thomas DB, Gao DL, Ray RM, et al.: Randomized trial of breast self-examination in Shanghai: final results. J Natl Cancer Inst 94 (19): 1445-57, 2002.[PUBMED Abstract]
- Semiglazov VF, Manikhas AG, Moiseenko VM, et al.: [Results of a prospective randomized investigation [Russia (St.Petersburg)/WHO]to evaluate the significance of self-examination for the early detection of breast cancer]. Vopr Onkol 49 (4): 434-41, 2003.[PUBMED Abstract]
-
偽陽性による追加検査と不安。
- 証拠の記述
-
乳がんの発生率および死亡率
乳がんは、米国の女性において最も一般的な非皮膚性のがんであり、2020年には新たに浸潤がん276,480例、非浸潤(in situ)がん48,530例が生じると推定され、42,170例が死亡すると予想されている。[ 1 ]BRCA1およびBRCA2遺伝子キャリアを含む遺伝リスクを有する女性が乳がん症例に占める割合はおおよそ5~10%である。男性は乳がん症例および乳がん死の1%を占める。[ 1 ]
乳がんの最大の危険因子は女性であることであり、次が加齢である。他の危険因子には、ホルモン的諸側面(早期初潮、遅発閉経、未経産、初回妊娠の遅さ、閉経後のホルモン療法など)、飲酒、および電離放射線への曝露などがある。
白人女性の乳がん発生率は黒人女性より高く、黒人女性は診断時のあらゆる病期で生存率も低い。このことはスクリーニング行動や医療へのアクセスの違いを反映している可能性がある。ヒスパニック系およびアジア太平洋諸島の出身者では、発生率および死亡率はいずれも白人や黒人よりも低い。[ 3 ]
乳がん発生率は、生殖の問題(早期妊娠 vs 晩期妊娠、多経産、および授乳など)、スクリーニングへの参加、および閉経後のホルモン使用により異なる。乳がんの発生率(特に非浸潤性[in situ]乳管がん[DCIS])は、米国および英国でマンモグラフィが広く採用されるようになって以降、劇的に増加した。[ 4 ]閉経後のホルモン療法の広範な使用は乳がん発生率の劇的な増加と関連していたが、この傾向はその使用が減少したことで反転した。[ 5 ]
いかなる集団でも、スクリーニングを採用してもその後に進行期がんの発生率は低下していない。
乳房症状の評価
乳房に症状を有する女性は、症状のない女性で施行されるスクリーニングマンモグラフィではなく、診断的マンモグラフィを受ける。医学的関心を促す乳房症状に関する10年間の研究で、乳房腫瘤ががんの診断に結びついたのは症例の10.7%であったのに対し、痛みががんと関連付けられたのは症例の1.8%のみであった。[ 6 ]
乳房組織の病理学的評価
浸潤性乳がん
乳がんは、生検時に切除された乳房組織の細胞を顕微鏡的に検査することで診断が可能である。標本採取する乳房組織は、画像検査での異常または触知可能であることで同定できる。乳房生検は、シリンジに取り付けた細い針(穿刺吸引法)、より太い針(コア生検)、または切除(切除生検)により施行することができる。画像ガイダンスにより精度を向上させることができる。針生検では、診断を下せるだけの広い異常部位の標本を採取する。切除生検は異常な領域全体を切除することを目的とする。
非浸潤性(in situ)乳管がん(DCIS)
DCISは浸潤がんと関連することがあり、またさまざまな頻度および時間経過で浸潤がんへと進行しうる非浸潤性病変である。[ 7 ]著者の中にはDCISを浸潤性乳がんの統計に含める者もいるが、DCISという用語は、子宮頸部および前立腺の前駆病変に用いられる用語法と同様に乳管上皮内新生物と言い換える方が適切であり、乳がんの統計からDCISを除外することを検討すべきであると主張する者もいる。
DCISはそのほとんどがマンモグラフィによって診断される。米国では、スクリーニングマンモグラフィ採用以前の1983年にDCISと診断された女性はわずか4,900人であったのに対し、2020年には約48,530人の女性が診断されると予想される。[ 1 ][ 7 ][ 8 ]50~59歳の女性を評価したCanadian National Breast Screening Study-2では、乳房視触診(CBE) + マンモグラフィを併用したスクリーニングを受けた女性のDCISの症例数が、CBEのみのスクリーニングを受けた女性で症例数の4倍であったが、乳がん死亡率には差がなかったことが判明した。[ 9 ](詳しい情報については、乳がんの治療[成人]に関するPDQ要約を参照のこと。)
DCISの自然史は、DCIS症例のほぼすべてがスクリーニングにより検出され、治療を受けるため、ほとんど解明されていない。DCISの治療後の乳がん発生は病変の病理学的特徴および治療法によって異なる。1件のランダム化試験では、腫瘤摘出術によりDCISを切除した女性の13.4%が90ヵ月以内に同側浸潤性乳がんを発症したのに対し、腫瘤摘出術に放射線療法を併用した女性では3.9%であった。[ 10 ]DCISを診断されて治療を受けた女性のうち、乳がんにより死亡した女性の割合は年齢をマッチさせた一般集団よりも低かった。[ 11 ][ 12 ]この良好な治療成績は、DCISの良性の性質や治療の有益性、ボランティア効果(すなわち、乳がんのスクリーニングを受ける女性は一般的にスクリーニングを受けない女性よりも健康的である)を反映している可能性がある。
乳房生検標本の解釈に関する病理医の診断のばらつき
病理医による乳房組織の診断の範囲には、異型なしの良性から、異型あり、DCIS、浸潤性乳がんが含まれる。乳房の異型またはDCIS病変の発生率は、過去30年間にマンモグラフィによるスクリーニングが普及した結果、上昇している(ただし、一般に異型についてはマンモグラフィでは検知されない)。[ 16 ][ 17 ]乳房病変の誤分類は病変の過剰治療または過小治療につながる可能性があり、異型およびDCISの診断では特にばらつきがある。[ 15 ][ 18 ][ 19 ][ 20 ][ 21 ][ 22 ]
このテーマに取り組んだ最大規模の研究であるB-Path研究では、米国の現役病理医115人に症例ごとに1つの乳房生検のスライドを解釈してもらい、その結果を専門家の合意による基準診断と比較した。[ 15 ]個別の病理医の解釈と専門家の基準診断との全般的な一致は浸潤がんで最も高かった一方、DCISと異型では一致のレベルが顕著に低かった。[ 15 ]B-Path研究には、実地臨床で一般的にみられるよりも異型およびDCIS症例の割合が高かったため、著者らは、乳房生検を受けた50~59歳の米国人女性の観点から診断のばらつきが正確度に及ぼす影響の程度を推定するため、ベイズの定理を適用して作業を拡大した。[ 18 ]米国の集団レベルでは、乳房生検による診断の92.3%(信頼区間[CI]、91.4%-93.1%)が専門家の合意による基準診断で確認され、最初の乳房生検の4.6%(CI、3.9%-5.3%)が過剰解釈され、3.2%(CI、2.7%-3.6%)が過少解釈されると推定されている。図1は、100乳房生検当たりの予測される結果を全体および診断カテゴリー別に示している。
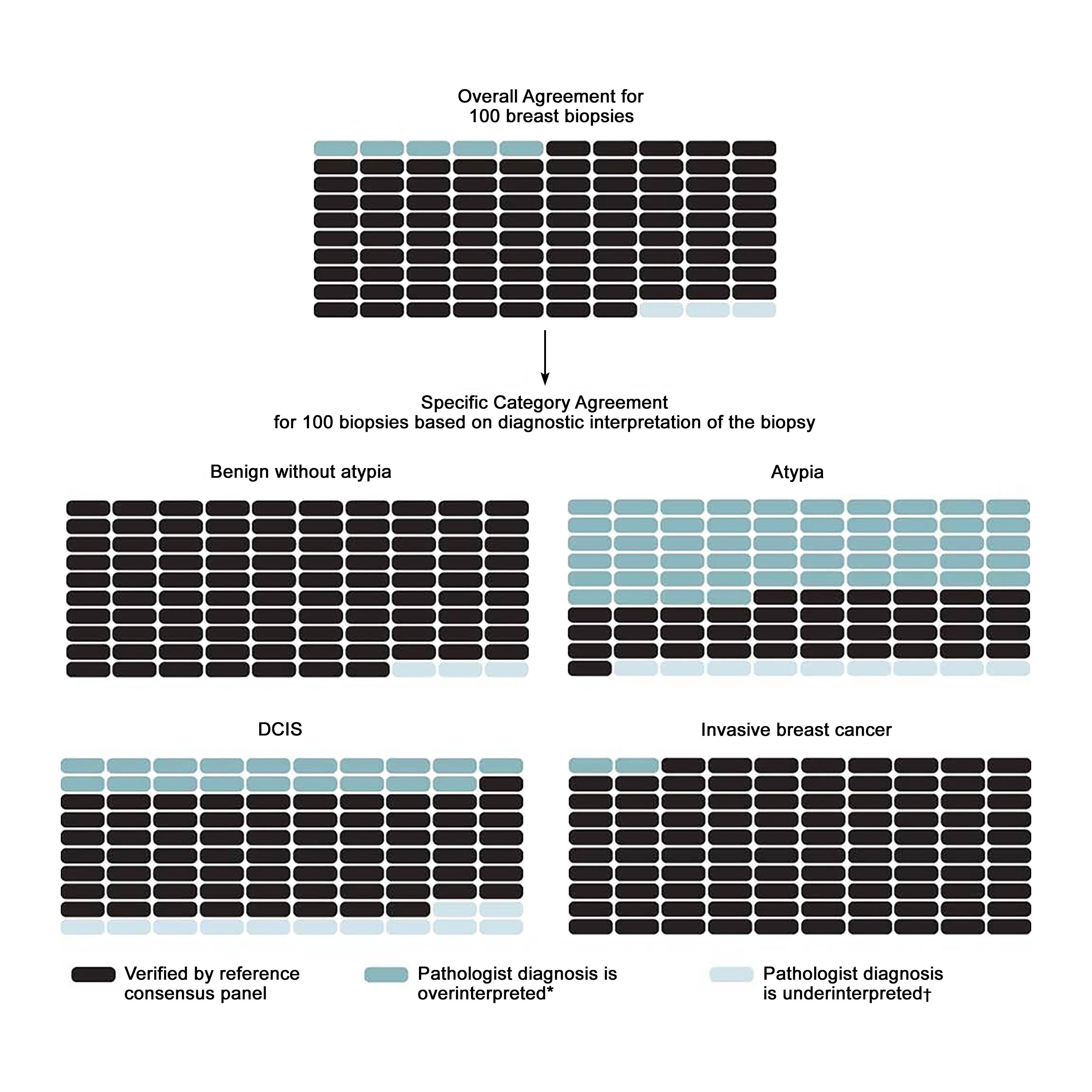
図1.100乳房生検当たりで予測される全体および診断カテゴリー別の結果。From Annals of Internal Medicine, Elmore JG, Nelson HD, Pepe MS, Longton GM, Tosteson AN, Geller B, Onega T, Carney PA, Jackson SL, Allison KH, Weaver DL, Variability in Pathologists' Interpretations of Individual Breast Biopsy Slides: A Population Perspective, Volume 164, Issue 10, Pages 649-55, Copyright © 2016 American College of Physicians.All Rights Reserved.American College of Physicians, Inc.から許諾を得て転載。 乳房組織の診断において不一致の割合が高い問題に対処するため、セカンドオピニオンを必要とする検査室の方針が一般的になりつつある。B-Path研究に参加した252人の乳房病理医を対象にした米国の調査で、回答者の65%が最初に浸潤がんと診断された全症例に対して検査室の方針ではセカンドオピニオンが必要であると報告した。また、回答者の56%がDCISの最初の診断に対して検査室の方針ではセカンドオピニオンが必要であると報告した一方、最初に異型乳管過形成が診断された症例に対してセカンドオピニオンを必要とする検査室の方針を報告した回答者は36%であった。[ 23 ]この同じ調査で、圧倒的多数の病理医が、セカンドオピニオンにより診断精度(96%)が改善したことに同意した。
B-Path研究のデータを用いた1件のシミュレーション研究では、乳房の病理組織所見の解釈を改善すべくセカンドオピニオンを得ることに対する12の戦略が評価された。[ 24 ]セカンドオピニオンを浸潤がん症例のみに限定した戦略を除いて、すべてのセカンドオピニオン戦略で正確度が有意に改善した。診断における病理医の信頼や経験値に関係なく、正確度が改善した。セカンドオピニオンにより正確度が改善した一方で、特に乳房異型の見分けにくい症例で診断のばらつきを完全に排除することはできなかった。
特殊集団
リスクが高く、スクリーニングで得られる有益性が高い可能性のある女性
BRCA1およびBRCA2遺伝子変異を有する女性
BRCA1またはBRCA2遺伝子変異を原因とする乳がんのリスクが高い女性はスクリーニングを増やすことが有益となる可能性がある。(詳しい情報については、乳がんおよび婦人科がんの遺伝学に関するPDQ要約を参照のこと。)
胸部放射線療法を受けた女性
ホジキンリンパ腫および非ホジキンリンパ腫で、マントル放射線照射による治療を受けた女性は、治療完了10年後から乳がんのリスクが高くなり、その状態が生涯続く。このため、開始が比較的若年齢となる場合であっても、スクリーニングマンモグラフィが提唱されている。[ 25 ][ 26 ]
スクリーニングによる有益性がほとんどない個人
余命が限られた女性患者
スクリーニングマンモグラフィの潜在的有益性は検査のかなり後、しばしば何年も後に得られるのに対し、有害性はすぐに生じる。このため、余命が限られ、併存症のある女性は有害性を被っても、有益性が得られない場合がある。それでも、このような女性の多くはスクリーニングマンモグラフィを受ける。[ 27 ]ある研究では、進行がん女性の約9%ががんスクリーニング検査を受けた。[ 28 ]
高齢女性
スクリーニングマンモグラフィでは、66~79歳の女性の約1%においてがんの診断がなされるが、これらのがんのほとんどは低リスクである。[ 29 ]高齢女性における限局性乳がんの診断および治療が有益かどうかについては疑問が残る。
若年女性
40歳未満の平均リスクの女性におけるスクリーニングマンモグラフィ実施の有益性については証拠がない。
参考文献- American Cancer Society: Cancer Facts and Figures 2020. Atlanta, Ga: American Cancer Society, 2020. Available online. Last accessed May 12, 2020.[PUBMED Abstract]
- Kurian AW, Griffith KA, Hamilton AS, et al.: Genetic Testing and Counseling Among Patients With Newly Diagnosed Breast Cancer . JAMA 317 (5): 531-534, 2017.[PUBMED Abstract]
- Howlader N, Noone AM, Krapcho M, et al.: SEER Cancer Statistics Review (CSR) 1975-2016. Bethesda, Md: National Cancer Institute, 2019. Available online. Last accessed February 27, 2020.[PUBMED Abstract]
- Johnson A, Shekhdar J: Breast cancer incidence: what do the figures mean? J Eval Clin Pract 11 (1): 27-31, 2005.[PUBMED Abstract]
- Haas JS, Kaplan CP, Gerstenberger EP, et al.: Changes in the use of postmenopausal hormone therapy after the publication of clinical trial results. Ann Intern Med 140 (3): 184-8, 2004.[PUBMED Abstract]
- Barton MB, Elmore JG, Fletcher SW: Breast symptoms among women enrolled in a health maintenance organization: frequency, evaluation, and outcome. Ann Intern Med 130 (8): 651-7, 1999.[PUBMED Abstract]
- Allegra CJ, Aberle DR, Ganschow P, et al.: National Institutes of Health State-of-the-Science Conference statement: Diagnosis and Management of Ductal Carcinoma In Situ September 22-24, 2009. J Natl Cancer Inst 102 (3): 161-9, 2010.[PUBMED Abstract]
- Virnig BA, Tuttle TM, Shamliyan T, et al.: Ductal carcinoma in situ of the breast: a systematic review of incidence, treatment, and outcomes. J Natl Cancer Inst 102 (3): 170-8, 2010.[PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000.[PUBMED Abstract]
- Fisher B, Dignam J, Wolmark N, et al.: Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol 16 (2): 441-52, 1998.[PUBMED Abstract]
- Ernster VL, Barclay J, Kerlikowske K, et al.: Mortality among women with ductal carcinoma in situ of the breast in the population-based surveillance, epidemiology and end results program. Arch Intern Med 160 (7): 953-8, 2000.[PUBMED Abstract]
- Welch HG, Prorok PC, O'Malley AJ, et al.: Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness. N Engl J Med 375 (15): 1438-1447, 2016.[PUBMED Abstract]
- Weaver DL, Rosenberg RD, Barlow WE, et al.: Pathologic findings from the Breast Cancer Surveillance Consortium: population-based outcomes in women undergoing biopsy after screening mammography. Cancer 106 (4): 732-42, 2006.[PUBMED Abstract]
- Rubin E, Visscher DW, Alexander RW, et al.: Proliferative disease and atypia in biopsies performed for nonpalpable lesions detected mammographically. Cancer 61 (10): 2077-82, 1988.[PUBMED Abstract]
- Elmore JG, Longton GM, Carney PA, et al.: Diagnostic concordance among pathologists interpreting breast biopsy specimens. JAMA 313 (11): 1122-32, 2015.[PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012.[PUBMED Abstract]
- Hall FM: Identification, biopsy, and treatment of poorly understood premalignant, in situ, and indolent low-grade cancers: are we becoming victims of our own success? Radiology 254 (3): 655-9, 2010.[PUBMED Abstract]
- Elmore JG, Nelson HD, Pepe MS, et al.: Variability in Pathologists' Interpretations of Individual Breast Biopsy Slides: A Population Perspective. Ann Intern Med 164 (10): 649-55, 2016.[PUBMED Abstract]
- Rosai J: Borderline epithelial lesions of the breast. Am J Surg Pathol 15 (3): 209-21, 1991.[PUBMED Abstract]
- Schnitt SJ, Connolly JL, Tavassoli FA, et al.: Interobserver reproducibility in the diagnosis of ductal proliferative breast lesions using standardized criteria. Am J Surg Pathol 16 (12): 1133-43, 1992.[PUBMED Abstract]
- Wells WA, Carney PA, Eliassen MS, et al.: Statewide study of diagnostic agreement in breast pathology. J Natl Cancer Inst 90 (2): 142-5, 1998.[PUBMED Abstract]
- Della Mea V, Puglisi F, Bonzanini M, et al.: Fine-needle aspiration cytology of the breast: a preliminary report on telepathology through Internet multimedia electronic mail. Mod Pathol 10 (6): 636-41, 1997.[PUBMED Abstract]
- Geller BM, Nelson HD, Carney PA, et al.: Second opinion in breast pathology: policy, practice and perception. J Clin Pathol 67 (11): 955-60, 2014.[PUBMED Abstract]
- Elmore JG, Tosteson AN, Pepe MS, et al.: Evaluation of 12 strategies for obtaining second opinions to improve interpretation of breast histopathology: simulation study. BMJ 353: i3069, 2016.[PUBMED Abstract]
- Mariscotti G, Belli P, Bernardi D, et al.: Mammography and MRI for screening women who underwent chest radiation therapy (lymphoma survivors): recommendations for surveillance from the Italian College of Breast Radiologists by SIRM. Radiol Med 121 (11): 834-837, 2016.[PUBMED Abstract]
- Allen SD, Wallis MG, Cooke R, et al.: Radiologic features of breast cancer after mantle radiation therapy for Hodgkin disease: a study of 230 cases. Radiology 272 (1): 73-8, 2014.[PUBMED Abstract]
- Walter LC, Lindquist K, Covinsky KE: Relationship between health status and use of screening mammography and Papanicolaou smears among women older than 70 years of age. Ann Intern Med 140 (9): 681-8, 2004.[PUBMED Abstract]
- Sima CS, Panageas KS, Schrag D: Cancer screening among patients with advanced cancer. JAMA 304 (14): 1584-91, 2010.[PUBMED Abstract]
- Smith-Bindman R, Kerlikowske K, Gebretsadik T, et al.: Is screening mammography effective in elderly women? Am J Med 108 (2): 112-9, 2000.[PUBMED Abstract]
- Fentiman IS, Fourquet A, Hortobagyi GN: Male breast cancer. Lancet 367 (9510): 595-604, 2006.[PUBMED Abstract]
- マンモグラフィ
-
記述と背景
マンモグラフィは、電離放射線を利用して乳腺組織の画像を描出する。検査は2枚のプレート間で乳房をしっかり圧迫することで行うが、このようにすることで重なっている組織が広げられ、画像描出に必要な放射線量が減る。米国におけるルーチンのスクリーニング検査用には、斜位(内外)方向および上下方向の両方から撮影する。[ 1 ]いずれの像も、乳頭から胸筋までの乳腺組織が描出されるようにする。放射線曝露は標準の2方向スクリーニング撮影ごとに4~24mSvである。2方向撮影では、正常な乳腺構造の重複による異常についての懸念が軽減されるため、1方向撮影のみの検査に比べてリコール率が低くなる。[ 2 ]2方向撮影ではまた、1方向撮影のみの検査よりも中間期がんの発生率が低い。[ 3 ]
マンモグラフィを実施する米国の施設はすべて、職員が標準的なトレーニングを受けており、低線量の標準化されたマンモグラフィ検査であることを保証するため1992年に議会が制定したMammography Quality Standards Act(MQSA)の下で米国食品医薬品局(FDA)の認定を受けなくてはならない。[ 4 ](Mammography Facility Surveys, Mammography Equipment Evaluations, and Medical Physicist Qualification Requirement under MQSAに関するFDAのウェブページを参照のこと。)1998年のMQSA再認可条例は、マンモグラフィの結果の一般向け要約文書を患者に渡すよう要求している。
マンモグラフィの結果の報告には、次のBreast Imaging Reporting and Data System(BI-RADS)のカテゴリーが用いられる:[ 5 ]
- 0:不完全-比較用に追加の画像評価および/または以前のマンモグラムを要する。
- 1:陰性;1年以内のがん診断のリスクが1%。
- 2:良性;1年以内のがん診断のリスクが1%。
- 3:良性と推定;1年以内のがん診断のリスクが2%。
- 4:悪性の疑い;1年以内のがん診断のリスクが2~95%。
- 4a:2~10%。
- 4b:10~50%。
- 4c:50~95%。
- 5:悪性の強い疑い;1年以内のがん診断のリスクが95%。
- 6:既に生検で悪性疾患が証明されている。
ほとんどのスクリーニングマンモグラフィは陰性または良性と解釈され(それぞれBI-RADS 1または2)、追加の評価のために再来院を求められる米国人女性は約10%である。[ 6 ]追加の評価のために再来院を求められる女性の割合は、各女性の遺伝的特徴だけでなく、マンモグラフィを実施する施設および放射線科医によっても異なる。[ 7 ]
デジタルマンモグラフィとコンピュータ支援検出
デジタルマンモグラフィはスクリーンフィルムマンモグラフィ(SFM)より高価であるが、データの記憶と共有により適している。がん発見率、感度、特異度、および陽性適中率(PPV)について、SFMとデジタルマンモグラフィ双方の性能が数件の試験で直接比較されているが、ほとんどの患者群で結果は同様であった。
Digital Mammographic Imaging Screening Trial(DMIST)において、米国の33の施設での42,760人の女性のデジタルおよびフィルムマンモグラフィの所見が比較された。50歳未満の女性におけるがん検出については、デジタルマンモグラフィが優れていた(デジタルについて曲線下面積[AUC] 0.84 +/- 0.03;フィルムについてAUC 0.69 +/- 0.05;P = 0.002)が、全体的乳がん検出について差は認められなかった。[ 8 ]DMISTの2番目の報告では、65歳以上の女性で、フィルムマンモグラフィの方がデジタルマンモグラフィより高いAUCを示す傾向が認められた。[ 9 ]
別の米国の大規模コホート研究[ 10 ]でも、50歳未満の女性でフィルムマンモグラフィの方が感度がわずかに良好であり、特異度は同様であったことが認められている。
2004年から2010年にオランダで実施されたデジタルマンモグラフィスクリーニング150万回とスクリーンフィルムマンモグラフィスクリーニング450万回の所見を比較したところ、デジタルマンモグラフィスクリーニングの方がリコール率とがん発見率が高いことが認められた。[ 11 ]DMIST[ 8 ][ 9 ]および米国のコホート研究[ 10 ]を含む10件の研究のメタアナリシス[ 12 ]では、デジタルマンモグラフィとフィルムマンモグラフィの両方を経験した女性82,573人を対象として、これらの手法が比較された。変量効果モデルで、2種類のマンモグラフィの間にがん検出に関する統計的有意差は認められなかった(フィルム:AUC 0.92、デジタル:AUC 0.91)。50歳未満の女性では、すべての研究でデジタルマンモグラフィの方が感度が高かったが、特異度は同等か、フィルムマンモグラフィの方が高かった。
コンピュータ支援検出(CAD)システムは、微小石灰クラスタや腫瘤などの疑わしい領域を強調するもので[ 13 ]、一般に感度は高めるが、特異度を低下させ[ 14 ]、非浸潤性(in situ)乳管がん(DCIS)の検出率を高める。[ 15 ]数種のCADシステムが使用されている。CADシステム導入前後のリコール率および乳がん発見率を比較した1件の大規模集団ベースの研究では、いずれの率にも変化が認められなかった。[ 13 ][ 16 ]別の大規模研究では、リコール率の増加およびDCIS発見の増加が確認されたが、浸潤がん発見率における向上は示されなかった。[ 15 ][ 17 ]40~89歳の女性を対象に大規模データベースおよびデジタルマンモグラフィを用いた別の研究で、CADは感度、特異度、または中間期がんの発見率を改善しなかったが、DCISの発見率を高めたことが認められた。[ 18 ]
Surveillance, Epidemiology, and End Results (SEER)-Medicareリンクデータベースに依拠し、2つの期間(2001年から2002年および2008年から2009年)における65歳以上の女性27万人以上による新たなスクリーニングマンモグラフィ法の使用について調査が行われた。デジタルマンモグラフィは2%から30%に増加し、CADは3%から33%に増加し、費用は$660,000,000から$962,000,000に増加した。CADは2008年にMedicareにより支払われたスクリーニングマンモグラフィの74%で使用され、これは2004年の約2倍の多さであったが、早期(DCISまたはI期)腫瘍または進行期(IV期)腫瘍の発見率における差は認められなかった。[ 19 ]
トモシンセシス
トモシンセシス、つまり3次元(3-D)マンモグラフィでは、標準の2-Dマンモグラフィと同様、乳房を圧迫し、X線を用いて画像を描出する。複数枚の短時間曝露X線写真がさまざまな角度で撮影される。一部のがんはマンモグラフィや超音波検査よりもこの方法での方が適切に描出される。放射線量は2-Dマンモグラフィの2倍である。
バーモント州の8つのスクリーニング施設からの観察データにより、2012年から2016年に実施されたデジタル乳房トモシンセシス(DBT)86,379例およびフルフィールドデジタルマンモグラフィ(FFDM)97,378例のスクリーニング検査の所見の比較が可能になった。女性の参加条件は、乳がんの既往がないか、乳房インプラントの挿入を受けていないこと、および臨床研究プロジェクトからの離脱を選択したことがないこととされた。質問票で人口統計学的因子および危険因子の情報が入手され、生検はすべてVermont Breast Cancer Surveillance Systemを介して病理検査が行われた。リコール率はDBTの方がFFDMよりも低かった(7.9% vs 10.9%;95%信頼区間[CI]、0.77-0.85)が、生検率または良性あるいは悪性病変の検出率における差は認められなかった。[ 20 ]
乳房画像検査により発見されたがんの特徴
病期、リンパ節転移の状態、および腫瘍の大きさに関係なく、スクリーニングで検出されたがんの方がスクリーニング以外で診断されたがんよりも予後が良好である。[ 2 ]このことは、そのようながんは生物学的に致死性が低い(おそらくは成長が遅く、局所的に浸潤し、転移する可能性が低い)ことを示唆している。これはスクリーニングに関連するレングス・バイアス効果と一致している。すなわち、スクリーニングでは緩慢性(増殖が遅い)乳がんが検出されやすい一方で、より侵攻性のがんはスクリーニング未実施期間に検出される。
浸潤性乳がんに罹患しているフィンランドの女性1,983人を対象とした10年にわたる追跡調査は、がんの検出方法が予後の独立変数であることを証明した。年齢、リンパ節転移の状態、および腫瘍の大きさに関する対照がある場合、スクリーニングで検出されたがんの方が再燃リスクが低く、全生存率が良好であった。スクリーニング以外の方法でがんが検出された女性では、たとえ補助全身療法を受ける可能性が高くても、死亡のハザード比(HR)は1.90(95%CI、1.15-3.11)であった。[ 21 ]
同様に、3件のランダム化スクリーニング試験(Health Insurance Plan、全国乳がんスクリーニング研究[NBSS]-1、およびNBSS-2)で発見された乳がんの検査では、病期、リンパ節転移の状態、および腫瘍の大きさが考慮され、スクリーニングでがんが発見された患者は予後がより良好であったという判断に至った。スクリーニングにより検出されたがんと比較すると、中間期がんおよび発生がんの死亡の相対リスク(RR)は1.53(95%CI、1.17-2.00)であった;スクリーニングにより検出されたがんと比較すると、対照群のがんでは1.36(95%CI、1.10-1.68)であった。[ 22 ]
3つ目の研究では、英国において1998年から2003年までに診断された女性計5,604人のスクリーニング発見乳がんの患者と症状のある乳がんの患者との間で転帰の比較が行われた。腫瘍の大きさ、リンパ節転移の状態、悪性度、患者の年齢について調整が行われた結果、スクリーニング発見乳がんの女性の方が経過が良好であったことが明らかになった。症状のある乳がん女性の生存に対するハザード比は0.79であった(95%CI、0.63-0.99)。[ 21 ][ 23 ]
これらの研究の知見は、スクリーニングで検出されたがんの一部は低リスクで過剰診断であるという証拠とも一致している。
スクリーニングバイアス-概念
膨大な数の非対照試験およびレトロスペクティブ・シリーズで、臨床経過の良好な小さな初期乳がんを診断するマンモグラフィの能力が実証されている。[ 24 ]がんがスクリーニングにより発見された患者は、スクリーニングにより生存期間が延長しない場合でさえ、がんがスクリーニングにより発見されなかった患者よりも高い生存率を示す。この概念は以下の4種類の統計的偏りにより説明される:
- リードタイム・バイアス:スクリーニングにより、症状に基づいて発見されたであろうがんより早期に発見されたがんは、診断日が早まるだけである。早期に発見、治療を行ってもがんの自然な進行は変化しない。診断時からの5年生存率は、スクリーニングによって患者の生存期間に差が生じない場合でも、早期に発見されたがんの方が高くなる。
- レングス・バイアス:スクリーニングマンモグラフィは、臨床的に現れた(医師または具合の悪くなった本人により発見される)がんより予後の良好な成長の遅いがんを発見する。このような非進行性のがんを生命を脅かすがん(早期の治療により治療成績が影響を受けない)に加えることで、スクリーニングによってどれだけ多くの人命が救われるかに違いが生じていない場合でも、5年生存率は増加する。
- 過剰診断バイアス:スクリーニングにより、決して症状や死亡の原因とならないであろうがんが発見され、生存期間を変えることなく生存率が増加する。
- 健康ボランティア・バイアス:スクリーニングへの参加を志願する人は、一般集団の中でも最も健康であり、または健康意識が最も高い女性である可能性がある。このため、彼女らの転帰は、早期診断で得られる可能性のある有益性に関係なく、健康でもなく、健康意識が高いわけでもない女性の転帰より良好となる。
このようなバイアスの影響は不明である。生存に関する有益性と、過剰診断バイアス、リードタイム・バイアス、レングスタイム・バイアス、健康ボランティア・バイアスの影響の双方を検討するために、原因別死亡をエンドポイントとする新たなランダム化比較試験(RCT)が必要である。これは実現可能ではない;患者をスクリーニング群と非スクリーニング群にランダム化することは非倫理的であり、また少なくとも30年間の追跡が必要となり、その間に治療法と画像検査技術の変化により結果が無効となるはずである。このため、判断は、制約があっても入手可能なRCT、また適切な対照群を用意し、交絡について調整を行った地域相関研究やコホート研究に基づかざるを得ない。(詳しい情報については、がんスクリーニングの概要に関するPDQ要約を参照のこと。)
性能と正確度の評価
米国におけるスクリーニングマンモグラフィの性能の基準は、Breast Cancer Surveillance Consortium(BCSC)のウェブサイトに記述されている。(詳しい情報については、がんスクリーニングの概要に関するPDQ要約を参照のこと。)
感度
マンモグラフィの感度とは、マンモグラフィによるスクリーニングにより発見される乳がん女性の割合をいう。感度は、腫瘍のサイズ、目立ちやすさ、ホルモン感受性、乳腺組織の陰影濃度、患者の年齢、月経周期の時期、画像全体の質、放射線科医の読影力に左右される。全体的な感度は約79%であるが、年齢の低い女性および乳房が濃く映る(dense breast)女性では低くなる(BCSCウェブサイトを参照のこと)。[ 25 ][ 26 ][ 27 ]乳がんに罹患している可能性のある女性の中には過剰診断により有害性が生じる場合もあるため、感度は有益性と同じというわけではない。Physician's Insurance Association of America(PIAA)によると、乳がん診断の遅れおよび誤診は、医療過誤訴訟の一般的な原因である。2002年から2011年までのPIAAのデータにより、乳がんに関する賠償請求で賠償金の支払総額が最も高かったのは誤診についてのものであり、賠償金の平均支払額は$444,557であったことが示されている。[ 28 ]
特異度および偽陽性率
マンモグラフィの特異度とは、乳がんのない全女性のうち陰性である割合をいう。偽陽性率とは、乳がんのない女性で検査結果が陽性となる確率をいう。特異度が低く、偽陽性率が高い場合は、不要な追加検査および追加措置を実施することになる。特異度はがんのないすべての女性を分母に含むため、偽陽性の割合が低い場合でも、絶対数は大きくなる。このため—スクリーニングでは—高特異度は非常に高いことが必要である。95%の特異度でもスクリーニング検査としては非常に低い。
中間期がん
中間期がんとは、通常のスクリーニング検査後から予期される次のスクリーニングマンモグラフィの日までの期間の間に診断されるがんである。中間期がんは50歳未満の女性に比較的多く発生し、粘液性または小葉性であり、高い組織学的悪性度と増殖活性を示し、マンモグラフィの所見は比較的良性で、石灰化を示さないことがある研究で認められている。逆に、スクリーニングで発見されたがんは、しばしば管腔状の組織型をとり、腫瘍径が小さく、病期が進んでおらず、ホルモン感受性があり、DCISの成分が大部分を占めていた。[ 29 ]全体として、中間期がんは急激な増殖を特徴としており[ 29 ][ 30 ]、診断時には進行期にあり、予後不良である。[ 31 ]
Nova Scotia Breast Screening Programは、見逃されたがんを以前のスクリーニング検査で偽陰性であったものと定義しており、頻度は女性1,000人当たり1件未満としている。同プログラムは、中間期がんの発生頻度は40~49歳の女性では1,000人当たり約1件、50~59歳の女性では1,000人当たり約3件であったと結論している。[ 32 ]
逆に、より大規模な試験では、中間期がんは40~49歳の女性で有病率が高かったことが認められている。スクリーニングマンモグラフィで陰性であった後、12ヵ月以内に現れる中間期がんは通常は乳腺密度が高いためと考えられた。24ヵ月以内に現れる中間期がんは、乳腺密度が高いことによるマンモグラフィの感度低下、または腫瘍の急激な増殖に関係していた。[ 33 ]
正確度に関連する変数
患者の特徴
マンモグラフィの正確度は、女性の年齢、乳腺密度、最初の検査であるかその後の検査であるか、前回のマンモグラフィからの経過時間など、患者の特徴により異なることが指摘されている。若い女性では、高齢女性より感度が低く、偽陽性率が高い。
英国のMillion Women Studyは、50~64歳の女性において、閉経後にホルモン療法を使用している場合、以前に乳房手術を受けている場合、または肥満指数が25未満である場合に感度と特異度が低下することを明らかにした。[ 34 ]前回のマンモグラフィからの間隔が長い場合、感度、リコール率、がん検出率は高くなり、特異度は低くなる。[ 35 ]
感度は、検査を月経開始後またはホルモン療法の停止中に予定することで改善できる。[ 36 ]肥満の女性はマンモグラフィの結果が偽陽性となるリスクが20%以上高くなるが、感度に変化はない。[ 37 ]
デンスブレスト(高濃度乳腺)はマンモグラフィでの小さな腫瘤の検出を不明瞭にする場合があり、それによりマンモグラフィの感度が低下する。[ 10 ]いずれの年齢の女性でも、乳腺密度が高ければ特異度は10~29%低くなる。[ 26 ]高い乳腺密度は生来の体質であり、遺伝性である可能性があり[ 38 ][ 39 ]、年齢、内因性[ 40 ]および外因性[ 41 ][ 42 ]のホルモン[ 43 ]、タモキシフェンのような選択的エストロゲン受容体調節因子[ 44 ]、食事の影響も受ける場合がある。[ 45 ]ホルモン療法は高い乳腺密度、マンモグラフィでの感度低下、中間期がんの割合の増加と関連している。[ 46 ]
デジタルマンモグラフィはデンスブレストの検査においてフィルムマンモグラフィよりも正確である。[ 8 ]米国のほとんどの州では、マンモグラフィ検査施設が乳腺密度を報告するように法律で定めているが、複数のガイドラインで一貫性がないため、患者と医療提供者の間で混乱と不安が生じている。[ 47 ]
デンスブレスト組織は異常ではない。乳腺密度はマンモグラフィ画像において濃く映る乳房組織 vs 脂肪組織の割合の記述である。[ 48 ]American College of RadiologyのBI-RADSでは、乳腺密度を以下のように分類している:
- ほぼ完全に脂肪性。
- 散在性線維腺組織(scattered fibroglandular densities)。
- 不均一高濃度。
- きわめて高濃度。
後者2つのカテゴリーはデンスブレスト組織と考えられ、40~74歳の女性の43%にみられる乳房組織である。[ 49 ]放射線科医による乳腺密度の割り付けは主観的であり、すべての女性で割り付けは経時的に変化しうる。[ 49 ][ 50 ]
乳腺密度が乳がんリスクの増加に関連する一方で[ 51 ]、乳腺密度は乳がんに対する危険因子としてはごくわずかであり、乳がん死に対するリスクはあまり高くない。乳腺密度カテゴリーaと乳腺密度カテゴリーdを比較した場合の乳腺密度による乳がん発生リスクの増加は4倍である。
いくつかのグループにより、デンスブレスト女性のスクリーニングでは超音波検査または乳房磁気共鳴画像法(MRI)による補助的な画像検査が提唱されているが、この戦略により乳がん死亡率が低下することを示すデータは得られていない。これらの補助的スクリーニング検査を追加した場合の潜在的な有害性は偽陽性が増加する可能性であり、追加の画像検査および乳房生検とともに結果として不安と費用が付随する。[ 51 ]補助的スクリーニング検査ではまた乳がんの過剰診断が増加する可能性があり、結果として過剰治療が行われる。
腫瘍の特徴
粘液性がんおよび小葉がんはマンモグラフィで発見されやすい。急速に増殖するがんは正常な乳房組織とときに間違えられることがある(例、髄様がん、しばしばBRCA1変異および侵攻性の特徴と関連するが、治療に対して比較的良好な反応を示す場合があるまれなタイプの浸潤性乳管がん)。[ 29 ][ 52 ]進行が緩徐に見えることがあるBRCA1/2変異に関連した他の一部のがんもまた、見逃される場合がある。[ 53 ][ 54 ]
医師の特徴
放射線科医の能力には幅があり、経験値および放射線科医が読影したマンモグラム数による影響を受ける。[ 55 ]学術センターの放射線科医が推奨した生検では、地域の放射線科医の推奨による生検よりも陽性適中率(PPV)が高い。[ 56 ]乳房画像検査のフェローシップ・トレーニングが発見の向上につながる。[ 8 ]
能力は施設によっても異なる。マンモグラフィによるスクリーニングの正確度は、診断検査も行っている施設よりもスクリーニング検査のみを行っている施設での方が高かった。乳房画像検査専門家のスタッフを有し、二重読影に対して単独読影を行い、毎年2回以上読影監査による見直しを受けていた施設でも、正確度が高かった。[ 57 ]
医療過誤に関する関心が高い施設および弱い立場にある女性(人種または民族的少数派の女性および教育程度が低く、家計収入が少なく、非都市部在住の女性)にサービスを提供している施設では、偽陽性率が高い。[ 58 ]このような集団ではがんの有病率が高く、フォローアップが行われない可能性がある。[ 59 ]
国際的な比較
スクリーニングマンモグラフィを多国間で比較したところ、集約度の高いスクリーニングシステムと国で定めた品質保証プログラムのある国では特異度が高くなることが判明した。[ 60 ][ 61 ]
リコール率は、米国での方が英国よりも2倍高いが、がん発見率に違いはない。[ 60 ]
有病率 vs その後の検査と検査の間隔
がん診断の可能性は、有病率(初回)のスクリーニング検査時が最も高く、検診1,000件につき年齢に応じて9~26例のがんが見つかる。その可能性は追跡検査を重ねる間に低下して、がん診断はスクリーニング1,000件につき1~3例となる。[ 62 ]
スクリーニングマンモグラフィの至適実施間隔は不明である;プロトコルおよびスクリーニング間隔に違いがあるにも関わらず、試験間のばらつきはほとんどない。英国の1件のプロスペクティブ試験では、50~62歳の女性が1年ごとまたは3年ごとのマンモグラフィを受ける群にランダムに割り付けられた。腫瘍の悪性度およびリンパ節転移の状態は両群とも同程度であったが、3年ごとにスクリーニングを実施する群と比較した場合、1年ごとにスクリーニングを実施する群では、サイズがやや小さいがんが多く検出された。[ 63 ]
ある大規模な観察研究によると、40代女性で2年ごとに実施するスケジュールに従った群は、1年ごとの実施スケジュールに従った群に比べ、診断時に進行がんとなるリスクがわずかに増大した(28% vs 21%;オッズ比[OR]、1.35;95%CI、1.01-1.81)が、50代または60代女性ではスケジュールの違いに基づく差は認められなかった。[ 64 ][ 65 ]
フィンランドの研究では、40~49歳の女性14,765人を1年ごとのスクリーニング群または3年ごとのスクリーニング群のいずれかにランダムに割り付けた。3年ごとのスクリーニング群では100,738生存年での乳がんによる死亡者数が18人で、1年ごとのスクリーニング群では88,780生存年での乳がんによる死亡者数が18人であった(HR、0.88;95%CI、0.59-1.27)。[ 66 ]
乳がん死亡率に関するマンモグラフィによるスクリーニングの有益性
ランダム化比較試験(RCT)
乳がん死亡率に対するスクリーニングマンモグラフィの影響を調べるRCTが1963年から2015年に実施され、4ヵ国の50万人以上の女性が参加した。1件の試験、Canadian NBSS-2では、マンモグラフィと乳房視触診(CBE)の併用とCBEのみ実施した場合とが比較された;他の試験は、CBEを併用するまたは併用しないスクリーニングマンモグラフィを通常のケアと比較した。本試験の詳細な記述については、本要約のランダム化比較試験の付録のセクションを参照のこと。
これらの試験は、デザイン、被験者の募集方法、介入方法(スクリーニング、治療のいずれも)、対照群の管理、スクリーニング群と対照群への割り付けのコンプライアンス、転帰の解析法が異なっていた。個々のランダム化を用いた試験もあれば、コホートを特定してからスクリーニングを提示したクラスターランダム化を採用した試験もある;1件の試験では誕生日の日にち(月には関係なく)を基に非ランダムに割り付けしたのもあった。クラスターランダム化を行うと、ときに、介入群と対照群との間に不均衡が生じることになった。数件の試験で、年齢差があることが明らかになっているが、その差が試験成績に大きな影響を及ぼすことはなかった。[ 67 ]Edinburgh Trialでは、乳がん死リスクと相関する社会経済的状態が介入群と対照群で顕著に異なっていたため、試験成績の解釈が不可能となった。
これらの各試験で乳がん死亡率が主要な治療成績パラメータであったため、死因の帰属に細心の注意が必要となった。盲検化したモニタリング委員会(ニューヨーク)の使用や、全国死亡登録(スウェーデンの諸試験)などの独立したデータ供給元との連携が組み入れられたが、スクリーニング群または対照群の女性の死因の偏りのない帰属を確保することはできなかった。Two-County Trialで乳がん死の誤分類が生じ、スクリーニングを支持する結果へのバイアスが生じた可能性が示唆されている。[ 68 ]
また、これらの試験結果の解析に用いられた方法にも違いがあった。スウェーデンの5件の試験のうち4件では、対照群ではスクリーニングマンモグラフィを1回だけ行うようデザインされ、研究群で実施する一連のスクリーニングマンモグラフィの最終回に時期を合わせて実施した。これらの試験の初期解析では評価解析を用いて、試験で実施した最後のマンモグラフィ時またはその前までにがんが発見された女性で生じた乳がん死のみをカウントしている。これらの試験の一部では、最後のマンモグラフィを実施するのが遅れたため、対照群の女性に乳がんが発生するまたは乳がんと診断される期間が長くなった。追跡解析を用いた試験もあり、診断の時期とは無関係に、乳がんに起因する全死亡者数をカウントしている。このタイプの解析は、評価解析に関する懸念を受けて、スウェーデンの試験5件のうち4件のメタアナリシスで用いられた。[ 68 ]
国際的な監査および検証に関するデータの入手しやすさも異なっており、公的な監査を受けたのはカナダの試験でのみであった。他の試験はさまざまな程度の監査を受けているが、厳格さの程度は低かった。[ 69 ]
いかなる集団においても乳がん死が全死亡者数に占める割合がごく小さいことから、これらの研究はすべて全原因死亡率ではなく乳がん死亡率を研究すべくデザインされている。諸試験における全原因死亡率をレトロスペクティブに検討すると、Edinburgh Trialのみがその研究群における前述の社会経済的差に起因する差を示した。このほか、4件のスウェーデンの試験のメタアナリシス(追跡手法)でも、全原因死亡率において、わずかな改善が認められた。
スクリーニングに原因を求めることのできる乳がん死亡率の相対的改善は約15~20%であり、個人レベルでの絶対的改善ははるかに小さい。乳がんスクリーニングの潜在的有益性は、乳がんの早期発見によって生存が延長された数で表すことができる。[ 70 ][ 71 ]
RCTの結果は限定的期間の定期的検査での経験を表すものだが、実際には女性は生涯を通じて20~30年間スクリーニングを受ける。[ 65 ][ 72 ]
最大50年前に実施されたこのようなRCTを用いて、乳がん死亡率に対するスクリーニングの現在の有益性を推定するにあたってはいくつか問題が存在する。以下に問題の例を挙げる:
- マンモグラフィの技術の向上により、ますますわずかな異常が確認できるようになっていること。
- 一般集団における乳がんに対する意識の高まりにより、女性がより早期に評価と治療を求めるようになっていること。
- 集団における乳がんの危険因子(初潮年齢、初回妊娠年齢、肥満、閉経後のホルモン療法の使用など)の変化。
- 乳がんの治療法が改善し、より大きく、より進行したがんでも以前より治癒率が高くなっていること。
- 短期RCT(例、5~10年)の結果を適用しての乳がんスクリーニングの生涯にわたる影響の推定。
このような理由のため、現在のスクリーニングにより生じる乳がん死亡率低下の推定は、RCTに加え、運営の優れたコホート研究や地域相関研究に基づいて行われる。
集団ベースのスクリーニングプログラムの有効性
スクリーニングの有効性の推定は、スクリーニング集団 vs 非スクリーニング集団の非ランダム化比較研究、実在の地域社会でのスクリーニングのケースコントロール研究、および大規模集団を対象としたスクリーニングの影響を調べるモデリング研究から行うことができる。これらの研究は、乳がん治療法の改善や地域社会での乳がんに対する意識の向上といった、乳がん死亡率に影響を及ぼす関係のない傾向の影響をわずかに抑えるか、排除するようデザインされている必要がある。
スウェーデンから報告された3件の集団ベースの観察研究では、スクリーニングマンモグラフィ計画の有無における乳がん死亡率が比較された。1件の研究では、スウェーデンの25県のうち7県において隣接する2つの期間を比較し、スクリーニングにより乳がん死亡率が、統計的に有意な18~32%の低下を示したことが認められた。[ 73 ]この研究における最も重大なバイアスは、乳がん補助療法の有効性に劇的な改善がなされた期間にこれらの県でスクリーニングが開始されており、研究の著者らがこの変化に対処しなかったことである。2つ目の研究では、11年間にわたる検討で、スクリーニングプログラムを実施した7つの県と実施しなかった5つの県が比較された。[ 74 ]スクリーニングを支持する傾向がみられたが、ここでも著者らは補助療法の影響や治療の実践に影響しうる地理的差(都市部 vs 非都市部)を考慮しなかった。
3つ目の研究では治療の影響を説明するために県ごとの詳細な解析が行われた。スクリーニングによる影響はほとんどないことが認められたが、この結論はデザインと解析のいくつかの欠陥により弱いものとなっている。[ 75 ]
1975年にオランダのナイメーヘンで集団ベースのスクリーニングプログラムが実施され、ケースコホート研究でスクリーニングを受けた女性の死亡率がスクリーニングを受けなかった女性との比較で低下したことが認められた(OR、0.48)。[ 76 ]しかしながら、ナイメーヘンの乳がん死亡率とスクリーニングプログラムを実施しなかったオランダの隣市アルンヘムの乳がん死亡率を比較したその後の研究では、乳がん死亡率の差は示されなかった。[ 77 ]
1983年から1998年に実施された米国の高品質の医療システムでのスクリーニングを対象とした地域社会ベースのケースコントロール研究では、以前のスクリーニングと乳がん死亡率の低下との間に関連は見出されなかったが、マンモグラフィによるスクリーニング率は概して低かった。[ 78 ]
運営の優れた1件の地域相関研究で、医療制度の類似性および集団の構成で対応させた欧州の3組の隣国の比較が行われた(このうち一国では、国家的なスクリーニングプログラムが他国よりも数年早く開始されていた)。研究者たちは、各国で乳がん死亡率の低下がもたらされたが、対応する国どうしでのスクリーニングによる差は認められなかったことを明らかにした。死亡率の低下はスクリーニングによるものというよりも、乳がん治療および/または医療機関の改善によるものである可能性が高いことが、著者たちによって示唆された。[ 79 ]
2011年3月までに発表された地域相関研究および大規模コホート研究の系統的レビューで、乳がんスクリーニングをさまざまな時期に開始した50~69歳の女性の大規模集団における乳がん死亡率が比較された。17件の研究が選択基準を満たしたが、いずれの研究にも、対照群の相違点、乳がんリスクおよび乳がん治療の地域差に対する調整の不十分さ、そして比較された地域間での乳がん死亡率の測定値が類似していることに伴う問題といった方法論的な問題がみられた。研究間の結果には大きなばらつきがあり、4件の研究では33%以上の乳がん死亡率の相対的低下(広範な信頼区間を伴う)がみられ、5件の研究では乳がん死亡率における低下はみられなかった。乳がん死亡率の全般的な低下のうち、スクリーニングによるものはほんの一部であると考えられるため、このレビューでは、スクリーニングによる乳がん死亡率の相対的低下は10%程度であろうと結論付けられた。[ 80 ]
1976年から2008年に実施された米国の1件の地域相関分析で、40歳以上の女性に対する早期 vs 進行期乳がんの発生率が調査された。スクリーニングの効果を評価するため、著者らは早期がんの増加の大きさと進行がんの予想される減少の大きさを比較した。研究期間中、早期がん発生率の絶対的増加は女性10万人当たり122例であった一方、進行がんの絶対的減少は女性10万人当たり8例であった。ホルモン療法および他の不明な原因による発生率の変化の調整後、著者らは(1)乳がん死亡率に対するスクリーニングの有益性は小さく、(2)乳がんと診断されたうちの22~31%は過剰診断であり、(3)乳がん死亡率で認められた改善はおそらくはスクリーニングではなく、治療法の改善による可能性が高いと結論付けた。[ 81 ]
乳がん死亡率の減少に対するスクリーニング vs 治療の寄与、および過剰診断の大きさを概算するために、分析アプローチが用いられた。[ 82 ]40歳以上の女性において、米国での(マンモグラフィ導入前から)2012年(広く普及した後)までの乳がんの大きさの分布における変化が、SEERデータを用いて調査された。この期間中、臨床的に意義のある乳がんの割合が一定しているものと仮定された。著者らは、乳がん症例の致死率の低下とともに、比較的大きな(2cm以上)腫瘍の発生率の低下を認めた。比較的大きい腫瘍を有する女性の死亡率の低下は治療の改善によるものであった。大きさ別の症例の致死率の低下の3分の2は治療の改善によるものであった。
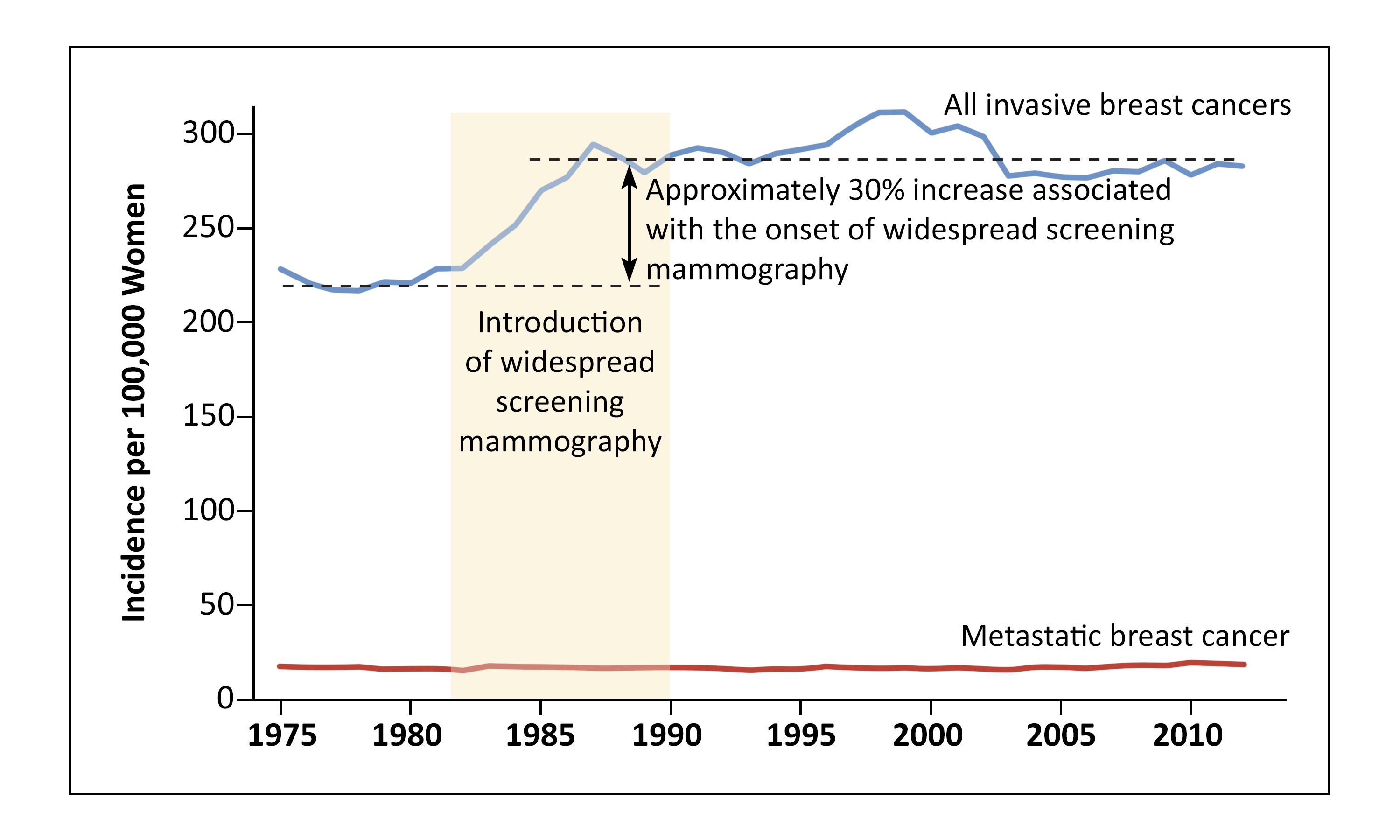
図2.スクリーニングマンモグラフィと浸潤性乳がん発生率の増加。1975年から2012年の期間中、Surveillance, Epidemiology, and End Results(SEER)プログラムの9つの場所で40歳以上の女性における全般的な浸潤性乳がんおよび転移性乳がんの発生率が示されている。From New England Journal of Medicine, Welch HG, Prorok PC, O'Malley AJ, Kramer BS, Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness, Volume 375, Issue 15, Pages 1438-47, Copyright © 2016 Massachusetts Medical Society.Massachusetts Medical Societyから許諾を得て転載。 米国における地域社会ベースのスクリーニングプログラムに関する1件のプロスペクティブ・コホート研究により、1年ごとのスクリーニングマンモグラフィは2年ごとのスクリーニングマンモグラフィと比較して、50~74歳の女性または乳房がきわめて濃く映ることのない40~49歳の女性において発見される予後不良な乳がんの割合を低下させないことが明らかにされた。乳房がきわめて濃く映る40~49歳の女性では、1年ごとのスクリーニングにより2.0cmを超えるがんが減少した(OR、2.39;95%CI、1.37-4.18)。[ 83 ]
40~74歳の女性を対象にカナダの12のスクリーニングプログラムの7つで実施された観察研究では、1990年から2009年の間に少なくとも1回のスクリーニングを受けた参加者(集団の85%)における乳がん死亡率がスクリーニングを受けなかった女性(集団の15%)の乳がん死亡率と比較された。抄録では、参加者における乳がん死亡率が平均40%であったと報告されているが、この研究のDiscussionの記載内容に基づくと、乳がん死亡率が40%低下したことを報告しようとした可能性が高い。[ 84 ]
この研究の制限として、全原因死亡率に関するデータがないこと、スクリーニングの程度、研究以外でのスクリーニング、研究以前のスクリーニング、予想された死亡率および非参加者の参照率の算出に用いられた手法、非参加者の生存率、州別の集団差、データベースの制限により参加者間で年齢および他の差を補正できなくなる程度、単一の州(ブリティッシュコロンビア)のサブスタディデータの一般化可能性、および選択バイアスの潜在的に大きな影響が挙げられた。全体として、この研究は重要なデータが不足しており、方法論およびデータ解析に制限があった。
米国における乳がん発生率と死亡率の統計モデル分析
スクリーニングの最適な実施間隔について、モデラーによる取り組みが行われている。モデリングでは正しくない可能性がある仮説を設ける;それでも、そのモデリングの信頼性は、そのモデルによりランダム化試験と一致する全体的な結果が得られる場合、およびそのモデルを使用して内挿または外挿される場合により高くなる。例えば、1年ごとのスクリーニングについてモデルの出力がRCTの結果と一致すれば、2年ごと vs 1年ごとのスクリーニングの相対的有効性の比較において信頼性がより高くなる。
2000年に米国国立がん研究所はモデリンググループ(Cancer Intervention and Surveillance Modeling Network[CISNET])のコンソーシアムを創設し、米国における乳がん死亡率に観察された減少に対するスクリーニングおよび補助療法の相対的寄与率の解明に取り組んだ。[ 85 ]これらのモデルでは、RCTの状況で予測されたものと同様な乳がん死亡率の減少が予測されたが、現代的な補助療法の使用に対して更新されていた。2009年に、CISNETモデラーにより、1年ごと vs 2年ごとのスクリーニングの比較を含めて、マンモグラフィの有害性および有益性に関するいくつかの課題への取り組みが行われた。[ 65 ]50~74歳の女性は、2年ごとにマンモグラフィを受けることで、1年ごとのスクリーニングの死亡率に関する有益性の大半を得ていた。スクリーニングを1年ごとから2年ごとに変更したために維持された乳がん死亡数の減少の範囲は6つのモデル群全体で72~95%に及び、中央値で80%であった。
1990年以降にみられる死亡率低下がどの程度スクリーニングのための画像技術の進歩によるものなのか、およびどの程度治療における有効性の改善の結果であるかに関するデータは限られている。6つのシミュレーションモデルに関する1件のCISNET研究において、2012年の乳がん死亡率低下の約1/3がスクリーニングによるものであり、治療によるものと均衡が取れていた。[ 86 ]このCISNET研究では、スクリーニングまたは治療を実施しない場合に2012年に推定されるベースラインの死亡率と比較して、全乳がん死亡率において推定された低下の平均は49%(モデルの範囲、39~58%)であった;この低下の37%(モデルの範囲、26~51%)がスクリーニングに関連し、この低下の63%(モデルの範囲、49~74%)が治療に関連した。
マンモグラフィによるスクリーニングの有害性
スクリーニングマンモグラフィの悪影響には、過剰診断(臨床的意義をもたないであろう真陽性)、偽陽性(検査の特異度に関係する)、偽陰性(検査の感度に関係する)、検査に伴う不快感、放射線曝露リスク、心理的有害性、経済的なストレス、および機会費用がある。
表1は、年1回のスクリーニングマンモグラフィを10年間にわたって受診した女性10,000人について推定されるスクリーニングマンモグラフィの有益性と有害性の概要を示している。[ 87 ]
表1.年1回のスクリーニングマンモグラフィを10年間にわたって受診した女性10,000人について推定されるスクリーニングマンモグラフィの有益性と有害性a 年齢、歳 マンモグラフィスクリーニングにより、次の15年間にわたって回避される乳がん死亡数 10年間に1回以上偽陽性結果となる数(95%CI) 10年間に1回以上の偽陽性結果が生検実施につながる数(95%CI) 臨床的には決して重要にならない乳がんまたはDCISが10年間に診断される数(過剰診断) CI = 信頼区間;DCIS = 非浸潤性(in situ)乳管がん。 a出典:Pace and Keating.[ 87 ] b回避された死亡数の出典:Welch and Passow.[ 88 ]下方限界は、(カナダの試験[ 89 ][ 90 ]の最小限の有益性に基づいて)乳がん死亡の相対リスクが0.95であった際の乳がん死亡の低下を示し、上方限界は、(スウェーデンの2-County Trial[ 91 ]に基づいて)相対リスクが0.64であった際の乳がん死亡の低下を示す。 c偽陽性および生検の推定値および95%信頼区間はHubbard et al.およびBraithwaite et al.において報告された10年累積リスクである。[ 92 ] [ 93 ] d過剰診断例数はWelch and Passowにより算出された。[ 88 ]下方限界はMalmö試験[ 94 ]の結果に基づく過剰診断であり、上方限界はBleyer and Welch[ 81 ]からの推定値である。 eWelch and Passow[ 88 ]により報告された過剰診断の下方限界推定値の出典はMalmö試験[ 94 ]であった。この研究には50歳未満の女性は登録されなかった。 40 1–16 6,130 (5,940–6,310) 700 (610–780) 50 3–32 6,130 (5,800–6,470) 940 (740–1,150) 60 5–49 4,970 (4,780–5,150) 980 (840–1,130) 過剰診断
過剰診断は、スクリーニングを実施しなければ臨床では決して明らかにならないであろうがんがスクリーニング手技によって発見される場合に起こる。こうしたがんの同定は患者に利益をもたらさない一方で、診断的手技およびがん治療の副作用が重大な有害性を引き起こす可能性があるため、特に重要である。過剰診断の大きさが、特に自然史が不明ながん前駆病変であるDCISに関して議論されている。このように診断時に腫瘍の挙動を確信的に予測できないことで、浸潤がんとDCISに対する標準治療法が過剰治療の原因となる可能性がある。関連する有害性には、治療関連の副作用およびがんの診断に伴ういくつかの有害性の数があり、これらは直ちに生じる。逆に、死亡率に関する有益性は将来の不定の時点で生じる。
過剰診断を解明するための1つのアプローチは、がん以外の原因で死亡した女性における潜伏がんの有病率を調べることである。7件の剖検研究の概要では、有病率の中央値は潜伏浸潤性乳がんで1.3%(範囲、0~1.8%)、DCISで8.9%(範囲、0~14.7%)であった。[ 95 ][ 96 ]
過剰診断は、スクリーニング受診集団とスクリーニング非受診集団における乳がん発生率を比較することで間接的に測定することができる。こうした比較では、時代、地理、健康行動、ホルモンの使用など、集団の差によって交絡が生じる可能性がある。過剰診断の算定はリードタイム・バイアスに対する調整において相違がみられることがある。[ 97 ][ 98 ]29件の研究の概要により、算定された過剰診断の割合は0~54%であり、ランダム化研究での割合は11~22%であったことが明らかにされた。[ 99 ]スクリーニング受診集団とスクリーニング非受診集団が同時に存在したデンマークでは、2つの異なる方法論が用いられ、浸潤がんの過剰診断の割合は14%および39%と算定された。DCISの症例を含めた場合、過剰診断の割合は24%および48%であった。2つ目の方法論はスクリーニング対象年齢より若い女性における地域差を考慮しており、より正確である可能性が高い。[ 100 ]
理論的には、ある集団において早期に発見される乳がんが増えると、その後の進行期がんの発生率が低下するはずである。現在までに研究されたいかなる集団においてもこの低下は起こっていない。したがって、より多くの早期がんの発見は過剰診断を意味している可能性が高い。オランダの集団ベースの研究では、スクリーニングで発見されたDCISを含むすべての乳がんの約半数が過剰診断を意味しており、スクリーニングに関連するかなりの割合の過剰診断を示した他の研究と一致している。[ 101 ]
ノルウェーの1件のコホート研究で、年齢と居住地に基づく適格性により、スクリーニングに適格な女性におけるがん発生率の増加と、スクリーニングに適格ではないより年齢の低い女性におけるがん発生率とが比較された。適格な女性では限局性がんの発生率が60%増加した(RR、1.60;95%CI、1.42-1.79)一方、進行がん発生率は2群間で同程度のままであった(RR、1.08;95%CI、0.86-1.35)。[ 102 ]
米国の異なる郡を比較した集団研究では、スクリーニングマンモグラフィの利用率が高いほど乳がん診断率が高かったが、それに対応する10年乳がん死亡率における低下はみられなかったことが示された。[ 103 ]この研究の強みは、非常に大規模であること(1600万人の女性)と郡間で観察された相関の強さおよび一貫性が挙げられる。この研究の限界には、マンモグラフィの自己報告、スクリーニング受診率推定での2年の期間の使用、解析期間(閉経期のホルモン使用が行われていた時期)がある。[ 103 ]
ランダム化臨床試験であるCanadian NBSSで過剰診断の程度が推定されている。5回のスクリーニング検査終了時に、マンモグラフィ受診群では対照群と比較して浸潤性乳がんの診断が142例多かった。[ 104 ]15年経過時に対照群と比較したマンモグラフィ受診群のがん症例の過剰数は106例であり、スクリーニングで発見された484例の浸潤がんに対する過剰診断の割合が22%であったことを意味している。[ 104 ]
スクリーニングマンモグラフィの結果として、現在、挙動が緩徐な多数の乳がんが同定されており、潜在的な過剰治療を引き起こしている。早期乳がん患者においてタモキシフェン vs 全身療法なしを比較したランダム化試験の2回目の解析において、著者らは70-gene MammaPrintアッセイを利用し、15%の患者が超低リスクであることを確認した(20年疾患特異的生存率はタモキシフェン群で97%で対照群で94%であった)。したがって、これらの患者は手術単独できわめて良好な転帰を有する可能性が高い。スクリーニング集団におけるこうした超低リスクがんの頻度は、およそ25%であろう。70-gene MammaPrintアッセイなどのツールは将来、これらのがんの同定に用いられる可能性があり、これにより過剰治療のリスクが低下する。ただし、こうした所見を確認するために追加の研究が必要である。[ 105 ]
2016年に、25年間の追跡を実施したランダム化スクリーニング試験であるCanadian NBSSでは、マンモグラフィスクリーニングによる年齢層別の乳がんの過剰診断を再評価し、40~49歳の女性においてスクリーニングで発見された浸潤がんの約30%および50~59歳の女性においてスクリーニングで発見された浸潤がんの最大20%が過剰診断であったと結論付けた。非浸潤性(in situ)がんを含めると、過剰診断の推定リスクは40~49歳の女性で40%および50~59歳の女性で30%である。過剰診断は、対照群と比較したスクリーニング群において持続する過剰な発生率をスクリーニングで発見された症例数で除したものとして計算された(過剰発生率法)。 この方法を利用して過剰診断を適切に推定するための要件には、以下のものが含まれた:
- 試験のスクリーニングプロトコルが完了している場合は、スクリーニング群の参加者はスクリーニングを停止すること。
- スクリーニング停止後の追跡は、スクリーニングで発見された症例における最も長いリードタイム(スクリーニングで発見されたがんの確認とスクリーニングが行われなかった場合にそのがんに症状が現れて診断されるまでの間の期間)と同じだけの期間が必要である。
- ランダム化試験の対照群と同様に、スクリーニング群におけるスクリーニング中およびスクリーニング停止後のがん発生に対する比較集団は、スクリーニングが実施されていないが同等のがんリスクを有する個人で構成する必要がある。
- 試験プロトコルのスクリーニング期間中、スクリーニング群におけるスクリーニングに伴うコンプライアンスは高く、対照群における混合(プロトコル以外のスクリーニング)は低いこと。
カナダ全域で集団ベースのスクリーニングが最短でも2年、ほとんどの場合5~10年後まで利用できなくなったこと(これにより、試験スクリーニング期間後のスクリーニングが中止され、リードタイムのほとんどの推定値よりも長期の追跡が可能となった)、混合は最小限となっていることが証明されていること、および個別のランダム化によって2つの試験群間で44の人口統計学的因子および危険因子がほとんど同じように分散されたことにより、CNBSSではこれらの条件の大部分が満たされた。
1988年における試験スクリーニング期間の終結以降、スクリーニングの質、強度、勧誘された年齢層、生検の閾値における差によって、これらの結果の一般化可能性が低下している。これらの因子および画像検査技術/質の向上および生検に対する低い閾値は、浸潤がんの過剰診断の推定値よりも非浸潤性(in situ)がんの過剰診断の推定値の低下に貢献している可能性が高い。[ 106 ]
上記の表1は、10,000人の女性の10年間にわたるスクリーニングの結果であり、臨床的には決して重要なものとならない(過剰診断)乳がんまたはDCISを有する女性の推定数を示している。旧技術のマンモグラフィおよびCBEを用いたHealth Insurance Plan研究では過剰診断はおそらく認められなかった。改善された技術を用いたマンモグラフィの時代では過剰診断がより顕著になっている。しかしながら、技術の向上により死亡率が元の技術よりさらに低下すると示されたわけではない。要約すると、乳がんの過剰診断は複雑な話題である。多くのさまざまな方法を用いた諸研究により、広範な推定値が報告されており、新たながん症例が過剰診断されたものであるのか、あるいは患者に真に害を及ぼすものであるのかを評価する方法は現在のところ存在しない。[ 87 ]
偽陽性による追加介入
スクリーニングを受診した女性1,000人のうち乳がんがあるのは5人未満であるため、マンモグラフィの特異度を90%としても(すなわち、乳がんのない全女性のうち90%がマンモグラフィの陰性所見を得る)、マンモグラフィの異常所見のほとんどは偽陽性である。[ 62 ]
このようなマンモグラフィの高い偽陽性率は過小評価されており、基準謬論として知られる統計に基づく認知バイアスのために直感に反したものにみえる場合がある。乳がんのベースになる発生率は低い(5/1,000)ため、この偽陽性率は、非常に正確な検査を利用した場合でさえ、真陽性率を大きく上回る。
約90%というマンモグラフィの真陽性率は、乳がんを有する女性のうち約90%が陽性所見を示すということである。90%という真陰性率は、乳がんのない女性のうち、90%が陰性所見を示すということである。1,000人について10%の偽陽性率があるということは、1,000人中100人が偽陽性となるということである。1,000人の女性のうち5人に乳がんがある場合、乳がんを有する女性4.5人が陽性所見を示す。別の言い方をすれば、4.5人の真陽性例ごとに約100例の偽陽性例が生じるということである。
さらに、スクリーニングマンモグラフィの結果が異常であれば、懸念領域のマンモグラフィ、超音波検査、MRI、および組織採取(穿刺吸引法、コア生検、または切除生検による)などの追加の検査や手技が促される。全体として、不要な検査や治療による有害性は、早期発見の有益性に照らして評価する必要がある。
健康維持機構に加入している女性2,400人における乳がんスクリーニング研究では、10年間に88例のがんが診断され、そのうち58例がマンモグラフィで同定されたことが分かった。被験者の3分の1に、追加検査を必要とするマンモグラフィ異常所見が認められて、539人に追加のマンモグラフィ、186人に超音波検査、188人に生検が実施された。マンモグラフィの異常所見による累積生検率(真の陽性率)は、約1/4(23.6%)であった。この母集団におけるスクリーニングマンモグラフィ異常所見でのPPVは、40~49歳の女性で6.3%、50~59歳で6.6%、60~69歳で7.8%であった。[ 107 ]同じ女性コホートから得られたデータの継続解析とモデリングでは、マンモグラフィで少なくとも1回偽陽性となるリスクは、初回マンモグラフィで7.4%(95%CI、6.4%-8.5%)、5回までのマンモグラフィで26.0%(95%CI、24.0%-28.2%)、9回までのマンモグラフィで43.1%(95%CI、36.6%-53.6%)と推定された。[ 108 ]少なくとも1回偽陽性である累積リスクは、4つの患者の変数(比較的年齢が低いこと、以前の乳房生検回数が多いこと、乳がんの家族歴、および現在のエストロゲン使用)と3つのX線の変数(スクリーニングの間隔が長いこと、現在および以前のマンモグラフィの比較を行えないこと、およびマンモグラフィを異常と解釈する放射線科医それぞれの傾向)によって異なった。全体的に見て、偽陽性のマンモグラフィの原因となる最大の因子は、放射線科医それぞれがマンモグラフィを異常と読影する傾向であった。
地域社会ベースのスクリーニングに関する1件のプロスペクティブ・コホート研究により、1年ごとにスクリーニングを受けた女性が10年後に少なくとも1回のスクリーニングで偽陽性を経験する割合は、乳腺密度に関係なく、2年ごとにスクリーニングを受けた女性における割合よりも高いことが明らかにされた。散在性線維腺組織(scattered fibroglandular densities)を有する女性について、40歳代でのこの差は68.9%(1年ごと) vs 46.3%(2年ごと)であった。この乳腺組織を有する集団の50~74歳の女性における差は、49.8%(1年ごと) vs 30.7%(2年ごと)であった。[ 83 ]
表1に示されているように、年1回のスクリーニングマンモグラフィを10年間にわたって受診した女性10,000人のうち、少なくとも1回は検査結果が偽陽性となる女性の推定数は、40~50歳で6,130人、60歳で4,970人である。偽陽性の検査結果が生検実施につながる女性の数は年齢によって700~980人に及ぶと推定されている。[ 87 ]
偽陰性による誤った安心感
マンモグラフィの感度は、読影を行う放射線科医の特徴(経験の程度)および女性の特徴(年齢、乳房密度、ホルモン状態および食事)に応じて、70~90%の幅がある。平均感度を80%と仮定すると、マンモグラムはスクリーニング時に存在している乳がんの約20%を見落とすことになる(偽陰性)。見落とされたこれらのがんの多くが高リスクであり、有害な生物学的特徴を有する。正常なマンモグラムであるために女性または担当医が乳房の症状の評価を中止または延期すると、女性が有害な結果を被る可能性がある。このため、マンモグラフィが陰性であったからといって、女性や担当医は乳房の症状の追加評価を決して中止するべきではない。
不快感
女性の位置決めおよび乳房の圧迫によって動きの人為的結果が減少し、マンモグラムの画像の質が向上する。マンモグラフィを受診した女性の90%が疼痛および/または不快感を報告しており、女性の12%はその感覚を強いまたは耐えられないものと評価した。[ 109 ]マンモグラフィに伴う疼痛および不快感について調査した22件の研究の系統的レビューでは大きなばらつきが認められ、その一部は月経周期の段階、不安、およびマンモグラフィ前の疼痛の予期に関連していた。[ 110 ]
放射線曝露
放射線関連の乳がんの主要危険因子は曝露時の若年齢および線量であるが、まれに放射線誘発性の損傷に対する遺伝的脆弱性を有する女性がおり、この場合はいかなる年齢でも放射線曝露を避ける必要がある。[ 111 ][ 112 ]40歳以上の女性の多くでは、スクリーニングマンモグラフィで得られる可能性のある有益性はリスクを上回る。[ 113 ][ 111 ][ 114 ] 標準2方向スクリーニングマンモグラフィによる乳房に対する曝露の平均線量は4mSvであり、全身に対しては0.29mSvである。[ 112 ][ 115 ]したがって、40歳から80歳まで年1回のマンモグラフィを受けた女性1,000人につき、最大で1件の乳がんが引き起こされる可能性がある。放射線量を増やす必要のある大きな乳房をもつ女性や、追加の撮影を必要とする豊胸を行った女性では、このようなリスクは倍増する。放射線誘発乳がんは、40歳で毎年スクリーニングを開始する場合より、50歳で2年ごとのスクリーニングを開始する女性の方が5倍減らすことができる。[ 116 ]
偽陽性の心理的有害性
スクリーニングマンモグラフィから3ヵ月経過した時点で実施された308人の女性の電話調査法では、追加検査のために呼び戻された女性68人のうち約1/4が、その検査でがんの可能性が否定されたにもかかわらず、その時点でも気分や機能を損なうほどの不安に苛まれていることが明らかになった。[ 117 ]偽陽性の検査結果の心理的影響が長期に及ぶかどうかに関する調査では相反する結果が得られた。2002年のスペインにおけるコホート研究では、偽陽性のマンモグラフィ結果を受け取った後の女性に対する即時の心理的影響が明らかにされたが、これらの結果は2~3ヵ月以内に消失した。[ 118 ]偽陽性の検査結果を受けてから数年後の心理的影響を測定した2013年のデンマークにおけるコホート研究では、長期にわたるマイナスの心理的結果が明らかにされた。[ 119 ]数件の研究は、偽陽性の検査結果の評価後の不安が原因となって、その後のスクリーニング検査への参加が増大したことを示している。[ 120 ][ 121 ][ 122 ][ 123 ]
経済的負担と機会費用
スクリーニングのこのような潜在的有害性については十分な研究が行われていないが、それらが存在することは明らかである。
参考文献- Siu AL; U.S. Preventive Services Task Force: Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 164 (4): 279-96, 2016.[PUBMED Abstract]
- Sickles EA: Findings at mammographic screening on only one standard projection: outcomes analysis. Radiology 208 (2): 471-5, 1998.[PUBMED Abstract]
- Dibden A, Offman J, Parmar D, et al.: Reduction in interval cancer rates following the introduction of two-view mammography in the UK breast screening programme. Br J Cancer 110 (3): 560-4, 2014.[PUBMED Abstract]
- Lillie-Blanton M: Mammography Quality Standards Act : X-ray Quality Improved, Access Unaffected, but Impact on Health Outcomes Unknown: Testimony Before the Subcommittee on Health and the Environment, Committee on Commerce, House of Representatives. Washington, D.C.: Committee on Commerce, 1998. Available online. Last accessed March 11, 2020.[PUBMED Abstract]
- D'Orsi CJ, Sickles EA, Mendelson EB, et al.: ACR BI-RADS Atlas, Breast Imaging Reporting and Data System. 5th ed. Reston, Va: American College of Radiology, 2013. Also available online. Last accessed March 11, 2020.[PUBMED Abstract]
- Rosenberg RD, Yankaskas BC, Abraham LA, et al.: Performance benchmarks for screening mammography. Radiology 241 (1): 55-66, 2006.[PUBMED Abstract]
- Sickles EA, D'Orsi CJ, Bassett LW, et al.: ACR BI-RADS Mammography. In: D'Orsi CJ, Sickles EA, Mendelson EB, et al.: ACR BI-RADS Atlas, Breast Imaging Reporting and Data System. 5th ed. Reston, Va: American College of Radiology, 2013, pp 3-171. Also available online. Last accessed March 11, 2020.[PUBMED Abstract]
- Pisano ED, Gatsonis C, Hendrick E, et al.: Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 353 (17): 1773-83, 2005.[PUBMED Abstract]
- Pisano ED, Hendrick RE, Yaffe MJ, et al.: Diagnostic accuracy of digital versus film mammography: exploratory analysis of selected population subgroups in DMIST. Radiology 246 (2): 376-83, 2008.[PUBMED Abstract]
- Kerlikowske K, Hubbard RA, Miglioretti DL, et al.: Comparative effectiveness of digital versus film-screen mammography in community practice in the United States: a cohort study. Ann Intern Med 155 (8): 493-502, 2011.[PUBMED Abstract]
- van Luijt PA, Fracheboud J, Heijnsdijk EA, et al.: Nation-wide data on screening performance during the transition to digital mammography: observations in 6 million screens. Eur J Cancer 49 (16): 3517-25, 2013.[PUBMED Abstract]
- Souza FH, Wendland EM, Rosa MI, et al.: Is full-field digital mammography more accurate than screen-film mammography in overall population screening? A systematic review and meta-analysis. Breast 22 (3): 217-24, 2013.[PUBMED Abstract]
- Gur D, Sumkin JH, Rockette HE, et al.: Changes in breast cancer detection and mammography recall rates after the introduction of a computer-aided detection system. J Natl Cancer Inst 96 (3): 185-90, 2004.[PUBMED Abstract]
- Ciatto S, Del Turco MR, Risso G, et al.: Comparison of standard reading and computer aided detection (CAD) on a national proficiency test of screening mammography. Eur J Radiol 45 (2): 135-8, 2003.[PUBMED Abstract]
- Fenton JJ, Taplin SH, Carney PA, et al.: Influence of computer-aided detection on performance of screening mammography. N Engl J Med 356 (14): 1399-409, 2007.[PUBMED Abstract]
- Elmore JG, Carney PA: Computer-aided detection of breast cancer: has promise outstripped performance? J Natl Cancer Inst 96 (3): 162-3, 2004.[PUBMED Abstract]
- Fenton JJ, Xing G, Elmore JG, et al.: Short-term outcomes of screening mammography using computer-aided detection: a population-based study of medicare enrollees. Ann Intern Med 158 (8): 580-7, 2013.[PUBMED Abstract]
- Lehman CD, Wellman RD, Buist DS, et al.: Diagnostic Accuracy of Digital Screening Mammography With and Without Computer-Aided Detection. JAMA Intern Med 175 (11): 1828-37, 2015.[PUBMED Abstract]
- Killelea BK, Long JB, Chagpar AB, et al.: Evolution of breast cancer screening in the Medicare population: clinical and economic implications. J Natl Cancer Inst 106 (8): , 2014.[PUBMED Abstract]
- Fujii MH, Herschorn SD, Sowden M, et al.: Detection Rates for Benign and Malignant Diagnoses on Breast Cancer Screening With Digital Breast Tomosynthesis in a Statewide Mammography Registry Study. AJR Am J Roentgenol 212 (3): 706-711, 2019.[PUBMED Abstract]
- Joensuu H, Lehtimäki T, Holli K, et al.: Risk for distant recurrence of breast cancer detected by mammography screening or other methods. JAMA 292 (9): 1064-73, 2004.[PUBMED Abstract]
- Shen Y, Yang Y, Inoue LY, et al.: Role of detection method in predicting breast cancer survival: analysis of randomized screening trials. J Natl Cancer Inst 97 (16): 1195-203, 2005.[PUBMED Abstract]
- Wishart GC, Greenberg DC, Britton PD, et al.: Screen-detected vs symptomatic breast cancer: is improved survival due to stage migration alone? Br J Cancer 98 (11): 1741-4, 2008.[PUBMED Abstract]
- Moody-Ayers SY, Wells CK, Feinstein AR: "Benign" tumors and "early detection" in mammography-screened patients of a natural cohort with breast cancer. Arch Intern Med 160 (8): 1109-15, 2000.[PUBMED Abstract]
- Carney PA, Miglioretti DL, Yankaskas BC, et al.: Individual and combined effects of age, breast density, and hormone replacement therapy use on the accuracy of screening mammography. Ann Intern Med 138 (3): 168-75, 2003.[PUBMED Abstract]
- Rosenberg RD, Hunt WC, Williamson MR, et al.: Effects of age, breast density, ethnicity, and estrogen replacement therapy on screening mammographic sensitivity and cancer stage at diagnosis: review of 183,134 screening mammograms in Albuquerque, New Mexico. Radiology 209 (2): 511-8, 1998.[PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Likelihood ratios for modern screening mammography. Risk of breast cancer based on age and mammographic interpretation. JAMA 276 (1): 39-43, 1996.[PUBMED Abstract]
- New PIAA Study Analyzes Diagnosis and Treatment of Breast Cancer [News Release]. Rockville, MD: Physician's Insurance Association of America, 2013. Available online. Last accessed March 11, 2020.[PUBMED Abstract]
- Porter PL, El-Bastawissi AY, Mandelson MT, et al.: Breast tumor characteristics as predictors of mammographic detection: comparison of interval- and screen-detected cancers. J Natl Cancer Inst 91 (23): 2020-8, 1999.[PUBMED Abstract]
- Hakama M, Holli K, Isola J, et al.: Aggressiveness of screen-detected breast cancers. Lancet 345 (8944): 221-4, 1995.[PUBMED Abstract]
- Tabár L, Faberberg G, Day NE, et al.: What is the optimum interval between mammographic screening examinations? An analysis based on the latest results of the Swedish two-county breast cancer screening trial. Br J Cancer 55 (5): 547-51, 1987.[PUBMED Abstract]
- Payne JI, Caines JS, Gallant J, et al.: A review of interval breast cancers diagnosed among participants of the Nova Scotia Breast Screening Program. Radiology 266 (1): 96-103, 2013.[PUBMED Abstract]
- Buist DS, Porter PL, Lehman C, et al.: Factors contributing to mammography failure in women aged 40-49 years. J Natl Cancer Inst 96 (19): 1432-40, 2004.[PUBMED Abstract]
- Banks E, Reeves G, Beral V, et al.: Influence of personal characteristics of individual women on sensitivity and specificity of mammography in the Million Women Study: cohort study. BMJ 329 (7464): 477, 2004.[PUBMED Abstract]
- Yankaskas BC, Taplin SH, Ichikawa L, et al.: Association between mammography timing and measures of screening performance in the United States. Radiology 234 (2): 363-73, 2005.[PUBMED Abstract]
- American Cancer Society: Breast Density and Your Mammogram Report. Atlanta, Ga: American Cancer Society, 2017. Available online. Last accessed date March 11, 2020.[PUBMED Abstract]
- Elmore JG, Carney PA, Abraham LA, et al.: The association between obesity and screening mammography accuracy. Arch Intern Med 164 (10): 1140-7, 2004.[PUBMED Abstract]
- Pankow JS, Vachon CM, Kuni CC, et al.: Genetic analysis of mammographic breast density in adult women: evidence of a gene effect. J Natl Cancer Inst 89 (8): 549-56, 1997.[PUBMED Abstract]
- Boyd NF, Dite GS, Stone J, et al.: Heritability of mammographic density, a risk factor for breast cancer. N Engl J Med 347 (12): 886-94, 2002.[PUBMED Abstract]
- White E, Velentgas P, Mandelson MT, et al.: Variation in mammographic breast density by time in menstrual cycle among women aged 40-49 years. J Natl Cancer Inst 90 (12): 906-10, 1998.[PUBMED Abstract]
- Harvey JA, Pinkerton JV, Herman CR: Short-term cessation of hormone replacement therapy and improvement of mammographic specificity. J Natl Cancer Inst 89 (21): 1623-5, 1997.[PUBMED Abstract]
- Laya MB, Larson EB, Taplin SH, et al.: Effect of estrogen replacement therapy on the specificity and sensitivity of screening mammography. J Natl Cancer Inst 88 (10): 643-9, 1996.[PUBMED Abstract]
- Baines CJ, Dayan R: A tangled web: factors likely to affect the efficacy of screening mammography. J Natl Cancer Inst 91 (10): 833-8, 1999.[PUBMED Abstract]
- Brisson J, Brisson B, Coté G, et al.: Tamoxifen and mammographic breast densities. Cancer Epidemiol Biomarkers Prev 9 (9): 911-5, 2000.[PUBMED Abstract]
- Boyd NF, Greenberg C, Lockwood G, et al.: Effects at two years of a low-fat, high-carbohydrate diet on radiologic features of the breast: results from a randomized trial. Canadian Diet and Breast Cancer Prevention Study Group. J Natl Cancer Inst 89 (7): 488-96, 1997.[PUBMED Abstract]
- Crouchley K, Wylie E, Khong E: Hormone replacement therapy and mammographic screening outcomes in Western Australia. J Med Screen 13 (2): 93-7, 2006.[PUBMED Abstract]
- DenseBreast-info: Legislation and Regulations for Dense Breast [News]. Deer Park, NY: DenseBreast-info, Inc., 2019. Available online. May 6, 2019.[PUBMED Abstract]
- Melnikow J, Fenton JJ, Whitlock EP, et al.: Supplemental Screening for Breast Cancer in Women With Dense Breasts: A Systematic Review for the U.S. Preventive Services Task Force. Ann Intern Med 164 (4): 268-78, 2016.[PUBMED Abstract]
- Sprague BL, Gangnon RE, Burt V, et al.: Prevalence of mammographically dense breasts in the United States. J Natl Cancer Inst 106 (10): , 2014.[PUBMED Abstract]
- Ho JM, Jafferjee N, Covarrubias GM, et al.: Dense breasts: a review of reporting legislation and available supplemental screening options. AJR Am J Roentgenol 203 (2): 449-56, 2014.[PUBMED Abstract]
- Smetana GW, Elmore JG, Lee CI, et al.: Should This Woman With Dense Breasts Receive Supplemental Breast Cancer Screening?: Grand Rounds Discussion From Beth Israel Deaconess Medical Center. Ann Intern Med 169 (7): 474-484, 2018.[PUBMED Abstract]
- Wallis MG, Walsh MT, Lee JR: A review of false negative mammography in a symptomatic population. Clin Radiol 44 (1): 13-5, 1991.[PUBMED Abstract]
- Tilanus-Linthorst M, Verhoog L, Obdeijn IM, et al.: A BRCA1/2 mutation, high breast density and prominent pushing margins of a tumor independently contribute to a frequent false-negative mammography. Int J Cancer 102 (1): 91-5, 2002.[PUBMED Abstract]
- Ganott MA, Harris KM, Klaman HM, et al.: Analysis of False-Negative Cancer Cases Identified with a Mammography Audit. Breast J 5 (3): 166-175, 1999.[PUBMED Abstract]
- Elmore JG, Jackson SL, Abraham L, et al.: Variability in interpretive performance at screening mammography and radiologists' characteristics associated with accuracy. Radiology 253 (3): 641-51, 2009.[PUBMED Abstract]
- Meyer JE, Eberlein TJ, Stomper PC, et al.: Biopsy of occult breast lesions. Analysis of 1261 abnormalities. JAMA 263 (17): 2341-3, 1990.[PUBMED Abstract]
- Taplin S, Abraham L, Barlow WE, et al.: Mammography facility characteristics associated with interpretive accuracy of screening mammography. J Natl Cancer Inst 100 (12): 876-87, 2008.[PUBMED Abstract]
- Jackson SL, Taplin SH, Sickles EA, et al.: Variability of interpretive accuracy among diagnostic mammography facilities. J Natl Cancer Inst 101 (11): 814-27, 2009.[PUBMED Abstract]
- Goldman LE, Walker R, Miglioretti DL, et al.: Accuracy of diagnostic mammography at facilities serving vulnerable women. Med Care 49 (1): 67-75, 2011.[PUBMED Abstract]
- Smith-Bindman R, Chu PW, Miglioretti DL, et al.: Comparison of screening mammography in the United States and the United kingdom. JAMA 290 (16): 2129-37, 2003.[PUBMED Abstract]
- Elmore JG, Nakano CY, Koepsell TD, et al.: International variation in screening mammography interpretations in community-based programs. J Natl Cancer Inst 95 (18): 1384-93, 2003.[PUBMED Abstract]
- Kerlikowske K, Grady D, Barclay J, et al.: Positive predictive value of screening mammography by age and family history of breast cancer. JAMA 270 (20): 2444-50, 1993.[PUBMED Abstract]
- The Breast Screening Frequency Trial Group: The frequency of breast cancer screening: results from the UKCCCR Randomised Trial. United Kingdom Co-ordinating Committee on Cancer Research. Eur J Cancer 38 (11): 1458-64, 2002.[PUBMED Abstract]
- White E, Miglioretti DL, Yankaskas BC, et al.: Biennial versus annual mammography and the risk of late-stage breast cancer. J Natl Cancer Inst 96 (24): 1832-9, 2004.[PUBMED Abstract]
- Mandelblatt JS, Cronin KA, Bailey S, et al.: Effects of mammography screening under different screening schedules: model estimates of potential benefits and harms. Ann Intern Med 151 (10): 738-47, 2009.[PUBMED Abstract]
- Parvinen I, Chiu S, Pylkkänen L, et al.: Effects of annual vs triennial mammography interval on breast cancer incidence and mortality in ages 40-49 in Finland. Br J Cancer 105 (9): 1388-91, 2011.[PUBMED Abstract]
- Gøtzsche PC, Olsen O: Is screening for breast cancer with mammography justifiable? Lancet 355 (9198): 129-34, 2000.[PUBMED Abstract]
- Gøtzsche PC, Nielsen M: Screening for breast cancer with mammography. Cochrane Database Syst Rev (4): CD001877, 2006.[PUBMED Abstract]
- Nyström L, Andersson I, Bjurstam N, et al.: Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet 359 (9310): 909-19, 2002.[PUBMED Abstract]
- Kerlikowske K: Efficacy of screening mammography among women aged 40 to 49 years and 50 to 69 years: comparison of relative and absolute benefit. J Natl Cancer Inst Monogr (22): 79-86, 1997.[PUBMED Abstract]
- Glasziou PP, Woodward AJ, Mahon CM: Mammographic screening trials for women aged under 50. A quality assessment and meta-analysis. Med J Aust 162 (12): 625-9, 1995.[PUBMED Abstract]
- Nelson HD, Tyne K, Naik A, et al.: Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med 151 (10): 727-37, W237-42, 2009.[PUBMED Abstract]
- Duffy SW, Tabár L, Chen HH, et al.: The impact of organized mammography service screening on breast carcinoma mortality in seven Swedish counties. Cancer 95 (3): 458-69, 2002.[PUBMED Abstract]
- Jonsson H, Nyström L, Törnberg S, et al.: Service screening with mammography of women aged 50-69 years in Sweden: effects on mortality from breast cancer. J Med Screen 8 (3): 152-60, 2001.[PUBMED Abstract]
- Autier P, Koechlin A, Smans M, et al.: Mammography screening and breast cancer mortality in Sweden. J Natl Cancer Inst 104 (14): 1080-93, 2012.[PUBMED Abstract]
- Broeders MJ, Peer PG, Straatman H, et al.: Diverging breast cancer mortality rates in relation to screening? A comparison of Nijmegen to Arnhem and the Netherlands, 1969-1997. Int J Cancer 92 (2): 303-8, 2001.[PUBMED Abstract]
- Verbeek AL, Hendriks JH, Holland R, et al.: Reduction of breast cancer mortality through mass screening with modern mammography. First results of the Nijmegen project, 1975-1981. Lancet 1 (8388): 1222-4, 1984.[PUBMED Abstract]
- Elmore JG, Reisch LM, Barton MB, et al.: Efficacy of breast cancer screening in the community according to risk level. J Natl Cancer Inst 97 (14): 1035-43, 2005.[PUBMED Abstract]
- Autier P, Boniol M, Gavin A, et al.: Breast cancer mortality in neighbouring European countries with different levels of screening but similar access to treatment: trend analysis of WHO mortality database. BMJ 343: d4411, 2011.[PUBMED Abstract]
- Harris R, Yeatts J, Kinsinger L: Breast cancer screening for women ages 50 to 69 years a systematic review of observational evidence. Prev Med 53 (3): 108-14, 2011.[PUBMED Abstract]
- Bleyer A, Welch HG: Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med 367 (21): 1998-2005, 2012.[PUBMED Abstract]
- Welch HG, Prorok PC, O'Malley AJ, et al.: Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness. N Engl J Med 375 (15): 1438-1447, 2016.[PUBMED Abstract]
- Kerlikowske K, Zhu W, Hubbard RA, et al.: Outcomes of screening mammography by frequency, breast density, and postmenopausal hormone therapy. JAMA Intern Med 173 (9): 807-16, 2013.[PUBMED Abstract]
- Coldman A, Phillips N, Wilson C, et al.: Pan-Canadian study of mammography screening and mortality from breast cancer. J Natl Cancer Inst 106 (11): , 2014.[PUBMED Abstract]
- Berry DA, Cronin KA, Plevritis SK, et al.: Effect of screening and adjuvant therapy on mortality from breast cancer. N Engl J Med 353 (17): 1784-92, 2005.[PUBMED Abstract]
- Plevritis SK, Munoz D, Kurian AW, et al.: Association of Screening and Treatment With Breast Cancer Mortality by Molecular Subtype in US Women, 2000-2012. JAMA 319 (2): 154-164, 2018.[PUBMED Abstract]
- Pace LE, Keating NL: A systematic assessment of benefits and risks to guide breast cancer screening decisions. JAMA 311 (13): 1327-35, 2014.[PUBMED Abstract]
- Welch HG, Passow HJ: Quantifying the benefits and harms of screening mammography. JAMA Intern Med 174 (3): 448-54, 2014.[PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 137 (5 Part 1): 305-12, 2002.[PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000.[PUBMED Abstract]
- Tabár L, Vitak B, Chen TH, et al.: Swedish two-county trial: impact of mammographic screening on breast cancer mortality during 3 decades. Radiology 260 (3): 658-63, 2011.[PUBMED Abstract]
- Hubbard RA, Kerlikowske K, Flowers CI, et al.: Cumulative probability of false-positive recall or biopsy recommendation after 10 years of screening mammography: a cohort study. Ann Intern Med 155 (8): 481-92, 2011.[PUBMED Abstract]
- Braithwaite D, Zhu W, Hubbard RA, et al.: Screening outcomes in older US women undergoing multiple mammograms in community practice: does interval, age, or comorbidity score affect tumor characteristics or false positive rates? J Natl Cancer Inst 105 (5): 334-41, 2013.[PUBMED Abstract]
- Zackrisson S, Andersson I, Janzon L, et al.: Rate of over-diagnosis of breast cancer 15 years after end of Malmö mammographic screening trial: follow-up study. BMJ 332 (7543): 689-92, 2006.[PUBMED Abstract]
- Welch HG, Black WC: Using autopsy series to estimate the disease "reservoir" for ductal carcinoma in situ of the breast: how much more breast cancer can we find? Ann Intern Med 127 (11): 1023-8, 1997.[PUBMED Abstract]
- Black WC, Welch HG: Advances in diagnostic imaging and overestimations of disease prevalence and the benefits of therapy. N Engl J Med 328 (17): 1237-43, 1993.[PUBMED Abstract]
- Duffy SW, Lynge E, Jonsson H, et al.: Complexities in the estimation of overdiagnosis in breast cancer screening. Br J Cancer 99 (7): 1176-8, 2008.[PUBMED Abstract]
- Gøtzsche PC, Jørgensen KJ, Maehlen J, et al.: Estimation of lead time and overdiagnosis in breast cancer screening. Br J Cancer 100 (1): 219; author reply 220, 2009.[PUBMED Abstract]
- Nelson HD, Pappas M, Cantor A, et al.: Harms of Breast Cancer Screening: Systematic Review to Update the 2009 U.S. Preventive Services Task Force Recommendation. Ann Intern Med 164 (4): 256-67, 2016.[PUBMED Abstract]
- Jørgensen KJ, Gøtzsche PC, Kalager M, et al.: Breast Cancer Screening in Denmark: A Cohort Study of Tumor Size and Overdiagnosis. Ann Intern Med 166 (5): 313-323, 2017.[PUBMED Abstract]
- Autier P, Boniol M, Koechlin A, et al.: Effectiveness of and overdiagnosis from mammography screening in the Netherlands: population based study. BMJ 359: j5224, 2017.[PUBMED Abstract]
- Lousdal ML, Kristiansen IS, Møller B, et al.: Effect of organised mammography screening on stage-specific incidence in Norway: population study. Br J Cancer 114 (5): 590-6, 2016.[PUBMED Abstract]
- Harding C, Pompei F, Burmistrov D, et al.: Breast Cancer Screening, Incidence, and Mortality Across US Counties. JAMA Intern Med 175 (9): 1483-9, 2015.[PUBMED Abstract]
- Miller AB, Wall C, Baines CJ, et al.: Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ 348: g366, 2014.[PUBMED Abstract]
- Esserman LJ, Yau C, Thompson CK, et al.: Use of Molecular Tools to Identify Patients With Indolent Breast Cancers With Ultralow Risk Over 2 Decades. JAMA Oncol 3 (11): 1503-1510, 2017.[PUBMED Abstract]
- Baines CJ, To T, Miller AB: Revised estimates of overdiagnosis from the Canadian National Breast Screening Study. Prev Med 90: 66-71, 2016.[PUBMED Abstract]
- Elmore JG, Barton MB, Moceri VM, et al.: Ten-year risk of false positive screening mammograms and clinical breast examinations. N Engl J Med 338 (16): 1089-96, 1998.[PUBMED Abstract]
- Christiansen CL, Wang F, Barton MB, et al.: Predicting the cumulative risk of false-positive mammograms. J Natl Cancer Inst 92 (20): 1657-66, 2000.[PUBMED Abstract]
- Freitas R, Fiori WF, Ramos FJ, et al.: [Discomfort and pain during mammography]. Rev Assoc Med Bras 52 (5): 333-6, 2006 Sep-Oct.[PUBMED Abstract]
- Armstrong K, Moye E, Williams S, et al.: Screening mammography in women 40 to 49 years of age: a systematic review for the American College of Physicians. Ann Intern Med 146 (7): 516-26, 2007.[PUBMED Abstract]
- Swift M, Morrell D, Massey RB, et al.: Incidence of cancer in 161 families affected by ataxia-telangiectasia. N Engl J Med 325 (26): 1831-6, 1991.[PUBMED Abstract]
- Kopans DB: Mammography and radiation risk. In: Janower ML, Linton OW, eds.: Radiation Risk: a Primer. Reston, Va: American College of Radiology, 1996, pp 21-22.[PUBMED Abstract]
- Feig SA, Ehrlich SM: Estimation of radiation risk from screening mammography: recent trends and comparison with expected benefits. Radiology 174 (3 Pt 1): 638-47, 1990.[PUBMED Abstract]
- Helzlsouer KJ, Harris EL, Parshad R, et al.: Familial clustering of breast cancer: possible interaction between DNA repair proficiency and radiation exposure in the development of breast cancer. Int J Cancer 64 (1): 14-7, 1995.[PUBMED Abstract]
- Suleiman OH, Spelic DC, McCrohan JL, et al.: Mammography in the 1990s: the United States and Canada. Radiology 210 (2): 345-51, 1999.[PUBMED Abstract]
- Miglioretti DL, Lange J, van den Broek JJ, et al.: Radiation-Induced Breast Cancer Incidence and Mortality From Digital Mammography Screening: A Modeling Study. Ann Intern Med 164 (4): 205-14, 2016.[PUBMED Abstract]
- Lerman C, Trock B, Rimer BK, et al.: Psychological side effects of breast cancer screening. Health Psychol 10 (4): 259-67, 1991.[PUBMED Abstract]
- Sandin B, Chorot P, Valiente RM, et al.: Adverse psychological effects in women attending a second-stage breast cancer screening. J Psychosom Res 52 (5): 303-9, 2002.[PUBMED Abstract]
- Brodersen J, Siersma VD: Long-term psychosocial consequences of false-positive screening mammography. Ann Fam Med 11 (2): 106-15, 2013 Mar-Apr.[PUBMED Abstract]
- Gram IT, Lund E, Slenker SE: Quality of life following a false positive mammogram. Br J Cancer 62 (6): 1018-22, 1990.[PUBMED Abstract]
- Burman ML, Taplin SH, Herta DF, et al.: Effect of false-positive mammograms on interval breast cancer screening in a health maintenance organization. Ann Intern Med 131 (1): 1-6, 1999.[PUBMED Abstract]
- Pisano ED, Earp J, Schell M, et al.: Screening behavior of women after a false-positive mammogram. Radiology 208 (1): 245-9, 1998.[PUBMED Abstract]
- Brewer NT, Salz T, Lillie SE: Systematic review: the long-term effects of false-positive mammograms. Ann Intern Med 146 (7): 502-10, 2007.[PUBMED Abstract]
- その他の画像検査法:超音波検査、磁気共鳴画像法(MRI)、サーモグラフィ
-
超音波検査
超音波検査は、初回スクリーニング方法としての実施ではなく、触知可能な腫瘤またはマンモグラフィにより確認された腫瘤の診断的評価に使用される。乳がんスクリーニングに関するヨーロッパグループ(European Group for Breast Cancer Screening)による文献と専門家の見解の見直しでは、「あらゆる年齢において、集団乳がんスクリーニングへの超音波検査の使用を支持する証拠はほとんどない」という結論に達している。[ 1 ]Japan Strategic Anti-cancer Randomized Trial(J-START)は、マンモグラフィと超音波検査によるスクリーニング(介入群)またはマンモグラフィのみによるスクリーニング(対照群)に40~49歳の女性をランダムに割り付けたスクリーニング試験である。この試験の最初の結果では、超音波検査による補助的スクリーニング(すなわち、マンモグラフィ+超音波検査vsマンモグラフィ単独)が早期乳がんの検出率を増加させたことが示されたが、死亡率に対する影響は現時点では明らかではない。[ 2 ]
乳房のMRI
乳房のMRIは、シリコンインプラントの完全性評価、手術後または放射線療法後の触知可能な腫瘤の査定、腋窩リンパ節転移のある女性におけるマンモグラフィまたは超音波検査によって存在を示唆された潜伏乳がんの発見、既知の乳がんを有する患者に対する術前計画などの診断的評価のために女性に用いられる。この手技によって電離放射線に曝露することはない。BRCA1/2突然変異キャリア、乳がんの強い家族歴、またはリー-フラウメニ症候群やコーデン症候群などいくつかの遺伝的症候群に基づいて、乳がんリスクが高い女性における乳がんのスクリーニング検査としてMRIが奨励されている。[ 3 ][ 4 ][ 5 ]乳房のMRIはスクリーニングマンモグラフィよりも感度は高いものの特異度は低く[ 6 ][ 7 ]、費用は最大35倍高い。[ 8 ][ 9 ][ 10 ][ 11 ][ 12 ]
サーモグラフィ
赤外線画像技術を用いる乳房サーモグラフィは、皮下に存在する腫瘍の潜在的指標として皮膚の温度変化を検知し、色分けしてその変化を表示する。サーモグラフィ装置は米国食品医薬品局により510(k)の下、承認されているものだが、サーモグラフィを他のスクリーニング法を比較したランダム化試験は行われていない。複数の小規模コホート研究では、サーモグラフィを補助診断法として使用することに関する追加の有益性は何も示唆されていない。[ 13 ][ 14 ]
参考文献- Teh W, Wilson AR: The role of ultrasound in breast cancer screening. A consensus statement by the European Group for Breast Cancer Screening. Eur J Cancer 34 (4): 449-50, 1998.[PUBMED Abstract]
- Ohuchi N, Suzuki A, Sobue T, et al.: Sensitivity and specificity of mammography and adjunctive ultrasonography to screen for breast cancer in the Japan Strategic Anti-cancer Randomized Trial (J-START): a randomised controlled trial. Lancet 387 (10016): 341-348, 2016.[PUBMED Abstract]
- Warner E, Plewes DB, Hill KA, et al.: Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination. JAMA 292 (11): 1317-25, 2004.[PUBMED Abstract]
- Kriege M, Brekelmans CT, Boetes C, et al.: Efficacy of MRI and mammography for breast-cancer screening in women with a familial or genetic predisposition. N Engl J Med 351 (5): 427-37, 2004.[PUBMED Abstract]
- Warner E, Hill K, Causer P, et al.: Prospective study of breast cancer incidence in women with a BRCA1 or BRCA2 mutation under surveillance with and without magnetic resonance imaging. J Clin Oncol 29 (13): 1664-9, 2011.[PUBMED Abstract]
- Lord SJ, Lei W, Craft P, et al.: A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer. Eur J Cancer 43 (13): 1905-17, 2007.[PUBMED Abstract]
- Lehman CD, Gatsonis C, Kuhl CK, et al.: MRI evaluation of the contralateral breast in women with recently diagnosed breast cancer. N Engl J Med 356 (13): 1295-303, 2007.[PUBMED Abstract]
- Pataky R, Armstrong L, Chia S, et al.: Cost-effectiveness of MRI for breast cancer screening in BRCA1/2 mutation carriers. BMC Cancer 13: 339, 2013.[PUBMED Abstract]
- Saadatmand S, Tilanus-Linthorst MM, Rutgers EJ, et al.: Cost-effectiveness of screening women with familial risk for breast cancer with magnetic resonance imaging. J Natl Cancer Inst 105 (17): 1314-21, 2013.[PUBMED Abstract]
- Ahern CH, Shih YC, Dong W, et al.: Cost-effectiveness of alternative strategies for integrating MRI into breast cancer screening for women at high risk. Br J Cancer 111 (8): 1542-51, 2014.[PUBMED Abstract]
- Pistolese CA, Ciarrapico AM, della Gatta F, et al.: Inappropriateness of breast imaging: cost analysis. Radiol Med 118 (6): 984-94, 2013.[PUBMED Abstract]
- Cott Chubiz JE, Lee JM, Gilmore ME, et al.: Cost-effectiveness of alternating magnetic resonance imaging and digital mammography screening in BRCA1 and BRCA2 gene mutation carriers. Cancer 119 (6): 1266-76, 2013.[PUBMED Abstract]
- Wishart GC, Campisi M, Boswell M, et al.: The accuracy of digital infrared imaging for breast cancer detection in women undergoing breast biopsy. Eur J Surg Oncol 36 (6): 535-40, 2010.[PUBMED Abstract]
- Arora N, Martins D, Ruggerio D, et al.: Effectiveness of a noninvasive digital infrared thermal imaging system in the detection of breast cancer. Am J Surg 196 (4): 523-6, 2008.[PUBMED Abstract]
- 画像検査以外のスクリーニング法
-
乳房視触診
乳がん死亡率に対するスクリーニングのための乳房視触診(CBE)の影響は十分に確立されていない。Canadian National Breast Screening Study(CNBSS)は、50~59歳の女性を対象に高品質のCBEとマンモグラフィの併用をCBE単独と比較した。1乳房当たり5~10分間行うCBEは、診療の質を定期的に評価されている熟練した医療専門家が行った。がん診断の頻度、病期、中間期がんおよび乳がん死亡率は、両群間ではほぼ同じであり、マンモグラフィ単独での転帰と同様であった。[ 1 ]平均13年の追跡で、乳がん死亡率は、両群間でほぼ同じであった(死亡率比、1.02;95%信頼区間[CI]、0.78-1.33)。[ 2 ]研究者らは、CBE単独について作業特性を推測した;50~59歳の女性19,965人では、試験開始から1、2、3、4、および5年の感度はそれぞれ83%、71%、57%、83%、および77%であり、特異度は88%と96%の間に分布した。陽性適中率(PPV)とは、検査で異常を認めた件数に対する検知されたがんの割合を示し、3~4%と推定された。登録時にのみ検査を受けた40~49歳の女性25,620人について、推定感度は71%、特異度は84%、PPVは1.5%であった。[ 3 ]
地域の臨床医を対象とした臨床試験では、CBE型のスクリーニングは、検査者が経験したよりも特異度が高く(97~99%)[ 4 ]、感度は低かった(22~36%)。[ 5 ][ 6 ][ 7 ][ 8 ]乳がん家族歴のある女性における1件のスクリーニング研究では、通常の初期評価の後、患者自身または担当医が実施するCBEの方がマンモグラフィより多くのがんを同定したことが示された。[ 9 ]
別の研究では、スクリーニングマンモグラフィにCBEを追加する方法の有用性が調査された;マンモグラフィおよびCBEによるスクリーニングを受けた40歳を超える女性61,688人において、マンモグラフィの感度は78%、マンモグラフィとCBEの併用した場合の感度は82%であった。両方のスクリーニング法を受けた女性は、マンモグラフィ単独を受けた女性よりも特異度が低かった(97% vs 99%)。[ 10 ]CBEに関する他の国際的試験がインドで2件およびエジプトで1件進行中である。
乳房自己検査(BSE)
月1回のBSEが奨励されているが、乳がん死亡率を低下させるという証拠はない。[ 11 ][ 12 ]唯一のBSEの大規模ランダム化臨床試験では、上海の工場勤務者の女性266,064人を、BSEの指導、強化、奨励群、または背中下部の痛みの予防に関する指導の群に割り付けた。両群とも他の方法による乳がんスクリーニングは受けなかった。10~11年間の追跡調査の後、指導群の乳がん死は135例、対照群では131例であった(相対リスク[RR]、1.04;95%CI、0.82-1.33)。両群における浸潤性乳がんの診断例はほぼ同数であったが、指導群では、胸部生検を受けた症例と良性病変が診断された症例が対照群の症例よりも多かった。[ 13 ]
BSEに関する他の研究結果が3件の試験から得られている。第一に、レニングラードの10万人以上の女性がBSEトレーニング群または対照群にクラスターランダム化により割り付けられた;BSEトレーニング群では乳房生検の実施が多かったが、乳がん死亡率の改善はみられなかった。[ 14 ]第二に、英国の乳がん早期発見試験(United Kingdom Trial of Early Detection of Breast Cancer)では、45~64歳の女性63,500人以上がBSEの講習会に招かれた。10年間の追跡後、乳がん死亡率は組織的なBSE教育を実施しなかった施設の死亡率と同様であった(RR、1.07;95%CI、0.93-1.22)。[ 15 ]第三に、対照的に、CNBSS内ネステッドケースコントロール研究では、登録前の自己申告によるBSE実践頻度と乳がん死亡率とが比較された。自分の乳房を視覚的にチェックして、指球と示指、中指、薬指の3本の指で腫瘤の有無を調べた女性の方が、乳がん死亡率が低かった。[ 16 ]
組織採取(穿刺吸引法、乳頭吸引法、乳管洗浄法)
乳がんのスクリーニング方法として、悪性腫瘍が乳房組織にないかを分析するためのさまざまな方法が提唱されているが、死亡率の低下と関連することが示されているものはない。
参考文献- Baines CJ: The Canadian National Breast Screening Study: a perspective on criticisms. Ann Intern Med 120 (4): 326-34, 1994.[PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: Canadian National Breast Screening Study-2: 13-year results of a randomized trial in women aged 50-59 years. J Natl Cancer Inst 92 (18): 1490-9, 2000.[PUBMED Abstract]
- Baines CJ, Miller AB, Bassett AA: Physical examination. Its role as a single screening modality in the Canadian National Breast Screening Study. Cancer 63 (9): 1816-22, 1989.[PUBMED Abstract]
- Fenton JJ, Rolnick SJ, Harris EL, et al.: Specificity of clinical breast examination in community practice. J Gen Intern Med 22 (3): 332-7, 2007.[PUBMED Abstract]
- Fenton JJ, Barton MB, Geiger AM, et al.: Screening clinical breast examination: how often does it miss lethal breast cancer? J Natl Cancer Inst Monogr (35): 67-71, 2005.[PUBMED Abstract]
- Bobo JK, Lee NC, Thames SF: Findings from 752,081 clinical breast examinations reported to a national screening program from 1995 through 1998. J Natl Cancer Inst 92 (12): 971-6, 2000.[PUBMED Abstract]
- Oestreicher N, White E, Lehman CD, et al.: Predictors of sensitivity of clinical breast examination (CBE). Breast Cancer Res Treat 76 (1): 73-81, 2002.[PUBMED Abstract]
- Kolb TM, Lichy J, Newhouse JH: Comparison of the performance of screening mammography, physical examination, and breast US and evaluation of factors that influence them: an analysis of 27,825 patient evaluations. Radiology 225 (1): 165-75, 2002.[PUBMED Abstract]
- Gui GP, Hogben RK, Walsh G, et al.: The incidence of breast cancer from screening women according to predicted family history risk: Does annual clinical examination add to mammography? Eur J Cancer 37 (13): 1668-73, 2001.[PUBMED Abstract]
- Oestreicher N, Lehman CD, Seger DJ, et al.: The incremental contribution of clinical breast examination to invasive cancer detection in a mammography screening program. AJR Am J Roentgenol 184 (2): 428-32, 2005.[PUBMED Abstract]
- Baxter N; Canadian Task Force on Preventive Health Care: Preventive health care, 2001 update: should women be routinely taught breast self-examination to screen for breast cancer? CMAJ 164 (13): 1837-46, 2001.[PUBMED Abstract]
- Humphrey LL, Helfand M, Chan BK, et al.: Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 137 (5 Part 1): 347-60, 2002.[PUBMED Abstract]
- Thomas DB, Gao DL, Ray RM, et al.: Randomized trial of breast self-examination in Shanghai: final results. J Natl Cancer Inst 94 (19): 1445-57, 2002.[PUBMED Abstract]
- Semiglazov VF, Moiseyenko VM, Bavli JL, et al.: The role of breast self-examination in early breast cancer detection (results of the 5-years USSR/WHO randomized study in Leningrad). Eur J Epidemiol 8 (4): 498-502, 1992.[PUBMED Abstract]
- Ellman R, Moss SM, Coleman D, et al.: Breast cancer mortality after 10 years in the UK trial of early detection of breast cancer. UK Trial of Early Detection of Breast Cancer Group. The Breast 2 (1): 13-20, 1993.[PUBMED Abstract]
- Harvey BJ, Miller AB, Baines CJ, et al.: Effect of breast self-examination techniques on the risk of death from breast cancer. CMAJ 157 (9): 1205-12, 1997.[PUBMED Abstract]
- ランダム化比較試験の付録
-
1963年、Health Insurance Plan、米国 [ 1 ][ 2 ]
- 登録時の年齢:40~64歳。
- ランダム化の方法:個人、ただし、割り付けられた群間には、閉経状態(P < 0.0001)および教育(P=0.05)の差で明らかなように、有意な不均衡が認められる。
- サンプルサイズ:スクリーニング群30,000~31,092人、対照群30,565~30,765人。
- 報告の整合性:サンプルサイズの報告にばらつきがみられる。
- 介入:年1回の2方向撮影マンモグラフィ(MMG)と乳房視触診(CBE)を3年間。
- 対照:通常のケア。
- コンプライアンス:初回スクリーニングの不参加者(スクリーニング群の35%)については再度の召喚はなされなかった。
- 混合:スクリーニングMMGは試験以外では実施されないようになっていた;対照群女性におけるCBEの実施回数は不明である。
- 死因の帰属: 試験登録前に乳がんと診断され乳がん死した女性は、スクリーニングと対照の群間比較から除外された。しかしながら、除外の方法は2群間で異なっていた。スクリーニング群の女性は試験期間になされた決定に基づいて、初回スクリーニング時に除外された。これらの女性は、これ以降すべての検討対象から外された。試験デザインによって、対照群患者は定期的に通院しないことになっていたため、対照群の患者の試験前のがんの状態は特定できなかった。対照群の患者が死亡し、その死因が乳がんだと特定された場合、乳がんの診断日を特定するためレトロスペクティブな調査が行われた。診断日が試験期間の前であった場合は、その対照群の患者は解析から除外された。この方法の違いは、2群間の乳がん死亡率を比較する場合にかなりのバイアスを含む可能性があり、このバイアスはスクリーニングに有利に働く傾向がある。
- 解析:追跡調査。
- 外部監査:なし。
- 追跡期間:18年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%信頼区間[CI]):10年0.71(0.55-0.93)、15年0.77(0.61-0.97)。
- コメント:機器および技術が時代遅れであるため、後に実施された試験に比べて、MMGの質が低かった。介入群ではマンモグラフィとCBEとが併用されていた。試験実施に関する主な懸念は、初回のランダム化の妥当性と乳がんの既往歴のある女性の除外基準が異なっていることである。
- 登録時の年齢:45~69歳。
- ランダム化の方法:個人ランダム化、第一段階のMMGスクリーニング試験(MMST I)は誕生年ごとのコホート内で。MMST IIは1933年から1945年生まれを1つのコホートとして個人ランダム化、ただし、限られた医療財源によりやむを得ず変動あり。両群にみられる年齢解析では有意差は認められない。
- 除外:スウェーデンのメタアナリシスでは、既存の乳がんの女性393人を介入群から除外し、412人を対照群から除外した。しかし、全体でみると、除外例は対照群よりも介入群の方が86人多かった。
- サンプルサイズ:スクリーニング群21,088人、対照群21,195人。
- 報告の整合性:症例数にばらつきはみられない。
- 介入:18~24ヵ月ごとに1回2方向撮影マンモグラフィ(MMG)×5。
- 対照:通常のケア、試験終了時にマンモグラフィ。
- コンプライアンス:マルメーから移住した被験者(2%/年)は追跡されなかった。被験女性の参加率は、1巡目74%、2巡目以降70%であった。
- 混合:1回以上マンモグラフィ(MMG)を受けたのは対照群の全被験者中24%であり、45~49歳の対照群女性では35%であった。
- 死因の帰属:初期の報告では剖検率は76%であるが、のちには低くなる。死因の評価は、乳がんの診断を受けた被験者をマスクした。スウェーデン死因登録に結びつけた。
- 解析:初期評価。追跡解析は、スウェーデンのメタアナリシスの一部として実施。[ 5 ]
- 外部監査:なし。
- 追跡期間:12年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.81(0.62-1.07)。
- コメント:評価解析には、対照群でマンモグラフィの実施が遅れたため、補正係数が必要であった。2件のMalmo試験、MMST IおよびMMST IIは、大部分の解析で1つにまとめられている。
1977年 エステルイェトランド(County E of Two-County Trial)、スウェーデン[ 6 ][ 7 ][ 8 ]
- 登録時の年齢:40~74歳。
- ランダム化の方法:居住地(都市部か非都市部)、社会経済的因子および大きさによる層別化を用いた、地理的クラスターランダム化。ベースラインの乳がん発生率および死亡率は、ランダム化により割り付けられた地理的クラスター間で同等であった。介入群の女性は対照群の女性よりも年齢が高かった(P < 0.0001)が、この年齢差は、試験結果に大きな影響は及ぼさなかったはずである。
- 除外:既存の乳がんの女性を両群から除外したが、文献によって報告数が異なっていた。スウェーデンのメタアナリシスは、割り付けられた群とは無関係に、既に乳がんの診断を受けていた女性をすべて除外した。
- サンプルサイズ:スクリーニング群38,405~39,034人、対照群37,145~37,936人と、報告によりばらつきがある。
- 報告の整合性:ばらつきがある。
- 介入:50歳未満の女性については、2年ごとに1方向撮影マンモグラフィ(MMG)×3、50歳以上の女性については、33ヵ月ごとに1方向撮影マンモグラフィ×3。
- 対照:通常のケア、試験終了時にマンモグラフィ。
- コンプライアンス:89%がスクリーニングを受けた。
- 混合:Two-County試験において13%の女性が、主に1983年から1984年にルーチンケアとしてマンモグラフィを受けた。
- 死因の帰属:地元の医師チームにより判断。スウェーデン死因登録から得たデータを用いてスウェーデンのメタアナリシスで試験結果を算出し直すと、既報よりもスクリーニングの有益性が小さかった。
- 解析:当初は、対照群のマンモグラフィ実施時期の遅れを補正して、評価。追跡解析は、スウェーデンのメタアナリシスの一部として実施。[ 5 ]
- 外部監査:なし。しかしながら、乳がん例および乳がん死は、研究者を含むスウェーデンの委員会に評価された。[ 9 ]
- 追跡期間:12年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.82(0.64-1.05)、エステルイェトランド(スウェーデン)。
- コメント:ランダム化の方法と、評価解析について懸念が提起され、対照群のマンモグラフィ実施時期の遅延に対する補正が必要とされた。スウェーデンメタアナリシスは、この問題を適切に解消した。
1977年 コッパルベリ(County W of Two-County Trial)、スウェーデン[ 6 ][ 7 ][ 8 ]
- 登録時の年齢:40~74歳。
- ランダム化の方法:居住地(都市部か非都市部)、社会経済的因子および大きさによる層別化を用いた、地理的クラスターランダム化。ランダム化のプロセスは述べられていない。介入群の女性は対照群の女性よりも年齢が高かった(P < 0.0001)が、この年齢差は、試験結果に大きな影響は及ぼさなかったはずである。
- 除外:既存の乳がんの女性を両群から除外したが、文献によって報告数が異なっていた。
- サンプルサイズ:介入群38,562~39,051人、対照群18,478~18,846人と、報告によりばらつきがある。
- 報告の整合性:ばらつきがある。
- 介入:50歳未満については、2年ごとに1方向撮影マンモグラフィ(MMG)×3、50歳以上については、33ヵ月ごとに1方向撮影マンモグラフィ×3。
- 対照:通常のケア、試験終了時にマンモグラフィ。
- コンプライアンス:89%が参加。
- 混合:Two-County試験において13%の女性が、主に1983年から1984年にルーチンケアとしてマンモグラフィを受けた。
- 死因の帰属:地元の医師チームにより判断(エステルイェトランド参照)。
- 解析:評価。
- 外部監査:なし。しかしながら、乳がん例および乳がん死は、研究者を含むスウェーデンの委員会に評価された。[ 9 ]
- 追跡期間:12年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.68(0.52-0.89)。
1976年 エジンバラ、英国[ 10 ]
- 登録時の年齢:45~64歳。
- ランダム化の方法:医師ごとのクラスターランダム化、ただし、研究開始後に、多くのランダム化割り付け法が変更された。試験への各患者の適性に関して医師の判断に基づいた被験者の募集方法が、各試験内で一貫していなかった。介入群と対照群との間には大きな社会経済的地位の差があったが、試験終了後まで認識されていなかった。
- 除外:既存の乳がんの女性被験者の除外者数は、介入群(338)の方が、対照群(177)よりも多かった。
- サンプルサイズ:スクリーニング群23,226人、対照群21,904人。
- 報告の整合性:良好。
- 介入:初回には2方向撮影マンモグラフィ(MMG)+CBE、以降は年1回のCBEと、3年目、5年目、7年目に1方向撮影マンモグラフィ。
- 対照:通常のケア。
- コンプライアンス:61%がスクリーニングを受けた。
- 混合:なし。
- 死因の帰属:がん登録データによる。
- 解析:追跡調査。
- 外部監査:なし。
- 追跡期間:10年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.84(0.63-1.12)。
- コメント:ランダム化の過程には不備があった。全原因による死亡率が、介入群よりも対照群の方で高いのは、おそらく介入群と対照群との間の社会経済的格差のためであろう。この全原因による死亡率における差は、対照群の乳がん死亡率の4倍に当たり、このため対照群の乳がん死亡率はスクリーニングを受けた女性よりも高いことを説明しうる。最終解析には補正因子を用いたが、解析を十分に調整できたとはいえない。
この研究デザインおよび運営方法によって、これらの試験結果の評価が、また結果を他の試験結果と合わせることが難解になる。
1980年 カナダ全国乳がんスクリーニング研究(National Breast Screening Study[NBSS])-1、カナダ[ 11 ]
- 登録時の年齢:40~49歳。
- ランダム化の方法:個人志願者をランダム化、割り付けリストに受診順に記入された名前による。ランダム化の手順に対して批判があるが、完全に独立した審査から、破壊因子(subversion)の証拠がないことおよび試験結果に影響を及ぼすほど大規模な破壊因子はありそうもないと判明した。[ 12 ]
- 除外:ほとんどなく、両群とも均衡が取れていた。
- サンプルサイズ:スクリーニング群25,214人(CBE登録後に100%スクリーニングを受診)、対照群25,216人。
- 報告の整合性:良好。
- 介入:年1回の2方向撮影マンモグラフィ(MMG)とCBEを4~5年間。
- 対照:通常のケア。
- コンプライアンス:当初100%、5回目のスクリーニングまでに85.5%に低下。
- 混合:通常ケア群26.4%。
- 死因の帰属:死亡診断書と、盲検化された検討委員会による疑いのある症例のレビュー。Statistics CanadaのCanadian Mortality Data Baseとも連携した。
- 解析:追跡調査。
- 外部監査:あり。独立したもので、数名の審査官がデータを解析。
- 追跡期間:25年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI): 1.09 (0.80–1.49).
- コメント:これは、40~49歳の女性を研究するために特にデザインされた唯一の試験である。研究群および対照群とも登録時に診断されたがんが含まれた。試験完了前に、マンモグラフィの技術的妥当性、放射線科医の訓練、および機器の標準化についての懸念が表明され、そのことが独立した外部の審査を促した。この審査により明らかにされた第一の欠陥は、1980年から1985年にかけて中外斜位方向の代わりに中外方向の撮影を行っていたことであり、中外斜位方向の撮影は1985年以降に用いられた。[ 13 ]その後の解析から、この試験でマンモグラフィにより発見されたがんのサイズおよび病期は、他の諸試験のものと同じであることが分かった。[ 14 ]この試験およびNBSS-2は、腋窩リンパ節陽性女性に乳がんの局所療法後、補助ホルモン療法および化学療法を一貫して採用している点で、他のランダム化比較試験と異なっている。
1980年 NBSS-2、カナダ [ 15 ]
- 登録時の年齢:50~59歳。
- ランダム化の方法:個人志願者(NBSS-1参照)。
- 除外:ほとんどなく、両群とも均衡が取れていた。
- サンプルサイズ:スクリーニング群19,711人(CBE登録後に100%スクリーニングを受診)、対照群19,694人。
- 介入:年1回の2方向撮影マンモグラフィ(MMG)とCBE。
- 対照:年1回のCBE。
- コンプライアンス:マンモグラフィとCBEの実施群では、当初100%、5回目のスクリーニングまでに86.7%に低下。CBEのみ実施群では、当初100%、5回目のスクリーニングまでに85.4%に低下。
- 混合:CBEのみ実施群の16.9%。
- 死因の帰属:死亡診断書と、盲検化された検討委員会による疑いのある症例のレビュー。Statistics CanadaのCanadian Mortality Data Baseとも連携した。
- 解析:追跡調査。
- 外部監査:あり。独立したもので、数名の審査官がデータを解析。
- 追跡期間:25年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群:1.02(95%CI、0.77-1.36)。
- コメント:この試験は、あるスクリーニング法と別のスクリーニング法を比較し、スクリーニング非受診対照群を設けていないという点で独特である。この試験に関する批評およびコメントについては、NBSS-1を参照のこと。
1981年 ストックホルム、スウェーデン[ 16 ]
- 登録時の年齢:40~64歳。
- ランダム化の方法:誕生日によるクラスターランダム化。2件のサブトライアルがあり、第1のサブトライアルのランダム化では均衡が保たれていたが、第2のサブトライアルでは著しい不均衡がみられ、対照群よりもスクリーニング群の被験者数が508人多かった。
- 除外:報告に一貫性がない。
- サンプルサイズ:公表された諸報告に差があり、サイズは介入群では40,318人から38,525人まで減少し、対照群では19,943人から20,978人まで増大した。
- 報告の整合性:ばらつきがある。
- 介入:28ヵ月ごとに1方向撮影マンモグラフィ×2。
- 対照:5年目にマンモグラフィ。
- コンプライアンス:82%がスクリーニングを受けた。
- 混合:試験に参加した女性の25%が、登録前の3年の間にマンモグラフィを受けていた。
- 死因の帰属:スウェーデン死亡登録(Swedish Cause of Death Registry)と連携。
- 解析:評価解析、対照群では試験終了時のマンモグラフィの実施が1年遅れた。追跡解析は、スウェーデンのメタアナリシスの一部として実施。[ 5 ]
- 外部監査:なし。
- 追跡期間:8年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.80(0.53-1.22)。
- コメント:特に2番目のサブトライアルにおけるランダム化、除外および対照群のマンモグラフィ実施の遅れについて懸念がある。スウェーデンのメタアナリシスにこのデータを組み込むことは、こうした疑問の多くを解消することになる。
1982年 Gothenberg、スウェーデン
- 登録時の年齢:39~59歳。
- ランダム化の方法:複雑;高齢群(50~59歳)では誕生年内で行う誕生日によるクラスターランダム化割り付け、若年群(39~49歳)では個人ごと;対照群に対する研究群の比は、MMGの利用可能性によって年ごとに異なる(ランダム化は1982年から1984年に実施)。
- 除外:過去の乳がんの診断のために両群から同じ割合の女性を除外した(各1.2%)。
- サンプルサイズ:最近の発表:21,650人勧誘、対照群29,961人。
- 報告の整合性:ばらつきがある。
- 介入:最初に2方向撮影マンモグラフィ(MMG)、その後、18ヵ月ごとに1方向撮影マンモグラフィ×4。最初の3巡は単独での読影、その後二重読影。
- 対照:対照群は、研究群の最終スクリーニングからおよそ3~8ヵ月後に1回スクリーニング検査を受けた。
- 死因の帰属:スウェーデン死亡登録(Swedish Cause of Death Registry)と連携。また、独立エンドポイント委員会を使用。
- 解析:評価と追跡の両方法。[ 5 ]
- 外部監査:なし。
- 追跡期間:12~14年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):年齢39~59歳:0.79(0.58-1.08)[評価];0.77(0.60-1.00)[追跡]。
- コメント:年齢50~54歳の女性では減少がなかったが、他の5歳ごとの年齢グループでは同様の減少がみられた。
- 結論:対照群におけるマンモグラフィの実施の遅れおよび勧誘群と対照群との女性の数の不平等性(複雑なランダム化の手順)が解釈を複雑化する。
- 登録時の年齢:39~41歳。
- ランダム化:イングランド、ウェールズ、およびスコットランドの地理的に限定された地域の一般医のリストからの個人。
- 除外:所在不明であるか、死亡しているために、各群で少数が除外された(勧誘群でn = 30および非勧誘群でn = 51)。
- サンプルサイズ:160,921人(勧誘:53,884人;非勧誘:106,956人)。
- 報告の整合性:該当せず。
- 介入:48歳以下の勧誘群はMMGによる年1回のスクリーニングを提供された(初回は2方向撮影、それ以降は中外斜位方向);68%が初回スクリーニングを受け、69~70%が再び勧誘された(81%が少なくとも1回のスクリーニングに参加した)。
- 対照:非勧誘群は通常の医療を受け、自身の研究への参加に気付いておらず、ランダム化前にスクリーニングを受けた者はほとんどなかった。
- 死因の帰属:National Health Service(NHS)の中央登録簿から受けた死亡証明書コード。
- 解析:追跡手法はintention-to-treat解析であった(ただし50歳の女性は全員にNHSによるスクリーニングが提供された)。
- 外部監査:なし。
- 追跡期間:10.7年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.83(0.66-1.04)。
- 結論:統計的に有意な結果は得られなかったが、他の研究と一致している。
- 追跡期間:ランダム化から10年に制限。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.75(0.58-0.97)。
- 結論:統計的に有意な結果。
- 追跡期間:中央値17.7年。
- 乳がん死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.88(0.74-1.04)。
- 結論:統計的に有意な結果は得られなかった。
- 追跡期間:中央値17.7年。
- 全原因死の相対リスク、スクリーニング群 vs 対照群(95%CI):0.98(0.93-1.03)。
- 結論:統計的に有意な結果は得られなかった。
追跡期間中央値17.7年での乳がん死亡率の低下は、死亡1,000例当たり0.1例(または10,000例当たり1例)の絶対リスク低下に相当する。
39~49歳の女性におけるスクリーニングマンモグラフィ開始によって乳がん死亡率が臨床的に有意に低下するという結論を支持するには、この証拠は不十分である。標準以外の画像検査スケジュール、標準以外の画像検査プロトコル、および生検に対する標準以外の閾値に基づくと、報告された乳がん死亡率の低下は非常に小さく一過性の低下である;したがって、一般集団との関連は不明である。絶対的には、これは死亡1,000例当たり0.1例(または10,000例当たり1例)の絶対リスク低下に相当する。また、この死亡率の低下は統計的に有意でなかった元のデータセットの再解析に基づいており、サブグループの乳がん死亡率の再計算は10年間の追跡に限定されていた。20年の追跡期間で、乳がんのリスクまたは全原因死亡率における統計的に有意な低下は認められなかった。[ 18 ]
過剰診断の大きさを明確に判断するには、証拠が不十分である。証拠がサブグループ解析と標準以外の画像検査スケジュール、標準以外の画像検査プロトコル、および生検に対する標準以外の閾値に基づいており、一般集団との関連が不明であるため、「最悪の場合でもわずかな過剰診断」という研究者の結論は支持されない。[ 18 ]
参考文献- Shapiro S, Venet W, Strax P, et al.: Ten- to fourteen-year effect of screening on breast cancer mortality. J Natl Cancer Inst 69 (2): 349-55, 1982.[PUBMED Abstract]
- Shapiro S: Periodic screening for breast cancer: the Health Insurance Plan project and its sequelae, 1963-1986. Baltimore, Md: Johns Hopkins University Press, 1988.[PUBMED Abstract]
- Andersson I, Aspegren K, Janzon L, et al.: Mammographic screening and mortality from breast cancer: the Malmö mammographic screening trial. BMJ 297 (6654): 943-8, 1988.[PUBMED Abstract]
- Nyström L, Rutqvist LE, Wall S, et al.: Breast cancer screening with mammography: overview of Swedish randomised trials. Lancet 341 (8851): 973-8, 1993.[PUBMED Abstract]
- Nyström L, Andersson I, Bjurstam N, et al.: Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet 359 (9310): 909-19, 2002.[PUBMED Abstract]
- Tabár L, Fagerberg CJ, Gad A, et al.: Reduction in mortality from breast cancer after mass screening with mammography. Randomised trial from the Breast Cancer Screening Working Group of the Swedish National Board of Health and Welfare. Lancet 1 (8433): 829-32, 1985.[PUBMED Abstract]
- Tabàr L, Fagerberg G, Duffy SW, et al.: Update of the Swedish two-county program of mammographic screening for breast cancer. Radiol Clin North Am 30 (1): 187-210, 1992.[PUBMED Abstract]
- Tabar L, Fagerberg G, Duffy SW, et al.: The Swedish two county trial of mammographic screening for breast cancer: recent results and calculation of benefit. J Epidemiol Community Health 43 (2): 107-14, 1989.[PUBMED Abstract]
- Holmberg L, Duffy SW, Yen AM, et al.: Differences in endpoints between the Swedish W-E (two county) trial of mammographic screening and the Swedish overview: methodological consequences. J Med Screen 16 (2): 73-80, 2009.[PUBMED Abstract]
- Roberts MM, Alexander FE, Anderson TJ, et al.: Edinburgh trial of screening for breast cancer: mortality at seven years. Lancet 335 (8684): 241-6, 1990.[PUBMED Abstract]
- Miller AB, To T, Baines CJ, et al.: The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 137 (5 Part 1): 305-12, 2002.[PUBMED Abstract]
- Bailar JC, MacMahon B: Randomization in the Canadian National Breast Screening Study: a review for evidence of subversion. CMAJ 156 (2): 193-9, 1997.[PUBMED Abstract]
- Baines CJ, Miller AB, Kopans DB, et al.: Canadian National Breast Screening Study: assessment of technical quality by external review. AJR Am J Roentgenol 155 (4): 743-7; discussion 748-9, 1990.[PUBMED Abstract]
- Fletcher SW, Black W, Harris R, et al.: Report of the International Workshop on Screening for Breast Cancer. J Natl Cancer Inst 85 (20): 1644-56, 1993.[PUBMED Abstract]
- Miller AB, Baines CJ, To T, et al.: Canadian National Breast Screening Study: 2. Breast cancer detection and death rates among women aged 50 to 59 years. CMAJ 147 (10): 1477-88, 1992.[PUBMED Abstract]
- Frisell J, Eklund G, Hellström L, et al.: Randomized study of mammography screening--preliminary report on mortality in the Stockholm trial. Breast Cancer Res Treat 18 (1): 49-56, 1991.[PUBMED Abstract]
- Moss SM, Cuckle H, Evans A, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years' follow-up: a randomised controlled trial. Lancet 368 (9552): 2053-60, 2006.[PUBMED Abstract]
- Moss SM, Wale C, Smith R, et al.: Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years' follow-up: a randomised controlled trial. Lancet Oncol 16 (9): 1123-32, 2015.[PUBMED Abstract]
- 本要約の変更点(04/29/2020)
-
PDQがん情報要約は定期的に見直され、新情報が利用可能になり次第更新される。本セクションでは、上記の日付における本要約最新変更点を記述する。
その他の画像検査法:超音波検査、磁気共鳴画像法(MRI)、サーモグラフィ
本文で以下の記述が改訂された;Japan Strategic Anti-cancer Randomized Trial(J-START)試験の最初の結果では、超音波検査による補助的スクリーニング(すなわち、マンモグラフィ+超音波検査vsマンモグラフィ単独)が早期乳がんの検出率を増加させたことが示されたが、死亡率に対する影響は現時点では明らかではない。
本要約はPDQ Screening and Prevention Editorial Boardが作成と内容の更新を行っており、編集に関してはNCIから独立している。本要約は独自の文献レビューを反映しており、NCIまたはNIHの方針声明を示すものではない。PDQ要約の更新におけるPDQ編集委員会の役割および要約の方針に関する詳しい情報については、本PDQ要約についておよびPDQ® - NCI's Comprehensive Cancer Databaseを参照のこと。
- 本PDQ要約について
-
本要約の目的
医療専門家向けの本PDQがん情報要約では、乳がんのスクリーニングについて、包括的な、専門家の査読を経た、そして証拠に基づいた情報を提供する。本要約は、がん患者を治療する臨床家に情報を与え支援するための情報資源として作成されている。これは医療における意思決定のための公式なガイドラインまたは推奨事項を提供しているわけではない。
査読者および更新情報
本要約は編集作業において米国国立がん研究所(NCI)とは独立したPDQ Screening and Prevention Editorial Boardにより定期的に見直され、随時更新される。本要約は独自の文献レビューを反映しており、NCIまたは米国国立衛生研究所(NIH)の方針声明を示すものではない。
委員会のメンバーは毎月、最近発表された記事を見直し、記事に対して以下を行うべきか決定する:
- 会議での議論、
- 本文の引用、または
- 既に引用されている既存の記事との入れ替え、または既存の記事の更新。
要約の変更は、発表された記事の証拠の強さを委員会のメンバーが評価し、記事を本要約にどのように組み入れるべきかを決定するコンセンサス過程を経て行われる。
本要約の内容に関するコメントまたは質問は、NCIウェブサイトのEmail UsからCancer.govまで送信のこと。要約に関する質問またはコメントについて委員会のメンバー個人に連絡することを禁じる。委員会のメンバーは個別の問い合わせには対応しない。
証拠レベル
本要約で引用される文献の中には証拠レベルの指定が記載されているものがある。これらの指定は、特定の介入やアプローチの使用を支持する証拠の強さを読者が査定する際、助けとなるよう意図されている。The PDQ Screening and Prevention Editorial Boardは、証拠レベルの指定を展開する際に公式順位分類を使用している。
本要約の使用許可
PDQは登録商標である。PDQ文書の内容は本文として自由に使用できるが、完全な形で記し定期的に更新しなければ、NCI PDQがん情報要約とすることはできない。しかし、著者は“NCI's PDQ cancer information summary about breast cancer prevention states the risks succinctly: 【本要約からの抜粋を含める】.”のような一文を記述してもよい。
本PDQ要約の好ましい引用は以下の通りである:
PDQ® Screening and Prevention Editorial Board.PDQ Breast Cancer Screening.Bethesda, MD: National Cancer Institute.Updated <MM/DD/YYYY>.Available at: https://www.cancer.gov/types/breast/hp/breast-screening-pdq.Accessed <MM/DD/YYYY>.[PMID: 26389344]
本要約内の画像は、PDQ要約内での使用に限って著者、イラストレーター、および/または出版社の許可を得て使用されている。PDQ情報以外での画像の使用許可は、所有者から得る必要があり、米国国立がん研究所(National Cancer Institute)が付与できるものではない。本要約内のイラストの使用に関する情報は、多くの他のがん関連画像とともにVisuals Online(2,000以上の科学画像を収蔵)で入手できる。
免責条項
これらの要約内の情報は、保険払い戻しの決定基準として使用されるべきものではない。保険の適用範囲に関する詳しい情報については、Cancer.govのManaging Cancer Careページで入手できる。
お問い合わせ
Cancer.govウェブサイトについての問い合わせまたはヘルプの利用に関する詳しい情報は、Contact Us for Helpページに掲載されている。質問はウェブサイトのEmail UsからもCancer.govに送信可能である。

 画像を拡大する
画像を拡大する